蛋白转导结构域4-铜/锌-超氧化物歧化酶融合蛋白的制备及其穿细胞膜的功能研究
王宇,刘菊英,王贤裕,柯昌斌,李瑞明,王晓勋
(十堰市太和医院、湖北医药学院附属医院a.麻醉科,b.生物医学研究所,湖北十堰 442000)
铜/锌超氧化物歧化酶(Cu/ZnSOD)是一种广泛存在于真核生物细胞质及过氧化物酶体中的大分子蛋白,是机体内主要的具有特异性的内源性氧自由基清除剂[1]。因此增加细胞内 Cu/ZnSOD水平有望成为防治缺血再灌注损伤的有力措施之一,但由于Cu/ZnSOD在细胞膜上没有专一受体或通道,外源性Cu/ZnSOD难以进入细胞和组织内发挥生物学作用,因而限制了其临床应用。蛋白转导结构域(PTD)是一种能携带大分子物质无特异性的穿透哺乳动物细胞膜的阳离子小分子多肽[2-3]。研究发现可以通过优化PTD结构域的空间结构和表面的电子分布来提高PTD结构的内化效率,达到携带大分子物质高效进入细胞内发挥生物学效应的目的。本研究拟构建具有高效穿膜特性的人类PTD4-Cu/ZnSOD原核表达质粒,在大肠杆菌中制备和纯化蛋白,并观察这种PTD4-Cu/ZnSOD融合蛋白穿膜能力,为利用细胞穿透肽携Cu/ZnSOD治疗缺血性疾病的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒 PGEM-T载体购自Promaga公司。pET-16b、E.coli BL21(DE3)购于 Novagen公司。
1.1.2 主要仪器设备 PCR仪(EPPENDORF,美国),凝胶数字图像分析仪(Alpha ImagerTM2200.Alpha Innotech,美国),基因测序仪(ABI310,美国),电泳仪(MINI-PROTEAN3BIO-RAD,德国)。RobusT®RT-PCR_kit、限制性内切酶:BamHI、XhoI、NdeⅠ、T4连接酶、PfuUltratmhigh-fidelity酶、TAQ酶、Wizaad®SV Gel and PCR Clean-Up System、Wizard®Plus SVminipreps DNA Purification System、DCFH-DA分别购自 Gibicol、Finnzymes、New England、Stratagene、SABC、Promaga、碧云天公司。IPTG购自Duchefa公司。Ni+2-nitrilotriacetic acid Sepharose superflow购自Qiagen公司。
1.2 方法
1.2.1 PTD4多肽跨膜结构域的设计 根据PTD多肽跨膜结构域的特点,利用软件设计具有高效跨膜活性的蛋白结构域YARAAARQAR(Q)A,并简并设计的寡核苷酸序列。在两端修饰添加Ndel、XhoI限制性内切酶位点:5′-T ATG ACC TAT GCG CGT GCG GCA GCG CGT CAG GCT CGT GCC C-3′;5′-TCG AGG GGC ACG AGC CTG ACG CGC TGC CGC ACG CGC ATA GGT CA-3′设计扩增人 Cu/Zn SOD蛋白全长CDS引物。5′-CCG CTC GAG GCG ACG AAG GCC GTG TGC GTG-3′;5′-CGG GAT CCT ATT ATT GGG CGA TCC CAA TTA C-3′,两端分别修饰加入限制性内切酶XhoI、BamHI酶位点。
1.2.2 Cu/ZnSOD蛋白全长cDNA序列的获得及鉴定 提取胚胎肝脏组织的总RNA,以其为模板用于Cu/ZnSOD全长 CDs的逆向转录和扩增。PCR总反应体系(20μL)如下:Oligo(dT)15 primer(0.5 mg·L-1)1μL,total RNA sample 1μL,DEPC water补足 12μL,在反应体系中加入 dNTP(10 mmol·L-1)2μL,5×Reaction Buffer 4μL,RNase inhibitor(20 U·μL-1)1μL,M-MμlV RT(200 U·μL-1)1μL置于PCR仪中42℃ 1 h。PCR扩增目的片段扩增体系(50μL)如下:10×buffer 5μL,dNTP(10 mmol·L-1)1μL,MgCl2(25 mmol·L-1)5μL,上游引物15μL,下游引物25μL,pfuDNA聚合酶1μL,反转录产物1μL,加去离子水至50μL。将上述各组分混合均匀,预变性94℃3 min、变性94℃30 s、退火68℃ 30 s、延伸72℃ 30 s。经过30个循环后在72℃5 min。PCR产物行1%琼脂糖凝胶电泳检测。将获得的人Cu/ZnSOD蛋白全长CDs片段,加腺嘌呤(A)处理纯化后插入PGEMT载体,获得 PGEM-Cu/ZnSOD(CDs)载体。
1.2.3 pET16b-PTD4-Cu/ZnSOD蛋白原核表达载体的构建 用XhoI、BamHI酶切获得的pGEM-Cu/ZnSOD(CDs)载体,获得两端带有黏性末端的双链全长Cu/ZnSOD CDs片段,同时用同样的酶对pET-16b空载体进行双酶切。胶回收两端带有黏性末端的线性载体及Cu/ZnSOD全长CDs片段,将其定向插入pET-16b空载体,获得 pET-Cu/ZnSOD(CDs)原核表达载体。对上述获得的 pET-Cu/ZnSOD(CDs)原核表达载体进行特异性酶切,并根据PTD4设计的两条简并寡核苷酸序列进行高特异性退火杂交,获得人工合成的两端带有限制性内切酶黏性末端的小片段简并双链DNA序列,将其插入上述线性载体中,获得 pET-PTD4-Cu/ZnSOD(CDs)原核表达载体。
1.2.4 重组质粒pET16b-PTD4-Cu/ZnSOD酶切鉴定 选用引物设计时修饰的所带有的酶切位点XhoI和 BamHI酶切鉴定正确重组的 PDC315-TRAIL载体。酶切体系如下:10×Buffer 5μL,Plasmid 5μL,100×BSA 1μL,内切酶各2μL,加去离子水至总体积50μL,反应条件37℃过夜,分别加入1%琼脂糖凝胶中,在1×TAE中进行电泳,观察酶切结果,选取正确的克隆送上海生工生物技术有限公司测序鉴定,用 T7、SP6测序引物测序与GENEBANK X02317 CDs比对。
1.2.5 PTD4-Cu/ZnSOD融合蛋白的诱导、表达与纯化 将上述原核表达载体导入感受态E.coli BL21(DE3)中,铺叠到含氨苄青霉素(100 mg·L-1)的TB固体培养基中培养16 h,挑取单个菌落至50 mL含氨苄青霉素(100 mg·L-1)的 LB液体培养液中37℃增扩培养。当细菌生长至OD600为0.6时(大约3 h)加入0.1 mol·L-1IPTG至终浓度1 mmol·L-1,置25℃诱导培养过夜。低温离心收集细菌,将收集的菌体溶于25 mL结合缓冲液,然后冰浴超声破菌,低温离心收集上清。把上清缓慢通过Ni+2-亲和层析柱,完毕后,静置1~2 h,使融合蛋白上的His-Tag与层析柱内的Ni+2结合,再用10倍体积的结合缓冲液和6倍体积的漂洗缓冲液(60 mmol· L-1imidazole,500 mmol· L-1NaCl,20 mmol·L-1Tris HCl,pH 7.9)分别过柱,洗脱未结合的其它蛋白,然后用洗脱缓冲液(1 mol·L-1imidazole,500 mmol·L-1NaCl,20 mmol·L-1Tris-HCl,pH 7.9)洗脱蛋白,分别得到 His-Tag-Human Cu/ZnSOD和His-Tag-PTD4-Human Cu/ZnSOD两种融合蛋白。分别储存于70℃冰箱内用于以下的实验。
1.2.6 PTD4-Cu/ZnSOD融合蛋白穿膜能力检测人心肌细胞株购于ATCC。在细胞的培养液中不加任何处理因素(对照组),或分别加入10μmol·L-1的 Cu/ZnSOD(Cu/ZnSOD组)、10μmol·L-1的PTD4-Cu/ZnSOD(PTD4-Cu/ZnSOD 组),孵 育 10 min。免疫组织化学法检测融合蛋白穿膜能力:4℃的4%多聚甲醛固定24 h、PBS洗涤后,加入抗His或抗SOD的单克隆抗体,4℃冰箱孵育12 h。PBS洗涤后每孔加入浓度为FITC标记二抗,孵育、洗涤,用 DAPI染色液复染细胞核,用荧光显微镜照相。
2 结果
2.1 Cu/ZnSOD全长CDs的克隆及序列测定Cu/ZnSOD cDNA上下游引物扩增后,行琼脂糖凝胶电泳,可见预期的482 bp大小的片段(图1)。
2.2 p ET16b-PTD4-Cu/ZnSOD双酶切鉴定pET16b表达系统为了便于克隆表达蛋白,设计有NdeI、XhoI、BamH三个酶切位点,将 hCu/ZnSOD CDs插入XhoI、BamHI两位点之间,得到pET16b-Cu/ZnSOD原核表达载体。接着把人工设计合成PTD4的核酸片段插入NdeI、XhoI位点之间,得到pET16b-PTD4-Cu/ZnSOD原核表达载体。Cu/Zn-SOD cDNA序列有 XhoI、BamHI两个酶切位点,经过XhoI、BamHI酶切后,出现预期的564 bp和5 148 bp的2条带(图2)。

图1 RTPCR产物电泳结果
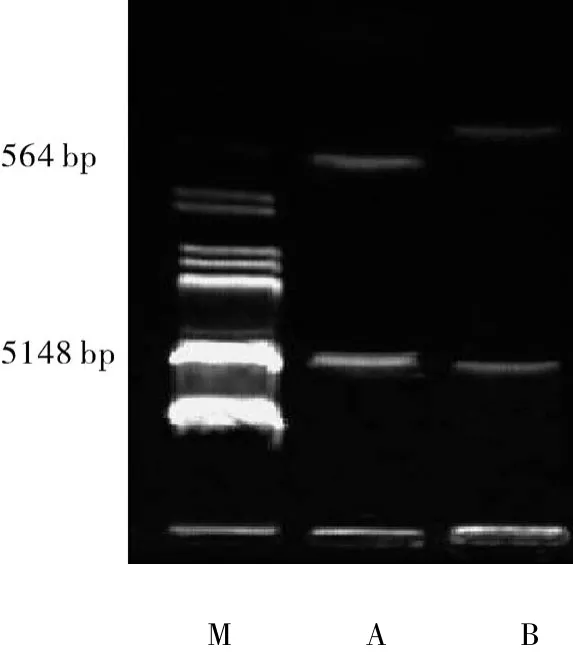
图2 重组质粒酶切电泳
2.3 p ET16b-PTD4-Cu/ZnSOD质粒测序结果将RT-PCR获得的人 Cu/Zn SOD全长 CDs插入PGEM-T载体中,酶切,选取正确的克隆。用 T7、SP6引物进行正反向测序获得的序列经过软件对比显示我们测序的序列与已被登陆的GENBANK“X02317”CDS序列一致(图3)。
2.4 表达后细菌的蛋白提取物和融合蛋白纯化后的SDS Page分析 融合蛋白提取物和融合蛋白纯化后 SDS-PAGE(图4)结果表明,分别在18.6 kDa和20 kDa出现Cu/ZnSOD和PTD4-Cu/ZnSOD目标表达条带,显示目的融合蛋白的表达量在约占宿主总蛋白表达量的46%。图象显示洗脱液里含有的纯化融合蛋白量,提取后分装放置在-70℃保存。

图3 pET16b-PTD4-Cu/ZnSOD原核表达质粒测序结果

图4 蛋白提取物和融合蛋白纯化后的SDS Page分析
2.5 融合蛋白质穿膜能力检测 与对照组和Cu/ZnSOD组比较,PTD4-Cu/ZnSOD组细胞内绿色荧光显著增强。显示融合蛋白PTD4-Cu/ZnSOD能穿透心肌细胞,分布于胞质及胞核中。
3 讨论
Gu/ZnSOD是一种广泛存在于真核生物细胞的细胞质、植物的叶绿体及过氧化物酶体中的大分子蛋白,在胞质内发挥抗氧化作用,是机体内主要的特异性的内源性氧自由基清除剂[4]。在正常情况下,细胞内有一定量的表达,以保持机体内氧化-还原的稳态。发生缺血再灌注时,由于氧自由基生成速度远远超过的清除能力,导致氧自由基的堆积,从而发生再灌注损伤。因此增加细胞内Gu/ZnSOD的水平则有可能成为防治缺血再灌注损伤的有力措施,但是Gu/ZnSOD在哺乳动物细胞膜上没有专一受体或通道,所以外源性的Gu/ZnSOD很难进入细胞和组织内发挥生物学作用的,由此限制了其在临床的应用。近年研究发现利用病毒载体、脂质体作为载体转染SOD基因对大鼠心肌缺血再灌注损伤有明显保护作用。但这些方法存在一些关键问题尚未解决,主要包括基因导入效率、基因表达的可控性、安全性等,从而能限制了上述方法在临床上得应用[5]。因此本研究目的是找到一种合适的方法将 Gu/ZnSOD带入到细胞内,为应用 Gu/Zn-SOD防治心肌缺血再灌注损伤提供参考。
Green等和Frankel等在1988年首次报道了HIV-1的反式激活蛋白Tat具有跨膜进入细胞的功能[6-7]。进一步研究发现,Tat蛋白真正具有转导作用的是其序列中的47~57这11个氨基酸残基,称之为PTD。在研究这些序列特征与结构后,Alan等应用生物信息学软件通过改变结构域中疏水氨基酸和碱性氨基酸的种类和分布、优化表面电子分布,得到人工设计出比TAT-PTD具有更高效率的穿膜活性的PTD分子。与此同时,各国的研究者分别把TAT-PTD、9-Polylysine、以及用生物信息学软件设计的多肽结构引入Human Cu/ZnSOD和其它目的蛋白的透膜实验,显示出逐渐增强的穿膜特性[8]。随后,TAT-PTD介导多种大分子跨膜进入细胞的实验广泛开展[9],对其生物合成过程,融合蛋白的免疫活性,毒性,穿膜效能和靶向治疗等进行了深入研究。本研究中,我们设计并合成一段高效PTD序列用于融合表达的 PTD4-Cu/ZnSOD蛋白[10],并构建 出 pET16b-Cu/ZnSOD 和 pET16b-PTD4-Cu/Zn-SOD两种原核表达载体。选用pET16b作为原核表达载体,使表达的两种蛋白的N段含有连续的10个His标签融合序列,以便于方便快捷利用Ni+2柱层析进行纯化,方便检测。两种载体可以高效地稳定表达两种蛋白,其表达效率可达49%和42%。蛋白以可溶的形式表达,有利于重折叠形成有活性的蛋白,这是其发挥生物学效应的关键[11]。已有研究证实正确折叠的TAT-GFP蛋白虽可高效转导至细胞内但其荧光强度显著降低。蛋白使氧自由基的消除的过程中也同样依赖于过氧化氢酶的作用,PTD-Cu/ZnSOD进入细胞后把氧自由基转化成H2O2,由过氧化氢酶再把H2O2还原为H2O和新生态氧而转化成O2。因此PTD-Cu/ZnSOD蛋白的活性不仅依赖于蛋白表达时的复性重折叠,也依赖于细胞内过氧化氢酶的含量。
本研究发现,经PTD4-Cu/ZnSOD处理的心肌细胞,胞内出现高水平的His,由于正常细胞内几乎没有His结构,说明这种His结构是外源性的PTD4-Cu/ZnSOD导入的,并且PTD4-Cu/ZnSOD处理的细胞内SOD水平显著高于正常心肌细胞,由此可见,我们实验中构建的PTD4-Cu/ZnSOD具有高效的穿透细胞膜的内化作用。
综上所述,本研究依赖于生物信息学蛋白结构和跨膜蛋白结构的原理设计合成具有高效穿膜活性的PTD结构和Cu/ZnSOD融合表达,经过实验显示良好的穿膜特性,进一步提高了PTD分子的内化作用,为建立一种高效的PTD分子打下了良好的基础。而PTD能够携带生物大分子高效进入成活细胞的特性也预示着其广阔的应用前景,可以把PTD作为一种载体工具,携带缺少穿越细胞膜能力的生物大分子高效穿越细胞生物膜来发挥其生物活性,进行靶向治疗。
[1] 贾进明,濮翔科.PEP-1-SODl融合蛋白的制备、表达及纯化[J].徐州医学院学报,2015,35(2):105-108.
[2] ALAN HO,STEVEN R,SCHWARZE J,et al.Synthetic protein transduction domains:enhanced transduction potential in vitro and in vivo[J].Cancer Research,2001,61(2):474-477.
[3] 刘莲,余榕捷,戴云,等.重组蛋白 PTD-HSP27的制备及其穿细胞膜和角膜组织的功能研究[J].中国病理生理杂志,2015,31(1):135-140.
[4] VONK WI,WIJMENGA C,BERGER R,et al.Cu,Zn superoxide dismutase maturation and activity are regulated by COMMD1[J].J Biol Chem,2010,285(37):28991-29000.
[5] 王冠杰,赵娅娟,董济民.脂质体和厚朴酚联合热疗对腺样囊性癌增殖的协同抑制作用[J].安徽医药,2016,20(7):1237-1240.
[6] GREEN M,LOEWENSTEIN PM.Autonomous functional domains of chemically synthesized human immunodeficiency virus tat transactivator protein[J].Cell,1988,55(6):1179-1188.
[7] FRANKEL AD,PABO CO.Cellular uptake of the tat protein from human immunodeficiency virus[J].Cell,1988,55(6):1189-1193.
[8] YU C,WANG P,LI S,et al.The protective effect of Cu/Zn-SOD against oxidative stress after PTEN deletion[J].Cancer Invest,2011,29(4):253-256.
[9] HUANG C,DU R,ZHANG P,et al.Expression,purification,and functional characterization of recombinant PTD-SARA[J].Acta Biochim Biophys Sin(Shanghai),2011,43(2):110-117.
[10]LIU J,HOU J,XIA ZY,et al.Recombinant PTD-Cu/Zn SOD attenuates hypoxia-reoxygenation injury in cardiomyocytes[J].Free Radic Res,2013,47(5):386-393.
[11]YOON JS,JUNGYT,HONGSK,et al.Characteristics of HIV-Tat protein transduction domain[J].J Microbiol,2004,42(4):328-335.

