胰岛素抵抗与心血管病理生理机制
张静,赵春江,蔡辉
(南京军区南京总医院中西医结合科,江苏南京 210002)
临床研究表明,胰岛素抵抗(IR)是高血压、动脉粥样硬化、冠心病、糖尿病肾病等心血管疾病产生的潜在危险因素。本文参阅相关文献资料,首先简要概述了胰岛素的生理作用,其次试析了IR与心血管损伤之间的机制,并进一步总结出有关“IR导致靶器官损害机制”的三点基本认识,即IR的“蓄积”效应、“局部IR效应”和“靶器官损伤差异性”。
1 IR的概念和临床特点
目前认为:IR是指全身性胰岛素敏感性下降的一种状态,即胰岛素的外周组织及靶器官或靶组织,主要是肝脏、脂肪组织、骨骼肌对胰岛素的敏感性及反应性降低,致正常量的胰岛素产生的生物学效应低于正常水平,常伴有高胰岛素血症[1]。
因此,IR的显著特点是高胰岛素血症,同时可伴有其他并发症的临床表现,如肥胖、高血压、高脂血症、动脉粥样硬化等临床特征,但并非高胰岛素血症均由IR引起。
2 胰岛素的生理作用机制
胰岛素是体内最强有力的合成内分泌素,调节蛋白质、脂肪、离子和氨基酸转运、细胞增殖、分化、一氧化氮(NO)的合成,且对这些作用敏感性差别很大,具有生理作用选择性与器官选择性,这种选择性决定了在IR及高胰岛素状态下,胰岛素对靶器官损伤程度不同,具有损伤差异性,这种差异性取决于靶器官对胰岛素水平的耐受[2]。
胰岛素通过与靶器官上的胰岛素受体结合而发挥作用。其受体属于酪氨酸激酶受体,胰岛素与细胞内存在的胰岛素受体底物(IRS)结合后引起多个酪氨酸残基磷酸化。磷酸化后的IRS可以与多种蛋白激酶、蛋白磷酸酶锚定和激活,对连接蛋白、磷脂酶和离子通道具有易化作用,从而中介下游一系列级联反应(图1)。
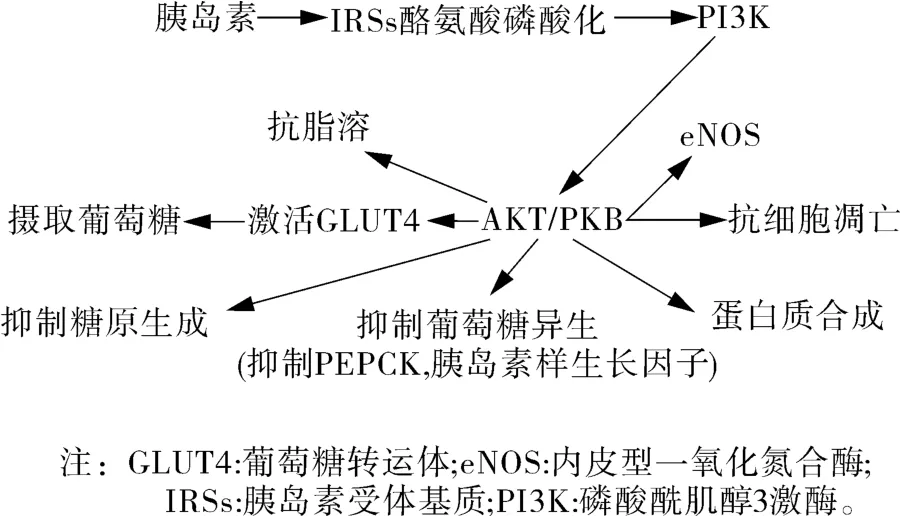
图1 胰岛素激活PI-3K/AKT信号系统参与糖代谢
通过上述信号转导机制,胰岛素可改变三大营养物质酶活性,发挥重要的调节作用,最显著的就是提高组织摄取葡萄糖的能力,促进糖原合成,增强糖酵解、糖氧化和丙酮酸氧化过程,减少糖异生和糖原分解,降低血糖,同时促进脂肪和蛋白质合成,抑制其分解;增加机体脂肪和蛋白质含量,这是胰岛素的经典代谢调节作用。
除此之外,胰岛素还可通过激活MAPK途径,对细胞增殖、损伤及凋亡产生重要影响,并呈现出浓度依赖性的特点,即在一定范围内,胰岛素损伤并诱导细胞凋亡,在适当范围内又能促进细胞的生长、增殖(图2)。
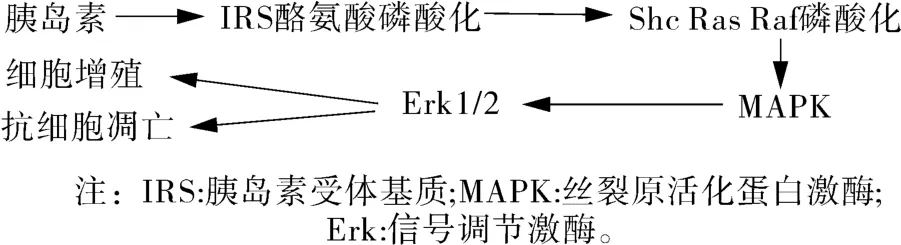
图2 胰岛素活化MAPK参与细胞增殖和凋亡
上述两种信号转导途径是胰岛素主要的受体后传导途径,并且两者具有“竞争性抑制作用”,特别是对于高胰岛素状态,具有明显的刺激MAPK途径,同时抑制PI-3K途径的作用[2]。
3 IR及心血管损伤病理机制
3.1 IR的病理机制 IR的发生与遗传、肥胖、饮食运动不良、吸烟以及部分药物如噻嗪类,β受体阻滞剂的使用等原因密切相关,其发生机制复杂,涉及多种因素的相互作用,相互影响,目前认为胰岛素信号转导障碍是IR的主要机制。
胰岛素信号转导障碍可以分为受体前、受体和受体后缺陷,又以受体后水平的变化最为多见,是产生IR的主要原因。具体机制有(1)胰岛素受体基质(IRS)异常:①IRS的不正常降解,导致其含量下降,减弱靶细胞对胰岛素的敏感性。②IRS磷酸化异常:包括IRS丝氨酸/苏氨酸位点磷酸化水平异常增高和IRS酪氨酸位点磷酸化水平的降低。③IRS分布异常:IRS在胞质内过度聚集引起IR。(2)PI-3K异常:PI-3K的表达和(或)活性降低,导致胰岛素信号无法通过PI-3K通路传递,出现IR。(3)PKB异常:PKB是PI-3K的直接靶蛋白,PKB表达和/或活性降低,可导致IR的形成。(4)GSK-3异常:GSK-3在胰岛素作用下,磷酸化而失活,启动糖原合成,促进葡萄糖转运,GSK-3表达水平的升高与IR的发生发展具有密切关系。(5)GLUT4异常:GLUT4的表达减少、转位障碍以及内在活性的降低使葡萄糖的摄取和代谢受损,产生胰岛素作用障碍[3]。
有文献报道IR与炎症密切相关[4],肿瘤坏死因子-α(TNF-α)作为主要的炎症因子之一,在体内外均可诱导IR的发生[5]。徐杰等[6]研究发现TNF-α可以特异性诱导11β-HSDl的表达。同时证实了TNF-α引起 IR,HepG2细胞中,11β-HSDl确实参与了TNF-α诱导的IR,BVT2733可以显著提高胰岛素敏感性,逆转TNF-α的作用。
3.2 IR与心血管损伤的病理生理机制 IR对心血管系统的损伤作用最常见于糖尿病所致的慢性并发症,主要分为大血管病变和微血管病变。前者主要表现为动脉粥样硬化,后者是糖尿病的特异性并发症,其典型改变是微循环障碍和微血管基底膜增厚,损伤机制复杂,主要体现在对血管内皮细胞、血管平滑肌细胞和心肌细胞的影响,特别是IR引起内皮细胞损伤及功能障碍,在IR与心血管损伤中,具有举足轻重的作用。
3.2.1 IR对血管内皮细胞损伤的机制 近年来研究发现,胰岛素可通过酶诱导形式损伤血管内皮细胞,而血管内皮细胞的损伤是心血管疾病发生的首要环节[7]。血管内皮细胞是胰岛素的靶器官之一,胰岛素与内皮细胞上的受体结合后,通过促进内皮细胞合成及释放一氧化氮(NO)、内皮素-1(ET-1)而实现血管舒张与收缩的生理功能。内皮功能紊乱是2型糖尿病(T2DM)大血管病变的早期危险因素[8]。
血管内皮细胞(EC)是一种覆盖整个血管壁的扁平单层细胞。具有合成分泌生物活性物质(主要有NO、活性氧、前列腺素、内皮素、血管紧张素Ⅱ等)、屏障功能、调节血管通透性、接受和传递信息以及抗凝和促凝作用。
正常情况下,胰岛素通过 PI-3K途径,上调eNOS的表达,增加NO的产生,NO可扩张血管作用,从而增加肌肉和脂肪组织对葡萄糖的利用。另外通过MAPK途径刺激ET-1的分泌,使血管根据机体需要舒张和收缩,并且次路径完全独立于PI-3K途径。这两种途径维持了葡萄糖代谢水平与血流动力学的稳定与平衡[9-10]。在IR及高血糖存在的情况下,此种平衡失调,内皮细胞、大动脉及心脏的eNOs和内皮素mRNA表达水平降低,NO产生减少,血管张力增加,IR通过改变血管内皮细胞分泌的血管活性介质影响动脉张力,但不影响血管表皮生长因子的表达[11]。王熠等[12]研究发现 T2DM中存在内皮细胞IR,使得胰岛素诱导内皮源性的血管收缩因子产物增加,参与了内皮功能紊乱的机制。
另外,在IR及高血糖存在的情况下,机体易诱发氧化应激反应,使活性氧类物质(ROS)生成增加,此类物质极易与周围分子反应,损伤细胞膜相结构,破坏细胞骨架,引起内皮细胞,血管平滑肌细胞受损,血管反应调节异常,心血管事件风险增加[3](图3);同时,活性氧类物质可激活核因子-JB(NF-JB)、催化蛋白(AP)-1、MAPK、c-Jun氨基末端激酶(JNK)和己糖胺等多种信号转导通路,引起胰岛素受体和丝氨酸/苏氨酸激酶信号级联活化,抑制酪氨酸磷酸化,导致下游信号分子活性降低,减弱胰岛素的效应,并又可通过使高级糖基化终末产物(AGE)增加的途径,抑制IRS-1和IRS-2酪氨酸的磷酸化、减少PI-3K和Akt的激活、降低糖原合酶的活性。加剧IR,形成恶性循环[10]。
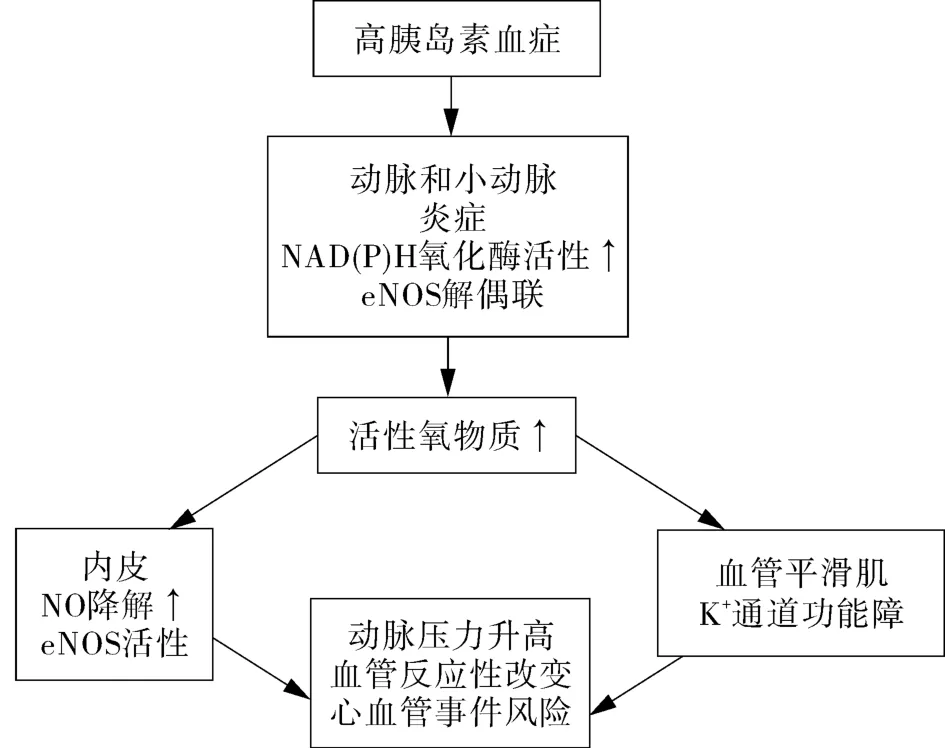
图3 活性氧类物质增加心血管事件风险
另有研究表明,炎性因子的参与是IR与内皮细胞损伤的重要机制[14]。
IR状态下血液循环系统中炎性指标异常,如C-反应蛋白(CRP)、TNF-α、瘦素增高,脂联素降低等。瘦素可能是2型糖尿病患者亚临床血管病变及IR的危险因素,脂联素可能是糖尿病动脉粥样硬化及IR的保护因子。CRP、TNF-α可能是通过激活经典的IKKB-NF-JB分子通路导致内皮源性NO产生减少,血管舒张功能异常[15-17]。
脂肪组织中的炎症反应也参与血管内皮损伤。在IR的肥胖患者中,皮下脂肪组织巨噬细胞浸润,并上调细胞因子的表达,导致血管内皮功能障碍,在脂肪组织中炎症可能参与全身动脉损伤[18],而降脂药HMG-CoA还原酶选择性抑制剂——阿托伐他汀,在降低胆固醇水平的同时,具有减轻IR,抗炎,并增加血管紧张度的作用[19]。
内皮细胞功能受损后,可导致(1)分泌活性物质功能紊乱,其中可引起AngⅡ升高,AngⅡ具有致炎症作用,进一步加剧了血管的损伤,产生氧化脂蛋白,氧化脂蛋白是内皮细胞损伤的关键成分,也是形成动脉粥样硬化、高血压的基础。(2)屏障功能受损,使细胞间隙增大,通透性增加,有利于大分子物质以及炎性细胞进入血管壁中,促进动脉粥样硬化的发生。(3)接受和传递信息功能失调,主要表现在内皮细胞存在的受体功能的紊乱,血流动力学调节紊乱。(4)凝血异常,心血管内皮细胞的损伤是血栓形成最重要和最常见的原因。内皮细胞损伤后可启动内源性及外源性凝血过程,另外IR可引起纤溶酶原激活物抑制物1(PAL-1)升高,两者均有利于血栓形成,易导致机体动静脉栓塞。
因此,IR可以损伤内皮细胞,导致内皮细胞功能障碍,是原发性高血压、动脉粥样硬化、冠心病等疾病产生的重要因素,同时,内皮细胞功能紊乱又加剧了IR,两者相辅相成,互为因果。
除此之外,另有研究表明:2型糖尿病患者内皮祖细胞(EPC)数量减少,增殖迁移能力降低,外周血单核细胞核因子-κB活化,并可能通过可能通过上调sE-let、sICAM-1的表达,共同参与了IR及大血管病变的发生、发展过程[20-21]。
3.2.2 IR对血管平滑肌损伤的作用机制 血管平滑肌是指存在于血管壁且组成其主要部分的特定类型平滑肌。主要功能是调节体内血管的管径,平衡和调节血压动态稳定。IR对血管平滑肌损伤的作用主要表现为:在高胰岛素水平下,胰岛素通过类胰岛素1号增长因子(IGF-1)结合蛋白4和5的不同表达和生物学活性作用而发挥促增殖作用,促进血管平滑肌合成胶原并迁移[22]。这一作用使血管管壁增厚,管腔狭窄,成为高血压、冠心病、脑梗死等疾病的发病基础。
进一步研究分析,在IR出现的早期,大血管和微血管平滑肌细胞BKCa功能均受损[23]。BKCa主要作用为调节膜电压和Ca2+内流,在调节血管紧张度中发挥关键作用。该功能受损可导致通道对Ca2+敏感性大大增高而增加通道的开放时程和开放概率,导致血管紧张度增加,加速高血压及动脉粥样的进程。除Ca2+通道功能异常外,国外相关研究显示:参与动脉反射的四种钾离子通道,即:ATP敏感性钾离子通道(KATP),Ca2+调钾离子通道(K2+Ca),内向整流钾离子通道(IRK)以及电压依赖性钾离子通道(KV),这些通道接受来自内皮细胞、组织或血管周围神经组织分泌的血管活性物质的调节,在IR状态下,该通道功能受损,血管平滑肌细胞内外离子正常浓度梯度维持异常,导致平滑肌功能调节受损[24],但具体机制仍未明确,尚需进一步研究。
3.2.3 IR对心肌损伤的作用机制 IR引起的心肌损伤作用,主要继发于心脏微血管病变和心肌代谢功能紊乱引起的心肌广泛灶性坏死(称为糖尿病心肌病),可诱发心力衰竭、心律失常和猝死。下面主要分析IR引起心肌代谢功能紊乱的机制。
在正常情况下,心肌供能的主要物质是游离脂肪酸(FFA),而在IR的情况下,心肌代谢紊乱,发生心肌代谢重构[25],即心肌细胞糖类和脂肪等物质代谢紊乱引起的心脏能量代谢途经改变,致使心肌能量产生障碍,导致结构和功能异常的现象。
IR时,葡萄糖摄取及利用减少,脂肪酸生成和摄取过多,心肌细胞内FFA含量显著高于正常心肌。在早期,脂肪酸β氧化相关的酶表达及活性代偿性增高,增加对FFA的利用。晚期参与脂肪酸氧化的基因下调或功能缺陷,FFA氧化利用减少,直接导致三磷酸腺苷(ATP)缺乏,心肌能量供应缺乏,心肌细胞膜上离子通道重塑[26],主要表现在:(1)外向钾电流(Ito):电流密度下降及 Kv2.1、Kv4.3、Kv4.2转录翻译水平下降,造成复极延长,心电图有明显改变,并且在使用胰岛素处理后,这一现象可以逆转;(2)钙平衡失调和心肌兴奋-收缩耦联功能改变:主要为Ca2+瞬间幅度变小导致的收缩功能障碍和Ca2+衰减变慢导致的舒张功能障碍;(3)IkATP通道:该通道的开放状态取决于 ATP/ADP比值、pH值等细胞代谢微环境的情况,将细胞代谢微环境与心肌兴奋连接起来,通过减轻钙超载主要机制保护心功能,在IR的状态下,该通道对代谢微环境变化的敏感性降低,容易导致钙超载,引起心肌损伤;(4)离子泵功能状态改变:参与心肌兴奋、收缩的离子泵主要有Na+-K+泵、Ca2+泵等,ATP能量供应不足,直接导致离子泵功能降低,影响心肌细胞内外离子浓度梯度的建立,对心肌兴奋性、自律性、传导性、收缩性产生重要影响。
4 结论
综上所述,IR与高胰岛素血症对心血管内皮细胞的损伤是导致心血管疾病的主要机制,氧化应激反应和炎性反应心血管内皮细胞的损伤中发挥关键作用。对血管内皮细胞、血管平滑肌细胞及心肌离子通道的损伤,是IR导致心血管损害及心血管系统疾病的重要路径,但具体病理机制错综复杂,尚未明晰。
分析IR与心血管损伤机制的核心和关键在于胰岛素正常发挥生理作用的分子生物学路径受损,导致胰岛素的“蓄积”。这种蓄积不仅仅体现在血浆胰岛素水平的升高,从分子生物学水平角度来说,更体现在因为胰岛素信号转导障碍所致其上游环节产物的蓄积,并由此引发一系列的级联反应、瀑布效应所产生的损伤。
其次,“局部IR效应”也可能参与IR及心血管损伤的形成。无论是从宏观角度还是微观分子水平,胰岛素的作用机制和信号转导机制的路径很多,但并非所有路径均同时对胰岛素产生抵抗效应,增高的胰岛素水平势必加强其他途径的“输出”,以降低体内过高的胰岛素水平,这一点与胰岛素的生理作用选择性与器官选择性类似,但并非完全相同。其主要效应是增加其他胰岛素代谢途径的负荷,引起心血管等靶器官相应改变。
再次,胰岛素对靶器官的生理作用选择性与器官选择性是引起IR、心血管损伤以及靶器官损伤差异性的重要因素。这种双重选择作用一方面可以理解为不同器官组织对胰岛素的敏感差异性。另一方面可以理解为同一器官,不同生理功能的差异性。这种生理上差异决定了在IR及高胰岛素血症状态下,心血管等靶器官的损伤程度,甚至是损伤顺序。如IR对血管的损伤更为直接和广泛,而对于心肌的损伤多继发于心肌内微血管病变以及心肌代谢重构。
总之,IR与心血管损伤的病理生理机制错综复杂,很多机制并未明确,但首先应明确胰岛素对心血管靶器官生作用的生理机制,特别是胰岛素作用机制的信号转导途径,只有明确正常的生理机制才能分析其发病环节。另外,在研究方法上,可采取模块分区方法,以胰岛素生理效应的不同信号转导途径为主线模块,分析各模块之间以及各路径上游和下游的相互关系,并将其与病理损伤系统(如高钙损伤机制、氧化应激损伤、炎症机制、离子通道异常等)联系起来,寻找其中的共同路径和桥接点,将更有利于病理生理机制的分析。
[1] 方颖璇,赖德源.胰岛素抵抗与慢性肾脏病关系的研究进展[J].临床医学工程,2012,19(1):141-144.
[2] 胰岛素生理作用选择性与器官选择性[J].中华高血压杂志,2009,17(1):82-83.
[3] 赵海燕,王勇,马永平,等.胰岛素信号转导障碍与胰岛素抵抗[J].新医学,2010,41(4):267-271.
[4] LOU M,LUO P,TANG R,et al.Relationship between neutrophillymphocyte ratio and insulin resistance in newly diagnosed type 2 diabetes mellitus patients[J].BMC Endocr Disord,2015,15:9.
[5] LIANG H,YIN B,ZHANG H,et al.Blockade of tumor necrosis factor(TNF)receptor type 1-mediated TNF-alpha signaling protected Wistar rats from diet-induced obesity and insulin resistance[J].Endocrinology,2008,149(6):2943-2951.
[6] 徐杰,李国平,唐蔚青,等.Ⅰ型11β羟基类固醇脱氢酶在肿瘤坏死因子-α诱导的胰岛素抵抗中的作用[J].中华老年医学杂志,2016,35(5):537-542.
[7] 肖新华.胰岛素抵抗的病理生理机制和治疗选择[J].国外医学(内分泌学分册),2005,25(3):179-181.
[8] SENA CM,PEREIRA AM,SEIÇA R.Endothelial dysfunction-a major mediator of diabetic vascular disease[J].Biochim Biophys Acta,2013,1832(12):2216-2231.
[9] 郑佳荣.胰岛素抵抗与血管内皮细胞释放一氧化氮关系的研究进展[J].黑龙江医药,2012,25(1):49-50.
[10]王彤.胰岛素抵抗与血管内皮功能障碍[J].江西医药,2012,47(1):84-87.
[11]VICENT D,ILANY J,KONDO T,et al.The role of endothelial insulin signaling in the regulation of vascular tone and insulin resistance[J].JClin Invest,2003,111(9):1373-1380.
[12]王熠,叶红英,张朝云,等.环氧化酶2介导2型糖尿病db/db小鼠胰岛素抵抗内皮功能紊乱的机制[J].中华糖尿病杂志,2016,8(4):232-236.
[13]BUSIJA DW,MILLER AW,KATAKAM P,et al.Adverse effects of reactive oxygen species on vascular reactivity in insulin resistance[J].Antioxid Redox Signal,2006,8(7/8):1131-1140.
[14]蒲素,余叶蓉,陆志明.炎症因子对胰岛素抵抗动物模型血管内皮细胞功能影响的研究[J].四川大学学报(医学版),2010,41(3):398-402,419.
[15]蒋晓真,邹宇峰,顾哲,等.炎症因子与胰岛素抵抗及糖尿病亚临床血管病变的关系研究[J].中国全科医学,2010,26(13):2900-2902,2905.
[16]许奕.胰岛素抵抗与2型糖尿病患者微血管病变的相关性[J].上海医药,2009,30(5):215-216.
[17]孙霞,汪大望.脂肪细胞因子与胰岛素抵抗及大血管病变的相关性研究进展[J].温州医学院学报,2011,41(5):506-508,封3.
[18]APOVIANCM,BIGORNIA S,MOTTM,et al.Adipose macrophage infiltration is associated with insulin resistance and vascular endothelial dysfunction in obese subjects[J].Arterioscler Thromb Vasc Biol,2008,28(9):1654-1659.
[19]MAHMOUD MF,EL-NAGAR M,EL-BASSOSSY HM.Anti-inflammatory effect of atorvastatin on vascular reactivity and insulin resistance in fructose fed rats[J].Arch Pharm Res,2012,35(1):155-162.
[20]张会峰,赵志刚,袁慧娟,等.2型糖尿病患者内皮祖细胞的数量和功能与大血管病变的相关性研究[J].中国糖尿病杂志,2010,18(4):276-278.
[21]盛春永,宋士洪,王德忠,等.2型糖尿病患者外周血单核细胞核因子-κB的活化对胰岛素抵抗及大血管病变的影响[J/CD].中华临床医师杂志(电子版),2010,4(10):2011-2013.
[22]邓宜鹂,于长青,王旭开.高胰岛素对血管的损伤作用[J].现代医药卫生,2012,28(10):1530-1533.
[23]李尚俭,艾文婷,梁磊,等.胰岛素抵抗对大鼠血管平滑肌细胞BKCa功能的影响[J].西安交通大学学报(医学版),2011,32(2):145-150.
[24]DAVID W,ALLISONW,PRASAD K.Mechanisms of vascular dysfunction in insulin resistance[J].Current Opinion in Investigational Drugs,2004,9(5):929-935.
[25]VAN BILSEN M,SMEETSPJ,GILDE AJ,et al.Metabolic remodelling of the failing heart:the cardiac burn-out syndrome[J].Cardiovasc Res,2004,61(2):218-226.
[26]李德隆,李卫华,黄峥嵘.胰岛素抵抗与心肌离子通道[J].中国心脏起搏与心电生理杂志,2011,25(6):553-555.

