Levan型低聚果糖对断奶仔猪生长性能和养分消化率的影响
敖 翔,周建川,张立泰,李元凤,何 健
(1.四川铁骑力士集团冯光德实验室,四川 绵阳 621006;2.西南科技大学生命科学与工程学院,绵阳 621010)
低聚果糖具有食后不被消化吸收而直入大肠、选择性地刺激机体自身双歧杆菌增殖的作用。动物内源消化酶几乎不能分解低聚果糖,胃肠道中的有益菌群能充分利用低聚果糖,而有害菌群则很少利用。因此低聚果糖作为益生素已被广泛应用于动物饲料中(Lemieux等,2003;White等,2002)[1-2]。研究表明其具有提高动物生长性能、改善肠道健康、增加养分消化率和增强免疫力的功能(Lemieux等,2003;Roberfroid等,2005)[1,3]。Estrada 等(2001)[4]研究表明,5 000 g/t低聚果糖提高了断奶仔猪平均日增重和饲料转化率。
Levan型低聚果糖,是一类主要来源于微生物的果糖高聚物,由大量的β-(2,6)果糖苷键组成的聚糖主链和少量的β-(2,1)果糖苷键组成的支链组成(陆娟等,2013)[5]。与主要由 β-(2,1)果糖苷键组成的菊粉不同,Levan型低聚果糖具有更高的溶水性和益生活性(Kang等,2005)[6]。Levan型低聚果糖可以在胃里被酸水解,生成小分子的Levan型寡糖,随后被肠道菌群充分利用(Bernd等,2009)[7]。Jang等(2003)[8]在小鼠上已经证实了其益生素的作用。已有研究还表明Levan型低聚果糖具有抗肿瘤、抗病毒、降血脂、免疫增强的作用,还可以提高离子吸收率(陆娟等,2013;Kim 等,2004)[5,9]。
低聚果糖虽在饲料工业和养殖业中已有所应用,但Levan型低聚果糖的应用少有报道,尤其在断奶仔猪方面。鉴于此,本试验通过在饲粮中添加Levan型低聚果糖,初步研究其对断奶仔猪生长性能和养分消化率的影响,寻求Levan型低聚果糖在断奶仔猪饲粮中应用的可能性,为Levan型低聚果糖在养猪生产中的应用提供理论依据。
1 材料与方法
1.1 Levan型低聚果糖来源
试验用Levan型低聚果糖为韩国RealBioTech公司产品,为白色粉末状,纯度≥98%,平均分子量为700 kDa。
1.2 试验设计
试验采用随机试验设计,选择18日龄、体重相近的健康杜长大三元杂种断奶仔猪240头,平均体重为(5.5±0.15)kg。按体重相近、公母各半的原则随机分为3个处理,每个处理8个重复,每个重复10头仔猪。对照组饲喂基础饲粮,阿美拉霉素组在基础饲粮中添加阿美拉霉素165 g/t,Levan组在基础饲粮中添加Levan型低聚果糖1 000 g/t。预试期3 d,正试期28 d。
1.3 试验动物饲养管理
饲养试验于2017年4—5月在四川铁骑力士牧业科技有限公司万安猪场开展。仔猪饲养栏舍为封闭、漏缝地板式猪舍。饲喂、饮水和免疫等饲养管理按商业养殖场规范操作,采用自由采食,鸭舌式自动饮水器饮水。每天密切观察仔猪的采食情况、粪便质量,以及其它异常情况,并作好详细记录。同时每天记录圈舍的温度、湿度、腹泻频率和死淘数。
1.4 试验饲粮配制与生产
试验饲粮参考NRC(2012)营养标准配制。先对玉米、豆粕、鱼粉等大宗原料采样,分析测定水分、粗蛋白质等,然后设计配方。试验料生产在四川铁骑力士实业有限公司进行,生产工艺采用低温制粒加工,温度控制在60~65℃。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平
1.5 样品采集与处理
1.5.1 饲料样品 每个处理均匀取样品250 g,贮存于冰柜4℃,送检测中心进行饲料常规养分含量的测定。
1.5.2 粪料样品 每个重复随机选4头猪于试验第14天和第28天采集粪样,加10%盐酸(HCl)进行固氮,混合后保存在-20℃。所采集的粪样在65℃烘干48 h至恒重,粉碎过40目筛后冷藏备测。本试验采用内源指示剂法(Vogtmann 等,1975)[10]测定消化率,参照美国AOAC(2000)[11]的分析方法测定饲粮和粪便中养分的含量,采用绝热式氧弹热量计测定总能。
1.5.3 测定指标及方法
(1)生长性能指标。平均日增重(ADG):在试验第 0 天、第 14 天和第 28 天的早上 7:30~8:00,仔猪空腹称量,记录体重数据,计算仔猪0~14 d、15~28 d和 0~28 d的平均日增重(ADG)。
平均日采食量(ADFI):在试验期间每天记录仔猪每圈的投料量、余料量、浪费量,计算仔猪0~14 d、15~28 d和 0~28 d的平均日采食量(ADFI)。
料重比(F/G):按平均日采食量和平均日增重之比计算料重比。
(2)仔猪腹泻指标。根据腹泻程度评分标准(表2)进行仔猪腹泻程度统评分,计算仔猪0~28 d的腹泻频率。腹泻频率=试验期腹泻仔猪头次/(试验仔猪头数×试验天数)×100%。

表2 仔猪腹泻程度评分标准
(3)养分表观消化率。消化试验采用内源指示剂法,以酸不溶灰分(AIA)为内源指示剂(Vogtmann等,1975)[10],参照美国 AOAC(2000)[11]的分析方法测定饲粮和粪便中干物质、氮和总能,采用绝热式氧弹热量计测定总能。营养物质表观消化率计算参照Stein等[12](2001)的方法。
饲料消化率的计算公式为:D=1-FIA/EIA。式中:D为消化率;FIA为食物中酸不溶灰分含量;EIA为粪样中酸不溶灰分含量。
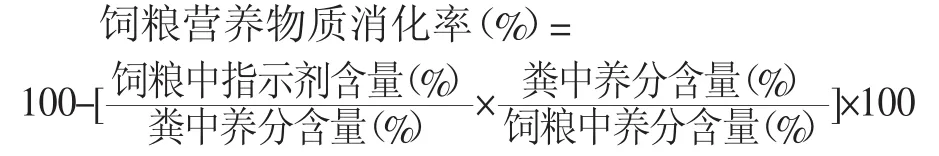
1.6 数据统计与分析
用Excel 2010进行数据统计,应用SAS 8.0统计软件进行方差分析(ANOVA),差异显著采用Duncan′s法进行多重比较,以P<0.05作为差异显著性判断标准。
2 试验结果
2.1 Levan型低聚果糖对断奶仔猪生长性能和腹泻频率的影响
由表3可知,0~14 d各处理组间日增重和日采食量差异不显著(P>0.05),而对照组和Levan组的料重比显著高于阿美拉霉素组(P<0.05)。15~28 d各处理组间日采食量差异不显著(P>0.05);而阿美拉霉素组的日增重显著高于对照组(P<0.05),且料重比显著低于对照组和Levan组(P<0.05);Levan组的料重比显著低于对照组(P<0.05)。0~28 d各处理组间日增重和日采食量差异不显著(P>0.05),而阿美拉霉素组和Levan组的料重比显著低于对照组(P<0.05)。对照组腹泻频率显著高于阿美拉霉素组和Levan组(P<0.05)。
2.2 Levan型低聚果糖对断奶仔猪养分表观消化率的影响
由表4可知,与对照组相比,Levan组提高了第14天时的干物质、氮和总能的消化率(P>0.05)。第28天时各处理组间干物质、氮和总能的消化率差异不显著(P>0.05)。
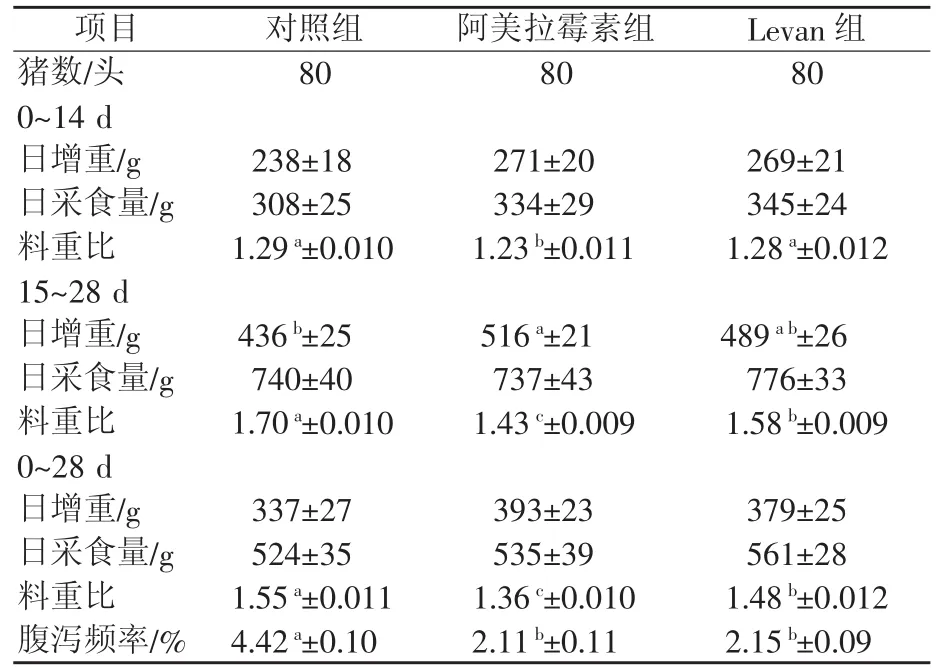
表3 Levan型低聚果糖对断奶仔猪生长性能和腹泻频率的影响

表4 Levan型低聚果糖对断奶仔猪养分表观消化率的影响
3 讨论
3.1 Levan型低聚果糖对断奶仔猪生长性能和腹泻频率的影响
本试验结果再次证实了阿美拉霉素对断奶仔猪的促生长效果,与Cromwell(1991)[13]的研究结果一致。本试验中,饲粮添加1 000 g/t Levan型低聚果糖对断奶仔猪的平均日增重、平均日采食量均未见显著影响。但与对照组相比,Levan组断奶仔猪0~14 d、15~28 d和0~28 d的日增重分别提高了13%、12%和12%。在0~14 d,添加1 000 g/t Levan型低聚果糖组的日增重几乎达到了添加165 g/t阿美拉霉素组的水平(相差2 g),而15~28 d时虽仍然高于对照组,但与阿美拉霉素组的差异变大,可见Levan型低聚果糖对前期断奶仔猪的生长还是有一定的促进作用。在15~28 d和0~28 d,与对照组相比,添加1 000 g/t Levan型低聚果糖显著降低了料重比,但未达到阿美拉霉素组的效果。有研究表明,低聚果糖对断奶仔猪生长性能无影响(Houdijk 等,1998;Mikkelsen等,2003)[14-15]。Kang等(2005)[6]和 Yamamoto 等(1999)[16]研究发现7 kg/t或1~5 kg/t Levan型低聚果糖对小鼠的日增重和采食量无显著影响。添加1.8 kg/t低聚果糖提高了断奶仔猪平均日增重和饲料转化率(Farnworth等,1992)[17]。然而,也有研究表明40 kg/t低聚果糖对断奶仔猪生长性能无影响(Mikkelsen 等,2003)[15]。
3.2 Levan型低聚果糖对断奶仔猪养分表观消化率的影响
本试验中,添加165 g/t阿美拉霉素显著增加了第14天时干物质、氮和总能的消化率,这与Hanhn等(2006)[18]研究结果一致。本试验中,Levan型低聚果糖的添加对养分消化率没有显著影响。有研究发现添加7.5、15和10 kg/t低聚果糖对生长猪养分消化率没有显著影响(Houdijk 等,1998;Mountzouris等,2006)[14,19]。此外,添加3~9 kg/t菊粉型低聚果糖或果寡糖对狗的回肠消化率没有影响(Propst等,2003)[20]。Levan 型低聚果糖对养分消化率的影响还需进一步研究。
4 结论
在本试验条件下,与对照组相比,断奶仔猪饲粮中添加1 000 g/t Levan型低聚果糖降低了料重比和腹泻频率,但还未达到添加抗生素的效果。
[1]Lemieux F M H,Bidner T D.Journal of Animal Science[J],2003,81:2482-2487.
[2]White L A,Newman M C,Cromwell G L,et al.Journal of Animal Science[J],2002,80:2619-2628.
[3]Roberfroid M B.British JournalofNutrition[J],2005,93:S13-S25.
[4]Estrada A,Drew M D,Van Kessel A.Canadian Journal of Animal Science[J],2001,81:141-148.
[5]陆娟,唐俊,肖敏,等.生物学杂志[J],2013,30(6):86-92.
[6]Kang S A,Chun U,Jang K H.Biotechnology Bioprocess Engineering[J],2005,10:582-586.
[7]Bernd H A.Clean-soil,Air,wate[J],2009,6:145-161.
[8]Jang K H,Kang S A,Cho Y,et al.Journal of Microbiology and Biotechnology[J],2003,13:348-353.
[9]Kim Y Y,Jang K H,Kang S A.Food Science and Biotechnology[J],2004,13(4):450-454.
[10]Vogtmann H,Pfirter H P,Prabucki A L.British Poultry Science[J],1975,16(5):531-534.
[11]AOAC.Official Methods of Analysis[S].17th ed.Assoc Off Anal Chem,2000,Gaithersburg,MD.
[12]Stein H H,Kim S W,Nielsen T T,et al.Journal of Animal Science[J],2001,79(8):2113-2122.
[13]Cromwell G L.Antimicrobial agents.In:E.R.Miller,D.E.Ullrey,and A.J.Lewis(Ed.)Swine Nutrition[M].Butterworth-Heinemann,Boston,MA,1991:297-314.
[14]Houdijk J G M,Bosch M W,Verstegen M W A,et al.Animal Feed Science Technology[J],1998,71:35-48.
[15]Mikkelsen L L,Jakobsen M,Jensen B B.Animal Feed Science Technology[J],2003,109:133-150.
[16]Yamamoto Y,Takashi Y,Kawano M,et al.Journal of nutritional biochemistry[J],1991,10:13-18.
[17]Farnworth E R,Modler H W,Jones D J,et al.Canadian Journal of Animal Science[J],1992,72:977-980.
[18]Hahn T W,Lohakare J D,Lee S L,et al.Journal of Animal Science[J],2006,84:1422-1428.
[19]Mountzouris K C,Balaskas C,Fava F,et al.Anaerobe[J],2006,12:178-185.
[20]Propst E L,Flickinger E A,Bauer L L,et al.Journal of Animal Sciece[J],2003,81:3057-3066.

