连接酶-ELISA检测K-ras基因突变方法研究*
肖 娜,唐一通△,崔海忠,李智山,邹玖明
(1.湖北文理学院医学院,襄阳 441053;2.湖北文理学院医学院枣阳临床学院,枣阳 441200;3.湖北文理学院附属医院,襄阳 441021)
K-ras基因是常见的致癌基因,其突变会造成表皮生长因子受体(EGFR)酪氨酸激酶抑制剂类和EGFR抗体类药物的耐药,K-ras基因突变检测能够帮助肿瘤患者制定个体化治疗方案,提高临床治疗的针对性和有效性[1-2]。目前,多种方法可进行K-ras基因突变检测[3-8]。由于DNA测序灵敏度较低,而高分辨率熔解曲线法[6]、焦磷酸测序[8]等方法虽具有较高的灵敏度,但其对实验仪器、实验条件具有很高的要求,在只具备简单实验条件的常规临床检测中很少能够应用。基于此,本研究建立了一种简便、快速、灵敏的K-ras突变检测方法,并以肺癌血浆标本为检测对象,对K-ras基因12位密码子的6个点突变进行了检测。
1 材料与方法
1.1材料
1.1.1标本来源 非小细胞肺癌血浆标本72例收集于湖北文理学院附属医院和枣阳临床学院,抽提血浆循环DNA,-20 ℃保存。
1.1.2寡核苷酸检测探针 检测探针设计方法见图1,用4条特异性检测探针P-12(SRC)-N(N=A/T/G/C)和1条共用探针P-12(SRC)检测K-ras基因12位密码子的G12S、G12R、G12C 3种突变。P-12(SRC)-N探针的5′端为通用扩增序列Tag1,中间序列为与模板同源互补序列H1,3′端为与突变位点碱基对应的互补碱基N。P-12(SRC)探针的5′端为与模板同源互补序列H2,3′端为通用扩增序列Tag2。同理,用4条特异性检测探针P-12(DAV)-N(N=A/T/G/C)和1条共用探针P-12(DAV)检测K-ras基因12位密码子的G12D、G12A、G12V 3种突变,所用检测探针和检测位点的对应见表1。

图1 检测探针设计示意图(N=A/T/G/C)
对探针进行通用扩增的引物序列为:Tag1:5′biotin-GGG TTC GTG GTA GAG CGT CGG AGT-3′;CTag2:5′digoxin-CCA GAC GAC ACC GAG ATA GCA GCC-3′。所有核酸序列由上海生工生物有限公司合成。

表1 检测探针序列
1.1.3实验试剂 2×PCR Mastermix购自天根生化科技北京有限公司,QIAamp DNA Blood Mini Kit(QIAGEN)购自上海叶舟生物科技有限公司,Low MW DNA Marker-A购自上海生工生物工程有限公司,Taq DNA 连接酶购自New England BioLabs,链亲和素磁性微粒购自西安金磁纳米生物技术有限公司,其余试剂均为分析纯。
1.2方法
1.2.1K-ras基因扩增 对K-ras基因exon2进行PCR扩增,引物为,正向引物:5′-TAA GCG TCG ATG GAG GAG TT-3′;反向引物:5′-CAT CAT GGA CCC TGA CAT AC-3′;扩增体系:标本循环DNA 5 μL,扩增引物各2.5 μL(10 pmol/μL),去离子水5 μL ,2×Taq PCR Mastermix 15 μL。扩增条件为:95 ℃ 5 min;95 ℃ 45 s,54 ℃ 45 s,72 ℃ 90 s,36个循环;72 ℃ 4 min。扩增产物进行1.5%琼脂糖凝胶电泳,同时用直接测序法测定序列。
1.2.2连接反应 用4支反应管对G12S、G12R、G12C 3种突变位点进行检测,分别标记为P-12(SRC)-C,P-12(SRC)-T,P-12(SRC)-G,P-12(SRC)-A管。另4支反应管对G12D、G12A、G12V 3种突变位点进行检测,分别标记为P-12(DAV)-C,P-12(DAV)-T,P-12(DAV)-G,P-12(DAV)-A管。各管中分别加入10×连接反应缓冲液2 μL,模板2 μL,1 U Taq连接酶。将4组检测探针P-12(SRC)-C/T/G/A和P-12(SRC)各2 μL(10 nmol/L) 分别加入P-12(SRC)-C/T/G/A管,同理,4组检测探针P-12(DAV)-C/T/G/A和P-12(DAV)分别加入P-12(DAV)-C/T/G/A管,去离子水补足20 μL。另设定一空白对照管B,不加入检测探针,其他成分与检测管相同。各管95 ℃变性 45 s,60 ℃ 3 min,10个循环,95 ℃变性5 min。
1.2.3通用扩增 取3 μL连接反应产物,加入15 μL 2×PCR Mastermix,2 μL(5 μmol/L)通用扩增引物Tag1和CTag2,去离子水补足30 μL。扩增反应为:95 ℃ 30 s;95 ℃ 30 s,60 ℃ 45 s,72 ℃ 20 s,20个循环;72 ℃ 1 min。
1.2.4产物检测 用链亲和素磁性微粒提取纯化各管通用扩增产物,将各管磁性微粒提取物对应置于96孔板中,分别加入50 μL 辣根过氧化物酶(HRP)标记抗地高辛抗体溶液,恒温摇床中70 r/min,室温15 min。PBST(1×)清洗3次后加入100 μL 四甲基联苯胺(TMB)底物缓冲液,室温显色5 min,2 mol/L硫酸(H2SO4)终止显色,酶标仪测定各反应管450 nm处光密度值(OD)。根据两组反应管(OD-C、OD-T、OD-G、OD-A和OD-B)对应显色值进行突变类型判定(若OD-B<0.05时,设定OD-B=0.05)。对G12S、G12R、G12C 3种突变位点进行检测的OD-SRC-C、OD-SRC-T、OD-SRC-G、OD-SRC-A和OD-SRC-B 5个显色管,若OD-SRC-C/OD-B>5,则此检测位点为野生型;若OD-SRC-T/OD-B>5,则此检测位点为G12S(GGT/AGT)突变;若OD-SRC-G/OD-B>5,则此检测位点为G12R(GGT/CGT)突变;若OD-SRC-A/OD-B>5,则此检测位点为G12C(GGT/TGT)突变。对G12D、G12A、G12V 3种突变位点的判定方法同理。
2 结 果
2.1K-ras基因外显子扩增 各标本扩增产物经1.5%琼脂糖凝胶电泳,所在泳道均有长度为511 bp的目标条带出现,图2显示了对8个标本的K-ras基因外显子2 PCR扩增产物电泳检测结果。

图2 K-ras基因2外显子 PCR扩增产物凝胶电泳检测

检测管标本中各检测管对应显色值(OD⁃SRC)CTGAB17#1.46±0.171.02±0.090.12±0.050.15±0.030.04±0.0451#1.62±0.130.16±0.061.16±0.150.15±0.050.07±0.028#1.71±0.180.15±0.060.12±0.060.13±0.060.05±0.0232#1.81±0.110.17±0.060.16±0.050.12±0.030.07±0.0263#1.85±0.160.16±0.070.14±0.070.11±0.060.05±0.04
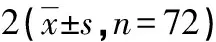
表3 循环DNA标本K-ras基因12位密码子ELISA基因突变检测结果
2.2标本检测 利用建立的方法共检测出3例标本存在突变。结果显示,突变类型分别为17#标本的G12S(GGT/AGT)突变,51#标本的G12R(GGT/CGT)突变,38#标本的 G12A(GGT/GCT)突变。3例突变标本(17、51、38#)和7例野生型标本对应各检测管的检测值见表2、3。17、51、38#标本的野生型等位基因对应检测管OD-C分别为1.46±0.17、1.62±0.13、1.59±0.09,突变等位基因对应检测管OD(OD-SRC-T、OD-SRC-G、OD-DAV-G)分别为1.02±0.09、1.16±0.15、1.14±0.02。并且,对每个突变标本检测的5个检测管中,突变等位基因检测管OD与非突变等位基因检测管OD的比值(如17#标本中OD-SRC-T/OD-SRC-G和OD-SRC-T/OD-SRC-A)明显大于5;突变等位基因检测管OD与对照管OD-B的比值(如17#标本中,OD-SRC-T/OD-B)明显大于10。对于非突变标本的检测,野生型等位基因对应检测管OD-C与其余各检测管对应的OD值比值均明显大于10。而通过对所有标本K-ras外显子扩增测序后发现,在12密码子对应测序位点均未见有明显的提示突变的杂合套峰出现。仅在17、51、38#标本相应突变碱基处有不明显的测序峰出现,且与背景分离不明显,见图3。说明直接测序方法检测灵敏度较低,对不均一标本的突变检测具有局限性,而新建立方法有着简便、灵敏的特点,适合于从不均一的标本中进行突变等位基因的检测。
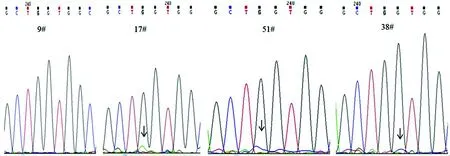
图 3 血浆循环DNA标本K-ras基因12位密码子位点测序图
3 讨 论
K-ras基因突变是EGFR-TKIs靶向药物治疗产生耐药性的原因之一,研究提示非小细胞肺癌中K-ras基因突变与较短的生存期及预后不良有密切联系[9-10]。开展K-ras基因突变检测对于肺癌、结直肠癌等肿瘤患者的个体化用药具有重要意义。DNA测序是目前核酸突变检测的金标准,但是灵敏度低,只有20%~50%[11-12],不能够有效地从肿瘤组织等不均一标本中检测到基因突变。虽然焦磷酸测序、实时定量PCR及质谱等检测方法具有高达1%的灵敏度[12-13],但这些检测方法却要求昂贵的检测平台和试剂,不能够在常规简便实验条件下应用。因此不适合于在基层医疗或研究机构应用。
本课题组在之前研究中建立了一种单核苷酸多态性(SNP)突变检测方法,具有较高的检测灵敏度,可达5%[14]。在此方法基础上,本研究根据K-ras基因突变特点,通过巧妙设计特定检测探针,建立了一种对K-ras基因突变检测的新方法。进行突变检测时,同时利用特异性检测探针3′端碱基与突变碱基的配对识别能力和Taq DNA连接酶对错配碱基的识别作用保证反应的高特异性。而方法的灵敏度则通过引物二次扩增及ELISA反应保证。
通过对K-ras基因12位密码子6种突变的检测,在72例肺癌循环DNA标本中共检测到3例突变,分别是17#标本的G12S(GGT/AGT)突变,51#标本的G12R(GGT/CGT)突变,38#标本的 G12A(GGT/GCT)突变。然而与直接测序方法比较时,测序方法中所得测序图谱在突变位点不能分离出明显的突变碱基对应峰,说明直接测序法由于检测灵敏度低,不适合于不均一的标本的突变检测。研究表明,K-ras基因突变率在不同肿瘤类型及人群中差异较大,如白种人群结直肠癌标本中可达15%~30%,而在亚裔人群肺癌标本中突变率只有4%~10%[2,4,15-17],与本研究中得出的突变检测率相近。
总之,本研究建立了一种基于连接酶-ELISA反应的对K-ras基因突变检测的方法。本方法操作简便,无需昂贵的实验仪器设备、试剂,在普通PCR仪、酶标仪等简单实验条件下即能完成。适合于在简单实验条件下对不均一标本进行常规突变检测。但是,本方法不能对未知突变位点进行检测,且有一定检测通量的限制,不适合于进行高通量检测。
[1]许洁,李丽,张科平,等.K-ras基因突变两种检测方法的比较[J].诊断病理学杂志,2013,20(10):629-633.
[2]张阳,潘振奎,张星,等.非小细胞肺癌患者K-RAS基因突变的研究[J].中国肺癌杂志,2010,13(6):602-606.
[4]KINUGASA H,NOUSO K,MIYAHARA K,et al.Detection of K-ras gene mutation by liquid biopsy in patients with pancreatic cancer[J].Cancer,2015,121(13):2271-2280.
[5]石冬琴,王荣,谢华,等.结直肠癌组织中K-ras基因突变的毛细管电泳检测[J].色谱,2013,31(6):582-586.
[6]毕媛,王捷.K-Ras基因突变检测方法进展[J].广东医学,2011,32(11):1496-1498.
[7]刑加迪,张连海,李晶晶,等.飞行时间质谱技术在结直肠癌K-ras基因突变检测中的应用[J].中华胃肠外科杂志,2013,16(1):80-83.
[8]VINCENZI B,CREMOLINI C,SARTORE-BIANCHI A,et al.Prognostic significance of K-Ras mutation rate in metastatic colorectal cancer patients[J].Oncotarget,2015,6(31):31604-31612.
[9]LI T,ZHENG Y T,SUN H,et al.K-Ras mutation detection in liquid biopsy and tumor tissue as prognostic biomarker in patients with pancreatic cancer:a systematic review with meta-analysis[J].Med Oncol,2016,33(7):61.
[10]TAO L Y,ZHANG L F,XIU D R,et al.Prognostic significance of K-ras mutations in pancreatic cancer:a meta-analysis[J].World J Surg Oncol,2016,14:146.
[11]GARCIA C A,AHMADIAN A,GHARIZADEH B,et al.Mutation detection by pyrosequencing:sequencing of exons 5-8 of the p53 tumor suppressor gene[J].Gene,2000,253(2):249-257.
[12]DUFORT S,RICHARD M J,DE FRAIPONT F.Pyrosequencing method to detect K-RAS mutation in formalin-fixed and paraffin-embedded tumor tissues[J].Anal Biochem,2009,391(2):166-168.
[13]JARRY A,MASSON D,CASSAGNAU E,et al.Real-time allele-specific amplification for sensitive detection of the BRAF mutation V600E[J].Mol Cell Probes,2004,18(5):349-352.
[14]崔海忠,肖娜,张永平,等.连接酶-ELISA反应检测循环DNA基因突变研究[J].天津医药,2015,43(5):533-536.
[15]OMIDIFAR N,GERAMIZADEH B,MIRZAI M.K-ras mutation in colorectal cancer,a report from southern Iran[J].Iran J Med Sci,2015,40(5):454-460.
[16]OHBA T,TOYOKAWA G,OSOEGAWA A,et al.Mutations of the EGFR,K-ras,EML4-ALK,and BRAF genes in resected pathological stage I lung adenocarcinoma[J].Surg Today,2016,46(9):1091-1098.
[17]卢珊珊,徐昕,郭会芹,等.非小细胞肺癌细胞学标本检测表皮生长因子受体和K-ras基因的突变[J].中华肿瘤杂志,2013,35(8):585-589.

