一种改进的小鼠嗅神经元原代培养方法及其鉴定*
田 俊,张三妹,李 丽
(1.山西医科大学第一医院耳鼻喉科,太原 030001; 2.山西大医院老年肿瘤科,太原 030032; 3.首都医科大学附属北京朝阳医院耳鼻喉科,北京 100020)
嗅神经元是气味感受的受体神经元,分布于鼻腔嗅黏膜区域。由于小鼠嗅区组织量非常少,而且早期嗅神经元的死亡几乎不可避免,小鼠嗅神经元原代培养成功率仍然很低。目前,大脑星形胶质细胞常作为原代培养嗅神经元的饲层细胞为离体的嗅神经元提供营养支持[1-3],然而,这类方法需要在培养嗅神经元之前的7~10 d接种好星形胶质细胞,并且操作过程复杂,成功率不稳定,同时饲层细胞的引入增加了后续嗅神经元纯化的难度。本研究介绍了一种改进的胚鼠嗅神经元原代培养方法,不通过饲养层细胞而获得具有典型双极神经元形态的嗅神经元,为嗅觉功能的体外研究提供实验基础。
1 材料与方法
1.1材料 嗅神经元培养基:100 mL Waymouth′s MB752/1培养基(1×,Life Technologeis公司),1 mL N2添加剂(100×,Life Technologies公司),100 μL庆大霉素(50 mg/mL,Life Technologies公司),不含钙镁的Hank′s平衡盐溶液/N-(2-羟乙基)哌嗪-N′-2-乙烷磺酸(HBSS/HEPES)液50 mL(10×),5 mL 1 mol/L HEPES(pH 7.2),5 mL青霉素-链霉素溶液(Life Technologies公司),加水至500 mL。
1.2方法 目前原代嗅神经元培养的主要步骤差别不大,通过比较这些方法后本研究以GONG等[4]介绍的方法为主进行改良,主要步骤如下。
1.2.1嗅黏膜取材 取孕15~20 d C57BL/6小鼠(购自北京维通利华实验动物有限公司,北京)的胚胎嗅神经元进行原代培养。将孕鼠腹腔戊巴比妥钠麻醉后脱臼处死,乙醇浸泡后移入超净台,取出胚胎置于HBSS/HEPES液中,见图1A。依次取出胚胎,断头后在体式显微镜下沿头部正中切开,显露并切取嗅黏膜,仔细去除黏膜下的骨质,见图1B。
1.2.2嗅黏膜的分离 将嗅黏膜置于HBSS/HEPES液稀释的2 mg/mL中性蛋白酶中37 ℃消化40 min,使嗅上皮和其基质松解,在显微镜下仔细去除混浊粘连的基质部位,见图1C。
1.2.3嗅神经元的分离和接种 将分离的小块状嗅上皮移入嗅神经元培养基中(图1 D),37 ℃ 5% CO2培养箱孵育3 h。为避免成纤维等杂细胞的污染,嗅上皮不再进一步消化。将孵育好的嗅上皮及培养基移入15 mL离心管中轻柔吹打10~15次。加入2 μL胎牛血清终止反应后静置1~2 min,吸取非沉淀部分,2 000 r/min 离心5 min,用新的培养基重悬后以5×104个/cm2接种至35 mm细胞培养皿(康宁),2 mL/皿,共6皿。用于激光共聚焦显微镜观察的神经元接种于玻璃底的专用培养皿上。
1.2.4换液 接种后的24 h以及之后的每天,用新鲜配制的温培养基更换50%旧的培养基。
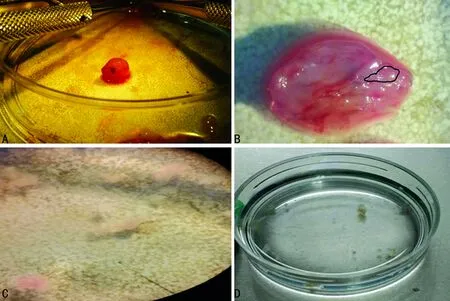
A:取出小鼠胚胎置于培养液中;B:头部正中切开,显露并切取嗅、黏膜(黑线条标记区域);C:中性蛋白酶中37 ℃消化40 min,嗅黏膜神经上皮层与基质分离;D:分离后的嗅上皮
图1嗅神经元的分离过程
1.2.5嗅神经元常规分离步骤 将嗅上皮小块转移至15 mL离心管中,2 000 r/min 离心2 min;吸掉培养基,加入1 mL温和胰酶消化(0.5 mmol/L乙二胺四乙酸),重悬后10 min 37 ℃水浴孵育;110 μL胎牛血清终止反应;用尖端0.3 mm巴斯德吸管吹打10~15次;2 000 r/min 离心5 min,弃上清后加入0.5 mL培养基后接种。
1.2.6嗅神经元的观察及鉴定 在用两种方法接种后的第1、3、5、7和9天,倒置显微镜(LEICA 4000B,德国)观察细胞形态。随机选择5个高倍视野,记录典型嗅神经元的个数。培养第5天时,采用标准的免疫荧光方法对嗅神经元进行鉴定,神经元特异的β微管蛋白Ⅲ抗体为鸡抗鼠多克隆抗体(Abcam Hong Kong Ltd,香港),工作浓度1∶200,成熟嗅神经元特异表达的嗅神经元标志蛋白(olfactory marker protein,OMP)为兔抗鼠多克隆抗体(Abcam Hong Kong Ltd,香港),工作浓度1∶200。激光共聚焦显微镜(Leica Microsystems TCS SP5,美国)观察结果。

2 结 果
通过倒置显微镜下的连续观察,按照改进的实验流程,在离体接种后24 h内大部分的细胞死亡,存活的细胞部分形态不典型(图2A),部分存活细胞则显示出了典型的双极神经元形态,包括圆形的胞体,一个短粗的树突和一个细长的轴突(图2A、B)。虽然每个神经元只能观察到一个轴突,但轴突的末端,可以观察到分支。当神经元相互接近的时候,更容易观察到这种分支。在接种后的第5天,这些细胞经过β微管蛋白Ⅲ和(图2C)嗅神经元标志蛋白(OMP)免疫荧光标记证实为嗅神经元(图2D)。在激光共聚焦显微镜下,可以观察到神经元之间的突触连接,部分嗅神经元可观察到嗅纤毛、细长的轴突。在接种后第9天,仍可观察到存活的嗅神经元能够保持其典型的双极形态,见图2、3。
采用普通的培养流程,在离体接种后的24 h内可见大部分的细胞死亡。在接种后的第1、3天,两种培养方法存活嗅神经元的数量比较差异无统计学意义[第1天,(6.4±1.8)vs. (4.6±1.1)个/高倍视野,P=0.10;第3天,(6.2±1.3)vs. (5.6±2.1)个/高倍视野,P=0.60]。不规则成纤维细胞开始生长,接种第5天,可见不规则的成纤维细胞长满了培养皿,仅可见散在的嗅神经元,见图4。

A:接种后24 h嗅神经元形态(×100);B:高倍镜下典型嗅神经元形态(×400);C:接种后第5天激光共聚焦显微镜下β微管蛋白Ⅲ免疫荧光标记嗅神经元(×800);D:接种后第5天激光共聚焦显微镜下OMP免疫荧光标记嗅神经元(×800)
图2改进方法原代培养的嗅神经元观察及免疫荧光鉴定

图3 改进方法原代培养的嗅神经元接种后第9天的形态观察(×100)

A.接种后第3天嗅神经元形态,可见不规则形态的成纤维细胞开始生长;B.接种后第5天嗅神经元形态,可见不规则形态的成纤维细胞几乎铺满培养皿,无法观察到典型的嗅神经元
图4普通方法原代培养的嗅神经元接种后第3、5天形态观察(×100)
3 讨 论
本研究在没有星形胶质细胞作为饲养层细胞的情况下,通过对嗅神经元分离步骤的改进,成功体外培养了嗅神经元,部分神经元具有典型的双极神经元形态,包括圆形的胞体,一个短粗的树突和一个细长的轴突,并表达OMP和神经元特异的β微管蛋白Ⅲ。这些离体的嗅神经元在体外存活10 d左右。同样在没有饲养层细胞的培养条件下,当采用一般的步骤进行原代嗅神经元培养时,在培养第3天,可观察到明显的成纤维细胞的污染,由于具备体外增殖能力,成纤维细胞几乎可以铺满培养皿,影响嗅神经元的生长和分离。
目前嗅神经元的原代培养技术并未成熟,操作步骤复杂、耗时长,对操作人员技术水平要求很高,神经元的存活率不高,受多种因素的影响,实验的稳定性较差[5-7]。
在神经元体外培养系统中,常用培养的单层神经胶质细胞作为神经元的底物。神经胶质细胞的突起可引起神经元的迁移和神经突起的生长,同时提供促进神经元存活的营养物质,促进神经元良好地发育[8-10]。GONG等[4]分离纯化新生小鼠星形胶质细胞,铺满培养皿后作为饲养层细胞再接种嗅神经元。在嗅神经元接种后的第3~5天,细胞的存活率为20%~30%,可见即使有饲养层细胞,嗅神经元很容易受到外界条件的影响而死亡。而饲养层细胞的加入,增加了操作的时间,增大了非目标细胞的污染,还可能会对后续嗅神经元的观察、分离、纯化或其他实验步骤产生干扰。通过本研究采用的改进步骤,在没有饲养层细胞的情况下,嗅神经元仍然能够保持一定的存活数量,并且生长出典型的轴突和树突。说明饲养层细胞并非是嗅神经元原代培养所必需。
目前报道的各种嗅神经元原代培养方法,主要步骤包括嗅黏膜的取材,嗅上皮的分离和嗅神经元的分离,时间可能超过8 h。将嗅神经元的前体细胞从嗅上皮分离是原代培养的关键步骤。如何减少嗅神经元分离过程试剂、操作、从离体到接种的时间对神经元活性的影响,仍需要不断地探索。本研究的改进主要在嗅神经元的分离步骤,通过去掉再次酶消化,用静置代替一次离心操作减轻操作本身对神经元活性的影响,同时缩短嗅神经元离体的时间来保存细胞的生物活性,结果表明这种改进是有效的。
分离神经细胞的原代培养常含有异质性的细胞群体,在通常的实验方法中,在嗅上皮37 ℃孵育2~3 h促进嗅神经元向嗅上皮表面移动后,为了获得足够数量的神经元,通常继续用酶消化上皮10 min以促进神经元更容易与支持细胞等脱离。而酶本身既影响嗅神经元的活性,同时也可能将嗅黏膜固有层未完全分离的其他组织类型细胞间的连接松解,在随后的分离步骤中混入嗅神经元中。本研究证实采用这种分离方法会使固有层中的成纤维细胞混入,虽然在接种后的2 d内对嗅神经元的影响不大,但由于成纤维细胞具有较强的增殖能力而嗅神经元不能增殖,3 d后可见到明显增殖的成纤维细胞,直至铺满培养皿。虽然充分分离嗅上皮和其下方的固有层理论上可以避免该污染的发生,但在实际中由于操作难度大而很难规避这一风险。
嗅觉功能的研究离不开嗅神经元的原代培养,由于嗅神经元自身的特点,或是因为相关原代培养技术的局限,现有的培养技术还远未满足科研的需要。通过对嗅神经元分离步骤的改进,本研究成功建立了一种相对简便的嗅神经元原代培养方法,为嗅神经元功能及嗅觉障碍相关疾病的基础研究提供了体外实验体系。
[1]GRILL R J,PIXLEY S K.In vitro generation of adult rat olfactory sensory neurons and regulation of maturation by coculture with CNS tissues[J].J Neurosci,1997,17(9):3120-3127.
[2]CALOF A L,CHIKARAISHI D M.Analysis of neurogenesis in a mammalian neuroepithelium:proliferation and differentiation of an olfactory neuron precursor in vitro[J].Neuron,1989,3(1):115-127.
[3]CARTER L A,Macdonald J L,Roskams A J.Olfactory horizontal basal cells demonstrate a conserved multipotent progenitor phenotype[J].J Neurosci,2004,24(25):5670-5683.
[4]GONG Q.Culture of mouse olfactory sensory neurons[J].Curr Protoc Neurosci,2012,3:3-24.
[5]GRILL R J,PIXLEY S K.In vitro generation of adult rat olfactory sensory neurons and regulation of maturation by coculture with CNS tissues[J].J Neurosci,1997,17(9):3120-3127.
[6]CALOF A L,CHIKARAISHI D M.Analysis of neurogenesis in a mammalian neuroepithelium:proliferation and differentiation of an olfactory neuron precursor in vitro[J].Neuron,1989,3(1):115-127.
[7]ROMNETT G V,Hester L D,Snyder S H.Primary culture of neonatal rat olfactory neurons[J].J Neurosci,1991,11(5):1243-1255.
[8]王廷华,冯忠堂.神经细胞培养理论与技术(第2版)[M].北京:科学出版社,2009:83-84.
[9]刘媛,龙在云,曾琳,等.不同类型星形胶质细胞对神经干细胞定向分化的影响[J].中国康复理论与实践,2007,13(11):1026-1028.
[10]邹亚芬,郑瑞珍,张苏明.不同饲养层细胞对胚胎干细胞和内细胞团的影响[J].华中科技大学学报(医学版),2005,34(4):416-419.

