骨巨细胞瘤中RunX2表达及对骨质调控的临床研究*
李国威,郭远清,陈 涛,张奎渤,张大卫,于 兵,张荣凯
(中山大学附属第五医院脊柱外科,广东珠海 519000)
骨巨细胞瘤(giant cell tumor of bone ,GCT)为常见的原发性骨肿瘤之一,具有较强的侵袭性,极少数有反应性新骨生成及自愈倾向,在大多文献中被描述为“低度恶性或潜在恶性的肿瘤”[1-2]。但是目前仍缺乏能够反映GCT生物学行为的可靠组织学指标。核心结合因子(RunX2)在成骨细胞的分化、软骨细胞成熟和骨基质蛋白形成等过程中起到重要作用[3-6]。本研究通过检测GCT组织中RunX2的表达情况,探讨RunX2与GCT临床病理特征之间的关系,为该病的诊疗和预后评判提供参考。
1 材料与方法
1.1材料 研究所用标本均取自2005年1-12月本院病理实验室存档的手术切除肿瘤组织蜡块。选择病历资料齐全的GCT标本58例,男31例,女27例,年龄20~64岁,平均(35.23±9.63)岁。41例为原发性肿瘤,17例既往有肿瘤切除病史,后诊断为肿瘤复发。肿瘤生长部位:颈椎1例,胸椎4例,腰椎3例,股骨18例,胫骨8例,肱骨6例,桡骨12例,腓骨、尺骨、掌骨各2例。49例患者首发症状为肿瘤生长区域局部疼痛,从首发症状开始到手术的中位时间为11.5(3~65)个月;肿瘤最大直径中位数值为9.38(2.1~19.2)cm;手术治疗过程,肿瘤病灶刮除手术34例,肿瘤整块全部切除手术19例,肿瘤分块全切手术2例,肿瘤部分切除手术3例。
1.2方法
1.2.1分组 (1)将58例GCT患者按照肿瘤性质的良恶性分为两组,比较RunX2在良性及恶性GCT中表达水平的差异;(2)将58例GCT患者按照肿瘤病理分级分为3组,比较RunX2在不同级别GCT中的表达水平的差异,并在不同级别之间进行两两比较;(3)将58例GCT患者按照肿瘤是否侵犯软组织分为两组,比较RunX2表达与GCT软组织侵犯情况的差异;(4)将58例GCT患者按照肿瘤是否发生病理性骨折分为两组,比较RunX2在两组间的表达水平的差异。
1.2.2分析GCT软组织侵犯情况 磁共振检查设备为 SIEMENS MAGNETOM CI 磁共振扫描仪,采用体部表面线圈,常规做矢状位 T1WI(TR 350 ms,TE 17 ms,矩阵256×256)、T2WI(TR 2 200 ms,TE 128 ms,矩阵256×256)和横断T2WI(TR 2 200 ms,TE 128 ms,矩阵256×256)。
1.2.3检测RunX2在良性及恶性GCT中的表达 应用免疫组织化学非生物素二步法(S-P法),鼠抗人RunX2(27-K)单克隆抗体购自美国Santa Cruz公司,超敏SP(鼠/兔)试剂盒与二氨基联苯胺(DAB)酶底物显色试剂盒均购自福州迈新生物技术公司。取患者肿瘤组织蜡块进行切片,厚度4 μm,按S-P法进行实验。染色结果由两位高年资病理科医师进行双盲阅片,RunX2阳性表达主要定位于细胞核,镜下表现为棕黄色或者黄褐色颗粒。RunX2表达评价标准:光学显微镜下随机选择10个高倍视野,每个高倍视野内计数100个肿瘤细胞,依照着色程度深浅(不着色、着色浅、中等着色和着色深者分别评为0~3分)与阳性细胞百分率(<5%计0分,5%~<25%计1分,25%~<50%计2分,≥50%计3分)的乘积,≤ 1分为(-),2~4分为(+),5~7者为(++),≥8分者为(+++)。
1.3统计学处理 采用SPSS20.0软件进行数据分析,计数资料用频数或百分率表示,组间比较采用两个独立样本Mann-WhitneyU非参数检验分析,独立样本间比较先进行Kruskal WallisH检验,利用Mann-WhitneyU非参数检验分析进行两两比较,以P<0.05为差异有统计意义。
2 结 果
2.1分析GCT软组织侵犯情况 肿瘤的实体部分在 T1WI上呈较低信号,在 T2WI上呈混杂的高信号,瘤组织包括基质细胞与多核巨细胞。受累椎体在T2WI上显示 “囊状”明显高信号,考虑与富含大量血窦有关。椎体若伴有病理骨折的变扁则呈哑铃状,椎体后缘呈球形向后突入椎管内,病灶突破骨皮质显示很清楚,低信号的骨皮质为异常信号的肿瘤组织替代并形成软组织肿块,见图1。巨细胞瘤侵及椎管及椎旁软组织,累及上下2个椎体,Tomita分型为6型。
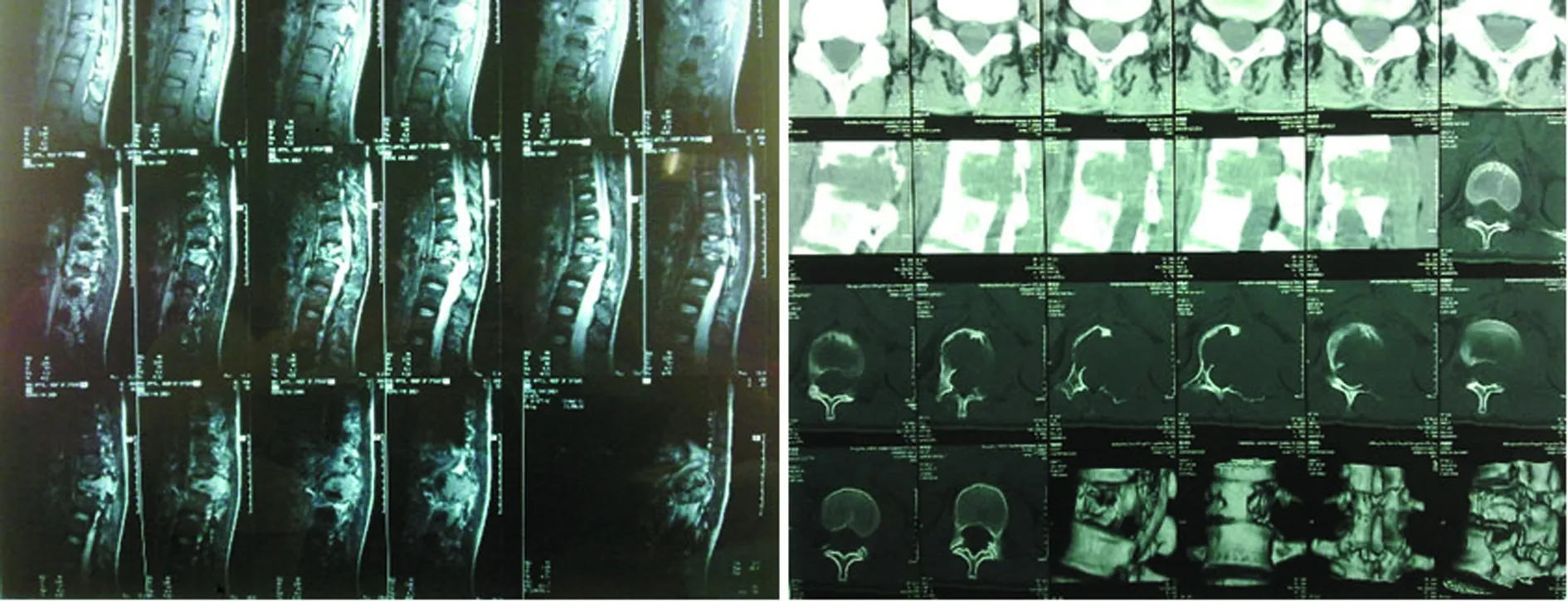
图1 磁共振检查结果
2.2RunX2在良性及恶性GCT中的表达 RunX2在良性GCT组织内的阳性表达率低于恶性GCT组织内的阳性表达率,差异有统计学意义(χ2=15.25,P<0.05)。RunX2表达水平与骨巨细胞恶性程度呈正相关(r=0.509,P<0.05),见表1。

表1 RunX2在良性及恶性GCT中的表达
2.3RunX2在不同级别GCT中的表达 RunX2在Ⅰ级GCT组织内的阳性表达率低于Ⅱ级GCT组织内的阳性表达率,Ⅲ级GCT组织内RunX2的阳性表达率最高,差异有统计学意义(χ2=13.89,P<0.05)。RunX2表达的水平随着GCT病理分型等级的增加而增高(r=0.480,P<0.05),见表2。

表2 RunX2在不同级别GCT中的表达
2.4RunX2表达与GCT软组织侵犯情况的关系 RunX2在有软组织侵犯的GCT组织内的阳性表达率高于无软组织侵犯的GCT组织内的阳性表达率,差异有统计学意义(χ2=33.02,P<0.05)。RunX2的表达水平的增高与GCT发生周围软组织侵犯呈正相关(r=0.788,P<0.05),见表3。

表3 RunX2表达与GCT软组织侵犯情况的关系
2.4RunX2表达与GCT发生病理性骨折的关系 RunX2在发生病理性骨折的GCT组织内的阳性表达率高于无病理性骨折的GCT组织内的阳性表达率,差异有统计学意义(χ2=6.58,P<0.05)。RunX2表达水平的增高与GCT发生病理性骨折呈正相关(r=0.338,P<0.05),见表4。

表4 RunX2表达与病理性骨折之间的关系
3 讨 论
临床上针对不同性质的GCT采用的治疗方法不同,因此对GCT良恶性的诊断成为后续临床治疗的关键。既往针对GCT良恶性的诊断多存在主观性强等缺点,因此临床漏诊及误诊率高。最新的研究表明,RunX2在GCT基质细胞中高度表达[7]。而本研究通过对临床上切取的标本采用免疫组织化学检测Runx2的表达发现:Runx2表达量多少与GCT的良恶性呈相关性;同时对不同病理分级的GCT中Runx2表达进行分析后发现,Runx2的表达量随着GCT病理恶性程度的提高而增加。
GCT具有一定的侵袭性,主要是由其细胞组织学特点决定[8-9]。在GCT组织中的3种细胞成分中,破骨细胞样的多核巨细胞是造成GCT溶骨性破坏的主要结构[10-12];基质细胞具备与脊髓间充质干细胞的相似的增殖能力[13-14],并且高表达与免疫系统及骨骼发育相关的基因如RunX2 等[15-16]。而RunX2是runt相关转录因子家族的重要成员,在成骨细胞的分化、软骨细胞成熟和骨基质蛋白形成等过程中起到主要作用,与GCT溶骨特性密切相关[16-17]。本研究通过分析GCT病理性骨折与Runx2表达的相互关系,结果提示Runx2在伴有病理性骨折的GCT组织内的表达量增加,且与GCT发生病理性骨折呈正相关。
Runx2是目前肿瘤学研究中与肿瘤周围软组织浸润有关的基因之一,LEONG等[18]认为Runx2与肿瘤细胞的浸润性密切相关。CHIMGE等[19]通过实验证明,Runx2可以通过Smad及旁路丝裂原激活的蛋白激酶(MAPK)通路影响TGF-β和Wnt通路起到影响肿瘤细胞浸润性的作用;此外,Runx2还可以通过磷脂酰肌醇-3羟基激酶/丝氨酸激酶(PI3K/Akt)信号通路增强细胞的软组织浸润性[20]。这些实验均说明RunX2表达与肿瘤侵袭性密切相关。而本研究结果表明RunX2表达的增高与GCT发生周围软组织侵犯成正相关,不仅验证了该理论,同时为后续临床研究提供了依据。
综上所述,RunX2的高表达与GCT性质恶变、高影像分级、有软组织侵犯以及伴发病理性骨折有关,RunX2可作为GCT上述临床病理特征的判定的参考指标。
[1]石磊,姜亮,刘晓光,等.胸腰椎骨巨细胞瘤手术治疗后复发的原因分析[J].中国脊柱脊髓杂志,2013,23(9):815-820.
[2]易志新,邹学农,彭建强.巨噬细胞对间充质干细胞成骨分化影响的研究进展[J].中国脊柱脊髓杂志,2015,25(12):1116-1119.
[3]孙强,邱勇,刘臻,等.Runx2在青少年特发性脊柱侧凸患者骨髓间质干细胞中的表达及意义[J].中国脊柱脊髓杂志,2005,15(10):616-619.
[4]VIMALRAJ S,ARUMUGAM B,MIRANDA P J,et al.Runx2:structure,function,and phosphorylation in osteoblast differentiation[J].Int J Biol Macromol,2015,78:202-208.
[5]BABETO E,CONCEIÇO A L,VALSECHI M C,et al.Differentially expressed genes in giant cell tumor of bone[J].Virchows Archiv,2011,458(4):467-476.
[6]HAXAIRE C,HAY E,GEOFFROY V.Runx2 controls bone resorption through the down-regulation of the Wnt pathway in osteoblasts[J].Am J Pathol,2016,186(6):1598-1609.
[7]MAK I W,COWAN R W,POPOVIC S A,et al.Upregulation of MMP-13 via Runx2 in the stromal cell of giant cell tumor of bone[J].Bone,2009,45(2):377-386.
[8]HUANG Q,JIANG Z Y,MENG T,et al.MiR-30a inhibits osteolysis by targeting RunX2 in giant cell tumor of bone[J].Biochem Biophys Res Commun,2014,453(1):160-165.
[9]COWAN R W,SINGH G.Giant cell tumor of bone:A basic science perspective[J].Bone,2013,52(1):238-246.
[10]FELLENBERG J,SAEHR H,KUNZ P,et al.Restoration of miR-127-3p and miR-376a-3p counteracts the neoplastic phenotype of giant cell tumor of bone derived stromal cells by targeting COA1,GLE1 and PDIA6[J].Cancer Lett,2016,371(1):134-141.
[11]CONNER J R,HORNICK J L.SATB2 is a novel marker of osteoblastic differentiation in bone and soft tissue tumours[J].Histopathology,2013,63(1):36-49.
[12]NAKAJIMA K,KHO D H,YANAGAWA T,et al.Galectin-3 in bone tumor microenvironment:a beacon for individual skeletal metastasis management[J].Cancer and Metastasis Reviews,2016,35(2):333-346.
[13]HE B H,HE G P,ZHENG X F,et al.Inhibitory effect of bone morphogenetic protein-2 on the proliferation of giant cell tumor of bone stromal cells in vitro[J].Exp Ther Med,2016,11(1):309-314.
[14]NUGENT M.MicroRNA function and dysregulation in bone tumors:the evidence to date[J].Cancer Manag Res,2014,6:15-25.
[15]LIU H,SUN Q,WAN C Y,et al.MicroRNA-338-3p regulates osteogenic differentiation of mouse bone marrow stromal stem cells by targeting Runx2 and Fgfr2[J].J Cell Physiol,2014,229(10):1494-1502.
[16]WEI J W,SHIMAZU J,MAKINISTOGLU M P,et al.Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation[J].Cell,2015,161(7):1576-1591.
[17]DENG Y,WU S,ZHOU H F,et al.Effects of a miR-31,Runx2,and Satb2 regulatory loop on the osteogenic differentiation of bone mesenchymal stem cells[J].Stem Cells Dev,2013,22(16):2278-2286.
[18]LEONG D T,LIM J,GOH X,et al.Cancer-related ectopic expression of the bone-related transcription factor RUNX2 in non-osseous metastatic tumor cells is linked to cell proliferation and motility[J].Breast Cancer Res,2010,12(5):R89.
[19]CHIMGE N O,BANIWAL S K,LUO J Q,et al.Opposing effects of Runx2 and estradiol on breast cancer cell proliferation:in vitro identification of reciprocally regulated gene signature related to clinical letrozole responsiveness[J].Clin Cancer Res,2012,18(3):901-911.
[20]PANDE S,BROWNE G,PADMANABHAN S,et al.Oncogenic cooperation between PI3K/Akt signaling and transcription factor Runx2 promotes the invasive properties of metastatic breast cancer cells[J].J Cell Physiol,2013,228(8):1784-1792.

