幽门螺杆菌检测方法的发展与比较
崔俊华, 李懿皞, 周佳烨, 吴 炯, 郭 玮, 潘柏申
(复旦大学附属中山医院检验科,上海 200032)
幽门螺杆菌(Helicobacter pylori,Hp)是一种寄生于人胃黏膜的革兰阴性螺杆菌,与许多胃肠道疾病如胃癌、胃溃疡等有关。中国幽门螺杆菌科研协作组对我国Hp的感染率进行了调查,结果显示我国Hp的总感染率高达56.22%[1]。自1983年Hp被发现以来,检测该细菌的方法也不断出现,但每种方法都存在着其各自的优缺点和临床应用的限制。临床常用的侵入性试验包括内镜成像、组织学检查、快速脲酶试验、分离培养和以聚合酶链反应(polymerase chain reaction,PCR)为代表的分子生物学检测;而非侵入性试验则包括同位素标记的尿素呼气试验(urea breath test,UBT)、粪便Hp抗原检测(stool antigen test,SAT)、血清学试验和分子生物学检测。本文旨在对目前常用的临床Hp感染检测试验进行比较,并简述它们各自的临床应用、可能存在的问题以及局限性。
1 侵入性试验
内镜检查是最常用的Hp诊断方法之一,常被用于Hp相关的消化性溃疡、萎缩性胃炎、胃黏膜淋巴组织相关淋巴瘤等疾病的诊断。同时,内镜检查也可为后续的其他侵入性试验如快速脲酶试验、组织学检查、分离培养等获取胃黏膜组织样本。除了临床常用的常规内镜外,还有酚红染色内镜[2]、靛蓝染色的放大内镜和激光共聚焦显微内镜。
组织学检查是首个被用于Hp感染检测的试验方法,通常被认为是Hp感染直接检查中的金标准,是最主要的检验方法之一。镜下典型的细菌形态伴有炎症的组织切片可以作为Hp感染的诊断指标。影响组织学检查诊断准确性的因素包括取材的部位、样本大小和数量、染色方法、质子泵抑制剂(protonpump inhibitor,PPI)或抗菌药物的运用[3]、病理医生的经验等。
肽核酸荧光原位杂交(peptide nucleic acid fluorescence in situ hybridization,PNA-FISH)是一种兼具高敏感性(97%)和高特异性(100%)的检测技术,其快速、准确、价格适宜,可检测胃组织样本中是否存在对克拉霉素耐药的Hp[4],还可检测常规形态学检查中易被漏检的Hp球形体。
快速脲酶试验具有廉价、快速、简单、高特异性、原料获取方便等优点,是诊断Hp感染颇具实用性的侵入性试验。快速脲酶试验的敏感性和特异性分别达到了88%和89%[5]。一般来说,商业化的快速脲酶试验通常有95%~100%的特异性和85%~95%的敏感性,而运用化学发光酸碱指示剂可以得到比常规的快速脲酶试验更快的结果和更高的敏感性。
2 分离培养
从胃组织活检样本中分离培养Hp是一种特异性很高(接近100%)的方法。常用于Hp分离培养的介质包括:H.pylori agar、Skirrow agar、哥伦比亚血平板、布鲁菌平板、脑心浸液平板等,需要在35~37 ℃微需氧环境中至少孵育5~7 d。而最近的研究表明,大气等级的氧含量再加上10%左右的二氧化碳可促进Hp的生长,随后基于Hp形态学、脲酶阳性、过氧化物酶阳性、氧化酶阳性的特点进行鉴别诊断[6]。但样本状况不合格、延迟运送、暴露于氧气环境、转运温度改变或分离培养过程中操作不当等都会对分离培养的结果产生负面影响,降低诊断的准确性[7]。
尽管分离培养是一种昂贵、耗时的Hp诊断方法,但能进行抗菌药物的敏感性试验使其在临床应用中具有独特的优势。在克拉霉素耐药率>20%的地区或在二线抗菌治疗无效时就应进行Hp的分离培养和抗菌药物体外敏感性试验[3]。此外,分离培养可得到供后续表型和基因型特征分析试验用的Hp单个菌株,从而能更好地理解其病理特征,为临床治疗提供依据。
3 非侵入性试验
3.1 同位素标记UBT
UBT在临床上已经应用了接近30年,直至今日,仍是诊断Hp感染最常用的非侵入性试验,并用于Hp流行病学调查和根除治疗的疗效评估[3]。在一项UBT的Meta分析中,其敏感性和特异性分别为96%和93%[8]。目前,临床常用的13C-UBT和14C-UBT在诊断准确性上并无差异[9]。为避免假阴性结果的产生,患者需要在试验前2 周停用PPI或在试验前4周停用抗菌药物[3];患者的出血症状会造成UBT的假阴性结果,而胃中其他产尿素酶的病原体的存在也会导致假阳性结果的产生。UBT对于胃部分切除的Hp患者诊断不佳的原因可能是尿素没能充分与尿素酶发生反应[10]。一种快速持续的实时UBT-Breath ID可能可以克服这种缺点,有研究显示其准确性达到87%,高于UBT(72%)[11]。
3.2 SAT
SAT是另一种对于Hp诊断有着很高敏感性和特异性的非侵入性试验。在一项全球性的Meta分析中,其敏感性和特异性分别为94%和97%[12]。选用单克隆抗体的试验方法相比多克隆抗体的准确性更高,而酶免疫法的结果比免疫层析法更为可靠。SAT结果的准确性受多种因素,如抗菌药物、氢离子泵抑制剂、N-乙酰半胱氨酸、排便和上消化道出血的影响[3]。而样本的保存,如温度、运送时间和临界值的选择也对SAT诊断的准确性有影响[13]。近来研发的Atlas Hp抗原检测是一种全新的单克隆免疫层析SAT,相比之前的单克隆免疫层析SAT有着更优秀的诊断性能(敏感性91.7%、特异性100.0%、准确性96.6%)[14]。另一项采用SAT检测胃远端胃癌切除患者粪便Hp抗原的小型研究显示,SAT的检测敏感性、特异性和准确性分别为100.0%、90.5%和96.6%[15]。
3.3 抗体相关检测
有无数基于抗Hp IgG抗体的血清学试验被用于Hp感染的诊断,由于其具有廉价、快速、易于被患者接受的特点而被广泛用于流行病学的调查。血清学试验的准确性依赖于试剂选用的抗原以及作为抗原的特定Hp菌株的流行率,所以应选用当地流行菌株或不同组菌株汇总抗原谱,同时血清学试验的临界值也应根据当地的情况来设置。不同的血清学试验存在明显的差异,酶免疫试验中的敏感性为57.8%~100.0%,特异性为58.7%~96.8%;免疫层析试验的敏感性为55.6%~97.8%,特异性为60.3%~96.8%[16]。
血清学试验在毒力因子和病原学的研究中也起到了重要的作用。胃蛋白酶原(pepsinogen,PG)Ⅰ、PGⅡ和PGⅠ/PGⅡ比值三者结合抗Hp抗体的检测已被广泛用于预测萎缩性胃炎和胃癌的风险[17]。Hp感染患者血清中存在的抗细胞毒素相关抗原A(cytotoxinassociated antigen A,CagA)抗体、抗空泡细胞毒素(vacuolating cytotoxin A,VacA)抗体和抗热休克蛋白60抗体可作为感染高危险性菌株的血清标志物。一项Meta分析显示,CagA抗体检测用来诊断胃癌的综合敏感性和特异性分别为71%和40%,诊断优势比为2.11[18]。
血清学试验的其他优点包括诊断准确性不受溃疡出血、胃萎缩和抗菌药物或PPI使用的影响,这些因素在其他的侵入性或非侵入性试验中会导致假阴性结果的产生,但其仍不能被作为Hp感染的首选诊断试验[19]。血清学试验由于其抗体效价在根治成功后仍能维持很长时间,故不能用于评估根治疗法的疗效,也不能区分Hp的近期感染和既往感染[3]。
4 PCR
PCR被广泛地用于检测来自胃组织、粪便、胃分泌物以及其他样本中的Hp。相比其他常规的检测方法,PCR拥有着超过95%的特异性和敏感性,并在检测消化道出血患者的Hp时能得出更准确的结果。用于检测Hp的目的基因包括ure A、glmM、ure C、16S rRNA、23S rRNA、HSP60和VacA等。2个不同的保守目的基因的联合运用可避免假阳性结果的出现,尤其是非胃组织来源的临床样本,从而提高了检测的特异性。PCR的其他优点包括样本中需要的原始菌量少、检测快速、无需特殊处理或转运流程,能帮助临床医生在诊疗时作出更快、更准确的判断。此外,PCR也能同时对特定位点的耐药基因[大环内酯类和喹诺酮类药物(cagA、νacA)[20]、克拉霉素(23S rRNA)、喹诺酮类药物(gyrA)、四环素(16S rRNA)、利福平(rpoB)、阿莫西林(pbp-1a)和甲硝哒唑(rdxA、frxA、frxA)[21]等]的突变进行检测。在一项运用实时PCR检测Hp感染和克拉霉素耐药的研究中,学者认为定义至少5个可能改变的位点对于提升耐药性监测的准确性极为重要[22]。
实时PCR现在常常被用于定量分析组织样本中Hp的DNA含量,但实时PCR的开展需要昂贵的热循环仪,对于很多临床实验室来说这依旧是个难题。目前已研发出了一种基于双启动寡核苷酸(dual-priming oligonucleotide,DPO)的多重PCR来同时检测Hp感染及其对克拉霉素的耐药性,这项试验可以在任何的常规热循环仪上进行,其成本低于实时PCR。
CHUNG等[23]采用已进行过快速脲酶试验的组织样本评估DPO-PCR的诊断准确性,结果显示DPO-PCR相比快速脲酶试验和组织学检查有着更高的敏感性,同时DPO-PCR也可以检测出那些快速脲酶试验阴性样本中的Hp,胃组织样本的DPO-PCR与快速脲酶试验检测结果的一致率达到94.4%。
有学者建立了一种高通量多基因检测Hp(high-throughput multiplex genetic detection system,HMGS)[24],可以使用胃组织样本直接检测Hp并且能检出多种Hp的混合感染,同时还能进行Hp毒力基因(cagA、dupA、luxS、νacA s1、oipA、νacA m1等)和多种耐药基因(pbp1A、23S rRNA、gyrA、rdxA等)的检测。相比组织培养和快速脲酶试验,HMGS有着很高的特异性(97.1%)、敏感性(93.7%)和准确性(95.5%)[25]。
对毒力因子进行PCR检测有助于评估Hp毒力因子的基因多态性,同时也给我们带来更多的信息以理解感染不同Hp菌株患者的临床差异。毒力因子基因如cagA和νacA,与许多剧烈的胃部炎症及高发病率的消化性溃疡、胃癌有关。一种新设计的配有特异性引物(基于整个221位dupA基因序列)的实时PCR将dupA基因的检测率提高到了64.2%,而常规PCR的检测率只有29.9%~37.8%[26]。这篇文章的作者指出,PCR的设计方案对于检测毒力因子有很重大的影响。
运用PCR检测粪便中的Hp是可靠、方便的方法,尤其对于儿童来说。粪便PCR也有着能鉴别特定基因型以及对抗菌药物耐药性的优点。口腔被认为是Hp在胃以外的重要聚集地,但口腔中Hp作为再感染或传播途径的意义仍旧不明。唾液和牙斑是口腔中Hp检测常用的样本。快速脲酶试验和分离培养的方法常常在早期的研究中被用于检测口腔Hp,而PCR是近期试验中最为常用和可靠的方法。口腔Hp检测的分布有着很大的差异,从0%到100%不等,同时也有唾液中阴性而牙斑中阳性的情况。口腔中Hp分布的巨大差异可能与不同研究方法、不同人群和不同引物的使用有关。近期的研究重点主要为引物的修改对于提高诊断准确性的作用。一种采用了基于48种Hp菌株全基因组中共有的高度保守序列的Hp特异性引物的新PCR系统近日已被研发出来,可以提升口腔PCR的诊断准确性。环介导等温扩增法(loop-mediated isothermal amplification,LAMP)是一种新的具有高度特异性和敏感性的DNA扩增法。AMIRI等[27]的研究结果显示,LAMP有着比PCR更高的Hp检出率,LAMP和PCR对牙斑样本中Hp的检出率分别为66.7%和44.0%。
PCR对流行病学调查中环境样本Hp的检测也有着很大的帮助。运用PCR检测出的饮用水样本中高含量的Hp能提供更多通过饮用水传播的Hp信息。在未洗净的蔬菜上污染Hp的高检出率也提示了洗净蔬菜能减少Hp的污染。
PCR比快速脲酶试验、组织学检查和分离培养有着更高的敏感性,其敏感性分别为91%、66%、43%和37%,与血清学检查、UBT的敏感性(均为94%)相当,在消化性溃疡出血患者的Hp检查中PCR与UBT的检测准确性相当。但PCR的特异性(100%)仅明显优于血清学试验(65%),与其他试验并无太大区别(快速脲酶试验95%、组织学检查95%、分离培养100%、UBT 85%)[28]。巢式PCR检测根治疗法后胃组织活检样本中Hp比快速脲酶试验、组织学检查、分离培养有着更好的敏感性。此外基于PCR的方法能更好地分辨根治治疗后的再复发和二次感染。
虽然PCR能更快速、更精确地检测Hp及其耐药菌株,但成本、试验设备等都影响着PCR在临床的应用。
5 总结
现有诊断技术的发展让我们能更准确地诊断Hp感染,同时也让我们对与Hp相关的疾病处理得更好。比较临床常用的方法,血清学试验、UBT、SAT、快速脲酶试验、组织学检查、PCR和分离培养的敏感性、特异性分别为85%和79%、75%~100%和77%~100%、67%~100%和61%~100%、75%~100%和84%~100%、66%~100%和94%~100%、75%~100%和84%~100%以及55%~56%和100%(图1),而PCR的检测敏感性可以通过改用巢式或半巢式PCR来提升[29]。目前尚无检测Hp的金标准方法,选择Hp感染的检测方法取决于当地流行的Hp、每种方法的优缺点与可操作性以及每例患者独特的临床状况。结合2种或2种以上检测方法以获取最可靠的结果在常规的临床操作中是个不错的选择。我们相信,在未来,我们会针对不同的临床目的、特定的人群和不同的基因型特征持续改进Hp的检测方法,从而使Hp感染的诊断更为可靠,诊断模式更为合理[30]。
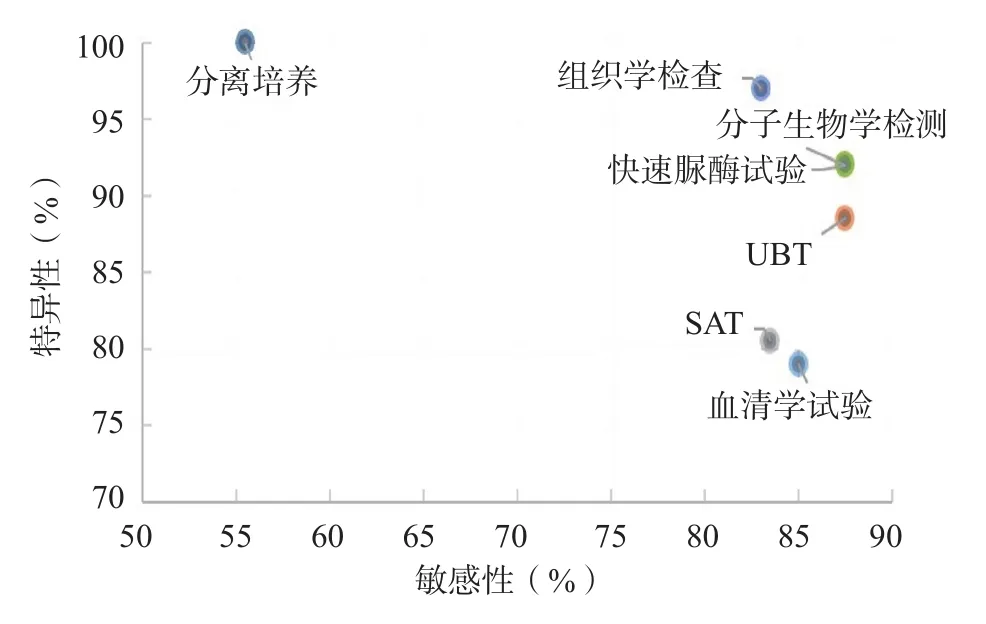
图1 不同Hp诊断试验的敏感性与特异性的对比
[1]张万岱,胡伏莲,萧树东,等. 中国自然人群幽门螺杆菌感染的流行病学调查[J]. 现代消化及介入诊疗,2010,15(5):265-270.
[2]HERNÁNDEZ-GARCÉS H R, CASTELLANOSGONZÁLEZ V V, GONZÁLEZ-FABIÁN L, et al.Chromoendoscopy with red phenol in the diagnosis of Helicobacter pylori infection[J]. Rev Esp Enferm Dig, 2012, 104(1): 4-9.
[3]MALFERTHEINER P, MEGRAUD F,O'MORAIN C A, et al. Management of Helicobacter pylori infection-the Maastricht V/ Florence consensus report[J]. Gut, 2017, 66(1):6-30.
[4]CERQUEIRA L, FERNANDES R M, FERREIRA R M, et al. Validation of a fluorescence in situ hybridization method using peptide nucleic acid probes for detection of Helicobacter pylori clarithromycin resistance in gastric biopsy specimens[J]. J Clin Microbiol, 2013, 51(6): 1887-1893.
[5]CHOU C H,SHEU B S, YANG H B, et al. Clinical assessment of the bacterial load of Helicobacter pylori on gastric mucosa by a new multi-scaled rapid urease test[J]. J Gastroenterol Hepatol, 1997, 12(1):1-6.
[6]PARK S A, KO A, LEE N G. Stimulation of growth of the human gastric pathogen Helicobacter pylori by atmospheric level of oxygen under high carbon dioxide tension[J]. BMC Microbiol, 2011,11: 96.
[7]NDIP R N, MACKAY W G, FARTHING M J,et al. Culturing Helicobacter pylori from clinical specimens: review of microbiologic methods[J]. J Pediatr Gastroenterol Nutr, 2003, 36(5): 616-622.
[8]FERWANA M,ABDULMAJEED I, ALHAJIAHMED A, et al. Accuracy of urea breath test in Helicobacter pylori infection: meta-analysis[J].World J Gastroenterol, 2015, 21(4): 1305-1314.
[9]NOCON M,KUHLMANN A, LEODOLTER A,et al. Efficacy and cost-effectiveness of the 13C-urea breath test as the primary diagnostic investigation for the detection of Helicobacter pylori infection compared to invasive and non-invasive diagnostic tests[J]. GMS Health Technol Assess, 2009, 5:Doc14.
[10]TIAN X Y, ZHU H, ZHAO J, et al. Diagnostic performance of urea breath test, rapid urea test,and histology for Helicobacter pylori infection in patients with partial gastrectomy: a metaanalysis[J]. J Clin Gastroenterol, 2012, 46(4): 285-292.
[11]WARDI J, SHALEV T, SHEVAH O, et al. A rapid continuous-real-time 13C-urea breath test for the detection of Helicobacter pylori in patients after partial gastrectomy[J]. J Clin Gastroenterol, 2012,46(4): 293-296.
[12]GISBERT J P, DE LA MORENA F, ABRAIRA V. Accuracy of monoclonal stool antigen test for the diagnosis of H. pylori infection: a systematic review and meta-analysis[J]. Am J Gastroenterol, 2006,101(8): 1921-1930.
[13]SHIMOYAMA T. Stool antigen tests for the management of Helicobacter pylori infection[J].World J Gastroenterol, 2013, 19(45): 8188-8191.
[14]OSMAN H A, HASAN H, SUPPIAN R,et al. Evaluation of the Atlas Helicobacter pylori stool antigen test for diagnosis of infection in adult patients[J]. Asian Pac J Cancer Prev, 2014, 15(13): 5245-5247.
[15]YAN J, YAMAGUCHI T, ODAKA T, et al. Stool antigen test is a reliable method to detect Helicobacter pylori in the gastric remnant after distal gastrectomy for gastric cancer[J]. J Clin Gastroenterol, 2010,44(1): 73-74.
[16]BURUCOA C, DELCHIER J C, COURILLONMALLET A, et al. Comparative evaluation of 29 commercial Helicobacter pylori serological kits[J].Helicobacter, 2013, 18(3): 169-179.
[17]YOSHIDA T, KATO J, INOUE I, et al. Cancer development based on chronic active gastritis and resulting gastric atrophy as assessed by serum levels of pepsinogen and Helicobacter pylori antibody titer[J].Int J Cancer, 2014, 134(6):1445-1457.
[18] ZHAO Z, LI Y, LIU S, et al. SerumHelicobacter pylori CagA antibody may not be used as a tumor marker for diagnosing gastric cancer in east Asian countries[J]. Tumour Biol, 2014, 35(12):12217-12224.
[19]GISBERT J P, ABRAIRA V. Accuracy of Helicobacter pylori diagnostic tests in patients with bleeding peptic ulcer: a systematic review and meta-analysis[J]. Am J Gastroenterol, 2006, 101(4): 848-863.
[20]SAEZ J, BELDA S, SANTIBÁÑEZ M, et al.Real-time PCR for diagnosing Helicobacter pylori infection in patients with upper gastrointestinal bleeding: comparison with other classical diagnostic methods[J]. J Clin Microbiol, 2012, 50(10):3233-3237.
[21]BINH T T, SUZUKI R, TRANG T T, et al. Search for novel candidate mutations for metronidazole resistance in Helicobacter pylori using next-generation sequencing[J]. Antimicrob Agents Chemother,2015, 59(4): 2343-2348.
[22]IWAMOTO A, TANAHASHI T, OKADA R,et al. Whole-genome sequencing of clarithromycin resistant Helicobacter pylori characterizes unidentified variants of multidrug resistant efflux pump genes[J].Gut Pathog, 2014, 6: 27.
[23]CHUNG W C, JUNG S H, OH J H, et al.Dual-priming oligonucleotide-based multiplex PCR using tissue samples in rapid urease test in the detection of Helicobacter pylori infection[J]. World J Gastroenterol, 2014, 20(2): 6547-6553.
[24]ZHANG Y, ZHAO F, KONG M, et al. Validation of a high-throughput multiplex genetic detection system for Helicobacter pylori identification,quantification, virulence, and resistance analysis[J]. Front Microbiol, 2016,7:1401.
[25]ZHANG Y, WANG S, HU B, et al. Direct detection of Helicobacter pylori in biopsy specimens using a high-throughput multiple genetic detection system[J]. Future Microbiol, 2016, 11:1521-1534.
[26]ABADI A T, LOFFELD R J, CONSTANCIA A C, et al. Detection of the Helicobacter pylori dupA gene is strongly affected by the PCR design[J]. J Microbiol Methods, 2014, 106: 55-56.
[27]AMIRI N, ABIRI R, EWAZI M, et al. The frequency of Helicobacter pylori in dental plaque is possibly underestimated[J]. Arch Oral Biol, 2015,60(5): 782-788.
[28]LO C C, LAI K H, PENG N J, et al. Polymerase chain reaction: a sensitive method for detecting Helicobacter pylori infection in bleeding peptic ulcers[J]. World J Gastroenterol, 2005, 11(25):3909-3914.
[29]PATEL S K, PRATAP C B, JAIN A K, et al.Diagnosis of Helicobacter pylori: what should be the gold standard[J]. World J Gastroenterol, 2014,20(36): 12847-12859.
[30]LOPES A I, VALE F F, OLEASTRO M.Helicobacter pylori infection-recent developments in diagnosis[J]. World J Gastroenterol, 2014, 20(28):9299-9313.

