新藤黄酸-pH敏感脂质体在大鼠体内药物代谢动力学研究
★ 余琼芳 周雅丽 张变 常佳丽 彭代银 陈卫东,4 张善堂
(1.安徽中医药大学药学院 合肥 230012;2.安徽省中医药科学院 合肥 230012;3.安徽省立医院药剂科 合肥 230012;4.安徽道地药材品质提升协同创新中心 合肥 230012)
新藤黄酸是从中药藤黄中分离得到的有效抗肿瘤成分之一,其抗癌谱较广,抗癌作用强,近年来的研究证实新藤黄酸对宫颈癌、肺癌、皮肤癌、乳腺癌、肝癌、胃癌、多发性骨髓瘤等多种肿瘤的生长有明显的抑制作用[1-7]。 但是,新藤黄酸的水溶性差,几乎不溶于水,而易溶于甲醇、乙醇等有机溶剂,并且其药动学研究显示,由于静脉给药血管刺激性强,半衰期短等缺点大大的限制了在临床的应用。为了使新藤黄酸能更好应用于临床并降低其毒副作用,Xia Huang等[8]将其制备成固体脂质纳米粒,减小了其血管刺激性并提高了其在体内的生物利用度,Qing Luo等[9]将新藤黄酸装载到立方液晶中,从而大大增加了其载药量和包封率,并延长了其在体内的生物半衰期。
据报道肿瘤微环境pH值要低于正常组织,因此可以利用这一特性制备一种具有pH敏感的载体,从而达到“智能”释药的目的。Juniala O. Silva等[10]成功制备了一种具有长循环和pH敏感性的脂质体用来包裹多柔比星,结果大大延长生物半衰期,并且增加了肝、肾摄取量,提高了该药物对肿瘤的特异性。因为脂质体具有很好的生物相容性和低毒等特点,结合“智能”释药的目的,将pH敏感的脂质体包载新藤黄酸,可改善其毒副作用,同时增加GNA对肿瘤的敏感性。本实验通过大鼠单次尾静脉分别注射GNA溶液和GNA-PLS,采用HPLC法测定给药后不同时间点新藤黄酸,初步阐明GNA-PLS在大鼠体内药代动力学特征,为GNA的临床应用提供一定的理论依据。
1 材料
1.1 仪器 LC-waters 1525高效液相色谱仪,包括Waters 2489紫外检测器和Waters 1525泵;CP225D型电子天平(德国赛多利斯公司);TG16-WS台式高速离心机(长沙湘仪离心机仪器有限公司);LC-4016低速离心机(安徽中科中佳科学仪器有限公司);KQ-300B型超声波清洗器(昆山市超声仪器有限公司);MTN-2800D氮吹浓缩装置(天津奥特赛恩斯仪器有限公司);XW-80A微型涡旋混合器(上海泸西分析仪器厂有限公司)。
1.2 药品与试剂 新藤黄酸对照品、原料药以及内标藤黄酸B(MA)(纯度≥98%,安徽中医药大学药学院GNA课题组提供);GNA-PLS(实验室自制);甲醇为色谱纯,其他试剂为分析纯。
1.3 动物 成年SPF级SD大鼠(生产许可证号:SCXK(皖)2011-001),雌雄各半,体重180~220g,安徽医科大学试验动物中心提供。
2 方法与结果
2.1 给药剂量 参考GNA前期研究基础,结合GNA静脉给药血管刺激性特别强的特点,同时结合制剂GNA-PLS中GNA浓度为0.275mg/mL、大鼠尾静脉给药体积不宜过大等一系列因素,通过预实验,最终确定给药剂量为1.5mg/kg。该剂量下12只大鼠无死亡情况,原料药组大鼠健康状况良好。
2.2 给药方法及血样采集 健康SD大鼠,12只,雌雄各半,随机平均分为两组(GNA溶液组和GNA-PLS组),于给药前禁食12h,自由饮水。本实验采用单次尾静脉注射的给药方式,给药剂量为1.50mg/kg,两组均在给药后0,3,5,10,20,40min及1,2,4,6,8h眼眦静脉取血约0.3mL,加到肝素处理过的EP管内,3500rpm离心10min后取上层血浆于-20℃避光冷冻保存,待用。
2.3 色谱条件 C18色谱柱(4.6mm×250mm, 5μm),流动相为甲醇-0.1%磷酸(92:8),流速为1.0mL/min,柱温为30℃,检测波长为360nm,进样量为20μL。
2.4 对照品溶液和内标溶液的配制
2.4.1 对照品溶液制备 精密称取新藤黄酸5mg置于10mL容量瓶中,用甲醇稀释溶解并定容到刻度,即得浓度为500μg/mL的对照品储备液,于4℃冰箱避光保存备用。
2.4.2 内标溶液的制备 精密称取藤黄酸B 5mg置于10mL容量瓶中,用甲醇溶解并定容到刻度,然后逐级稀释到20μg/mL,4℃冰箱避光保存备用。
2.5 血浆样品的处理 精密吸取大鼠血浆100μL,内标MA溶液10μL于1.5mL EP管中,涡旋混合后加入乙酸乙酯1mL,再涡旋震荡5min,3500r/min 离心10min,取出全部上清于37℃氮气吹干,取100μL甲醇复溶,涡旋混合后15 000r/min离心10min,取20μL进样测定分析。
2.6 方法学验证
2.6.1 观察组 专属性试验 取6只混合空白大鼠血浆、GNA和MA对照品溶液、GNA和MA空白血浆混合溶液、给药5min后加内标处理的样品、空白血浆加GNA溶液以及空白血浆加内标MA溶液,按照“2.5”项目方法处理,“2.3”色谱条件进样,考察内标MA和血浆中的内源性物质是否对GNA的测定产生干扰,结果见图1。由图可见,MA和GNA分离完全,峰型良好,血浆中的内源性杂质对GNA的测定无干扰。
2.6.2 标准曲线和最低检测限 精密吸取大鼠空白血浆8份,每份90μL,置于1.5mL EP 管中,再精密吸取GNA储备液和MA标准溶液各10μL,分别配制成25,15,5,1,0.5,0.125,0.05μg/mL的GNA血浆样品溶液。按“2.5”操作方法,“2.3”色谱条件进样。分别记录GNA和MA的峰面积,并计算二者比值(Ratio, Ri),以Ri为纵坐标,GNA浓度为横坐标,绘制标准曲线,求得标准曲线的方程为Y=3.7797X+0.0317,R2=0.9994,结果表明,GNA在0.05~25μg/mL之间线性关系良好,最低检测浓度为0.05μg/mL。
2.6.3 日间和日内精密度试验 精密吸取90μL空白血浆样品于1.5mL EP中,并按配制GNA低、中、高三种质量浓度(分别为0.1、1.5、20μg/mL),每种浓度各5份,再分别精密吸取10μL上述GNA浓度样品和MA内标溶液于EP管中,按“2.5”方法处理,“2.3”色谱条件进样,将得到的Ri值带入标准曲线,计算实测浓度,连续进样3天,考察日内和日间精密度。结果低、中、高三个质量浓度样品日内精密度RSD%为14.12%、5.10%、6.29%;日间精密度RSD%为13.06%、1.36%、2.46%,结果表明该方法符合生物样品分析要求。
2.6.4 回收率试验 精密吸取90μL空白血浆样品于1.5mL EP中,并按配制GNA低、中、高三种质量浓度(分别为0.1、1.5、25μg/mL),每种浓度各5份,再分别精密吸取10μL上述GNA浓度样品和MA内标溶液于EP管中,按“2.5”方法处理,“2.3”色谱条件进样,将得到的Ri值带入标准曲线,得实测浓度,计算回收率。结果三个浓度平均回收率(n=5)分别为(97.93±6.24)%、(99.66±6.15)%、(93.82±7.18)%。
2.6.5 稳定性试验 分别取低浓度0.1μg/mL、高浓度20μg/mL的质控样品各6份,按“2.5”方法,将样品于室温放置6h后处理与处理后放置6h,进样后与放置0h比较,RE%分别为-1.06%、0.976%;-2.46%、-0.255%。结果可知GNA大鼠血浆样品在该条件下稳定。
2.7 血药浓度测定以及药动学参数拟合 按照“2.2”方法收集血样后,以“2.5”方法处理,“2.3”色谱条件进样,计算血药浓度。将得到的GNA血浆药物浓度数据用DAS2.0药物代谢动力学软件进行参数拟合。两组平均药时曲线如图2,为了更清楚的看到图2,分别绘制了3~20min药时曲线和40~480min药时曲线,主要药动学参数如表1。
3 讨论
本实验涉及的GNA-pH敏感脂质体为实验室自制,其最优处方为GNA5.5mg、磷脂酰乙醇胺(PE)35mg、琥珀酸胆固醇单酯(CHEMS)8mg和胆固醇(CHOL)10mg,溶于2mL有机溶剂中为有机相,以0.1%的吐温80为表面活性剂,加入到pH7.4 PBS的水相,采用溶剂挥发法制备,制备的GNA-pH敏感脂质体的粒径为200nm左右,包封率在80%以上。
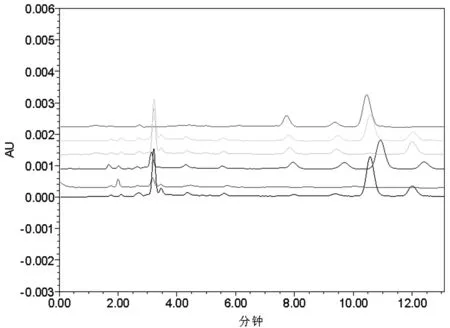
图1 各样品的高效液相色谱图
注:从上至下依次为:GNA+MA甲醇溶液;GNA+MA空白血浆溶液;MA血浆溶液;给药后5min GNA-PLS溶液;空白血浆溶液;GNA空白血浆溶液
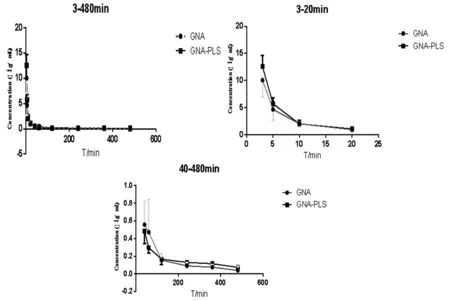
图2 GNA-PLS和GNA在血浆中平均血药浓度-时间曲线(n=5)
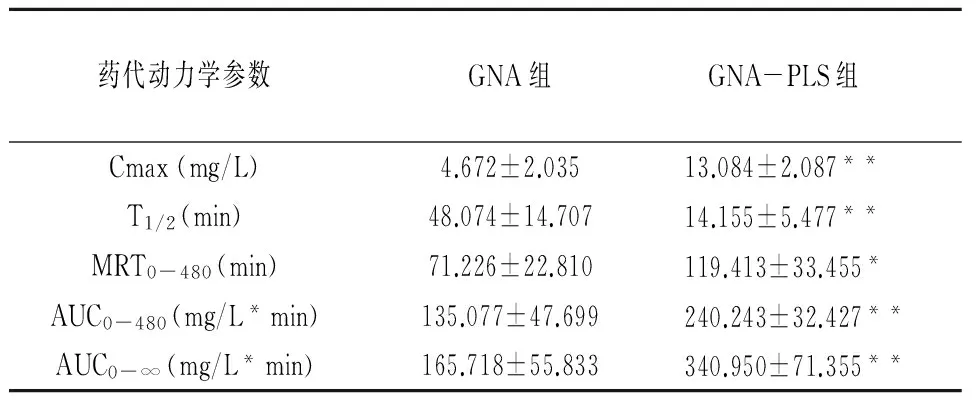
药代动力学参数GNA组GNA-PLS组Cmax(mg/L)4.672±2.03513.084±2.087**T1/2(min)48.074±14.70714.155±5.477**MRT0-480(min)71.226±22.810119.413±33.455*AUC0-480(mg/L*min)135.077±47.699240.243±32.427**AUC0-∞(mg/L*min)165.718±55.833340.950±71.355**
注:与GNA原料药相比,*P<0.05,**P<0.01。
本实验初步考察了GNA-PLS与GNA在大鼠体内的药物代谢动力学行为,实验结果表明PLS包载GNA后可能改变了GNA在大鼠体内的代谢行为,与GNA溶液相比,其Cmax、MRT0-480、AUC0-480、AUC0-∞都显著增加,显著提高了GNA在大鼠体内的生物利用度,这可能是因为
GNA为脂溶性药物,在体内溶解度低,进入体内后不能很好的被完全吸收,而本研究选用的PE、CHEMS[11]等材料制备的GNA-PLS,增加了GNA的溶解性,减小了GNA的血管刺激性,提高了GNA的生物利用度。但是与GNA原料药相比其T1/2确减小了,原因可能是制备脂质体的脑磷脂为不饱和脑磷脂[12],该磷脂的立体形状为圆锥体,而且有文献报道说具有PE结构的磷脂在血清中稳定性不高[13],所以GNA-PLS虽然增加了GNA在体内的溶解度,吸收效率提高,但是并没有延长其半衰期,这也是本实验的一个缺陷,在后期研究中,将会加以改进,为GNA进入临床研究进一步提供理论依据。
[1]石玉荣, 杨滢. 新藤黄酸对宫颈癌HeLa细胞增殖、凋亡、迁移的影响及机制研究[J].中药材, 2016, 6, 39(6): 1 393-1 398.
[2]范从进, 段惠芳. 新藤黄酸对人肺癌细胞株A549的增殖和凋亡的影响[J].国际检验医学杂志, 2015, 36(15): 2 180-2 182.
[3]程卉, 张璇, 苏婧婧, 等. 新藤黄酸通过PI3K/Akt/mTOR信号通路诱导黑色素瘤B16细胞凋亡的研究[J].中国中药杂志, 2014, 39(9): 1 666-1 669.
[4]陆彬彬,刘新姿,王娟,等. 新藤黄酸抑制人乳腺癌细胞株MCF-7增殖的实验研究[J].临床肿瘤学杂志, 2012, 17(8): 691-694.
[5] 刘卫海,肖国丽,赖小平,等.新藤黄酸诱导HepG2细胞凋亡与Bax及Bcl-2的关系[J].中国药理学通报, 2012, 28(3): 439-440.
[6] 王训翠,朱国旗,程卉,等. 新藤黄酸诱导人胃癌MGC-803细胞线粒体途径凋亡的实验研究[J].中药材, 2014, 37(1): 95-99.
[7]倪海雯, 孙祥图. 新藤黄酸诱导LP-1人多发性骨髓瘤细胞凋亡及抑制血管生成作用的实验研究[J].中医药临床杂志, 2012, 24(12): 1 139-1 142.
[8]Huang X, Chen YJ, Peng DY, et al. Solid lipid nanoparticles as delivery systems for Gambogenic acid[J].Colloids Surf B Biointerfaces, 2013(102): 391-397.
[9]Luo Q, Lin T, Zhang CY, et al. A novel glyceryl monoolein-bearing cubosomes for gambogenic acid:Preparation, cytotoxicity and intracellular uptake[J]. Int J Pharm, 2015, 493(1-2): 30-9.
[10]Silva JO, Fernandes RS, Lopes SC, et al. pH-Sensitive, Long-Circulating Liposomes as an Alternative Tool to Deliver Doxorubicin into Tumors: a Feasibility Animal Study[J]. Mol Imaging Biol, 2016,18(6): 898-904.
[11]Lehtinen J, Hyv?nen Z, Subrizi A, et al. Glycosaminoglycan-resistant and pH-sensitive lipid-coated DNA complexes produced by detergent removal method[J]. J Control Release, 2008, 131(2): 145-149.
[12]陈涛,傅经国,王昭,等. 酸敏脂质体的研究进展[J].世界最新医学信息文摘,2003, 2(4):729-732.
[13]Guo W, Gosselin MA, Lee RJ. Characterization of a novel diolein-based LPDII vector for gene delivery[J]. J control Release, 2002, 83(1): 121-132.

