基于含药肠吸收液法的“瓜蒌反草乌”配伍对离体胸主动脉环舒缩功能影响的实验研究
★ 李莹 李文宏 赖珍珍 肖雄 许照
(江西中医药大学 南昌 330004)
“十八反”作为传统的中药配伍禁忌,至今用药法规仍严格禁止临床使用,但应用相反药对治疗沉疴痼疾者仍不在少数。据统计2010版《中国药典》收录含“十八反”药对的成方制剂5个[1],《中医方剂大辞典》(南京中医药大学主编)共收录含反药同方配伍方剂1406首[2]。因此,系统开展“十八反”药物配伍关系研究,解析各相反药对的相互作用、宜忌条件、化学本质和生物学基础,揭示中药“十八反”的科学实质,对于临床安全用药具有重要的意义[3]。本课题组在国家重点基础研究发展计划和国家自然科学基金项目的资助下,系统开展了“半蒌贝敛芨攻(草)乌”的化学、药理及毒理研究。前期研究结果表明,草乌与瓜蒌的共煎液中双酯型生物碱(乌头碱、中乌头碱、次乌头碱)的含量高于草乌单煎液[4];草乌瓜蒌配伍的LD50小于草乌,毒性明显增加;配伍抑制蛋清致大鼠足趾肿胀的活性增强,毛细血管通透性降低,可见配伍的抗炎作用强于草乌[5]。上述结果表明,“瓜蒌反草乌”呈现相反配伍特征的增毒/增效作用模式。草乌对心血管系统的影响主要表现为调节心律、影响血压等。本研究针对草乌对心血管系统的影响,采用含药肠吸收液方法,以离体胸主动脉环为研究对象,研究草乌配伍瓜蒌后收缩血管效应的变化及其初步机理。
1 材料和方法
1.1 试验药物 生草乌AconitumkusnezoffiiReichb.购自浙江中医药大学中药饮片有限公司,批号120701;瓜蒌Trichosantheshisrilowii购自北京华邈中药技术开发中心,批号120906。经江西中医药大学生药学科组付小梅副教授鉴定药材合格。草乌单煎醇提液:取生草乌粉末,精密称取10g,加10倍量75%乙醇浸泡60min,微沸回流提取60min,过滤,再加5倍量75%乙醇微沸回流提取60min,合并滤液,在60℃下减压浓缩至1g·mL-1。
草乌与瓜蒌配伍提取液:取生草乌粉末,精密称取10g,按照相应比例称定瓜蒌粉末(9∶1组1.1g,3∶1组3.3g,1∶1组10g,1∶3组30g,1∶9组90g),混合,加10倍量75%乙醇浸泡60 min,微沸回流提取60 min,过滤,再加5倍量75%乙醇微沸回流提取60 min,合并滤液,在60 ℃下减压浓缩依次至1.1,1.3,2,4,10g·mL-1。
含药肠吸收液制备:按文献方法[6],取大鼠空肠或回肠肠段10cm制成翻转囊,置于草乌及与瓜蒌配伍的提取液中温孵,取肠囊内的缓冲液,即得含药肠吸收液。
6×10-2mol·L-1KCl(KH 液配制);苯肾上腺素(PE,中国食品药品检定研究所,批号:109K1528)临用时用 KH 液配成 1×10-6mol·L-1;普萘洛尔(中国食品药品检定研究所,批号:105468-201403)临用时用 KH 液配成3.38×10-2mol·L-1。
1.2 动物 SD大鼠,180±20 g,雌雄不拘,长沙市天勤生物技术有限公司提供,许可证号:SCXK(湘)2009-0012。
1.3 试剂 KH液:1 mmol·L-1含NaCl 120g,KCl 4.7g,MgSO4·7H2O 1.2g,KH2PO41.18g,CaCl22.5g,NaHCO324.5g,葡萄糖 11.1g,EDTA 0.03g,调 pH至7.4;KR液:1mmol·L-1含NaCl 129,KCl 4.7g,NaH2PO41.2g,CaCl22.5g,MgCl21.2g,NaHCO35.0g,葡萄糖3.0g,调节pH至7.4。
1.4 仪器 PowerLab多通道生理记录系统(澳大利亚 ADInstruments Pty Ltd),HL-2S恒流泵(上海青浦泸西仪器厂),HH-2数显恒温水浴锅(常州国华电器有限公司),微量加样器(上海求精生化试剂仪器有限公司),分析天平(北京赛多利斯仪器系统有限公司)。
1.5 方法
1.5.1 血管环的制备 按文献方法[6],取大鼠胸主动脉,制成2~3 mm的小环,悬挂于浴槽内,一端固定,另一端通过张力换能器连接于Powerlab 生物信号采集系统,调节张力2g, 6×10-2mol·L-1KCl 溶液刺激3次,待血管环收缩稳定后备用。
实验用BL-420F计算机生物信号记录分析系统记录血管的张力变化,分别以末次预处理药物刺激引起的最大/最小收缩幅度为100%,所得数据用百分比比值表示。
1.5.2 草乌瓜蒌配伍对基础状态大鼠离体胸主动脉环的影响 血管环稳定后,分别加入草乌及与瓜蒌配伍含药肠吸收液400μL,观察并记录胸主动脉环张力的变化。以血管环张力的变化率即X%=(基值-给药后值)/基值×100%表示。
1.5.3 草乌瓜蒌配伍对PE预刺激大鼠离体胸主动脉环的影响 血管环稳定后,以1×10-6mol·L-1的PE 10μL预刺激,待收缩达坪值后,分别加入草乌及与瓜蒌配伍离体肠吸收液 400μL,观察并记录胸主动脉环张力的变化。以测得的血管环张力变化值与PE预收缩血管张力变化值之比的百分率,即X%=(坪值-给药后值)/(坪值-基值)×100%表示,探讨草乌及与瓜蒌配伍肠吸收液对血管环收缩功能的影响。
1.5.4 草乌与瓜蒌配伍对KCl预刺激大鼠离体胸主动脉环影响实验 血管环稳定后,加入 10-2mol·L-1KCl 10μL刺激,待收缩达坪值后,分别加入草乌及与瓜蒌配伍离体肠吸收液 400μL,观察并记录胸主动脉环张力的变化,计算方法同“1.5.3”。
1.5.5 草乌与瓜蒌配伍对普萘洛尔预刺激大鼠离体胸主动脉环影响实验 血管环稳定后,加入3.38×10-2mol·L-1普萘洛尔10μL预处理,待舒张达坪值后,分别加入草乌及与瓜蒌配伍离体肠吸收液400μL,观察并记录胸主动脉环张力的变化,计算方法同“1.5.3”。
2 结果
2.1 对基础状态血管环张力的影响 草乌、草乌瓜蒌配伍含药肠吸收液对基础状态血管环均有收缩作用,且草乌瓜蒌各配伍组的收缩强度均不同程度地强于草乌组,其中草蒌1∶1组和草蒌1∶9组明显强于草乌组(P<0.05)。各组对血管环收缩功能影响的强度依次为:草蒌1∶1>草蒌1∶9>草蒌9∶1>草蒌1∶3>草蒌3∶1>草乌。表明瓜蒌能增强草乌对基础状态血管环的收缩作用,结果见图1。
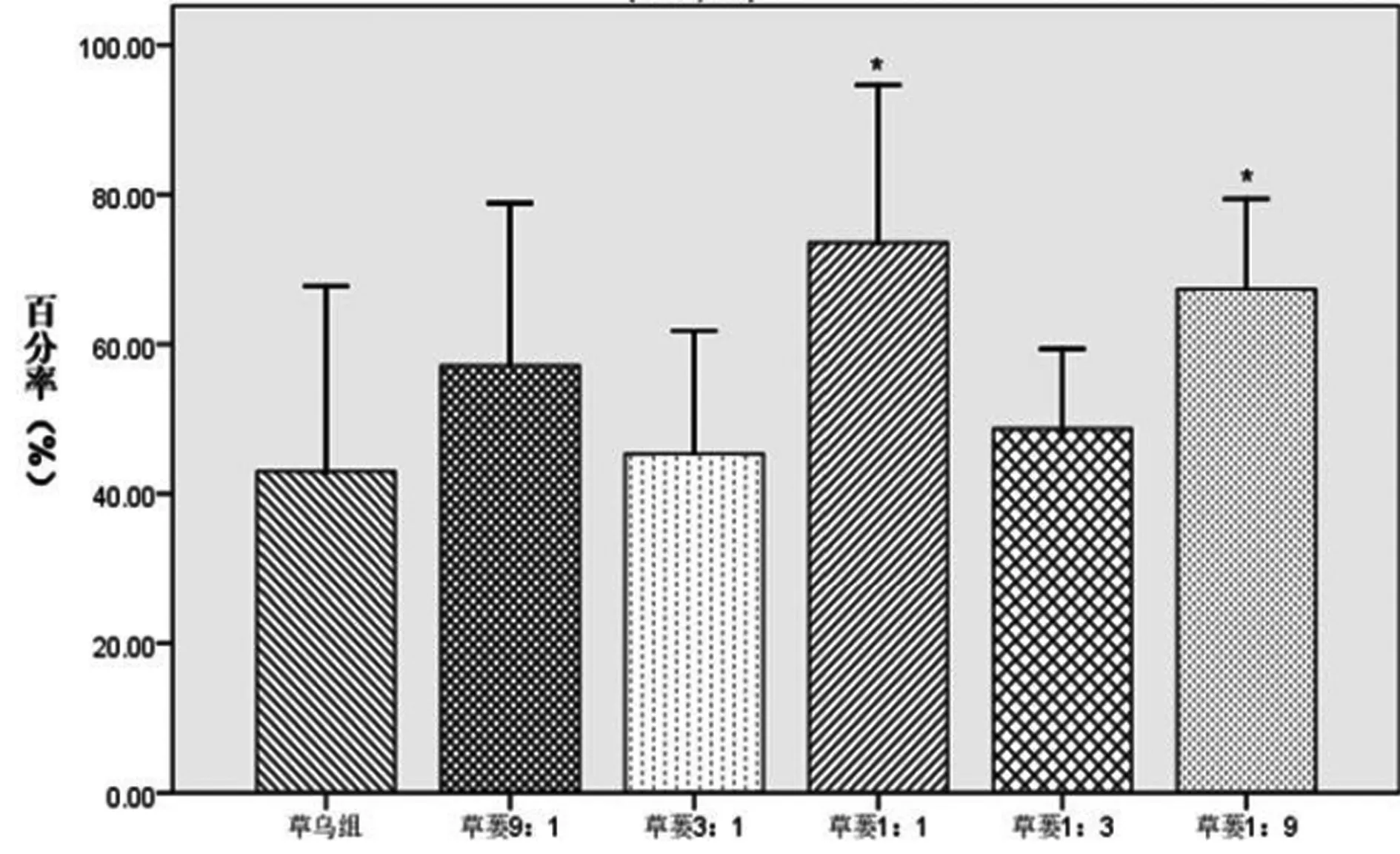
注:与草乌组比较,*P<0.05,**P<0.01。
图1 草乌及与瓜蒌配伍含药肠吸收液对基础状态离体血管环张力的影响
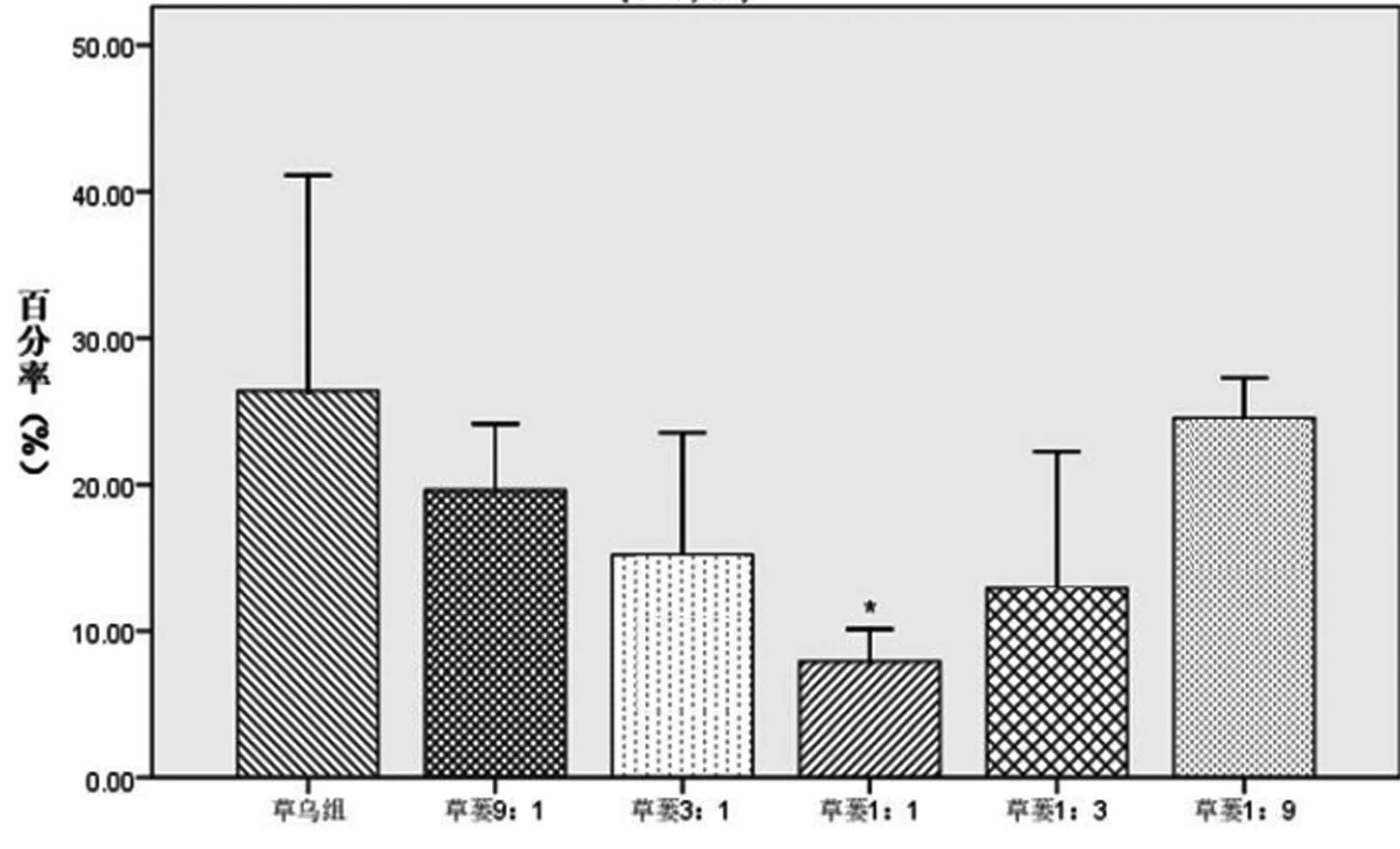
2.2 对PE预刺激血管环张力的影响 草乌、草乌瓜蒌配伍含药肠吸收液对PE预刺激血管环均能促进其进一步收缩,但草乌瓜蒌各配伍组的作用强度均不同程度地弱于草乌组,其中草蒌1∶3组明显弱于草乌组(P<0.05)。各组对PE预刺激血管环收缩功能影响的强度依次为:草乌>草蒌1∶1>草蒌1∶9>草蒌3∶1>草蒌9∶1>草蒌1∶3。表明瓜蒌能减弱草乌对PE预刺激血管环的收缩作用,结果见图2。
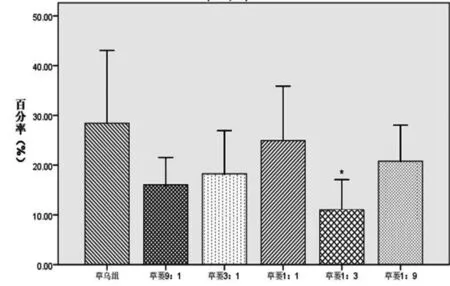
2.3 对KCl预刺激血管环张力的影响 草乌、草乌瓜蒌配伍含药肠吸收液对KCl预刺激血管环均能促进其进一步收缩,但草乌瓜蒌各配伍组的作用强度均不同程度地弱于草乌组,其中草蒌1∶1组明显弱于草乌组(P<0.05)。各组对KCl预刺激血管环收缩功能影响的强度依次为:草乌>草蒌1∶9>草蒌9∶1>草蒌3∶1>草蒌1∶3>草蒌1∶1。表明瓜蒌能减弱草乌对KCl预刺激血管环的收缩作用,结果见图3。
注:与草乌组比较,*P<0.05,**P<0.01。
图2 草乌及与瓜蒌配伍含药肠吸收液对PE预刺激离体血管环张力的影响
注:与草乌组比较,*P<0.05,**P<0.01。
图3 草乌及与瓜蒌配伍含药肠吸收液对KCl预刺激收缩离体血管环张力的影响
2.4 对普萘洛尔预刺激血管环张力的影响 草乌、草乌瓜蒌配伍含药肠吸收液对普萘洛尔预处理血管环均能促进其进一步收缩,且草乌瓜蒌各配伍组的作用强度均不同程度地强于草乌组,其中草蒌1∶9组、草蒌1∶3组、草蒌1∶1组明显强于草乌组(P<0.05,P﹤0.01)。各组对普萘洛尔预刺激血管环收缩功能影响的强度依次为:草蒌1∶9>草蒌1∶3>草蒌1∶1 >草蒌9∶1>草蒌3∶1>草乌。表明瓜蒌能增强草乌对普萘洛尔预刺激血管环的收缩作用,结果见图4。
3 讨论
血管静息张力取决于血管内皮依赖性舒张和血管平滑肌收缩之间的平衡[7]。实验结果显示草乌及与瓜蒌配伍含药肠吸收液对胸主动脉环的静息张力产生影响,进而对血管乃至心血管系统的生理活动产生影响。草乌瓜蒌各比例配伍组对基础状态胸主动脉环的收缩作用较草乌组增强,
表明瓜蒌可增强草乌对血管静息张力的影响作用。血管平滑肌收缩的关键因子是钙离子[8],主要对外源性钙离子的依赖性较大。外源性钙离子内流主要依靠细胞膜上电压依赖型通道(VDCC)和受体控制型通道(ROCC)[9]。在本实验中,草乌对PE 、KCl和普萘洛尔预刺激的血管环均具有收缩作用,表明草乌可能通过兴奋血管平滑肌细胞膜上VDCC和ROCC通道,促进细胞外钙离子内流而引起血管收缩;草乌瓜蒌配伍组对PE 和 KCl 预收缩的血管环的收缩作用均弱于草乌组,可见瓜蒌可减弱草乌促进细胞外钙离子内流的作用;而草乌瓜蒌配伍组对普萘洛尔预处理血管环的收缩强度明显强于草乌组,表明瓜蒌又可增强草乌促进细胞外钙离子内流的作用。该结果与文献报道一致,瓜蒌既有促进、又有抑制血管平滑肌细胞外钙离子内流的组分[10-11]。
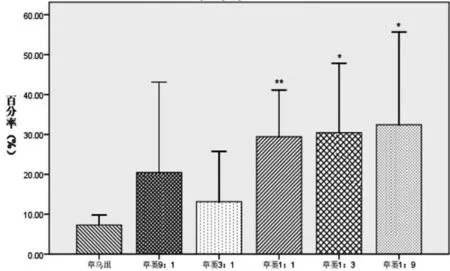
注:与草乌组比较,*P<0.05,**P<0.01。
图4 草乌及与瓜蒌配伍含药肠吸收液对普萘洛尔预刺激离体血管环张力的影响
综上,草乌对各种状态的血管环均有不同程度的收缩效应。配伍后,瓜蒌可增强草乌对基础状态、普萘洛尔预处理血管环的收缩效应;但减弱草乌对PE 、KCl预收缩血管环的收缩效应,呈现出双向调节草乌的血管收缩效应。此外,不同配伍比例对上述效应的影响也不尽相同,其配伍机理有待进一步探讨。
[1]刘佳,钟赣生,王茜,等. 2010 年版《中国药典》一部中含十八反十九畏药对的成方制剂收录情况及临床应用分析[J].中国实验方剂学杂志,2011,17(4):213-217.
[2]范欣生,尚尔鑫,陶静,等.”十八反”同方配伍探讨.中医杂志,2011,52(12):991-994.
[3]范欣生,段金廒,王中越,等. “十八反”结构形式上的中药配伍禁忌研究.中医杂志,2012,53(16):1 360-1 364.
[4]张凌,柳芳林,刘长安,等.HPLC测定草乌与瓜蒌配伍前后6种毒性成分量的变化.中草药,2014,45(6):786- 790.
[5]赖珍珍,张凌,李莹,等.”半夏反草乌”减弱抗炎效应及其减效机制.中国实验方剂学杂志,2015,21(17):84-87.
[6]李文宏,徐国良,彭彩霞,等. 基于含药肠吸收液法的复方丹参片对大鼠离体胸主动脉环的作用及机制初步研究[J].时珍国医国药,2014,25(3):570-573.
[7]Chen G,Suzuki H. Some electrical properties ofthe endothelium-dependent hyper-polarization recorded from rat arterial smooth muscle cells. Journal ofPhysiology, 1989, 410:91-106.
[8]Bolton TB, Gordienko DV, PucovskY V, et al. Calcium release events in excitation-contraction coupling in smooth muscle[J].Novartis Found SymP, 2002, 246: 154-168.
[9]Rembold, C M-Regulation ofcontraction and relaxation in arterial smooth muscle[J].Hypertension,1992, 20(2):129.
[10]莫尚武,吴玉蓉,杨涛,等. 瓜蒌皮提取物对大鼠主动脉Ca2+内流的影响[J].四川大学学报(自然科学版), 1999,36(2):328-331.
[11]杨远友,刘宁,邱明丰,等.用45Ca同位素示踪技术研究瓜蒌皮具钙拮抗作用的活性成分[J].核技术,2002,25(5):345-348.

