诺丽酵素在自然发酵过程中体外抗氧化活性变化及品质研究
周 偏,蔡 坤,梁丛颖,刘四新,李从发*
(1.海南大学 食品学院,海南 海口 570228;2.海南大学 材料与化工学院,海南 海口 570228)
诺丽(Morinda citrifoliaLinn)又称海巴戟、海巴戟天,属茜草科海巴戟天属药用植物,主要分布在南太平洋诸岛屿、澳大利亚、东南亚以及我国的海南岛、西沙群岛和台湾等地[1]。在波利尼西亚,诺丽作为保健食品和药品已有2 000多年的历史,其果实、叶片、种子、花、茎、根及树皮也常被用来治疗各种疾病,因此又被称为“超级水果”[2]。诺丽含有丰富的功能活性成分,主要包括多种氨基酸、维生素、酚类化合物、多糖、有机酸、生物碱、蒽醌、莨菪亭、环烯醚萜类化合物等[3-4]。现代研究证实,诺丽具有抗血栓、降血糖、抗癌、抗菌活性,以及清除自由基,调节胆固醇,刺激免疫系统,调节细胞功能和净化血液等多种功能,对癌症、糖尿病、痛风等多种疾病有较好的预防和治疗作用[5-7]。目前投放市场的诺丽产品主要有:诺丽酵素、鲜榨汁、果粉以及果茶等,其中以诺丽酵素最为畅销。酵素作为目前新兴的功能性微生物发酵产品,市场潜力巨大,受到越来越多的关注。酚类物质是诺丽发酵产品中的重要指标,它决定了产品的色泽和风味,而且对产品的各种保健功效也有很大贡献[8-9]。当前国内诺丽加工企业的诺丽酵素产品的生产工艺是基于传统波利尼西亚人的处理方法[10-11]加以改良,以传统自然发酵工艺为主(时间为2个月至1年不等),发酵周期不确定,产品品质不稳定。所以,阐明诺丽酵素在自然发酵过程中抗氧化活性的变化动态及其品质是很有必要的。为此本实验以诺丽果为研究对象,采用福林酚法、硝酸铝显色法和四种评价体系对诺丽发酵过程中总酚、总黄酮的含量及抗氧化活性的变化进行检测分析,并对诺丽酵素的理化指标及酶系进行测定。以期探讨诺丽果自然发酵过程中抗氧化活性动态的变化规律,科学评价诺丽酵素的抗氧化活性及其品质,为进一步开展诺丽自然发酵功能性成分的动态研究及发酵工艺的改善提供理论参考。
1 材料与方法
1.1 材料与试剂
诺丽鲜果由溪地阳光(海南)生物科技有限公司提供,其产自海南省万宁市,属热带季风气候。于2016年11月采摘自然开花,自然成熟,生长良好,成熟一致的果实,从中挑选出无病害、无机械损伤的成熟诺丽果经人工清洗自然风干备用。
福林酚:北京索莱宝科技有限公司;没食子酸标准品(纯度>98%)、芦丁标准品(纯度>98%)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS):美国Sigma公司;其他试剂均为市售国产分析纯。
1.2 仪器与设备
TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司;AL204电子天平:梅特勒-托利多仪器(上海)有限公司;DK-98-1电热恒温水浴锅:天津泰斯特仪器有限公司;TG16-WS高速离心机:长沙平凡仪器仪表有限公司;3B-5200-DTD超声波清洗机:宁波新芝生物科技股份有限公司;LRH-250A生化培养箱:韶关市泰宏医疗器械有限公司;SW-CJ-1FD洁净工作台:苏州佳宝净化工程设备有限公司。
1.3 方法
1.3.1 诺丽酵素发酵工艺流程
诺丽鲜果→清洗→消毒→沥干→装于发酵罐→自然发酵→过滤→杀菌→诺丽酵素
操作要点:选取新鲜成熟、无腐烂变质、无病虫害的诺丽果,清洗其表面,经无菌水洗涤多次后放置于无菌操作台,待诺丽果干燥后,装入发酵罐内。发酵罐先经高温杀菌(121℃、15 min)处理使其保持无菌状态。发酵罐放置暗处,室温(22~28℃)自然发酵3个月,当酚类物质含量趋于稳定时,酵素发酵结束,后经过滤、杀菌得诺丽酵素成品。
取样:每隔6 d取样一次,样品经8 000 r/min低温离心10 min后,取上清液用于测定。
1.3.2 总酚含量的测定
参照YANGJ等[12]所述Folin-Ciocalteu比色法测定。以没食子酸质量浓度(x)为横坐标,波长765 nm处吸光度值(y)为纵坐标,绘制没食子酸标准曲线。没食子酸标准曲线线性回归方程为y=0.103 7x+0.015 2,相关系数R2=0.998 9。根据没食子酸标准曲线线性回归方程计算样品中总酚含量。
1.3.3 总黄酮含量的测定
参照程池等[13]所述NaNO2-Al(NO3)3比色法测定。以芦丁质量浓度(x)为横坐标,波长510 nm处吸光度值(y)为纵坐标,绘制芦丁标准曲线。芦丁标准线性回归方程为:y=0.0071x-0.025 5,相关系数为R2=0.998 6。根据芦丁标准曲线回归方程计算样品中总黄酮含量。
1.3.4 DPPH·清除能力测定
参考MISHRA K等[14]的方法测定:于试管中依次加入无水乙醇、DPPH、待测液、混匀,30 min后在波长517 nm处测吸光度值记为Ai;以无水乙醇代替DPPH,测吸光度值记为Aj;以蒸馏水代替待测液,测吸光度值记为Ac。每个试样重复3次。DPPH自由基清除率计算公式如下:
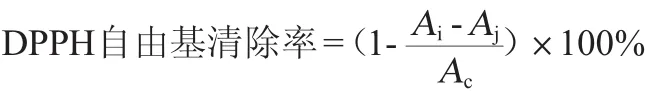
1.3.5 ABTS·清除能力测定
参考RE R等[15]的方法测定:于试管中依次加入无水乙醇、ABTS、待测液、混匀,6 min后在波长734 nm处测吸光度值记为Ai;以无水乙醇代替ABTS,测吸光值记为Aj;以乙醇代替待测液,测吸光度值记为Ac。每个试样重复3次。ABTS自由基清除率计算公式如下:
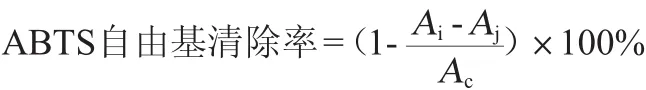
1.3.6 ·OH清除能力测定
参考张伟敏等[16]的方法测定:于试管中依次加入FeSO4、水杨酸-乙醇、H2O2、待测液、混匀,10 min后在波长510 nm处测吸光度值记为Ai;以蒸馏水代替H2O2,测吸光度值记为Aj;以蒸馏水代替待测液,测吸光度值记为Ac。每个试样重复3次。羟基自由基清除率计算公式如下:
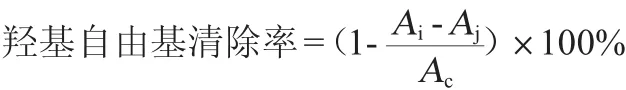
1.3.7 总还原力能力测定
参考OYAIZU M等[17]的方法测定:取待测液进行试验,以空白样品调零,测定各样品波长700 nm处的吸光度值。每个试样重复3次。
1.3.8 理化指标测定
pH值测定:取50 mL诺丽酵素,置于小烧杯中,用pH酸度计测定pH值;总酸含量测定:参照GB/T 12456—2008《食品中总酸的测定》,以乙酸计量;蛋白质含量测定:采用考马斯亮蓝方法[18]测定,通过牛血清白蛋白标准曲线回归方程(y=0.020 7x+0.054 2,相关系数R2=0.998 3)计算;还原糖含量测定:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)显色法[19]测定,通过葡萄糖标准曲线回归方程(y=0.993 2x-0.008 7,相关系数R2=0.999 7)计算;超氧化物歧化酶(superoxide dismutase,SOD)活性测定:采用WST-1法[20]测定,按照SOD检测试剂盒测定步骤在酶标仪上进行;淀粉酶活性测定:采用碘-淀粉比色法,按照淀粉酶测定试剂盒测定步骤进行。
1.3.9 统计分析
实验数据均是3次重复实验的平均值,结果表示为平均值±标准偏差。应用SPSS 24.0软件进行显著性和相关性分析,采用Origin 8.5软件作图。
2 结果与分析
2.1 诺丽酵素自然发酵过程中总酚含量的变化
诺丽酵素自然发酵过程中总酚含量变化结果见图1。由图1可知,在整个诺丽发酵过程中,总酚含量总体呈先下降后上升再下降趋势。在发酵前24 d,总酚含量显著降低(P<0.05),由最初的1.31 mg/mL下降至24 d的1.12 mg/mL,其减少的原因可能是在发酵初期,发酵液中的多酚类物质不断被氧化或沉淀,多酚类化合物可以与蛋白质等结合或吸附,从而导致酚类物质含量的降低[21]。随着发酵时间的延长,发酵液中总酚含量则显著升高(P<0.05),并在60 d时达到最高,其含量为1.61 mg/mL。发酵至中期,随着诺丽果汁液的渗出,导致果实大部分浸渍到发酵液中,有利于果肉中的多酚类化合物溶出,同时也可能随着发酵的进行,单体酚化合物的合成,多酚含量增加[22]。随后总酚含量开始显著下降(P<0.05),有可能是发酵后期产生的有机酸与酚类反应,生产酚酸类化合物,导致酚类物质快速减少[23],其次多酚化合物最重要的化学特征是可以通过疏水键和多元氢键与蛋白质发生结合,也可以与生物碱、多糖等生物大分子发生相似的反应,另外还可以与金属离子发生络合反应,这些均可能导致发酵后期总酚含量下降[24]。

图1 发酵过程中总酚含量的变化Fig.1 Changes of total phenols contents during fermentation process
2.2 诺丽酵素自然发酵过程中总黄酮含量的变化
诺丽酵素自然发酵过程中总黄酮含量变化结果见图2。由图2可知,在整个诺丽发酵过程中,总黄酮的含量呈现先下降后升高的趋势。在发酵前30d,总黄酮含量显著下降(P<0.05),从最初的0.44 mg/mL下降至30 d的0.31 mg/mL,与发酵前期总酚含量的变化趋势相类似,可能是在发酵前期,总黄酮类化合物有部分氧化或转化为其他物质。随后总黄酮含量逐渐上升(P<0.05),发酵至54 d时,总黄酮含量达到最高0.39 mg/mL,也可能是随着果肉浸渍,总黄酮类化合物从果中渗出导致总黄酮含量上升。随着发酵时间继续延长,总黄酮含量有一定的下降,68d后基本维持稳定。可能是由于发酵液中游离态的黄酮醇类物质易与所存在的糖苷结合,从而形成配糖体,导致黄酮类物质中的杨梅黄酮、毛地黄黄酮、槲皮素和山奈酚含量降低[25],同时黄酮醇配糖体随着发酵继续的进行又不断地发生水解[26],因此表现出总黄酮含量在发酵过程中呈现波动形变化。

图2 发酵过程中总黄酮含量的变化Fig.2 Changes of total flavonoids contents during fermentation process
2.3 诺丽酵素自然发酵过程中抗氧化活性的变化
不同的抗氧化化合物可能通过不同的作用机制与氧化剂发生反应,一个孤立的方法很难全面评估抗氧化剂的抗氧化能力,因此通常使用多种测定方法体系来衡量抗氧化特征[27-28]。在本文中,通过比较DPPH自由基体系、ABTS自由基体系、羟自由基体系和总还原力体系4种抗氧化活性体系评价诺丽酵素自然发酵过程中抗氧化能力。诺丽酵素在自然发酵过程中抗氧化活性能力的变化结果如图3所示。

由图3可知,DPPH自由基清除率、ABTS自由基清除率、羟自由基清除率和总还原力能力四者较为一致地描述了发酵过程中抗氧化活性的变化规律。发酵过程中抗氧化能力大体上呈现先下降后上升再下降的趋势。在发酵前12 d,ABTS自由基清除率、羟自由基清除率和总还原能力均迅速下降至最低,分别从66.87%、49.24%、0.583降低至60.78%、44.29%、0.520,DPPH自由基清除率在发酵前6 d从63.27%下降至最低60.12%,在随后的40多天又开始逐步上升,DPPH自由基清除率和羟自由基清除率在54 d时达到峰值,清除率分别为71.22%、58.64%,ABTS自由基清除率在66 d时达到峰值76.21%,总还原能力在72 d时最高0.593。结果表明,发酵时间在54~72 d时,诺丽酵素的抗氧化活性较好。
2.4 诺丽酵素自然发酵过程中总酚、总黄酮含量和抗氧化能力的相关性
对诺丽酵素自然发酵过程中总酚、总黄酮含量与DPPH自由基清除能力、ABTS自由基清除能力、羟自由基清除能力和总还原力能力,进行了Pearson法相关性分析,结果如表1所示。由表1可知,DPPH、ABTS自由基清除能力分别和羟自由基清除能力呈极显著正相关性(P<0.01),同时DPPH自由基清除能力和ABTS自由基清除能力呈显著正相关性(P<0.05),这和以往的报道是一致的[29-32]。在发酵过程中,总酚含量与DPPH自由基、羟自由基清除能力呈极显著正相关(P<0.01,DPPH:R=0.842;·OH:R=0.800),与ABTS自由基清除能力及总还原能力呈显著正相关(P<0.05,ABTS:R=0.778;还原力:R=0.509);但总黄酮含量与自由基清除能力及总还原能力相关性较弱,两者无统计学显著性。这些研究结果表明,酚类化合物是诺丽酵素中抗氧化能力的主要来源。
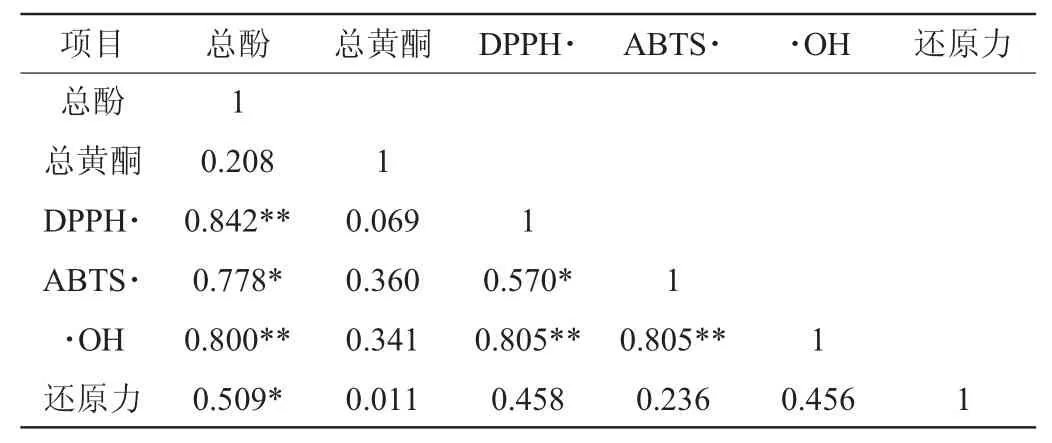
表1 诺丽酵素中总酚、总黄酮含量和抗氧化能力的相关性分析Table 1 Correlation analysis of total phenols,total flavonoidscontents and antioxidant activity of Noni ferment
2.5 诺丽酵素理化品质分析
对发酵三个月后的诺丽酵素产品进行相关的理化品质分析结果如表2所示。由表2可知,诺丽酵素的pH值、总酸、蛋白质和还原糖含量分别为3.65、2.475g/L、0.161mg/mL和29.351 mg/mL。适宜的酸度会增添诺丽酵素的口感和风味,伴有浓郁的典型的诺丽果香。蛋白质和还原糖一方面是诺丽酵素重要的营养物质,同时除了提供相应的口感风味,还可作为非酶褐变、酶褐变反应的底物之一,参与色素的合成。同时诺丽酵素中SOD活性达到376.426 U/mL,淀粉酶活性为17.645U/mL。相对比报道的其他水果酵素[33-34],可看出诺丽酵素具有更强的SOD活性和一定的淀粉酶活性,这从侧面也显示诺丽酵素具有更优的清除自由基能力和抗氧化活性,以及一定的助消化功效。表明了诺丽酵素具有良好的食用特性。
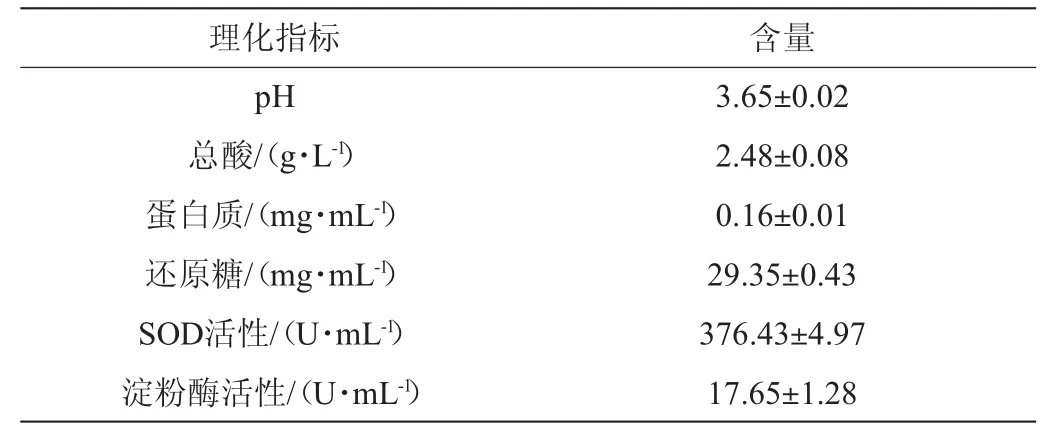
表2 诺丽酵素理化指标分析Table 2 Physical and chemical indicators analysis of Noni ferment
3 结论
通过对诺丽酵素在自然发酵过程中总酚、总黄酮含量以及抗氧化活性的动态变化和产品品质进行研究,结果表明,诺丽酵素在自然发酵过程中,总酚、总黄酮含量和抗氧化能力总体呈先下降后升高再逐渐下降趋势。总酚含量在自然发酵至60 d时达到最高1.61 mg/mL,总黄酮含量在54 d时达到最高0.39 mg/mL;DPPH、ABTS、羟基自由基清除能力和总还原能力在54~72 d时达到最高(71.22%、76.21%、58.64%、0.59)。同时,在自然发酵过程中自由基清除能力和总还原力与总酚含量均具有显著的正相关性(P<0.05)。此外,诺丽酵素发酵三个月后的pH值、总酸、蛋白质和还原糖含量分别为3.65、2.48 g/L、0.16 mg/mL和29.35 mg/mL,超氧化物歧化酶(SOD)活性和淀粉酶活性分别达到376.43 U/mL和17.65 U/mL。综合表明诺丽酵素自然发酵至54~72 d时,其抗氧化能力最强,同时具有营养补给、抗衰老、助消化等功能,可预见其在美容、保健和医药行业有较好的应用前景。
[1]MOTSHAKERI M,GHAZALI H M.Nutritional,phytochemical and commercial quality of Noni fruit:A multi-beneficial gift from nature[J].Trend Food Sci Technol,2015,45(1):118-129.
[2]ABOU ASSI R,DARWIS Y,ABDULBAQI I M,et al.Morinda citrifolia(Noni):A comprehensive review on its industrial uses,pharmacological activities,and clinical trials[J].Arabian J Chem,2017,10(5):691-707.
[3]SINGHR.MorindacitrifoliaL.(Noni):Areviewofthescientificvalidation for its nutritional and therapeutic properties[J].J Diabetes Endocrin,2012,3(6):77-91.
[4]OWEN P L,MARTINEAU L C,CAVES D,et al.Consumption of guava(Psidium guajavaL.)and Noni(Morinda citrifoliaL.)may protect betel quid-chewing Papua New Guineans against diabetes[J].Asia Pac J Clin Nutr,2008,17(4):635-643.
[5]MCCLATCHEYW.From Polynesian healersto health food stores:Changing perspectives ofMorinda citrifolia(Rubiaceae)[J].Integr Cancer Ther,2002,1(2):110-120.
[6]YAMAGUCHI S,OHNISHI J,SOGAWA M,et al.Inhibition of angiotensin Iconvertingenzyme byNoni(Morinda citrifolia)juice[J].J Jap Soc Food Sci Technol,2002,49(9):624-627.
[7]HORNICK C A,MYERS A,SADOWSKA-KROWICK H,et al.Inhibition of angiogenic initiation and disruption of newly established human vascular networks by juice fromMorinda citrifolia(Noni)[J].Angiogenesis,2003,6(2):143-149.
[8]DUSSOSSOY E,BRAT P,BONY E,et al.Characterization,anti-oxidative and anti-inflammatory effects of Costa Rican Noni juice(Morinda citrifoliaL.)[J].J Ethnopharmacol,2011,133(1):108-115.
[9]ALIM,MRUTHUNJAYAK,MANJULAS N.Health benefitsofMorinda citrifolia(Noni):A review[J].Pharmacogn J,2016,8(4):321-334.
[10]DIXON A R,MCMILLEN H,ETKIN N L.Ferment this:the transformation of Noni,a traditional Polynesian medicine(Morinda citrifolia,Rubiaceae)[J].Econ Bot,1999,53(1):51-68.
[11]SHARMA Y,VENUGOPAL C K,HEGDE R,et al.Noni:A new medicinalplantforthetropics[J].Afrn J Plant Sci,2014,8(5):243-247.
[12]YANG J,PAULINO R,JANKE-STEDRONSKY S,et al.Free radicalscavengingactivityandtotal phenolsofNoni(Morinda citrifoliaL.)juice and powder in processing and storage[J].Food Chem,2007,102(1):302-308.
[13]程 池,李 雪,李金霞,等.西沙诺尼果汁总黄酮含量的测定[J].食品科技,2014,39(11):323-326.
[14]MISHRA K,OJHA H&CHAUDHURY N K.Estimation of antiradical propertiesofantioxidantsusingDPPHassay:Acriticalreviewandresults[J].Food Chem,2012,130(4):1036-1043.
[15]RE R,PELLEGRINI N,PROTEGGENTE A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Bio Med,1999,26(9-10):1231-1237.
[16]张伟敏,符文英,李 楠,等.诺丽叶化学成分与提取物抗氧化性质研究[J].浙江大学学报:农业与生命科学版,2009,35(5):543-548.
[17]OYAIZU M.Studies on products of browning reactions:Antioxidative activities of products of browning reaction pre-pared from glucosamine[J].Jpn J Nutr,1986,44:307-315.
[18]黄婉玉,曹 炜,李 菁,等.考马斯亮蓝法测定果汁中蛋白质的含量[J].食品与发酵工业,2009,35(5):160-162.
[19]王 欢,卢红梅,张义明,等.固态发酵食醋中还原糖、总糖含量测定[J].中国酿造,2011,30(9):172-175.
[20]PESKIN A V,WINTERBOURN C C.A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt(WST-1)[J].Clin Chim Acta,2000,293(2):157-166.
[21]ESCUDERO-LOPEZ B,CERRILLO I,HERRERO-MARTIN G,et al.Fermented orange juice:Source of higher carotenoid and flavanone contents[J].J Agr Food Chem,2013,61(37):8773-8782.
[22]CHU S C,CHEN C.Effects of origins and fermentation time on the antioxidant activities of kombucha[J].Food Chem,2006,98(3):502-507.
[23]赵红宇,陈敦洪,邓 良,等.桑葚果酒全渣发酵过程中生物活性物质及其抗氧化活性变化的研究[J].食品工业科技,2015,36(23):182-185,189.
[24]KODAMA N,RAMADA M,NANBA H.Addition of Maitake D-fraction reduces the effective dosage of vancamycin for the treatment of Listeri-a-infected mice[J].Jpn J Pharmacol,2001,87(4):327-332.
[25]HERTOG M G L,HOLLMAN P C.Potential health effects of the dietary flavonol quercetin[J].Eur Jf Clin Nutr,1996,50(2):63-71.
[26]FANG F,LI J M,PAN Q H,et al.Determination of red wine flavonoids by HPLC and effect of aging[J].Food Chem,2007,101(1):428-433.
[27]PRIOR R L,WU X L,SCHAICH K.Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J].J Agr Food Chem,2005,53(10):4290-4302.
[28]XIAO Y,WANG L,RUI X,et al.Enhancement of the antioxidant capacity of soy whey by fermentation withLactobacillus plantarumB1-6[J].J Funct Food,2015,12:33-44.
[29]CHONG C H,LAW C L,FIGIEL A,et al.Colour,phenolic content and antioxidant capacity of some fruits dehydrated by a combination of different methods[J].Food Chem,2013,141(4):3889-3896.
[30]DUDONNE S,VITRAC X,COUTIERE P,et al.Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays[J].J Agr Food Chem,2009,57(5):1768-1774.
[31]陈冠林,陈松根,赵颖莹,等.33种水果的总酚含量及其抗氧化能力研究[J].食品工业,2014,35(9):264-268.
[32]张 华,周志钦,席万鹏.15种柑橘果实主要酚类物质的体外抗氧化活性比较[J].食品科学,2015,36(11):64-70.
[33]董银卯,何聪芬,王 领,等.火龙果酵素生物活性的初步研究[J].食品科技,2009,34(3):192-196.
[34]贾丽丽,冀 利,孙曙光,等.冬枣酵素发酵过程中生物学特性和抗氧化活性研究[J].食品与发酵科技,2014,50(4):30-33.

