电针预处理对脑缺血再灌注大鼠缺血半暗区细胞凋亡及凋亡相关蛋白表达的影响①
叶涛,朱路文,唐强,李宏玉,吴孝军,陈晨,姜云飞,李佳帅
1.黑龙江中医药大学,黑龙江哈尔滨市150040;2.黑龙江中医药大学附属第二医院,黑龙江哈尔滨市150001
全球每年约有1500万人患有脑卒中,约有500万人死亡,是造成死亡的第二大病因,也是长期残疾的主要原因,其中缺血性脑卒中约占所有病例的80%[1]。目前临床上急性缺血性脑卒中的标准治疗是采用组织纤溶酶原激活物进行溶栓诱导再灌注,但由于其时间窗非常窄,极易造成脑缺血再灌注损伤的发生[2]。研究显示[3-5],细胞凋亡在脑缺血再灌注引起的二次损伤中发挥重要作用,与脑梗死体积的大小密切相关,p53、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X Protein,Bax)是调控细胞凋亡的关键靶点。电针预处理,即缺血前给予单次或重复多次的电针干预,可以诱导脑缺血耐受,减轻缺血再灌注后脑损伤程度,发挥脑保护作用[6]。与其他预处理方式比较,电针更加简便易行,临床可操作性强。我们前期研究显示[6-7],针刺时程是电针预处理脑保护作用强弱的关键因素之一,电针多次重复预处理诱导脑缺血耐受的效果优于单次预处理,且重复预处理时间越长效果越好。
为了更好贴合临床住院治疗时间,建立缺血性脑卒中二级预防的电针预处理方案,我们选择每周5~6 d,连续2周的治疗方案,其脑保护作用在多次基础实验中得到证实[8-10]。本研究观察其对脑缺血再灌注大鼠脑缺血半暗区细胞凋亡及凋亡相关蛋白p53、Bax、Bcl-2表达的作用,拟从抗凋亡角度,探讨电针预处理的脑保护作用机制。
1 材料与方法
1.1 实验动物及分组
SPF级Sprague-Dawley大鼠,雄性,8~10周龄,初始体质量220~240 g,购于辽宁长生生物技术有限公司,合格证号SCXK(辽)2015-0001。大鼠饲养于黑龙江中医药大学动物实验中心SPF级屏障系统,动物自由食水。温度23~25℃,湿度60%~70%,人工光照12 h∶12 h明暗交替。
本实验经黑龙江中医药大学动物实验管理委员会批准,实验大鼠的处置符合2006年科技部发布的《关于善待实验动物的指导性意见》。
根据实验室目前大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型成功率(80%以上)和术后1 d死亡率(10%左右),考虑本实验每组最终需要18只大鼠,规定本实验的样本量为72只。将72只大鼠编号,选择数字表中的最大数对应大鼠编号1,依次从左至右,分别对应1~72号大鼠。用随机数字除以3得余数0、1、2,余数为0的对应假手术组,余数为1对应模型组,余数为2对应电针预处理组,最终各组分得24只大鼠。取材时假手术组无淘汰,模型组因造模失败与评分不合格各淘汰1只,电针预处理组因评分不合格淘汰2只,最终各组随机取18只,多余大鼠用于其他研究。
1.2 实验设备和试剂
G6805-2A型低频脉冲电针仪:上海华谊公司。一次性无菌针灸针:北京汉医医疗器械中心。Multiskan FC型酶标仪、微量移液器:美国THERMOSCIENTIFIC公司。RM2235型切片机:德国LEICA公司。H-2050R超速冷冻离心机:湖南湘仪公司。WD-9405B型水平摇床、DYCZ-24DN型双垂直蛋白电泳仪、DYCZ-40D型转移槽:北京六一生物科技有限公司。
p53、Bax、Bcl-2、内参抗体 β-actin、羊抗兔IgG-HRP、全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、ECL发光液:沈阳WANLEIBIO公司。TEMED:美国AMRESCO公司。PVDF膜:美国MILLIPORE公司。预染蛋白Marker:加拿大FERMENTAS公司。TTC粉:北京索莱宝科技有限公司。TUNEL试剂盒:德国ROCHE公司。
1.3 模型建立
大鼠术前12 h禁食不禁水。2%戊巴比妥钠3 ml/kg腹腔注射麻醉后,参照改良Longa法制备大鼠MCAO再灌注模型。颈部正中切口,于右侧胸锁乳突肌与二腹肌前头之间暴露颈总动脉、颈外动脉和颈内动脉。结扎颈总动脉、颈外动脉,暂时夹闭颈内动脉,用7号针头在颈总动脉距血管分叉1 cm处刺一小口,将用石蜡包被过头端的鱼线(直径0.26 mm)经颈总动脉送入颈内动脉,插入深度约18~22 mm,直达大脑中动脉起始处。2 h后拔出栓线。再灌注2 h后行大鼠行为学评分,Longa评分2~3分的纳入研究。
假手术组大鼠仅接受类似模型组的各项手术操作,不插入线栓。
1.4 电针预处理[9]
造模前2周,电针预处理组每次电针前腹腔注射2%戊巴比妥钠3 ml/kg麻醉大鼠,恒温加热板维持体温37~39℃。参照《实验针灸学》定位百会穴,采用直径0.25 mm,长25 mm针灸针向鼻尖方向平刺约5 mm。接G6805-2A型电针仪,正负极分别接大鼠右耳根部和针柄,疏密波,频率2/15 Hz,强度以右耳出现轻微震颤为度,持续刺激30 min。电针间隔24 h,每6天休息1 d。共2周。
假手术组、模型组接受相同的麻醉操作,但不进行电针干预。
整个预处理过程保证周围环境安静,电针结束后放回笼待其自行苏醒。
1.5 改良神经损害严重程度评分(modified Neurologic Severity Score,mNSS)[11]
再灌注24 h后,各组大鼠行mNSS评分,分别从运动、感觉、反射三个方面对大鼠的神经功能缺损程度进行评估。总分14分,1~4分为轻度缺损,5~9分为中度缺损,10~14分为重度缺损。
1.6 取材
完成mNSS评分后,大鼠2%戊巴比妥钠4~5 ml/kg腹腔注射深度麻醉。取6只断头取脑行TTC染色;6只用生理盐水和4%多聚甲醛溶液心内灌注后,切取缺血半暗区组织,常规制备厚5μm石蜡薄片,行TUNEL染色;6只冰板上快速断头取脑,切取缺血半暗区组织,液氮冻存,待Western blotting检测。
1.7 观察指标
1.7.1 脑梗死体积[12]
脑组织置-20℃冰箱内速冻15~20 min后取出。间隔2 mm冠状连续切取6个脑片,2%TTC PBS溶液37℃孵育15~20 min。平摊脑片于黑色背景上,旁边放置一把卡尺,数码相机拍照。Image-Pro Plus 6.0计算脑片的梗死面积与全脑面积百分比,取均数。
1.7.2 凋亡细胞计数
石蜡切片60℃烘烤2 h,二甲苯脱蜡两次,每次15 min,下行乙醇溶液水合,室温下蛋白酶K消化30 min,PBS漂洗3次,每次5 min(下同),37℃暗湿盒中滴加TUNEL反应液50μl孵育1 h,PBS漂洗;37℃暗湿盒中滴加POD反应液50μl孵育30 min,PBS漂洗。室温下DAB显色,PBS漂洗,苏木素复染,温水返蓝。上行乙醇溶液脱水,二甲苯透明,封片。每只大鼠选1张切片,10×10倍镜下定位脑梗死灶周边区顶叶皮质阳性表达“热点区”,10×40倍镜下观察不重叠3个视野并拍照。采用Image Pro Plus 6.0进行阳性细胞计数,取3个视野下的均值。
1.7.3 Western blotting
取脑组织样本称重,按加入蛋白裂解液5 ml/g制成蛋白匀浆,低温孵育后收集上清。BCA法测定总蛋白浓度。上样体积20μl,含蛋白40μg。SDS-PAGE电泳80 V、2.5 h分离目的蛋白,80V、1.5 h转到PVDF膜。室温下5%脱脂奶粉封闭1 h,加入p53(1∶500)、Bax(1∶500)、Bcl-2(1∶500)一抗,4 ℃孵育过夜。摇床摇动TBST洗膜4次,每次5 min;加入羊抗兔IgG-HRP二抗(1∶5000),37℃孵育45 min。摇床摇动TBST洗膜6次,每次5 min。加入ECL底物发光液,室温静置5 min,保鲜膜覆盖,玻棒去除多余水分,暗室曝光显影。扫描后,采用Quantity One图像分析软件进行定量分析。以假手术组某一样本蛋白表达量为1,其余样本均为与其较正后的相对表达量。
1.8 统计学分析
采用GraphPad Prism 7.0进行统计分析。数据以(xˉ±s)表示。组间比较采用单因素方差分析,两两比较采用LSD-t检验。显著性水平α=0.05。
2 结果
2.1 mNSS
假手术组大鼠mNSS评分均为0。模型组mNSS评分较假手术组升高(P<0.05),电针预处理组mNSS评分较模型组降低(P<0.05)。见表1。
2.2 凋亡细胞计数
假手术组大鼠TUNEL阳性细胞极少。模型组TUNEL阳性细胞较假手术组增多(P<0.05),电针预处理组TUNEL阳性细胞较模型组减少(P<0.05)。见表2、图1。
2.3 Western blotting
假手术组p53、Bax、Bcl-2蛋白基础表达。与假手术组比较,模型组p53、Bax蛋白表达升高,Bcl-2蛋白降低,Bax/Bcl-2比升高(均P<0.05);与模型组比较,电针预处理组p53、Bax蛋白表达降低,Bcl-2蛋白表达升高,Bax/Bcl-2比降低(P<0.05)。见表2、图2。
2.4 脑梗死体积
假手术组未出现脑梗死。模型组脑梗死百分比较假手术组增加(P<0.05),电针预处理组脑梗死百分比较模型组减小(P<0.05)。见表2、图3。
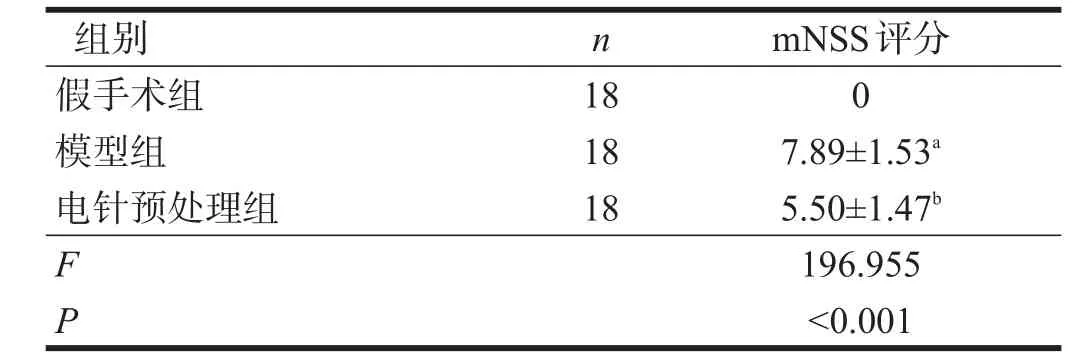
表1 各组大鼠mNSS评分比较

表2 各组大鼠各检测指标比较

图1 各组TUNEL阳性细胞(TUNEL染色,bar=50μm)

图2 各组Western blotting检测结果
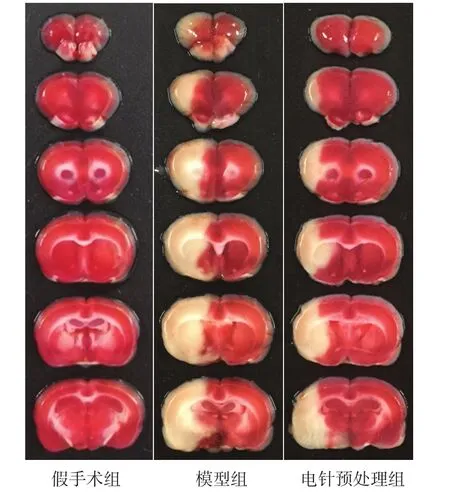
图3 各组大鼠脑梗死体积(TTC染色)
3 讨论
缺血性脑卒中属于中医学“中风”范畴,多因风、火、痰、瘀等病邪上扰清窍,而致“窍闭神匿,神不导气”所致,治疗当遵循“病变在脑,首取督脉”的理论。百会穴属督脉,为百脉之会,百病所主,有通络理气、升阳益气、熄风开窍、醒脑利窍等功效[13]。国内外研究证实[7-8,10,14-19],重复电针预处理百会穴可诱导脑缺血耐受,降低脑缺血再灌注损伤程度,发挥脑保护作用,机制与降低炎性反应、细胞凋亡、氧化应激、内质网应激,增强细胞自噬,促进细胞存活与增殖等有关,涉及多水平、多通路、多靶点的复杂调控网络。
细胞凋亡是多基因调控的细胞程序性死亡,再灌注引起的迟发型神经细胞死亡多以细胞凋亡为主,主要发生在缺血中心区周围的半暗区,脑损伤的严重程度、脑梗死体积的大小与其密切相关[20]。如何精准调控细胞凋亡,挽救缺血半暗区细胞成为减轻脑缺血损伤程度的重要靶点。本研究显示,脑缺血再灌注后,缺血半暗区大量神经细胞发生细胞凋亡;电针预处理干预可降低细胞凋亡水平,缩小脑梗死体积,改善神经功能,发挥脑保护作用。
本课题组前期已经证实[8-9,12],电针预处理的抗凋亡作用与下调缺血半暗区Toll样受体-4、核转录因子-κB蛋白表达,抑制血清与脑组织中白介素-1β、白介素-6介导的炎性损伤有关,但其具体机制仍需进一步阐明。
肿瘤抑制基因p53是细胞生存和死亡的重要调制器,抑制其表达可作为缺血性脑卒中的治疗手段[3,21]。p53作为调控细胞凋亡的关键基因,通过调控其下游相关通路靶蛋白发挥促进细胞凋亡功能。正常组织中表达量极低,主要通过转录依赖机制及转录非依赖机制两种途径引发细胞凋亡。除促进细胞凋亡外,p53还具有调控细胞增殖、自噬、再生修复、细胞生长分化等作用[22-24]。
Bcl-2家族主要参与细胞内源性凋亡途径,其作用贯穿脑缺血再灌注损伤始终[25]。Bcl-2是Bcl-2家族成员之一,是公认的抑制细胞凋亡基因,能够抑制细胞凋亡但不影响细胞增殖。Bcl-2是一种与线粒体相关的膜稳定蛋白,能够维持和保护膜的稳定性,抑制自由基产生,维持细胞核内钙离子浓度,抑制caspase活化和与Bax形成异源二聚体等,抑制细胞凋亡早期阶段[26-27]。脑缺血可促进p53表达,p53能抑制Bcl-2表达,同时促进Bax表达,上调Bax/Bcl-2比,进而调控caspase促进细胞凋亡,加重脑损伤[28-30]。电针干预可下调大脑皮层、海马Bax/Bcl-2比,使抗凋亡基因占据优势,抑制大鼠脑缺血再灌注损伤后细胞凋亡,减轻脑水肿,改善神经功能缺损[20,31]。
本研究显示,脑缺血再灌注损伤后缺血半暗区p53、Bax蛋白表达上调,Bcl-2蛋白表达下调,与既往结果保持一致。电针预处理一方面可以抑制促凋亡基因p53、Bax表达上调,另一方面又可促进抗凋亡基因Bcl-2进一步表达,下调Bax/Bcl-2比,从而降低细胞凋亡水平,发挥脑保护作用。
本研究尚不能证明电针预处理抑制p53表达与下调Bax/Bcl-2比直接相关,且仅从抗凋亡角度探讨了p53在电针预处理诱导脑缺血耐受中的作用机制。下一步我们将应用p53抑制剂和激动剂对p53介导的凋亡、自噬、细胞增殖途径展开深入研究,并探讨电针预处理在其中所发挥的作用,丰富其脑保护作用机制。
近年来,多项电针预处理的临床应用研究证实,其在心、脑损伤方面具有保护作用,有很好的临床应用前景[32-34]。我们将设计缺血性脑卒中电针预处理方案,以降低再次卒中的发病率和致残率。
[1]Murray CJ,Lopez AD.Measuring the global burden of disease[J].N Engl JMed,2013,369(5):448-457.
[2]Ansar S,Chatzikonstantinou E,Thiagarajah R,et al.Pro-inflammatory mediators and apoptosis correlate to rt-PA response in a novel mouse model of thromboembolic stroke[J].PLoS One,2014,9(1):e85849.
[3]Kizmazoglu C,Aydin HE,Sevin IE,et al.Neuroprotective effect of resveratrol on acute brain ischemia reperfusion injury by measuring annexin V,p53,Bcl-2 levels in rats[J].JKorean Neurosurg Soc,2015,58(6):508-512.
[4]Zhang J,Xia Y,Xu Z,et al.Propofol suppressed hypoxia/reoxygenation-induced apoptosis in HBVSMC by regulation of the expression of Bcl-2,Bax,Caspase3,Kir6.1,and p-JNK[J].Oxid Med Cell Longev,2016,2016:1518738.
[5]Lu H,Wang B.SIRT1 exerts neuroprotective effects by attenuating cerebral ischemia/reperfusion-induced injury via targeting p53/microRNA-22[J].Int J Mol Med,2017,39(1):208-216.
[6]叶涛,朱路文,唐强.电针预处理诱导脑缺血耐受的研究进展[J].针灸临床杂志,2015,31(2):87-90.
[7]林咸明,陈丽萍,姚旭.不同时程电针预处理对脑缺血再灌注大鼠血脑屏障基质金属蛋白酶-9,血管内皮生长因子的影响[J].针刺研究,2015,40(1):40-44.
[8]朱路文,叶涛,姜云飞,等.电针预处理对大鼠脑缺血再灌注损伤后炎性因子及细胞凋亡的影响[J].中国康复理论与实践,2016,22(7):765-768.
[9]叶涛,朱路文,唐强,等.电针预处理对脑缺血再灌注损伤大鼠神经功能和缺血半暗区Tolls样受体4、核转录因子κB蛋白的影响[J].中国康复理论与实践,2017,23(7):745-749.
[10]叶涛,朱路文,唐强,等.电针预处理对大鼠脑缺血再灌注损伤后脑梗死体积及血清TNF-α、IL-10含量的影响[J].中国针灸,2017,37(10):1093-1098.
[11]唐强,叶涛,朱路文,等.针康法对脑缺血大鼠神经功能和细胞外信号调节激酶1/2信号通路的影响[J].中国康复理论与实践,2017,23(1):27-31.
[12]Zhu L,Ye T,Tang Q,et al.Exercise preconditioning regulates the Toll-like receptor 4/nuclear factor-κb signaling pathway and reduces cerebral ischemia/reperfusion inflammatory injury:a study in rats[J].JStroke Cerebrovasc Dis,2016,25(11):2770-2779.
[13]程为平,韦燕博,张茜茹.论百会穴穴性及临床应用[J].辽宁中医药大学学报,2015,17(3):5-6.
[14]He X,Mo Y,Geng W,et al.Role of Wnt/β-catenin in the tolerance to focal cerebral ischemia induced by electroacupuncture pretreatment[J].Neurochem Int,2016,97:124-132.
[15]Jung YS,Lee SW,Park JH,et al.Electroacupuncture preconditioning reduces ROSgeneration with NOX4 down-regulation and ameliorates blood-brain barrier disruption after ischemic stroke[J].JBiomed Sci,2016,23:32.
[16]Ran QQ,Chen HL,Liu YL,et al.Electroacupuncture preconditioning attenuates ischemic brain injury by activation of the adenosine monophosphate-activated protein kinase signaling pathway[J].Neural Regen Res,2015,10(7):1069-1075.
[17]Wu ZQ,Cui S,Zhu L,et al.Study on the mechanism of mTOR-mediated autophagy during electroacupuncture pretreatment against cerebral ischemic injury[J].Evid Based Complement Alternat Med,2016,2016:9121597.
[18]陈怀龙,齐慧,刘孝洁,等.电针预处理对全脑缺血再灌注损伤大鼠海马葡萄糖调节蛋白78和生长停滞及DNA损伤基因153表达的影响[J].针刺研究,2014,39(6):431-436.
[19]张业贵,龚鑫,侯良芹.电针预处理对脑缺血再灌注大鼠大脑皮质一氧化氮合酶及胶质纤维酸性蛋白表达的影响[J].针刺研究,2015,40(2):113-118.
[20]张业贵,龚鑫,李怀斌.电针对脑缺血再灌注大鼠额叶皮质和海马CA1区Bcl-2,Bax表达的影响[J].皖南医学院学报,2014,33(2):95-98.
[21]Balaganapathy P,Baik SH,Mallilankaraman K,et al.Interplay between Notch and p53 promotes neuronal cell death in ischemic stroke[J].J Cereb Blood Flow Metab,2017.[Epub ahead of print].doi:10.1177/0271678X17715956.
[22]范瑞娟,罗亚非,陈永顺,等.桃红四物汤对大鼠脑缺血再灌注损伤后大脑皮质神经元Caspase-3与p53表达的影响[J].神经解剖学杂志,2015,31(6):739-745.
[23]Li T,Liu X,Jiang L,et al.Loss of p53-mediated cell-cycle arrest,senescence and apoptosis promotes genomic instability and premature aging[J].Oncotarget,2016,7(11):11838-11849.[24]Zhang P,Lei X,Sun Y,et al.Regenerative repair of Pifithrin-α in cerebral ischemia via VEGF dependent manner[J].Sci Rep,2016,6:26295.
[25]沈梅红,刘晓华,李缨,等.电针调节脑缺血再灌注大鼠大脑皮层Bcl-2和Bax mRNA的表达[J].辽宁中医杂志,2012,39(1):155-157.
[26]卜渊,张培影,耿德勤,等.电针药氧对大鼠全脑缺血再灌注后Bcl-2、Bax蛋白表达的影响[J].针刺研究,2010,35(3):208-212.
[27]陈锋,严志康,杨波.头皮针对脑缺血再灌注大鼠缺血区脑组织bcl-2、caspase-3蛋白表达以及血液流变的影响[J].针刺研究,2009,34(6):363-367.
[28]颜玲,黄德彬,刘锦红,等.黄芪多糖对脑缺血再灌注大鼠脑皮质中HSP70、PKB和P53蛋白表达的影响[J].中国病理生理杂志,2012,28(9):1610-1617.
[29]吴孝军,叶涛,李宏玉,等.运动预处理对脑缺血再灌注大鼠缺血半暗区细胞凋亡及相关蛋白P53表达的影响[J].中国康复理论与实践,2016,22(10):1117-1120.
[30]Liu QS,Deng R,Li S,et al.Ellagic acid protects against neuron damage in ischemic stroke through regulating the ratio of Bcl-2/Bax expression[J].Appl Physiol Nutr Metab,2017,42(8):855-860.
[31]范茜茜,董勤,沈梅红,等.电针对大鼠脑缺血再灌注损伤后细胞凋亡相关基因Bcl-2、Bax表达的影响[J].中国老年学,2017,37(5):1041-1043.
[32]Lu ZH,Bai XG,Xiong LZ,et al.Effect of electroacupuncture preconditioning on serum S100βand NSE in patients undergoing craniocerebral tumor resection[J].Chin J Integr Med,2010,16(3):229-233.
[33]Yang L,Yang J,Wang Q,et al.Cardioprotective effects of electroacupuncture pretreatment on patients undergoing heart valve replacement surgery:a randomized controlled trial[J].Ann Thorac Surg,2010,89(3):781-786.
[34]Wang Q,Liang D,Wang F,et al.Efficacy of electroacupuncture pretreatment for myocardial injury in patients undergoing percutaneous coronary intervention:a randomized clinical trial with a 2-year follow-up[J].Int JCardiol,2015,194:28-35.

