不同电针法对APP/PS1小鼠海马高迁移率族蛋白B1和白细胞介素-10表达的影响①
赵江豪,姚海江,王远征,卢梦晗,李昱颉,宋萌,杨利娟,刘俊彤,李志刚
1.北京中医药大学针灸推拿学院,北京市100029;2.中国康复研究中心北京博爱医院中医治疗中心,北京市100068;3.首都医科大学康复医学院,北京市100068;4.北京大学第一医院中西医结合科,北京市100084
阿尔茨海默病(Alzheimer's disease,AD)也称“老年性痴呆”,起病隐匿,以老年人(包括老年前期)为多发人群,是一种以认知、记忆能力持续受损和人格改变等为特征的中枢神经系统(central nervous system,CNS)退行性疾病[1]。AD是痴呆发病的最主要类型,在中国可占全部痴呆人群的50%~70%[2]。慢性炎症反应是AD发病过程中的重要病理表现之一[3-4]。小胶质细胞(microglia,MG)作为CNS的天然屏障,是重要的免疫细胞,在AD的病理发展过程中起着推波助澜的重要作用:MG的过度活化,可释放大量致炎蛋白因子,介导神经炎症反应,促使神经元持续受损[5-6]。非甾体类消炎镇痛药可降低AD的风险,减缓疾病进展,进一步佐证炎症反应与AD发病之间存在着密切关系[7-8]。
大量研究证实[9-10],电针对AD有效。本研究从MG活化角度出发,选取与AD反应密切相关的高迁移率族蛋白B1(high mobility group box protein-1,HMGB1)、白细胞介素-10(interleukin-10,IL-10),探讨分析不同电针在“通督启神”针法下对AD治疗效果的差异。
1 材料与方法
1.1 实验动物及分组
7月龄SPF级健康雄性黑色双转基因APP/PS1小鼠32只,购于南京大学南京生物医药研究院模式动物研究所,批准号SCXK(宁)2010-0001,体质量(24.6±4.3)g。饲养于北京中医药大学动物中心屏障系统单笼。根据小鼠体质量标号,随机数字表法分为模型组、药物组、脉冲电针组及音乐电针组各8只;选择8只同月龄相同背景的C57BL/6小鼠作为正常对照组。
1.2 主要试剂与仪器
ZYTH2013030504无菌针灸针,直径0.25 mm、长13 mm:北京中研太和医疗器械有限公司。ZJ-12H音乐电针治疗仪:深圳市圣祥高科技有限公司。HANS-202型韩式电针仪:南京济生医疗科技有限公司。XR-XM101型Morris水迷宫图像自动采集和软件分析系统:上海欣软信息科技公司。自制小鼠束缚套,约8×4 cm,头部用双层纱布缝制。电泳仪:美国BIO-RAD公司。离心机:美国THERMO公司。BX53光学显微镜:日本OLYMPUS公司。石蜡切片机:德国LEICA公司。
二甲苯(分析纯):北京化学试剂公司。兔抗HMGB1多克隆抗体、大鼠抗IL-10单克隆抗体:英国ABCAM公司。
1.3 方法
脉冲电针组小鼠用束缚套固定,参照实验动物针灸穴位图谱,交叉平刺百会、印堂,两针针体不接触,以防短路,深约0.5 cm,针柄接韩式电针仪,频率2 Hz,强度以小鼠头部稍稍颤动为宜,每次20 min,后点刺人中。每天上午9:00治疗1次,共15 d。
音乐电针组小鼠同法束缚、针刺,选取节奏明朗的痴呆处方干预,以小鼠保持安静不暴躁挣扎为度。
药物组予盐酸多奈哌齐0.92 mg/kg灌胃给药。
正常对照组、药物组和模型组同法抓取并用相同鼠套束缚20 min。
1.4 Morris水迷宫检测
Morris水迷宫水深约29 cm,水温(22±2)℃,加入低糖低脂奶粉使水成为半透明乳白色,以利于摄像分辨为度。水池内水面平均分为4个象限,平台放置于第三象限中央,水面下1 cm。水池上方装备摄像机,将所采集信号传入计算机分析软件系统,进行图像和数据自动采集和处理。
1.4.1 定位航行实验
在水迷宫实验前一天,撤离平台,小鼠在水池内游泳训练90 s。正式实验时,小鼠入水前先将其放在平台上10 s令其熟悉环境;以第一象限池壁中央为入水点,面朝池壁放入水中。小鼠登台停留5 s,自动记录逃避潜伏期;若90 s内小鼠未能登上平台,则逃避潜伏时记为90 s。共测试5 d。
1.4.2 空间探索实验
定位航行实验结束后,拆除平台,将小鼠分别从第一、二、四象限池壁中点相同方法放入池中,记录90 s内小鼠在原平台所在象限的游泳时间与游泳总时间之比。
1.5 HMGB1与IL-10检测
1.5.1 Western blotting
水迷宫测试完毕后,各组随机取4只小鼠,10%水合氯醛0.01 ml/g腹腔注射麻醉,断头处死,取出脑组织,冰袋上分离出大脑海马,存置于灭菌冻存管。将液氮中组织取出,加入蛋白裂解液,测定蛋白含量,取样本30μg,10%SDS-PAGE电泳,半干电转移仪转印至PVDF膜上,5%TBS-T脱脂奶粉封闭震荡60 min,加入 HMGB1 抗体(1∶100)或 IL-10 抗体(1∶2000)4℃孵育过夜。第2天洗膜,加二抗(HMGB1 1∶100,IL-10 1∶2000)37℃震荡孵育1 h;加发光液,曝光后显影清晰时漂洗定影,晾干扫描。用Image-Pro Plus软件对目的条带进行灰度分析,以目的蛋白与β-actin的相对灰度值表示。
1.5.2 免疫组化染色
将其余4只小鼠10%水合氯醛0.01 ml/g腹腔注射麻醉,开胸暴露心脏,左心尖插入针头固定,剪开右心耳,以生理盐水灌注至流出液体清亮,肝脏灰白色;换4%多聚甲醛继续灌注至小鼠躯干、四肢及尾部全部僵硬,取全脑,置4%多聚甲醛中,梯度酒精脱水,石蜡包埋,切片。切片脱蜡,枸椽酸水煮抗原修复10 min,PBS漂洗3遍。3%H2O2常温保湿盒中10 min,PBS漂洗;正常非免疫羊血清室温保湿盒中孵育10 min;加兔抗HMGB1多克隆抗体(1∶1100)或鼠抗IL-10单克隆抗体(1∶50),4℃冰箱孵育过夜;第2天PBS漂洗,HMGB1使用生物素标记的羊抗兔IgG二抗,IL-10使用生物素标记的羊抗鼠IgG二抗,37℃孵育10 min,PBS漂洗;链霉菌抗生物素蛋白-过氧化酶37℃孵育10 min,PBS漂洗;DAB显色,显微镜下观察并适时终止显色;苏木素复染(HMGB1不复染),酒精梯度脱水,中性树脂封片。以海马CA1部分为图片分析区域,每组取相互不重叠的6个视野,Image-Pro Plus软件分析系统计数阳性细胞数。
1.6 统计学分析
采用SPSS 20.0统计软件进行处理。各数据均以(xˉ±s)表示,水迷宫逃避潜伏期采用重复测量方差分析,水迷宫空间探索测试实验和Western blotting数据呈正态分布,采用单因素方差分析,组间比较选用LSD检验。显著性水平α=0.05。
2 结果
2.1 Morris水迷宫
定位航行实验随着训练时间增加,各组逃避潜伏期呈下降趋势。与正常对照组比较,模型组逃避潜伏期较长(P<0.05)。前两天药物组、脉冲电针组和音乐电针组均与模型组无显著性差异(P>0.05),第3天音乐电针组与模型组有显著性差异(P<0.05),第4天以后正常对照组、药物组、脉冲电针组、音乐电针组与模型组均有显著性差异(P<0.05),正常对照组逃避潜伏期最短,其次是音乐电针组、脉冲电针组、药物组,模型组最长。见表1。
空间探索实验中,正常对照组目标象限游泳时间比值最高,而后依次是音乐电针组、脉冲电针组、药物组,模型组最低。音乐电针组与脉冲电针组之间无显著性差异(P>0.05)。见表2。
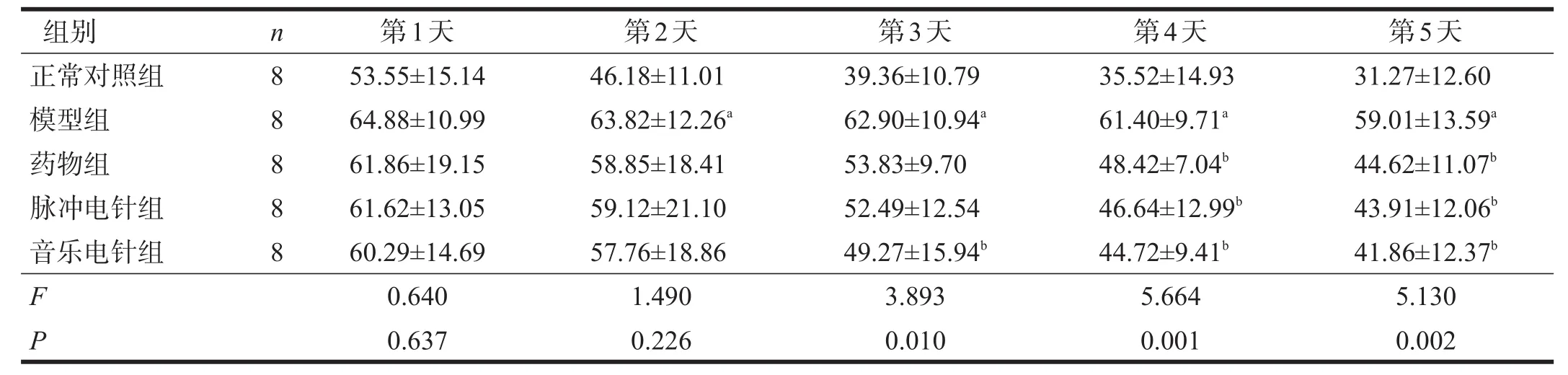
表1 各组Morris水迷宫定位航行实验逃避潜伏期比较(s)

表2 各组目标象限游泳时间与总时间之比的比较
2.2 Western blotting
与正常对照组比较,模型组HMGB1蛋白表达增加(P<0.05);与模型组相比,脉冲电针组和音乐电针组的蛋白表达下降(P<0.05);音乐电针组比脉冲电针组无显著性差异(P>0.05)。见表3、图1。
与正常对照组比较,模型组IL-10蛋白减少(P<0.05);与模型组相比,脉冲电针组和音乐电针组的IL-10蛋白表达上升(P<0.05);音乐电针组比脉冲电针组间无显著性差异(P>0.05)。见表3、图2。

图2 各组海马IL-10表达(Western blotting)
2.3 免疫组化染色
正常对照组小鼠海马CA1区HMGB1阳性细胞表达数量最少(P<0.001),模型组相同脑区表达最多,主要表达于胞浆和胞外。与模型组比较,脉冲电针组和音乐电针组HMGB1阳性细胞表达下降(P<0.05),音乐电针组表达少于脉冲电针组(P<0.05)。见表4、图3。
正常对照组小鼠海马CA1区IL-10表达最多,模型组表达最少(P<0.001),主要为胞质,胞核少量着色。与模型组比较,脉冲电针组和音乐电针组IL-10表达增多(P<0.05),音乐电针组表达多于脉冲电针组(P<0.05)。见表4、图4。
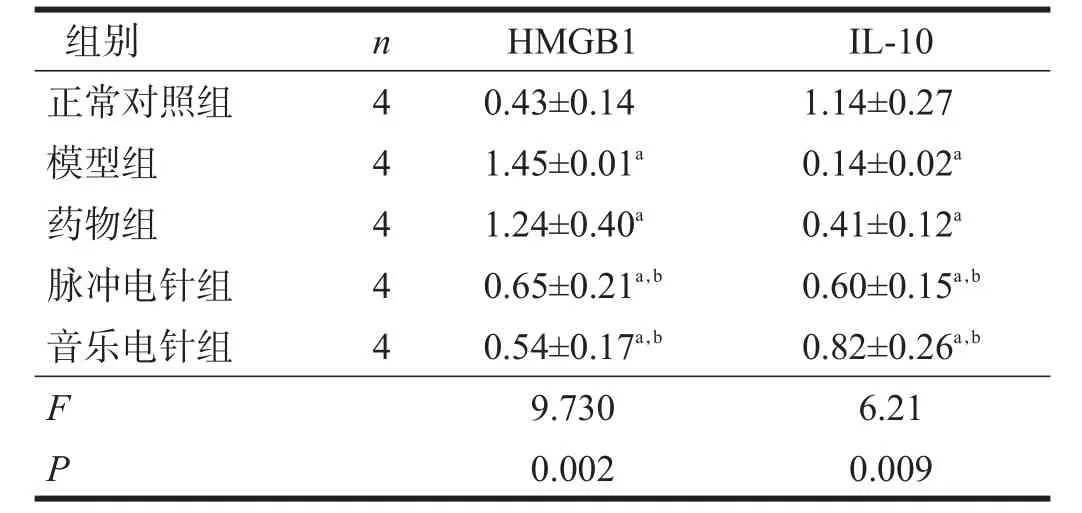
表3 各组海马HMGB1与IL-10表达比较

表4 各组海马HMGB1与IL-10阳性细胞数比较

图3 各组海马HMGB1表达(免疫组化染色,bar=50μm)

图4 各组海马IL-10表达(免疫组化染色,bar=50μm)
3 讨论
研究显示,由于β淀粉样蛋白(betaamyloid,Aβ)沉积引发MG过度活化,其诱发的神经炎症反应在AD神经元凋亡过程中发挥重要作用,可能是AD的发病机制之一[11-12]。MG作为CNS的免疫细胞,具有“双刃剑”效应,既可以监测脑内微环境,抵抗各种损伤,发挥吞噬凋亡细胞碎片的作用;又可诱导、加重CNS炎症反应,从而加速AD发展,加剧神经元破坏和凋亡[13]。MG可在Aβ沉积以及Tau磷酸化等的刺激下,呈M1型极化,胞体发生阿米巴样形态转化,正常吞噬功能减弱,分泌大量致炎因子。MG还具有拮抗炎症反应的M2型极化,大量分泌IL-10、IL-4、IL-13以及转化生长因子-β等,抑制抗炎因子表达,发挥营养和修复作用。
在Aβ持续激活下,MG从静息状态下过度活化、聚集,丧失生理警戒和抵御功能,过度产生的炎性介质加剧神经炎症,造成严重神经毒性,侵蚀损伤神经元,甚至导致其凋亡[14]。激活的MG和死亡的神经元可以释放HMGB1,HMGB1又作用于MG,促进促炎症因子或氧自由基释放,诱发级联放大效应,加重神经炎症,加重认知功能障碍及记忆力减退[15];同时,HMGB1可以与Aβ结合,形成较难降解的Aβ寡聚体,抑制MG对Aβ的清除[16]。
IL-10作为主要抗炎细胞因子之一,在降低促炎性细胞因子表达的同时,还能促进Aβ清除,从而减轻Aβ诱导的AD样变化[17-18]。
“通督启神”法以百会、印堂、人中三穴作为主穴。该法基于“脑为髓海”,又为元神之府,而“督脉者……上额,交巅,入络脑”,根据脑、神、督脉之间密切联系提出,在治疗精神神志类疾病中取得明显效果。百会是六阳经与督脉交会穴,可调全身神识,为调神第一大穴。叶涛等[19]的研究显示,电针百会可有效改善脑缺血再灌注造成的脑神经损伤。宋长明等[20]的研究证实,电针百会、神庭穴可改善再灌注损伤后大鼠学习记忆能力,并能改善模型大鼠脑内超微结构。印堂居眉心正中,功能镇惊醒神,降逆除烦。人中又名水沟,可沟通阴阳,为急救要穴,主醒神开窍,为诸多神经精神疾患要穴。三穴配合,可以达到“通督启神”的疗效。
音乐电针以电流输出波形模拟音乐节奏的低中频电刺激,电流如音乐般频率和振幅不断变换,避免机体过度适应和耐受。音乐电针不仅具有刺激腧穴和音乐节奏治疗的双重作用,而且克服了以往普通脉冲电针易产生耐受性的缺点,在治疗焦虑、抑郁等神经精神疾病中取得很好效果[21-22]。
我们前期研究已经证实,“通督启神”法两类电针能够降低痴呆小鼠脑内Aβ含量,进而改善其痴呆行为[23-24]。本研究显示,在改善AD模型小鼠空间记忆方面,音乐电针组逃避潜伏期自训练第3天起即明显少于模型组,而脉冲电针组和药物组则在第4天起少于模型组;音乐电针组逃避潜伏期少于脉冲电针组。目标象限游泳时间与总游泳时间之比也有相似的倾向。提示“通督启神”电针可改善APP/PS1小鼠空间记忆,且音乐电针优于脉冲电针,与本课题以往研究一致[25]。“通督启神”电针均可降低AD小鼠海马HMGB1的表达,增加IL-10表达,音乐电针更为明显。
总之,本研究提示,“通督启神”两种电针均为行之有效改善AD的手段,且音乐电针干预效果更优,其作用机制可能与其影响促炎因子HMGB1及抗炎因子IL-10,干预MG两种不同极化有关。但其具体作用机制尚需要进一步研究。
[1]贾建平.神经病学[M].7版.北京:人民卫生出版社,2013:217.
[2]Jia J,Wang F,Wei C,et al.The prevalence of dementia in urban and rural areasof China[J].Alzheimers Dement,2014,10(1):1-9.
[3]Azizi G,Mirshafiey A.Thepotential roleof proinflammatory and antiinflammatory cytokines in Alzheimer disease pathogenesis[J].Immunopharmacol Immunotoxicol,2012,34(6):881-895.
[4]Pimplikar SW.Neuroinflammation in Alzheimer's disease:from pathogenesis to a therapeutic target[J].JClin Immunol,2014,34(1 Suppl):64-69.
[5]Akiyama H,Barger S,Barnum S,et al.Inflammation and Alzheimer's disease[J].Neurobiol Aging,2000,21(3):383-421.
[6]Teeling JL,Perry VH.Systemic infection and inflammation in acute CNSinjury and chronic neurodegeneration:underlying mechanisms[J].Neuroscience,2009,158(3):1062-1073.
[7]Szekely CA,Breitner JC,Fitzpatrick AL,et al.NSAID use and dementia risk in the Cardiovascular Health Study Role of APOE and NSAID type[J].Neurology,2008,70(1):17-24.
[8]Breitner JC.NSAIDs and Alzheimer's disease:how far to generalise from trials?[J].Lancet Neurol,2003,2(9):527.
[9]谢艺婷,柳维林,陈立典,等.电针对阿尔茨海默病模型动物认知功能和组织病理学影响的研究进展[J].中国康复理论与实践,2017,23(5):539-542.
[10]王颖,李威,张亢亢,等.不同频率电针对阿尔茨海默病大鼠学习记忆能力和海马突触的影响[J].中国康复理论与实践,2016,22(6):635-639.
[11]张军,柯开富,邱一华,等.神经炎症在阿尔茨海默病发病机制中的作用[J].南通大学学报(医学版),2012,32(1):44-47.
[12]Halliday G,Robinson SR,Shepherd C,et al.Alzheimer's disease and inflammation:a review of cellular and therapeutic mechanisms[J].Clin Exp Pharmacol Physiol,2000,27(1-2):1-8.
[13]Cunningham C.Microglia and neurodegeneration:The role of systemic inflammation[J].Glia,2013,61(1):71-90.
[14]Solito E,Sastre M.Microglia function in Alzheimer's disease[J].Front Pharmacol,2012,10(3):14.
[15]Mazarati A,Maroso M,Iori V,et al.High-mobility group box-1 impairs memory in mice through both toll-like receptor 4 and receptor for advanced glycation end products[J].Exp Neurol,2011,232(2):143-148.
[16]陈轩,王永红.小胶质细胞与神经系统发育和阿尔茨海默病的关系[J].重庆医科大学学报,2017,42(6):755-758.
[17]唐丽娜,许小明,李艳红.炎症因子与阿尔茨海默病的相关性研究进展[J].中国老年学杂志,2016,36(17):4378-4380.
[18]张宪亮.有氧运动及白藜芦醇对Tg APP/PS1小鼠海马Aβ沉积的影响[D].上海:华东师范大学,2016.
[19]叶涛,朱路文,唐强,等.电针预处理对脑缺血再灌注损伤大鼠神经功能和缺血半暗区Tolls样受体4、核转录因子κB蛋白的影响[J].中国康复理论与实践,2017,23(7):745-749.
[20]宋长明,黄佳,林冰冰,等.电针百会、神庭穴对脑缺血再灌注大鼠学习记忆能力及海马CA1区突触超微结构的影响[J].中国康复理论与实践,2017,23(7):750-755.
[21]纪倩,李志刚,唐银杉,等.不同电针刺激对慢性应激抑郁模型大鼠行为学及海马谷氨酸转运体的影响[J].针刺研究,2013,38(3):202-207,219.
[22]纪倩,梅旭晖,唐银杉,等.音乐电针和脉冲电针对慢性应激抑郁大鼠行为学和海马星形胶质细胞的影响[J].中华中医药杂志,2013,28(3):648-651.
[23]周源,李志刚,周阿剑,等.音乐电针对阿尔茨海默病模型小鼠学习记忆行为能力和海马CA3区Aβ_(1-42)表达的影响[J].上海中医药大学学报,2015,29(3):76-80.
[24]唐银杉,李志刚,陈万顺,等.音乐电针和脉冲电针对快速老龄化SAMP8小鼠行为学和血清Aβ蛋白的影响[J].中医药学报,2014,42(1):87-90.
[25]邵千枫,李昱颉,曹瑾,等.“通督启神”法两种电针对APP/PS1小鼠额叶皮层小胶质细胞TNF-α表达的影响[J].世界科学技术-中医药现代化,2016,18(8):1327-1333.

