昼夜节律紊乱对大鼠运动耐力、运动后血压和心率的影响①
李一,王文竹,张玉阁,申嘉怡,张通,5
1.首都医科大学康复医学院,北京市100068;2.中国康复科学所中国康复医学所,北京市100068;3.北京脑重大疾病研究院神经损伤与修复研究所,北京市100068;4.神经损伤与康复北京市重点实验室,北京市100068;5.中国康复研究中心北京博爱医院神经康复中心,北京市100068
昼夜节律是一种接近24 h(19~28 h)的生物周期,广泛存在于人及其他哺乳动物中,以使机体功能适应日常环境的变化[1]。昼夜节律的核心机制来源于时钟基因通过转录-翻译-翻译后加工形成的反馈调节环路,从而产生生理水平的昼夜变化。昼夜节律的中枢位于下丘脑视交叉上核(suprachiasmatic nucleus,SCN),且广泛表达于心脏、肾脏、骨骼肌等组织中[2-3]。人体的心血管、内分泌等都存在昼夜节律变化,而昼夜节律紊乱会导致这些功能障碍,增加罹患心脑血管疾病、肥胖、糖尿病等慢性疾病的风险[4-5]。
随着社会经济的发展,越来越多的人群进入倒班工作。欧美国家约有20%的人从事倒班工作[6];我国虽然尚无倒班人群比例的准确报道,但倒班已成为我国各行各业的重要工作制度之一。许多研究表明,倒班所引起的昼夜节律紊乱,与睡眠障碍、胃肠道疾病、心血管疾病、肿瘤等密切相关[6-9]。此外,流行病学结果显示,昼夜节律紊乱与疲劳密切相关,倒班工人在工作中更易表现出注意力不集中、疲乏、精疲力尽等症状,严重影响其工作表现与工作安全[10-13],而这种疲劳水平一定程度受运动耐力的影响[14]。
高血压是心脑血管疾病的重要危险因素,患病人数持续增长[15],疾病负担较高。流行病学调查显示,2010年我国成人高血压患病率为33.5%[16]。高血压会造成运动耐力下降[17],而倒班工作造成的昼夜节律紊乱是高血压的危险因素之一[5]。推测昼夜节律紊乱可能通过对心血管因素的作用,影响运动耐力。
目前尚没有研究对昼夜节律紊乱与运动耐力之间的关系进行直接探讨,有3篇文献对短时间内睡眠剥夺对运动功能的影响进行报道,发现短时间睡眠剥夺会对运动功能造成影响,睡眠剥夺组的运动表现劣于正常对照组[18-20]。其他形式昼夜节律紊乱对运动功能的影响还需要进一步进行探讨。本研究构建自发性高血压大鼠(spontaneously hypertensive rats,SHR)昼夜节律紊乱模型,研究其对大鼠运动耐力的影响。
1 材料与方法
1.1 实验动物
成年雄性SHR大鼠30只和与其年龄、体质量匹配的同源正常血压WKY大鼠30只,11~12周龄,SPF级,购于北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001,饲养于中国康复医学所动物屏障实验室。
实验已通过首都医科大学伦理委员会审查(AEEI-2017-093)。
根据参考文献及预实验结果[4,21],采用随机数字表法将实验动物随机分为正常节律组(对照组)、12 h节律紊乱组(观察组1)、6 h节律紊乱组(观察组2),每组均含SHR大鼠10只、WKY大鼠10只。
1.2 造模方法
对照组光照/黑暗12 h/12 h。观察组1先光照/黑暗12 h/12 h,共3 d;后改为黑暗/光照12 h/12 h,共3 d,如此循环。观察组2持续光照/黑暗6 h/6 h。饲养间用40 W日光灯照明,光照度15~20 Lx。
1.3 评定方法
1.3.1 一次性力竭运动试验
于造模前及造模1个月、2个月、3个月时,分别进行一次性力竭运动试验。采用YLS-15A大鼠转轮式跑步机(北京众实迪创科技发展有限责任公司),试验前每天以0~15 r/min训练20 min,连续2 d,使大鼠适应跑轮运动。力竭运动参考Bedford运动标准,以30 r/min转速,直至大鼠跟不上预定速度,臀部压在笼具后壁,电刺激(超过10 s)驱赶无效为止。记录力竭时间。
1.3.2 运动后血压、心率
每次力竭运动试验后立即测量血压、心率。把大鼠放进固定器中,尾巴留在固定器外。采用6通道大鼠无创CODA血压计(美国KENT公司),从大鼠尾根部依次套入Ocuff和VPR传感器,并把大鼠放到加热板上加热;待血流量达到传感器阈值后,测量页面显示传感器压力变化的曲线以及血压和心率数值。取连续5~10个较为稳定的血压值(误差<5 mmHg),取平均值。血压测量过程中避免刺激大鼠,尽量使其保持舒适、放松状态,避免大鼠躁动。
1.4 统计学分析
使用SPSS 17.0进行统计学处理。力竭时间,运动后血压、心率均服从正态分布且方差齐,用(xˉ±s)表示。使用重复测量方差分析和单因素方差分析进行比较。各组内SHR大鼠与WKY大鼠造模3个月后力竭时间与基线水平的差值采用独立样本t检验。显著性水平α=0.05。
2 结果
2.1 力竭时间
2.1.1 SHR大鼠
对照组力竭时间随造模时间延长持续增加;观察组1力竭时间随造模时间延长逐渐下降,观察组2力竭时间造模后先增加后下降。造模时间与分组对力竭时间存在交互作用(P<0.05)。不同时间点比较,三组在造模3个月后力竭时间有显著性差异(P<0.05),对照组高于观察组1和观察组2。见表1。
2.1.2 WKY大鼠
对照组和观察组2力竭时间随造模时间延长持续增加,观察组1力竭时间在造模2个月后存在下降趋势。造模时间与分组无交互作用(P>0.05)。见表2。
2.1.3 SHR大鼠与WKY大鼠比较
造模3个月后与造模前差值比较,对照组及观察组2 SHR大鼠与WKY大鼠间无显著性差异(P>0.05),观察组1 SHR大鼠力竭时间改变大于WKY大鼠(P<0.05)。见表3。
2.2 运动后血压
2.2.1 收缩压
2.2.1.1 SHR大鼠
对照组和观察组1收缩压随造模时间延长持续增加,观察组2收缩压在造模2个月后下降。造模时间与分组间存在交互作用(P<0.05)。造模3个月后,三组收缩压有非常显著性差异(P<0.01),观察组1高于对照组和观察组2(P<0.05)。见表4。
2.2.1.2 WKY大鼠
三组收缩压均随造模时间延长而增加。造模时间与分组间无交互作用(P>0.05)。不同时间点,除造模1个月外,收缩压各组间均无显著性差异(P>0.05)。见表5。
2.2.2 舒张压
2.2.2.1 SHR大鼠
对照组和观察组1舒张压随造模时间延长持续增加,观察组2舒张压在造模2个月后下降。造模时间与分组间存在明显交互作用(P<0.01)。造模3个月后,三组舒张压有非常显著性差异(P<0.01),观察组1高于对照组和观察组2(P<0.05),对照组高于观察组2(P<0.05)。见表6。
2.2.2.2 WKY大鼠
三组舒张压均随造模时间延长而增加。造模时间与分组间无交互作用(P>0.05)。不同时间点舒张压各组间均无显著性差异(P>0.05)。见表7。
2.2.3 平均动脉压
2.2.3.1 SHR大鼠
对照组和观察组1平均动脉压随造模时间延长持续增加,观察组2平均动脉压在造模2个月后下降。造模时间与分组间存在明显交互作用(P<0.01)。造模3个月后,三组平均动脉压有非常显著性差异(P<0.01),观察组1高于对照组和观察组2(P<0.05),对照组高于观察组2(P<0.05)。见表8。
2.2.3.2 WKY大鼠
三组平均动脉压均随造模时间延长而增加。造模时间与分组间无交互作用(P>0.05)。不同时间点平均动脉压组间均无显著性差异(P>0.05)。见表9。
2.3 运动后心率
2.3.1 SHR大鼠
三组心率均随造模时间延长而增加。造模时间与分组间无交互作用(P>0.05)。造模3个月后,三组心率有非常显著性差异(P<0.01),对照组低于观察组1和观察组2(P<0.05)。见表10。
2.3.2 WKY大鼠
三组心率均随造模时间延长而增加。造模时间与分组间无交互作用(P>0.05)。不同时间点心率各组间均无显著性差异(P>0.05)。见表11。

表1 各组SHR大鼠力竭时间变化(min)

表2 各组WKY大鼠力竭时间变化(min)

表3 各组SHR大鼠与WKY大鼠造模前后力竭时间差值比较(min)

表4 各组SHR大鼠运动后收缩压变化(mmHg)

注:重复测量方差分析,F时间=23.052,P<0.001;F组间=3.645,P=0.050;F交互=1.885,P=0.155。a.与对照组比较,P<0.05

表6 各组SHR大鼠运动后舒张压变化(mmHg)

表7 各组WKY大鼠运动后舒张压变化(mmHg)
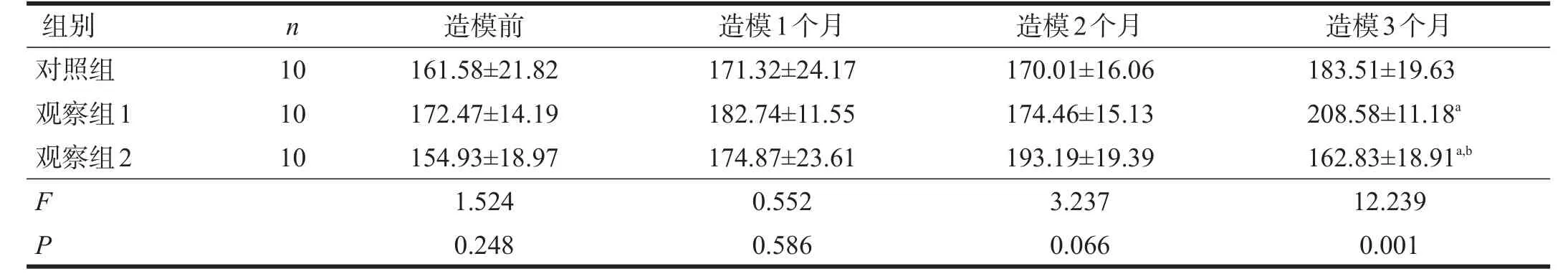
表8 各组SHR大鼠运动后平均动脉压变化(mmHg)
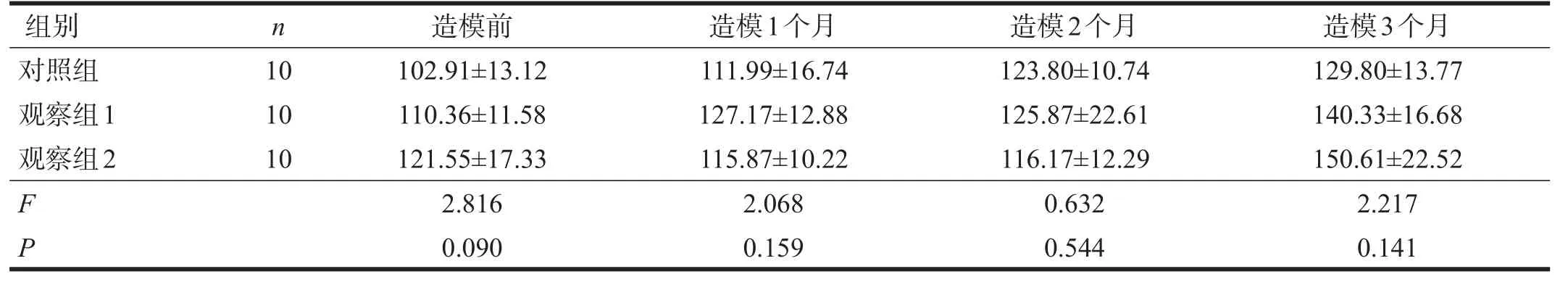
表9 各组WKY大鼠运动后平均动脉压变化(mmHg)

表10 各组SHR大鼠运动后心率变化(/min)
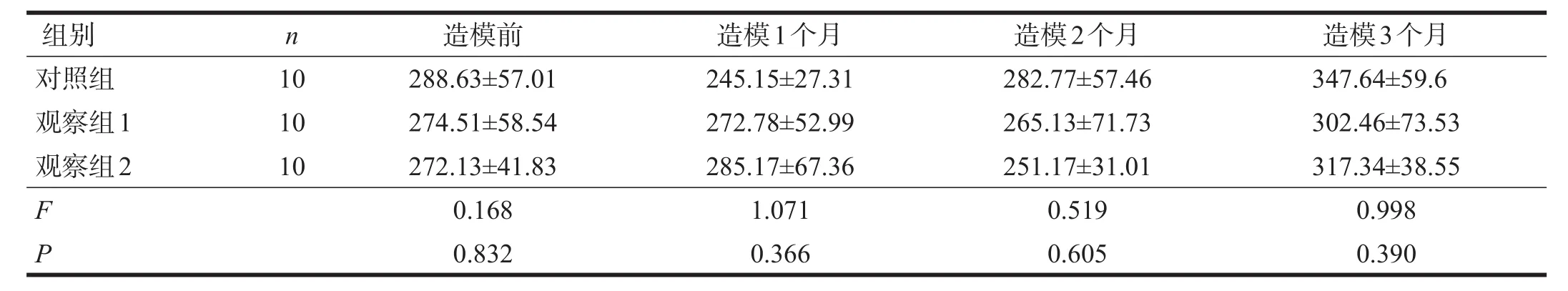
注:重复测量方差分析,F时间=4.931,P=0.005;F组间=1.175,P=0.334;F交互=0.911,P=0.495
3 讨论
昼夜节律广泛存在于人类和其他哺乳动物中,参与调节多种生理、心理和行为变化,是生命活动的本质特性[1]。昼夜节律紊乱会导致睡眠、心血管、代谢等多种功能障碍[4-5],而其造成的机体疲劳,更是严重影响工作表现与工作安全[12]。本研究设立观察组1和观察组2,分别模拟人类倒班工作及短时生活不规律[22],检测大鼠的运动耐力,发现节律紊乱后,高血压大鼠运动耐力下降。
大量研究证实,运动耐力存在昼夜节律,下午运动表现优于上午[23-24]。造成这种昼夜节律变化的原因包括中枢和外周两种因素,中枢因素是指昼夜节律对心肺功能的作用,而外周因素是骨骼肌细胞中时钟基因的作用[25]。
心血管功能和肺功能也受昼夜节律影响[26-27],血压、心率、呼出气温度等都存在24 h节律性波动,上午的血压、血儿茶酚胺水平、凝血活性都高于下午[28-30]。昼夜节律紊乱也会导致心血管及肺功能障碍,如高血压、冠心病、呼吸道症状和异常免疫炎症反应等[31-32],而这些心肺功能障碍会直接影响运动耐力[33]。
骨骼肌功能也存在昼夜节律[34]。骨骼肌细胞中的时钟基因对肌肉的质量、力量、肌纤维类型以及线粒体功能都起着重要作用[35]。使用基因敲除或基因突变大鼠的研究发现,时钟基因缺失会导致肌肉病理变化,包括肌纤维类型变化[36],线粒体呼吸减弱[37],肌肉力量下降[38]等。
光照的改变会同时影响中枢和外周两种因素[25,27],推测光照改变造成的昼夜节律紊乱也会对运动耐力造成影响。
本研究显示,造模3个月后,SHR大鼠观察组运动耐力低于对照组;虽然没有显著性差异,但WKY大鼠观察组1力竭时间在造模2个月后存在下降趋势。这表明昼夜节律紊乱会降低大鼠运动耐力。SHR大鼠和WKY大鼠运动耐力基线水平不一致,SHR大鼠基线力竭时间较长,这可能与SHR大鼠易冲动,在跑轮运动中更容易受电刺激驱使有关[39]。由于两者基线运动耐力存在差异,故本研究没有直接比较SHR大鼠与WKY大鼠的力竭时间,而是比较了两者造模前后力竭时间的差值,发现SHR大鼠观察组1运动耐力下降明显,而WKY大鼠则较基线水平稍有增加,表明昼夜节律紊乱对高血压大鼠运动耐力的影响较明显。研究发现,SHR大鼠时钟基因对昼夜节律紊乱的敏感性较高[40],故更易受昼夜节律紊乱的影响。
大鼠运动后血压及心率随昼夜节律紊乱时间的延长,总体呈上升趋势;造模3个月后,SHR大鼠观察组1运动后血压高于对照组,两个观察组运动后心率均高于对照组。心血管功能障碍会导致运动耐力下降,而运动后血压、心率等指标能有效反映心血管功能的变化。运动后收缩压过度升高由心功能不全导致,与心肌梗死、心绞痛、心率失常、心力衰竭等心血管并发症密切相关,可以作为诊断冠心病的有效指标[41-42]。运动后舒张压与内皮依懒性血管舒张功能相关,其过度升高由血管内皮功能受损导致[43]。运动后心率升高与心脏交感神经过度兴奋有关,也可作为冠心病、心力衰竭等疾病的辅助诊断指标[44]。本研究中SHR大鼠观察组运动后血压、心率的异常,表明其心血管功能存在障碍;且昼夜节律紊乱可以造成血管内皮损害与心脏自主神经功能障碍,增加罹患冠心病的风险[2,32,45]。推测昼夜节律紊乱会影响大鼠心血管功能,并由此影响大鼠的运动耐力。
有研究表明,高血压患者运动中血压过度升高与其肌力减退有关[46],这与力竭时间结果一致。在本研究中,SHR大鼠观察组2在造模2个月后,运动后血压出现降低趋势。有文献报道,部分高血压患者存在运动后血压降低情况,原因主要是运动后外周血管阻力和心输出量下降[47]。
综上所述,昼夜节律紊乱会降低大鼠的运动耐力,且观察组运动后血压、心率高于对照组。推测运动耐力下降与心血管功能相关。在下一步研究中,将从这方面进行深入探索。
本研究首次探讨了昼夜节律紊乱与运动耐力之间的关系,从新的层面阐释了昼夜节律紊乱对日常生活的影响。
[1]Bass J,Takahashi JS.Circadian integration of metabolism and energetics[J].Science,2010,330(6009):1349-1354.
[2]袁艳鹏.昼夜节律紊乱与心脑血管疾病[J].国际心血管病杂志,2010,37(5):292-294.
[3]Riley LA,Esser KA.The role of the molecular clock in skeletal muscle and what it is teaching us about muscle-bone crosstalk[J].Curr Osteoporos Rep,2017,15(3):222-230.
[4]Herrero L,Valcarcel L,Da SC,et al.Altered circadian rhythm and metabolic gene profile in rats subjected to advanced light phaseshifts[J].PLoSOne,2015,10(4):e122570.
[5]Portaluppi F,Tiseo R,Smolensky MH,et al.Circadian rhythms and cardiovascular health[J].Sleep Med Rev,2012,16(2):151-166.
[6]Boivin DB,Boudreau P.Impacts of shift work on sleep and circadian rhythms[J].Pathol Biol(Paris),2014,62(5):292-301.
[7]Sridhar GR,Sanjana NS.Sleep,circadian dysrhythmia,obesity and diabetes[J].World JDiabetes,2016,7(19):515-522.
[8]赵冬云,丁思悦,郭丽华,等.医院倒班制临床从业群体职业应激现况及对心血管危险因素的影响分析[J].中国医刊,2017,52(3):36-39.
[9]Samulin EJ,Noto HO,Skare O,et al.Mechanisms of breast cancer risk in shift workers:association of telomere shortening with the duration and intensity of night work[J].Cancer Med,2017,6(8):1988-1997.
[10]Barker LM,Nussbaum MA.Fatigue,performance and the work environment:a survey of registered nurses[J].J Adv Nurs,2011,67(6):1370-1382.
[11]Moradifar R,Hoveidi H,Givehchi S,et al.Examining fatigue and insomnia symptoms among workers of a gas transmission industry in 2013[J].Electron Physician,2014,6(2):827-831.
[12]Stimpfel AW,Brewer CS,Kovner CT.Scheduling and shift work characteristics associated with risk for occupational injury in newly licensed registered nurses:An observational study[J].Int JNurs Stud,2015,52(11):1686-1693.
[13]Dall'Ora C,Ball J,Recio-Saucedo A,et al.Characteristics of shift work and their impact on employee performance and wellbeing:A literature review[J].Int J Nurs Stud,2016,57(5):12-27.
[14]O'Leary TJ,Collett J,Howells K,et al.Endurance capacity and neuromuscular fatigue following high-vsmoderate-intensity endurance training:A randomized trial[J].Scand JMed Sci Sports,2017,16(2):1111.
[15]罗雪琚.从普通病例谈高血压发病率的攀升[J].中华高血压杂志,2016,24(5):402.
[16]李镒冲,王丽敏,姜勇,等.2010年中国成年人高血压患病情况[J].中华预防医学杂志,2012,46(5):409-413.
[17]Missault LH,Duprez DA,Brandt AA,et al.Exercise performance and diastolic filling in essential hypertension[J].Blood Press,1993,2(4):284-288.
[18]Patrick Y,Lee A,Raha O,et al.Effects of sleep deprivation on cognitive and physical performance in university students[J].Sleep Biol Rhythms,2017,15(3):217-225.
[19]Mejri MA,Yousfi N,Mhenni T,et al.Does one night of partial sleep deprivation affect the evening performance during intermittent exercise in Taekwondo players?[J].JExerc Rehabil,2016,12(1):47-53.
[20]Mejri MA,Yousfi N,Hammouda O,et al.One night of partial sleep deprivation increased biomarkers of muscle and cardiac injuries during acute intermittent exercise[J].J Sports Med Phys Fitness,2017,57(5):643-651.
[21]Xin L,Sun X,Lou S.Effects of methane-rich saline on the capability of one-time exhaustive exercise in male SD rats[J].PLoSOne,2016,11(3):e150925.
[22]Matsumura T,Nakagawa H,Suzuki K,et al.Influence of circadian disruption on neurotransmitter levels,physiological indexes,and behaviour in rats[J].Chronobiol Int,2015,32(10):1449-1457.
[23]Bessot N,Moussay S,Gauthier A,et al.Effect of pedal rate on diurnal variations in cardiorespiratory variables[J].Chronobiol Int,2006,23(4):877-887.
[24]Hamouda O,Chtourou H,Farjallah MA,et al.The effect of Ramadan fasting on the diurnal variations in aerobic and anaerobic performances in Tunisian youth soccer players[J].Biological Rhythm Research,2012,43(2):177-190.
[25]Harfmann BD,Schroder EA,Esser KA.Circadian rhythms,the molecular clock,and skeletal muscle[J].JBiol Rhythms,2015,30(2):84-94.
[26]Sundar IK,Yao H,Sellix MT,et al.Circadian molecular clock in lung pathophysiology[J].Am J Physiol Lung Cell Mol Physiol,2015,309(10):1056-1075.
[27]Gubin DG,Weinert D,Rybina SV,et al.Activity,sleep and ambient light have a different impact on circadian blood pressure,heart rate and body temperature rhythms[J].Chronobiol Int,2017,34(5):632-649.
[28]Carpagnano GE,Lacedonia D,Malerba M,et al.Exhaled breath temperature measurement:influence of circadian rhythm[J].J Biol Regul Homeost Agents,2017,31(1):229-235.
[29]Degaute JP,van de Borne P,Linkowski P,et al.Quantitative analysis of the 24-hour blood pressure and heart rate patterns in young men[J].Hypertension,1991,18(2):199-210.
[30]Vaara J,Kyrolainen H,Koivu M,et al.The effect of 60-h sleep deprivation on cardiovascular regulation and body temperature[J].Eur JAppl Physiol,2009,105(3):439-444.
[31]Sundar IK,Yao H,Sellix MT,et al.Circadian clock-coupled lung cellular and molecular functions in chronic airway diseases[J].Am JRespir Cell Mol Biol,2015,53(3):285-290.
[32]Vetter C,Devore EE,Wegrzyn LR,et al.Association between rotating night shift work and risk of coronary heart disease among women[J].JAMA,2016,315(16):1726-1734.
[33]Herdy AH,Ritt LE,Stein R,et al.Cardiopulmonary exercise test:background,applicability and interpretation[J].Arq Bras Cardiol,2016,107(5):467-481.
[34]van Moorsel D,Hansen J,Havekes B,et al.Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity[J].Mol Metab,2016,5(8):635-645.
[35]Aoyama S,Shibata S.The role of circadian rhythms in muscular and osseous physiology and their regulation by nutrition and exercise[J].Front Neurosci,2017,2(11):63.
[36]Schroder EA,Harfmann BD,Zhang X,et al.Intrinsic muscle clock is necessary for musculoskeletal health[J].J Physiol,2015,593(24):5387-5404.
[37]Dyar KA,Ciciliot S,Wright LE,et al.Muscle insulin sensitivity and glucose metabolism are controlled by the intrinsic muscleclock[J].Mol Metab,2014,3(1):29-41.
[38]Andrews JL,Zhang X,McCarthy JJ,et al.CLOCK and BMAL1 regulate MyoD and are necessary for maintenance of skeletal muscle phenotype and function[J].Proc Natl Acad Sci U SA,2010,107(44):19090-19095.
[39]Dela PI,Dela PI,de la Pena JB,et al.Methylphenidate and atomoxetine-responsive prefrontal cortical genetic overlaps in"impulsive"SHR/NCrl and Wistar rats[J].Behav Genet,2017,47(5):564-580.
[40]Olejnikova L,Polidarova L,Pauslyova L,et al.Diversedevelopment and higher sensitivity of the circadian clocks to changes in maternal-feeding regime in a rat model of cardio-metabolic disease[J].Chronobiol Int,2015,32(4):531-547.
[41]韦汐,胡世红.运动血压异常与心血管疾病的关系[J].重庆医学,2012,41(21):2214-2216.
[42]于宗良.运动后收缩压异常升高对冠心病的诊断价值的初步探讨[D].苏州:苏州大学,2003.
[43]杨兴义,胡志刚,赵勇,等.血管内皮功能与运动后血压反应相关性的研究[J].临床心血管病杂志,2005,21(2):76-78.
[44]康美华,王成.运动后心率恢复的研究进展[J].中国循证儿科杂志,2014,9(1):72-76.
[45]Portaluppi F,Tiseo R,Smolensky MH,et al.Circadian rhythms and cardiovascular health[J].Sleep Med Rev,2012,16(2):151-166.
[46]Kamada Y,Masuda T,Tanaka S,et al.Muscle weakness is associated with an increase of left ventricular mass through excessive blood pressure elevation during exercise in patients with hypertension[J].Int Heart J,2017,58(4):551-556.
[47]Gomes AP,Doederlein PM.A review on post-exercise hypotension in hypertensive individuals[J].Arq Bras Cardiol,2011,96(5):100-109.

