小麦耐Cu性综合评价及其谷胱甘肽相关酶活性差异研究
张黛静,刘雪晴,刘安琪,马建辉,杨惠荔,陈倩青,李春喜
河南师范大学生命科学学院,河南 新乡 453007
铜(Cu)是植物生长发育必需的微量营养元素,是一些调控蛋白和氧化酶的组成元素(Guerrero,2005),广泛参与各种代谢过程(Harrison et al.,1999),而适合植物生长的 Cu含量范围很窄,过量的Cu会造成毒害(Polle et al.,2004),使植物根尖细胞核核质解体、核空泡化,细胞功能丧失(王萍萍等,2007),影响根系活力,致使根系生理机能降低;此外,过量的 Cu还可以使植物体内积累等一系列活性氧(ROS)(Schützendübel et al.,2002)。
植物受重金属胁迫后,会启动体内抗氧化系统清除过量的ROS,从而保持机体内ROS代谢平衡(Pätsikkä et al.,2002)。还原型谷胱甘肽(GSH)是植物抗氧化系统中重要的非酶类抗氧化剂,不仅能够清除过量的ROS(Noctor et al.,2002),而且也是植物螯合肽(PC)的前体,能螯合细胞内游离的 Cu离子并将其转运至液泡后排出体外,从而降低重金属Cu的毒害作用(Rauser,1990)。谷胱甘肽硫转移酶(GSTs)作为一种多功能酶,参与GSH与有毒物质的结合与转运(Marrs,1996),GSTs不仅能催化 GSH与底物结合,与次生代谢产物相互作用,而且还具有 GSH依赖的谷胱甘肽过氧化物酶(GSH-PX)活性(张雪等,2017),在植物中有高达 90个基因编码,可在重金属诱导下表达(Chi et al.,2010;Moons,2003)。谷胱甘肽还原酶(GR)通过抗坏血酸-谷胱甘肽(ASA-GSH)循环途径清除过量的 ROS,有研究发现植物在遭受Cu(王松华等,2011)、铅(Pb)(杨志娟等,2015)、镉(Cd)(马晓丽等,2017)胁迫后,GR活性显著增强,且抗性品种的GR活性高于其敏感性品种(丁顺华,2006)。GSH-PX作为一种含巯基的过氧化物酶,在清除机体内的H2O2、有机氢过氧化物和脂质过氧化物过程中扮演重要角色(Mittler,2002;Margis et al.,2008)。
小麦(Triticum aestivum L.)作为世界上重要的谷物之一,近年来关于重金属 Cu对小麦的影响多集中于其生理生化(Gajewska et al.,2013)及基因表达差异(Li et al.,2014)方面,而关于小麦品种对重金属耐性评价的研究多集中于Cd(慈敦伟等,2011)、Pb(孙洪欣等,2015)、Al(林咸永,2002),对小麦耐 Cu性评价的研究却较少。有研究证实,小麦幼苗在30 mg·L-1Cu2+处理下会受到胁迫(董敬娜等,2011;张黛静等,2014)。本研究采用统计分析和综合评价法,比较不同品种小麦耐 Cu性差异,以期筛选出耐 Cu性差异较大的品种,进而分析其幼根谷胱甘肽相关酶的响应差异,为进一步研究其抗氧化机制提供参考。
1 材料与方法
1.1 试验材料及其培养
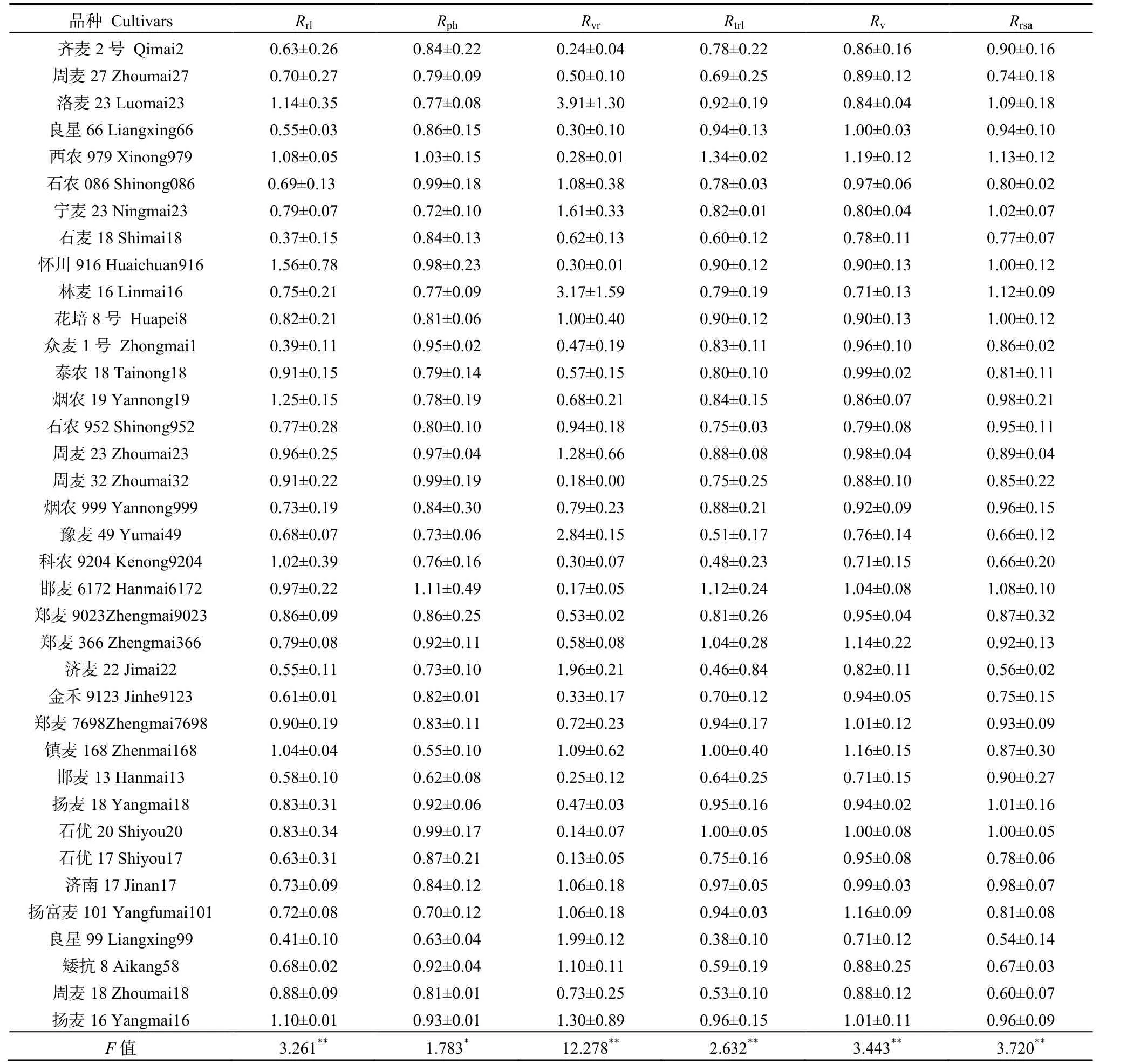
表1 Cu胁迫下37个小麦品种的相对性状平均值Table 1 The mean value of relative traits of 37 wheat cultivars under Cu stress
1.2 测定指标及方法
1.2.1 株高与根长
随机选取小麦幼苗30株测量其株高(cm)、根长(cm)。
1.2.2 根系形态
运用根系扫描仪(Epson V700),结合分析软件(WinRhizo),测量根系的总长度、总体积和总表面积。
1.2.3 根系活力
采用本实验室改良的氯化三苯基四氮唑(TTC)法测定(张志良等,2003)。
1.2.4 GSTs、GR和GSH-PX活力
特殊配合力(SCA)指一个亲本在与另一亲本所产生杂交组合的性状表现中偏离两亲本平均效应的特殊效应。将SCA效应值按正向、负向进行组合归类,从表4看出,各性状的SCA效应值为正向和负向的杂交组合个数相当,正向、负向效应值变幅较大。
取0.2 g幼根鲜样,加入0.8 mL预冷的0.1 mol∙L-1PBS(pH 6.5),冰浴研磨,低温离心 15 min后参照胡延玲等(2009)的试验方法测定 3种酶活力。
1.2.5 Cu耐性鉴定指标的筛选和Cu耐性综合评价
参照孙小芳等(2001)、陈仲英等(2016)的指标筛选方法,将各指标值换算成相对值(处理值/对照值),采用模糊数学隶属函数法计算各个指标的隶属度值、平均隶属度值,根据平均隶属度值大小进行聚类分析,综合评价小麦的耐Cu性。
隶属度值计算公式(杨梅等,2012):

式中,Xj表示用于隶属函数分析的第j个指标;Xjmax与_Xjmin分别表示第 j个指标的最大值和最小值,表示平均隶属度值。
1.3 数据分析
运用 Excel 2010进行数据整理并计算隶属度值,SPSS 22.0统计分析软件对数据进行Pearson相关分析和中位数聚类分析。
2 结果与分析
2.1 Cu胁迫下不同品种小麦幼根生长生理差异分析
以各个指标的相对值反映品种耐性,可以比较不同性状间的差异。由表1可知,Rvr相对于其他指标变幅较大,最大值是3.91,与最小值相差3.78,且品种间差异显著(P<0.01);Rv变化幅度较小,品种间差异显著(P<0.01)。此外,不同指标在相同品种中变化规律存在差异,比如西农979 Rvr小于1,其他指标相对值均大于1。综上可知,用任何单一指标的变化判断小麦的耐 Cu性,缺乏准确性、全面性。
分析结果表明,6个指标间存在一定的相关性(表 2)。其中,Rrl与 Rtrl、Rrsa呈极显著正相关;Rph分别与Rtrl和Rv、Rrsa呈极显著或显著正相关,而与Rvr呈显著负相关;Rvr与Rv存在显著负相关;Rtrl与Rv、Rrsa呈极显著正相关。

表2 37个小麦品种各相对性状值的相关系数Table 2 Correlation matrixes of each relative character values of different wheat cultivars
2.2 Cu胁迫下不同品种小麦耐Cu性的综合评价

图1 37个小麦品种平均隶属度值聚类分析图Fig. 1 Clustering chart of value of average membership degree of 37 wheat varieties
平均隶属度值的大小反映了品种耐性的强弱。采用中位数聚类分析法将37个品种分为3类(图1,表3):(Ⅰ)强耐Cu型,包括良星99、科农9204、济麦22等7个品种,即耐Cu能力排名前7的品种;(Ⅱ)中等耐Cu型,由花培8号、扬富麦101、烟农19、石农086等22个品种组成,耐Cu能力排名在8~29之间;(Ⅲ)弱耐Cu型,包括西农979、洛麦23、怀川916在内的8个品种,耐Cu能力排名在30~37之内。
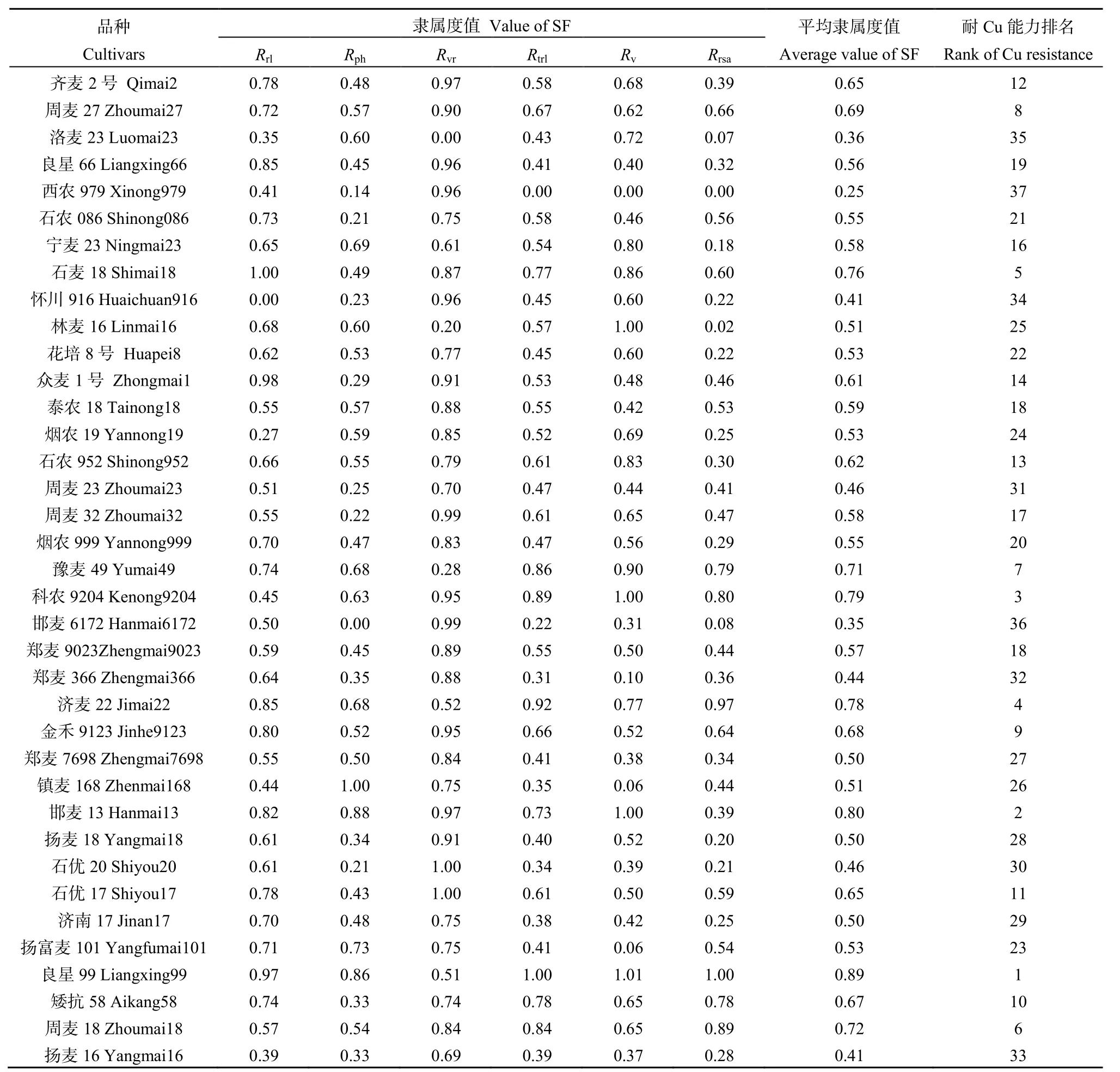
表3 37个小麦品种的耐Cu性综合评价Table 3 Comprehensive evaluation results of Cu resistance of 37 wheat varieties
2.3 Cu胁迫下不同耐性品种的谷胱甘肽相关酶活性差异分析
2.3.1 Cu胁迫下不同耐性品种的 GSTs活性差异分析
基于以上试验结果,选择强耐Cu型品种(济麦22、科农9204)和弱耐Cu型品种(西农979、洛麦23)各两个,测定根系GSTs、GR及GSH-PX活力,比较这3种酶在4个品种间的活性。从图2可知,CK处理下,4个品种的GSTs都表现较高的活性,GSTs活力在西农 979幼根中高达 1108.92 U∙g-1,显著高于其他3个品种(P<0.05)。Cu胁迫96 h后,洛麦23的GSTs被诱导,显著高于其对照处理(P<0.05),并与其他 3个品种呈显著差异(P<0.05)。济麦22、科农9204和西农979受Cu胁迫后GSTs活力略降低,科农9204幼根中GSTs活力低至 874.89 U∙g-1,显著低于其他 3个品种(P<0.05)。
2.3.2 Cu胁迫下不同耐性品种的GR活性差异分析
由图3可知,CK处理下,4个品种幼根的GR活力相对较低,西农 979显著低于其他 3个品种(P<0.05)。Cu胁迫下,济麦22 GR活力达到2.31 U∙g-1,显著高于其对照处理(P<0.05),与其他 3个小麦品种达显著性差异(P<0.05)。与CK相比,Cu胁迫下济麦22的GR活性显著升高,但其他品种均有不同程度的下降(P<0.05),且仅科农9204与对照差异不显著(P<0.05)。
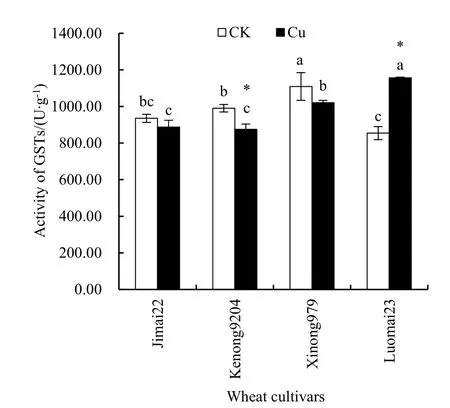
图2 Cu对4个小麦品种幼根GSTs活力的影响Fig. 2 Effects of Cu stress on the activity of GSTs in young roots of four wheat cultivars
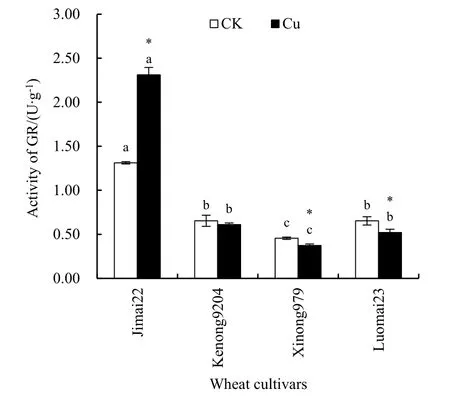
图3 Cu对4个小麦品种幼根GR活力的影响Fig. 3 Effects of Cu stress on the activity of GR in young roots of four wheat cultivars
2.3.3 Cu胁迫下不同耐性品种的GSH-PX活性差异分析
由图4知,CK处理下,洛麦23根部GSH-PX活力为 55.38 U∙g-1,显著低于其他 3个品种(P<0.05),西农979活力最大,且与其他3个品种差异显著(P<0.05)。Cu胁迫下,济麦 22、科农9204和西农979的GSH-PX活性相比CK呈升高趋势,济麦 22和西农 979的 GSH-PX活力分别为1198.50 U∙g-1和 1209.33 U∙g-1,均与其他 2 个品种达显著差异(P<0.05),且济麦 22的 GSH-PX活力显著高于其对照处理(P<0.05)。
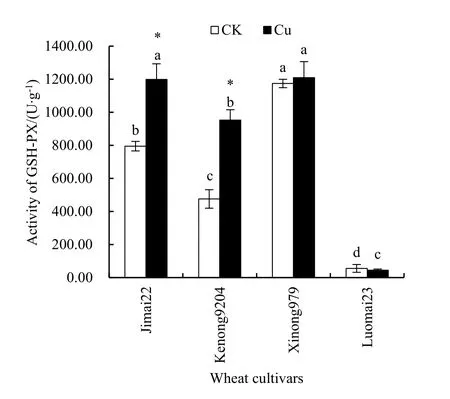
图4 Cu对4个小麦品种幼根GSH-PX活力的影响Fig. 4 Effects of Cu stress on the activity of GSH-PX in young roots of four wheat cultivars
3 讨论
3.1 小麦耐Cu性鉴定指标的筛选及综合评价方法
作物的耐重金属性(陈仲英等,2016)与抗旱性(张龙龙等,2016)、抗寒性(徐澜等,2015)都属于复杂的生物性状,由一系列因素共同决定,是基因与环境的综合表现,所以综合多个生长和生理指标更能全面、准确地评价小麦的耐 Cu性。在评价方法中,隶属函数法被广泛用于评价植物的抗旱性(李春喜等,2016)、抗寒性(张志伟等,2012)和耐重金属性(陈仲英等,2016;Ci et al.,2011),隶属度值是与品种耐性相关的生长生理指标综合的结果,较准确地反映品种间的耐性差异(姜丽娜等,2014)。聚类分析法能在未知分类数情况下对参试品种进行客观精确的分类,对品种耐性的划分具有较好的应用价值(许红等,2014)。本研究结合隶属函数法、聚类分析法以及耐 Cu能力排名相对客观精准地将37个小麦品种聚为3类。
3.2 重金属Cu对小麦GSTs、GR和GSH-PX活性的影响
本研究依据耐 Cu能力排名选择耐性强弱不同的4个品种,研究GSTs、GR和GSH-PX这3个酶在小麦受Cu胁迫后的活性变化规律。GSTs在植物抵御逆境过程中具有重要作用,当植物遭受重金属(Mokgalaka-Matlala et al.,2009)、低温(赵凤云等,2006)、干旱(邱宗波等,2008)和紫外线(刘新仿等,2002)等胁迫后,其活性被诱导,催化GSH与有毒物质的结合并转运至液泡排出体外,从而达到解毒的目的(Edwards et al.,2000)。有研究表明,Cd胁迫下,GSTs活性显著增强(Dixit et al.,2001;Iannelli et al.,2002),而且弱耐性品种GSTs活力高于强耐性品种(胡延玲等,2009),这在本试验中也有体现。洛麦23在本试验中的耐Cu能力排名是35,属于弱耐Cu型品种,受Cu胁迫后其活力升高并与其他3个品种差异显著。而济麦22、科农9204和西农979在Cu胁迫后GSTs活力略降低,且西农979在对照处理下,其GSTs活力最高,这可能与不同基因型小麦GSTs同工酶的组成和表达存在多样化有关,这在其他研究中也有发现(胡延玲等,2009;Zhang et al.,2008)。
GR能将氧化型谷胱甘肽(GSSG)还原为GSH(林宇丰等,2015),还能抑制O2-的产生(Mittler,2002),从而降低机体内过量的ROS,因此GR活力的升高对植物抵御非生物胁迫有重要作用。Gupta et al.(1999)用Cu胁迫菜豆和Drazkiewicz et al.(2003)用Cu胁迫拟南芥后都发现其GR活力升高。本研究中,济麦22受Cu胁迫后其幼根活性显著增强,且与其他3个品种差异显著,同时GR活性也显著增强,与其他3个品种差异显著,由于济麦22在本研究中耐Cu能力排名第四,故属于耐Cu性较强的品种,而西农979和洛麦23属于弱耐Cu型品种,GR活力较低,对重金属Cu较敏感,这与Mittova et al.(2003)的研究类似。王聪等(2010)用100 mmol∙L-1NaCl胁迫耐性不同的大豆也得到类似结果,而且耐性较强的“绿领特早”活性显著提高,这可能与GR酶在不同品种中被调控的因素不同有关。有研究发现,重金属对GR活性是先诱导后抑制,且诱导作用受重金属浓度影响,本试验中科农9204的GR活性较低,可能是因为本研究中Cu的质量浓度超过其GR耐受范围,导致GR结构或合成受到影响,进而降低活力(黄国勇等,2010)。
多数的GSH-PX在植物遭受重金属(Sugimoto et al.,1997)、高盐(Kim et al.,2014)、干旱(Neto et al.,2013)等一些非生物胁迫时被激活,迅速降解脂质过氧化产物(Foyer et al.,1997),从而减少胁迫引起的毒害。研究发现,Cu胁迫下GSH-PX活性增强(Zhou et al.,2001),且在强耐性品种中活力较强(Anjum et al.,2016)这在本研究也有体现。与CK相比,济麦22、科农9204在Cu胁迫后GSH-PX活性显著增强,洛麦 23略降低,且济麦22和科农9204在本实验中属于强耐Cu型品种。黄国勇等(2010)研究发现重金属胁迫下GSH-PX活性相对较高,对重金属耐受性较强,而本试验中西农979 GSH-PX活性较高,可能与其GSH-PX对Cu胁迫不太敏感有关。综上,GSTs、GR和GSH-PX活力在济麦22中相对较高,与其耐Cu性呈正相关。同一种酶在同一类型品种间的变化规律不同,这暗示了其在不同的品种间的调控解毒机制可能存在差异。然而这3种酶的同工酶数目较多,调控其表达的因素也有很多,在今后的研究中,需要借助分子生物学技术深入研究与 Cu解毒有关的同功酶及调控其表达的因素,这对揭示耐性小麦的解毒机制有重要意义。
4 结论
(1)本研究采用室内水培法,对参试的 37个小麦品种进行重金属 Cu胁迫处理。结合隶属函数法和中位数聚类分析法将37个小麦品种分为3类:强耐Cu型,包括良星99、济麦22、科农9204等7个品种;中等耐Cu型,由众麦1号、石农952等22个品种组成;弱耐Cu型,包括西农979、洛麦23等8个品种。
(2)重金属Cu胁迫下,GSTs活力升高,且在弱耐Cu型小麦品种间较高;GR和GSH-PX活力在强耐Cu型品种间较高,而在弱耐Cu型品种间变化不同,西农979的GSH-PX活力显著高于洛麦23。
ANJUM S A, TANVEER M, HUSSAIN S, et al. 2016. Osmoregulation and antioxidant production in maize under combined cadmium and arsenic stress [J]. Environmental Science & Pollution Research, 23(12):11864-11875.
CHI Y, HENG Y, VANITHA J, et al. 2010. Expansion mechanisms and functional divergence of the glutathione S-transferase family in sorghum and other higher plants [J]. DNA research, 18(1): 1-16.
CI D, JIANG D, DAI T, et al. 2011. Variation in cadmium tolerance and accumulation and their relationship in wheat recombinant inbred lines at seedling stage [J]. Biological Trace Element Research, 142(3):807-818.
DIXIT V, PANDEY V, SHYAM R. 2001. Differential antioxidative responses to cadmium in roots and leaves of pea (Pisum sativum L. cv.Azad) [J]. Journal of Experimental Botany, 52(358): 1101-1109.
DRAZKIEWICZ M, SKORZYNSKA-POLIT E, KRUPA Z. 2003.Response of the ascorbate–glutathione cycle to excess copper in arabidopsis thaliana (L.) [J]. Plant Science, 164(2): 195-202.
EDWARDS R, DIXON D P, WALBOT V. 2000. Plant glutathione S-transferases: enzymes with multiple functions in sickness and in health [J]. Trends in plant science, 5(5): 193-198.
FOYER C H, LOPEZ-DELGADO H, DAT J F, et al. 1997. Hydrogen peroxide-and glutathione-associated mechanisms of acclimatory stress tolerance and signaling [J]. Physiologia Plantarum, 100(2):241-254.
GAJEWSKA E, GLOWACKI R, MAZUR J, et al. 2013. Differential response of wheat roots to Cu, Ni and Cd treatment: oxidative stress and defense reactions [J]. Plant Growth Regulation, 71(1): 13-20.
GUERRERO I Y. 2005. Copper in plants [J]. Brazilian Journal of Plant Physiology, DOI: 10.1590/S1677-04202005000100012.
GUPTA M, CUYPERS A, VANGRONSVELD J, et al. 1999. Copper affects the enzymes of the ascorbate-glutathione cycle and its related metabolites in the roots of phaseolus vulgaris [J]. Physiologia Plantarum, 106(3): 262-267.
HARRISON M D, JONES C E, DAMERON C T. 1999. Copper chaperones: function, structure and copper-binding properties [J].Journal of Biological Inorganic Chemistry Jbic A Publication of the Society of Biological Inorganic Chemistry, 4(2): 145-153.
IANNELLI M A, PIETRINI F, FIORE L, et al. 2002. Antioxidant response to cadmium in Phragmites australis plants [J]. Plant Physiology and Biochemistry, 40(11): 977-982.
KIM Y J, JANG M G, NOH H Y, et al. 2014. Molecular characterization of two glutathione peroxidase, genes of panax ginseng, and their expression analysis against environmental stresses [J]. Gene, 535(1):33-41.
LI H X, FAN R C, LIBIN L I, et al. 2014. Identification and characterization of a novel copper transporter gene family TaCT 1, in common wheat[J]. Plant Cell & Environment, 37(7): 1561-1573.
MARGIS R, DUNAND CTEIXEIRA F K, MARGIS-PINHEIRO M. 2008.Glutathione peroxidase family-an evolutionary overview [J]. Febs Journal, 275(15): 3959.
MARRS K A. 1996. The functions and regulation of glutathione S-transferases in plants [J]. Annual review of plant biology, 47(1):127-158.
MITTLER R. 2002. Oxidative stress, antioxidants and stress tolerance [J].Trends in Plant Science, 7(9): 405-410.
MITTOVA V, THEODOULOU F L, KIDDLE G, et al. 2003. Coordinate induction of glutathione biosynthesis and glutathione-metabolizing enzymes is correlated with salt tolerance in tomato [J]. Febs Letters,554(3): 417-421.
MOKGALAKA-MATLALA N S, FLORES-TAVIZON E, CASTILLOMICHEL H, et al. 2009. Arsenic tolerance in mesquite (Prosopis sp.):Low molecular weight thiols synthesis and glutathione activity in response to arsenic [J]. Plant Physiology and Biochemistry, 47(9):822-826.
MOONS A. 2003. Osgstu3, and osgtu4, encoding tau class glutathione S-transferases, are heavy metal-and hypoxic stress-induced and differentially salt stress-responsive in rice roots [J]. Febs Letters,553(3): 427-432.
NETO J R C F, PANDOLFI V, BENKOISEPPON A M,et al. 2013. Early transcriptional response of soybean contrasting accessions to root dehydration [J]. Plos One, 8(12): e83466.
NOCTOR G, GOMEZ L, VANACKER H, et al. 2002. Interactions between biosynthesis, compartmentation and transport in the control of glutathione homeostasis and signaling [J]. Journal of experimental botany, 53(372): 1283-1304.
PÄTSIKKÄ E, KAIRAVUO M, SERSEN F, et al. 2002. Excess copper predisposes photosystem II to photoinhibition in vivo outcompeting iron and causing decrease in leaf chlorophyll [J]. Plant physiology,129(3):1359-1367.
POLLE A, SCHUTZENDUBEL A. 2004. Heavy metal signalling in plants:linking cellular and organismic responses [M]//Plant Responses to Abiotic Stress. Springer Berlin Heidelberg: 187-215.
RAUSER W E. 1990. Phytochelatins [J]. Annual review of biochemistry,59(1): 61-86.
SCHÜTZENDÜBEL A, POLLE A. 2002. Plant responses to abiotic stresses: heavy metal-induced oxidative stress and protection by mycorrhization [J]. Journal of Experimental Botany, 53(372):1351-1365.
SUGIMOTO M, FURUI S, SUZUKI Y. 1997. Molecular cloning and characterization of a cDNA encoding putative phospholipid hydroperoxide glutathione peroxidase from spinach [J]. Bioscience Biotechnology & Biochemistry, 61(8): 1379-1381.
ZHANG C H, YING G E. 2008. Response of glutathione and glutathione s-transferase in rice seedlings exposed to cadmium stress [J]. Rice Science, 15(1): 73-76.
ZHOU C, WU G, SHI G, et al. 2001. The role of antioxidant systems in Cu2+stress resistance in alternanthera philoxeroides [J]. Acta Botanica Sinica, 43(4): 389-394.
陈仲英, 龙瑜菡, 徐云, 等. 2016. 工业大麻品种萌发期及幼苗前期重金属Pb耐性评价研究[J]. 中国麻业科学, 38(3): 97-104.
慈敦伟, 姜东, 戴廷波, 等. 2011. 长江中下游麦区小麦地方品种幼苗耐镉性的差异[J]. 麦类作物学报, 31(6): 1035-1039.
丁顺华. 2006. 植物体内谷胱甘肽还原酶的功能研究[D]. 北京: 中国科学院研究生院(植物研究所): 21-23
董敬娜, 李光德, 敬佩, 等. 2011. 硅作用下铜对小麦幼苗生理特性影响研究[J]. 水土保持学报, 25(2): 222-226.
胡延玲, 张春华, 居婷, 等. 2009. 镉胁迫下两种水稻 GSH 和 GST 应答差异的研究[J]. 农业环境科学学报, 28(2): 305-310.
黄国勇, 王友绍, 孙翠慈, 等. 2010. 秋茄叶对复合重金属的胁迫反应及其积累能力研究[J]. 热带海洋学报, 29(6): 104-109.
姜丽娜, 马建辉, 樊婷婷, 等. 2014. 孕穗期低温对小麦生理抗寒性的影响[J]. 麦类作物学报, 34(10): 1373-1382.
李春喜, 郭雪妮, 张黛静, 等. 2016. 轻度干旱胁迫下黄淮麦区不同基因型小麦的响应分析[J]. 生态环境学报, 25(9): 1446-1452.
林咸永, 章永松, 罗安程. 2002. 小麦地上部和根系生长的相关性及其在耐Al性筛选中的作用[J]. 应用生态学报, 13(6):766-768.
林宇丰, 李魏, 戴良英. 2015. 抗氧化酶在植物抗旱过程中的功能研究进展[J]. 作物研究, 29(3): 326-330.
刘新仿, 李家洋. 2002. 紫外线强烈诱导的谷胱甘肽转移酶基因的功能鉴定[J]. 遗传学报, 29(5): 458-460.
马晓丽, 冀瑞萍, 田保华, 等. 2017. 一氧化氮(NO)对镉胁迫下小麦幼苗氧化损伤的影响[J]. 生物技术通报, 33(5): 102-107.
邱宗波, 李方民, 王芳, 等. 2008. CO2激光处理对干旱胁迫小麦幼苗谷胱甘肽抗氧化酶系统的影响[J]. 武汉植物学研究, 26(4): 402-406.
孙洪欣, 薛培英, 赵全利, 等. 2015. 镉、铅积累与转运在冬小麦品种间的差异[J]. 麦类作物学报, 35(8): 1161-1167.
孙小芳, 刘友良. 2001. 棉花品种耐盐性鉴定指标可靠性的检验[J]. 作物学报, 27(6): 794-801.
王聪, 朱月林, 杨立飞, 等. 2010. NaCl胁迫对菜用大豆种子抗坏血酸-谷胱甘肽循环的影响[J]. 植物营养与肥料学报, 16(5): 1209-1216.
王萍萍, 唐咏, 吴阔, 等. 2007. Cu2+胁迫对苘麻抗氧化酶系及根尖细胞超微结构的影响[J]. 沈阳农业大学学报, 38(3):362-365.
王松华, 张华, 何庆元. 2011. 铜胁迫对紫花苜蓿幼苗叶片抗氧化系统的影响[J]. 应用生态学报, 22(9): 2285-2290.
徐澜, 高志强, 安伟, 等. 2015. 冬麦春播小麦穗分化阶段对低温胁迫的响应及耐寒性[J]. 应用生态学报, 26(6): 1679-1686.
许红, 刘杨, 王威雁, 等. 2014. 冬小麦种子萌发期抗旱性的基因型差异[J]. 麦类作物学报, 34(10): 1426-1432.
杨梅, 郭军战. 2012. 不同果桑品种对低温胁迫的反应及抗寒性评价[J].北方园艺, (4): 29-32.
杨志娟, 陈银萍, 苏向楠, 等. 2015. 外源NO对铅胁迫下三叶鬼针草幼苗活性氧代谢的影响[J]. 广西植物, (5): 648-655.
张黛静, 马建辉, 杨淑芳, 等. 2014. 硅对铜胁迫下小麦幼根细胞超微结构的影响[J]. 应用生态学报, 25(8): 2385-2389.
张龙龙, 杨明明, 董剑, 等. 2016. 三个小麦新品种不同生育阶段抗旱性的综合评价[J]. 麦类作物学报, 36(4): 426-434.
张雪, 陶磊, 乔晟, 等. 2017. 谷胱甘肽转移酶在植物抵抗非生物胁迫方面的角色[J]. 中国生物工程杂志, 37(3): 92-98.
张志良, 瞿伟菁. 2003. 植物生理学实验指导 [M]. 第3版. 北京: 高等教育出版社.
张志伟, 王法宏, 李升东, 等. 2012. 不同类型小麦品种孕穗期低温生理反应及其抗寒性分析[J]. 麦类作物学报, 32(5): 900-906.
赵凤云, 王晓云, 赵彦修, 等. 2006. 转入盐地碱蓬谷胱甘肽转移酶和过氧化氢酶基因增强水稻幼苗对低温胁迫的抗性[J]. 植物生理与分子生物学学报, 32(2): 231-238.

