速灭威在几种枸杞土壤中的吸附及解吸行为研究
郝凤霞,谢青,夏维涛,李鹏,杨金会
省部共建煤炭高效利用与绿色化工国家重点实验室,宁夏 银川 750021
枸杞(Lycium barbarum)是一种名贵中药材,具有滋补肝肾、益精明目等功效(国家药典委员会,2010),《本草纲目》将其列为上等名贵药材(王海等,2015),枸杞是宁夏第一个“世界第一产业”,而农药在枸杞增产方面起了不可替代的作用(蒋雪松等,2005)。氨基甲酸酯类农药是继有机氯、有机磷类农药后发展较为迅速的一类高效、广谱杀虫剂,具有杀虫效果显著、分解快、代谢迅速、残留期短等特点,是全世界范围内使用最为广泛的农药之一(肖光普,1995;Wilsont et al.,2006;陈笑梅等,2007;朱松明等,2014;瞿德业等,2009;华小梅等,2000;Dyk et al.,2011)。其中,速灭威是常用于枸杞病虫害防治的一种氨基甲酸酯类农药,但是,若长期大量使用,在确保枸杞增产丰收的同时,大量残留在枸杞中的农药不仅会对生态环境造成污染,而且会对人体产生直接毒害(张昊等,2014)。
目前,有关氨基甲酸酯类农药的研究主要集中在其在蔬菜和水果(Lin et al.,2011;Chowdhury et al.,2013;Cesarino et al.,2012;Li et al.,2015;林丽静等,2013)、食品(Luo et al.,2017)及中药材(Yang et al.,2008;Wang et al.,2015;Peng et al.,2007;张燕等,2011)中含量的检测方面,而有关其在土壤中的研究主要有氨基甲酸酯类农药检测方法的建立,如王静等(2013)采用超高效液相色谱-串联质谱法在7 min内分析土壤及沉积物中20种氨基甲酸酯农药,检测限为0.20~0.60 ng∙g-1;聂春林等(2005)采用气相色谱法测定土壤中 15种农药的残留量;万益群等(2006)主要以丙酮-石油醚(4∶1,V/V)为提取剂,采用超声波提取土壤中农药残留,经弗罗里土层析柱净化,气相色谱-质谱法同时测定了土壤中 12种有机磷和氨基甲酸酯类农药。目前,有关氨基甲酸酯类农药在土壤中的吸附及解吸附的研究较少,如刘广良等(2000)研究了涕灭威在土壤中的吸附-脱附行为,发现涕灭威在土壤中会发生不可逆吸附现象,其在土壤中的最大不可逆吸附量为152.35 mg∙kg-1。施国兰等(2012)采用荧光猝灭滴定法研究土壤腐殖质与氨基甲酸酯类农药相互作用,结果表明,呋喃丹和西维因的荧光都能不同程度地被 FA(富里酸)和HA(腐殖酸)猝灭,主要猝灭机理为静电结合猝灭。
速灭威是一种在枸杞栽培中常用的氨基甲酸酯类农药(张奇等,2006),而有关其在土壤中的吸附、解吸附的研究未见报道。灌淤土、潮土和灰钙土是适宜种植枸杞的 3种土壤(李新虎,2007),因此,研究速灭威在枸杞土壤环境中的吸附及解吸附行为,对保障枸杞质量,保护环境有着重要的现实意义。
1 材料与方法
1.1 材料
速灭威标准品(由国家标准物质中心提供,纯度 99.9%)、甲醇(HPLC级)、氯化钙(购自天津市科密欧化学试剂有限公司)、实验室用水均为高纯水。灌淤土、潮土和灰钙土分别采自宁夏中宁县舟塔乡、宁夏银川市南梁农场和宁夏银川市西夏区,均为0~20 cm土层样品,3种土壤风干、磨细,过40目筛,备用,3种土壤理化性质见表1。
1.2 速灭威在土壤中的吸附动力学实验
准确称取不同土样各10.00 g于锥形瓶中,加入适量0.01 mol∙L-1CaCl2水溶液,使其pH稳定在8.0。准确吸取 1.0 mL速灭威标准溶液(1000µg∙mL-1)于上述锥形瓶中,盖塞防止溶液损失,置于真空恒温振荡器中,于(25±1) ℃和 150 r∙min-1条件下振荡,分别在0、10、20、30 min,1、2、4、8、10、12和24 h取样,然后在室温下离心(3500 r∙min-1)10 min,取适量上清液,待高效液相色谱(HPLC)测定,以上处理均重复两次。
1.3 速灭威在土壤中的等温吸附实验
准确称取不同土样各10.00 g于锥形瓶中,加入适量0.01 mol∙L-1CaCl2水溶液,使其pH稳定在8.0,依次准确移取速灭威标准溶液(1000 µg∙mL-1)0.50、0.75、1.00、1.25、1.50 mL,使最终体积保持 50 mL,分别置于真空恒温振荡器中,在(25±1) ℃和 150 r∙min-1条件下振荡 24 h 后取样,其余处理步骤同1.2。
1.4 速灭威在土壤中的吸附热力学实验
准确称取不同土样各10.00 g于锥形瓶中,加入适量0.01 mol∙L-1CaCl2水溶液,使其pH稳定在8.0,依次准确移取速灭威标准溶液(1000 µg∙mL-1)0.501、0.751、1.001、1.251、1.50 mL,使最终体积保持 50 mL,置于真空恒温振荡器中,分别设置(25±1)、(35±1)、(45±1) ℃和 150 r∙min-1条件下振荡24 h后取样,其余处理步骤同1.2。
1.5 土壤中速灭威的解吸动力学实验
准确称取不同土样各10.00 g放入锥形瓶中,加入48.5 mL 0.01 mol∙L-1CaCl2溶液,再加入1.50 mL速灭威标准溶液(1000 µg∙mL-1),使最终体积保持50 mL,置于真空振荡器中,于(25±1) ℃、150 r∙min-1条件下振荡 24 h 后,以 3500 r∙min-1离心 10 min,分离出上清液,向残留物中加入 0.01 mol∙L-1CaCl2溶液,使体系体积为 50.0 mL,再在(25±1) ℃、150 r∙min-1条件下振荡 0、10、30 min和 1、2、4、6、8、10、12、24 h,然后以3500 r∙min-1离心10 min,其余处理步骤同1.2。
1.6 土壤中速灭威的等温解吸特性实验
准确称取不同土样各10.00 g于锥形瓶中,加入适量0.01 mol∙L-1CaCl2水溶液,使其pH稳定在8.0,依次准确移取 1000 µg∙mL-1速灭威 0.50、0.75、1.00、1.25、1.50 mL,使最终体积保持 50mL。盖塞防止溶液损失,置于真空恒温振荡器中,在(25±1) ℃和 150 r∙min-1条件下振荡 24 h,以 3500 r∙min-1离心10 min后分离出上清液,向残留物中加入0.01 mol∙L-1CaCl2溶液,使体系体积为50.0 mL,再在(25±1) ℃、150 r∙min-1条件下振荡 24 h,然后以3500 r∙min-1离心10 min,其余处理步骤同1.2。
1.7 速灭威的测定
采用反相高效液相色谱测定速灭威含量,色谱条件:Agilent TC-C18(4.6 mm×250 mm×5 µm)为色谱柱,流动相为甲醇(A):水(B)梯度洗脱,0~20 min,从100% B到100% A,检测波长为258 nm,柱温为 25 ℃,进样量为 100 µL,保留时间16.84 min。
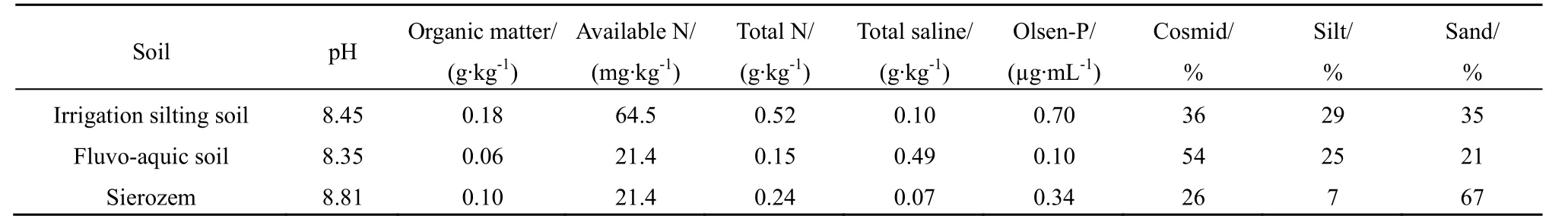
表1 供试土壤的部分理化性质Table 1 Selected physical and chemical properties of soils investigated
2 结果与讨论
2.1 速灭威在土壤中的吸附-解吸动力学
速灭威在 3种土壤中的吸附-解吸动力学曲线如图1所示。
由图1可知,在吸附开始的2 h内,供试土壤对速灭威的吸附量迅速上升,之后在2~10 h内吸附量出现上下波动,可能是由于土壤中的一部分吸附表面积被包裹在颗粒内部,而与土壤松散结合的速灭威分子又发生了解吸作用,而后土壤中的内部颗粒逐渐暴露,游离的速灭威分子又有机会吸附在新增的固相表面位点(杨丽华,2014),吸附量又逐渐增加,10 h时吸附量达到最大值。随着梯度浓度的下降,吸附过程趋于平衡。为了确保速灭威在供试土壤中吸附的平衡,本实验选择24 h作为吸附实验的平衡时间。由图2可知,随时间变化,速灭威的解吸量在2 h内逐渐增大,随着时间的推移,12 h后解吸量趋于平缓,与动力学吸附实验差别不大,但其最大解吸量为12 µg∙g-1左右,比吸附量小很多,说明整个实验中吸附试验较容易进行,可逆的程度不大。
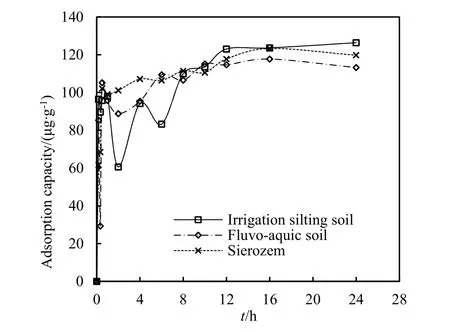
图1 速灭威在几种土壤中的吸附动力学曲线Fig. 1 The kinetic adsorption curve of MTMC on different soils
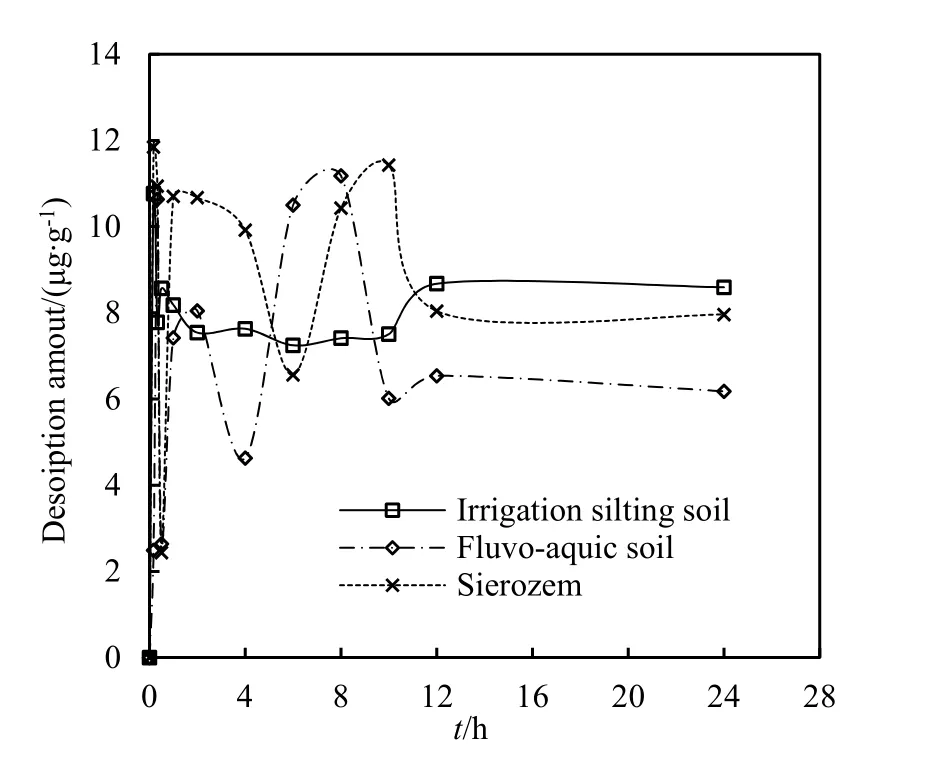
图2 速灭威在几种土壤中的解吸附动力学曲线Fig. 2 The kinetic desorption curve of MTMC on different soils
2.2 速灭威在土壤中的吸附-解吸等温吸附特性
本研究应用Linear、Freundlich、Langmuir吸附模型定量描述速灭威在土壤中的吸附与解吸附等温吸附特性:
Linear吸附模型公式为:

Freundlich吸附模型公式为:

lgQe与lgCe呈线性关系,直线的截距即为lgKd,斜率为1/n。
Langmuir吸附模型公式为:

式中,Qe为吸附平衡时土壤对速灭威吸附量,μg∙g-1;Ce为吸附平衡时的浓度,mg∙L-1;Kd为线性模型的吸附常数;Kf为Freundlich模型的吸附常数;1/n表示吸附的非线性程度;Qm为最大吸附量,μg∙g-1;KL为Langmuir模型中的与吸附自由能有关的常数。
不同的有机污染物在土壤中的解吸行为均存在明显的滞后现象,Huang等滞后系数表达式如下(刘维屏,2006):

式中,Qdes和 Qad分别指解吸和吸附过程在温度(T)和浓度(Ce)下,速灭威在土壤中的吸附量。
利用上述3种等温线模型对速灭威在3种土壤中的吸附数据进行拟合,结果见表 2、表 3,平均相关系数(r)大小排序为:Freundlich方程>Linear方程>Langmuir方程,表明Freundlich方程模拟吸附的效果最好,其次为线性方程,Langmuir方程模拟性较差。Freundlich方程对几种土壤的拟合效果表现为潮土>灌淤土>灰钙土,吸附能力为灰钙土(Kf=338.84)>灌淤土(Kf=234.42)>潮土(Kf=218.78),这可能与土壤的理化性质及异质性等有关。
由表 3可知,供试土壤中速灭威的解吸行为均表现为Linear模型的拟合性优于Freundlich模型,而且,速灭威的解吸等温线 lgKf值小于其相应的吸附等温线 lgKf值,这说明速灭威在几种土壤中不存在明显的解吸滞后现象。HIa<0,表示吸附-解吸滞后现象不显著,表明速灭威在几种土壤中迁移较快,可能会对地下水造成一定的污染。
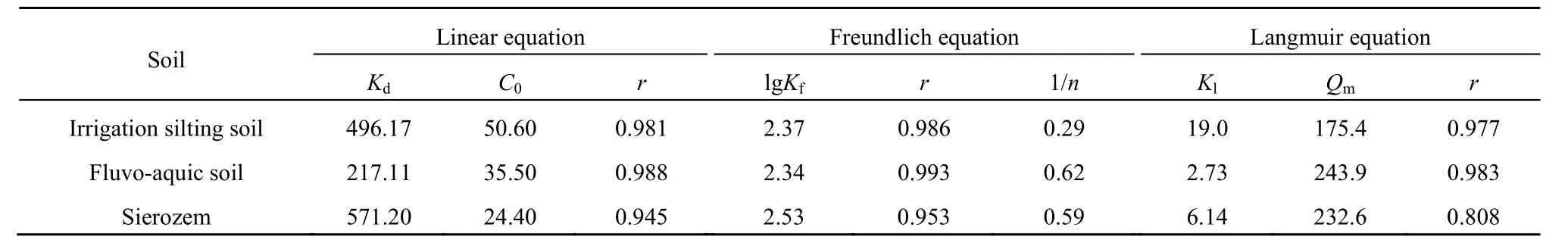
表2 速灭威在供试土壤中的吸附模型参数Table 2 Parameters of the fitted adsorption models of MTMC on different soils
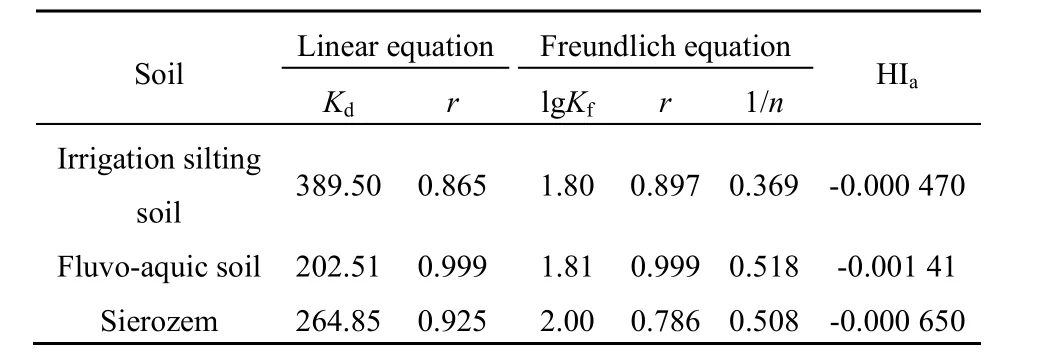
表3 速灭威在供试土壤中的解吸附模型参数和滞后系数Table 3 Parameters of the fitted desorption models and hysteresis indices of MTMC on different soils
2.3 速灭威在供试土壤中的吸附热力学
通过Gibbs方程计算热力学吸附过程吸附自由能(∆G)、吸附焓变(∆H)及吸附熵变(∆S),以及分析温度对供试土壤吸附速灭威的影响。

式中,K为吸附平衡常数,通过 lnQe/Ce对Qe作图,截距为K;Qe为吸附平衡时土壤中速灭威的质量浓度(mg∙L-1);Ce是速灭威在温度T时的平衡浓度(mg∙L-1);∆G 为吸附过程中的自由能变化值(KJ∙mol-1);∆H为吸附过程中的焓变化值(KJ∙mol-1);∆S 为吸附熵变化值(KJ∙mol-1∙K-1);R 为气体常数,为 8.314 J∙mol-1·K-1;T 为绝对温度(K)。
由表4可知,不同温度条件下∆G均为负值,且数值较小,表明速灭威在供试土壤中的吸附具有高度自发性,且随温度的升高,∆G绝对值增大,说明温度越高,吸附过程的自发趋势越大,且速灭威与供试土壤之间的吸附作用力越强。∆H为正值时,表示吸附反应是吸热过程,∆H为负值时,则表示吸附反应是放热过程。速灭威吸附于灌淤土与灰钙土中的∆H<0,而吸附于潮土中的∆H>0,这可能与速灭威在这两种土壤中吸附机理和土壤的结构及性质有关。在整个体系中,∆S均大于0,说明吸附过程中固液界面的无序度增加,亦反映供试土壤和速灭威之间相互作用产生了结构变化,使吸附熵增大。另外,由表4还可知,在本试验条件下,T∆S均大于∆H,说明速灭威在供试土壤中的吸附过程的自发性主要取决于熵增。
一般而言说,当∆H>0,∆S>0时,分子间作用力为典型的疏水作用力;当∆H<0,∆S<0时,为氢键和范德华力;当∆H≤0,∆S>0时,为静电作用力;当∆H<0,∆S>0时,为特异性静电作用(王春红,2010)。由表 4可知,速灭威在潮土中的吸附以疏水作用力为主,而在灌淤土与灰钙土中的吸附以特异性静电作用为主,这可能与土壤的理化性质及异质性等因素有关。
3 结论
速灭威在 3种土壤中的最大吸附量在 120µg∙g-1左右,但是解吸附量却在 12 µg∙g-1左右,比吸附量小很多,说明吸附可逆的程度不大;速灭威在灌淤土和灰钙土中吸附的∆H<0,∆S>0,作用力以静电作用力为主,而在潮土中吸附的∆H>0,∆S>0,主要以疏水作用力为主。速灭威在3种土壤中的等温吸附曲线能较好地符合 Freundlich模型,几种土壤吸附能力表现为:灰钙土(Kf=338.84)>灌淤土(Kf=234.42)>潮土(Kf=218.78);而等温解吸附能较好地符合Langmuir 模型,几种土壤对速灭威的解吸附能力表现为:灌淤土(Kd=389.50)>灰钙土(Kd=264.85)>潮土(Kd=202.51),且解吸平均滞后系数HIa<0,表明速灭威在几种土壤中的吸附-解吸滞后现象不显著,迁移较快,可能会污染地下水,对环境存在一定的危害。
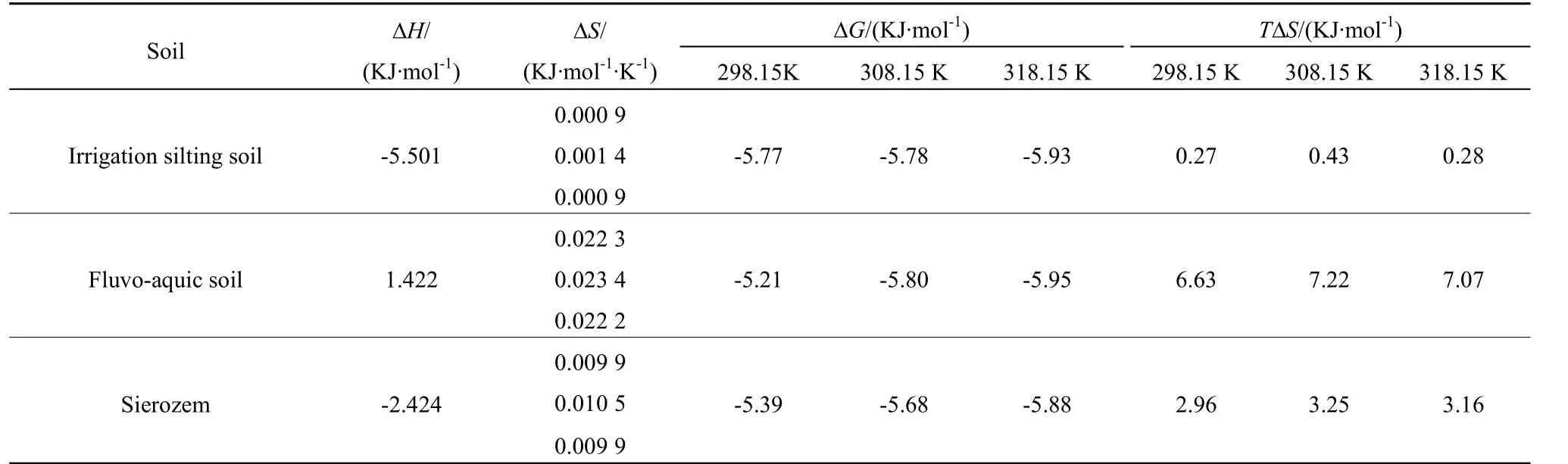
表4 速灭威在土壤中吸附的热力学参数Table 4 Thermodynamics parameter of adsorption of MTMC on different soils
另外,造成速灭威在几种土壤中的吸附及解吸附差异性的因素除土壤的理化性质外,土壤的种植历史、污染程度等因素也可能会影响其吸附及解吸附性能,这有待于进一步验证。
CHOWDHURY M A Z, FAKHRUDDIN A N M, ISLAM M N, et al. 2013.Detection of the residues of nineteen pesticides in fresh vegetable samples using gas chromatography-mass spectrometry [J]. Food Control, 34(2): 457-465.
CESARINO I, MORAES F C, LRV L, et al. 2012. Electrochemical detection of carbamate pesticides in fruit and vegetables with a biosensor based on acetylcholinesterase immobilized on a composite of polyaniline–carbon nanotubes [J]. Food Chemistry, 135(3):873-879.
DYK J S V, PLETSCHKE B. 2011. Review on the use of enzymes for the detection of organochlorine, organophosphate and carbamate pesticides in the environment [J]. Chemosphere, 82(3): 291-307.
WANG L L, KONG W J, YANG M H, et al. 2015. Safety issues and new rapid detection methods in traditional Chinese medicinal materials [J].Acta Pharmaceutica Sinica B, 5(1): 38-46.
LUO L, LEI H T, YANG J Y, et al. 2017. Development of an indirect ELISA for the determination of ethyl carbamate in Chinese rice wine[J]. Analytica Chimica Acta, 950: 162-169.
LIN X, CHEN X, HUO X, et al. 2011. Dispersive liquid-liquid microextraction coupled with high-performance liquid chromatography-diode array detection for the determination of N-methyl carbamate pesticides in vegetables [J]. Journal of Separation Science, 34(2): 202-209.
YANG M H, WANG L N. 2008. Advances in Techniques on Analysis and Removal of Pesticide Residues in Traditional Chinese Herbal Medicines [J]. World Science & Technology, 10(1): 107-112.
LI N, CHEN J, SHI Y P. 2015. Magnetic graphene solid-phase extraction for the determination of carbamate pesticides in tomatoes coupled with high performance liquid chromatography [J]. Talanta, 141: 212-219.
WILSONT P C, FOOS J F. 2006. Survey of carbamate and organophosphorous pesticide export from a south Florida (U. S. A.)agricultural watershed: implications of sampling frequency on ecological risk estimation [J]. Environmental Toxicology and Chemistry, 25(11): 2847-2852.
PENG X M, KNAPP B I, Bidlack J M, et al. 2007. High-affinity carbamate analogues of morphinan at opioid receptors [J]. Bioorganic &Medicinal Chemistry Letters, 17(6): 1508-1511.
陈笑梅, 胡贝贞, 刘海山, 等. 2007. 高效液相色谱-串联质谱法测定粮谷中 9种氨基甲酸酯类农药残留[J]. 分析化学, 35(1):106-110.
国家药典委员会. 2010. 中华人民共和国药典[ M ]. 二部. 北京: 中国医药科技出版社: 232-233.
华小梅, 江希流. 2000. 我国农药环境污染与危害的特点及控制对策[J].环境科学研究, 13(3): 40-43.
蒋雪松, 应义斌, 王剑平. 2005. 生物传感器在农药残留检测中的应用[J]. 农业工程学报, 21(4): 118-122.
李新虎. 2007. 土壤地球化学环境对宁夏枸杞品质的制约影响研究[D].北京: 中国地质大学:109.
林丽静, 程盛华, 李积华, 等. 2013. 茶树油清除豇豆农药残留的效果[J]. 农业工程学报, 29(3): 273-278.
刘广良, 戴树桂, 钱芸. 2000. 农药涕灭威在土壤中的不可逆吸附行为[J]. 环境科学学报, 20(5): 597-602.
刘维屏. 2006. 农药环境化学[M]. 北京: 化学工业出版社: 108-109.
聂春林, 梁贵平. 2005. 气相色谱法测定土壤中 15种农药的残留量[J].光谱实验室, 22(4): 843-846.
瞿德业, 魏善明, 周围, 等. 2009. 蔬菜中氨基甲酸酯类农药残留的固相微萃取分离和HPLC法检测[J]. 应用化学, 26(4): 498-500.
施国兰, 郑博福, 白英臣, 等. 2012. 荧光猝灭滴定法研究土壤腐殖质与氨基甲酸酯类农药相互作用[J]. 环境科学研究, 25(12):1404-1409.
万益群, 陈宗保. 2006. 土壤中多种有机磷及氨基甲酸酯类农药残留量的气相色谱-质谱法测定[J]. 分析科学学报, 22(5): 551-554.
王春红. 2010. 泰乐菌素在黑土胶体和矿物表面吸附解吸及热力学特性研究[D]. 武汉: 华中农业大学: 28.
王海, 高月, 王颉, 等. 2015. 适宜干燥方法提高干制枸杞品质[J]. 农业工程学报, 31(21): 271-276.
王静, 刘铮铮, 钟光剑. 2013. 超高效液相色谱-串联质谱法分析土壤及沉积物中氨基甲酸酯农药[J]. 中国环境监测, 29(4): 103-106.
肖光普. 1995. 氨基甲酸酯类农药与环境[J]. 世界农药, (3): 50-54.
杨丽华. 2014. 二氯喹啉酸在几种矿物和土壤中的吸附-解吸及机理研究[D]. 湖南: 湖南农业大学: 37.
张昊, 刘传志, 徐影, 等. 2014. 生物荧光传感器检测环境水样中氨基甲酸酯类农药残留[J]. 分析化学, 42(1): 104-108.
张奇, 李铁军, 朱晓霞, 等. 2006. 氨基甲酸酯类杀虫剂速灭威酶联免疫吸附分析方法研究[J]. 分析化学, 34(2): 178-182.
张燕, 杨钊, 金红宇, 等. 2011. UPLC-MS/MS测定中药材中19种氨基甲酸酯农药残留量[J]. 中国药学杂志, 46(3): 235-238.
朱松明, 周晨楠, 和劲松, 等. 2014. 基于酶抑制法的农药残留快速比色检测[J]. 农业工程学报, 30(6): 242-248.

