芒果苷减轻低氧致原代大鼠心肌细胞的凋亡
吴 庆,程阔菊,姚浩旗,黄 河,杨天德*
(1.陆军军医大学第二附属医院 麻醉科, 重庆 400037; 2.达州市中西医结合医院 药学部,四川 达州 635000)
缺血性心脏病是指心肌供血不足,导致心肌能量消耗与冠状动脉所供应能量不平衡而引起的心脏损害,表现为心肌细胞缺血和缺氧,进而凋亡和坏死,最终使心脏功能受损,严重者将发展成心功能不全和心力衰竭等症状,已成为全球病死率最高的疾病[1]。心肌细胞为终末分化细胞不可再生,因此如何在缺血性心脏病早期可逆性的抑制心肌细胞凋亡将会对缺血性心脏病起着非常重要的保护作用。芒果苷(mangiferin)来源于芒果的果实、皮和树叶,具有抗病毒、抗感染和抗氧化应激的作用,有研究显示芒果苷对糖尿病大鼠心肌细胞凋亡[2]和柔红霉素所致的心肌细胞凋亡[3]具有抑制作用,但对于更广泛存在的缺血性心脏病早期缺血缺氧诱导的心肌细胞凋亡的作用目前尚无相关研究。因此,本研究拟通过建立缺血低氧诱导的SD乳鼠心肌细胞凋亡模型,研究芒果苷对心肌细胞缺血低氧凋亡的影响,以期为缺血性心脏病的防治提供一些科学的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:新生SPF级SD大鼠(0~2 d)[陆军军医大学实验动物中心,动物合格证号:SCXK(渝)2007- 0003]。
1.1.2 主要试剂:一抗:Bax、Bcl- 2(Cell Singaling Technology公司);芒果苷(Sigma公司);Annexin V-APC/7-AAD细胞凋亡检测试剂盒(凯基公司);小牛血清、 DMEM/F12和胰蛋白酶(Gibco公司);caspase- 3和caspase- 9活性检测试剂盒(Biovision公司);余试剂为国产分析纯。
1.2 方法
1.2.1 新生SD大鼠原代心肌细胞的分离及培养:参照本实验室以往原代新生SD大鼠心肌细胞的分离和培养方法进行,详见参考文献[4]。
1.2.2 心肌细胞的分组及处理:将心肌细胞分为对照组、低氧组和芒果苷干预组; 低氧方法为低氧环境(94% N2-5% CO2-1% O2),低氧时间(2、4、8和12 h);芒果苷干预浓度为25、50、100和150 μmol/L。
待用心肌细胞培养24 h后,换成含不同浓度梯度(25、50、100和150 μmol/L)芒果苷的无血清DMEM培养液中孵育60 min后,置于低氧环境中继续孵育2、4、8和12 h,每组设立3个复孔,重复3次。
1.2.3 流式细胞仪检测心肌细胞凋亡:实验结束后,按照Annexin V-APC试剂盒说明书中对贴壁细胞的处理及检测方法对心肌细胞的凋亡进行流式细胞仪检测。
1.2.4 分光光度法检测心肌细胞凋亡蛋白酶caspase- 3和caspase- 9的活性:实验结束后,按照caspase- 3和caspase- 9活性检测试剂盒说明书中对贴壁细胞的处理及检测方法对心肌细胞中的凋亡蛋白酶caspase- 3和caspase- 9进行分光光度法检测。
1.2.5 Western blot检测促凋亡蛋白Bax和抗凋亡蛋白Bcl- 2的蛋白含量:弃去细胞培养液,经预冷PBS洗涤2次后,加入500 μL/孔的RIPA裂解缓冲液,置冰上裂解30 min后,用细胞刮刮下细胞,4 ℃、12 000 r/min离心15 min,收集上清,上清即为细胞的总蛋白溶解液,采用BCA protein assay kit定量蛋白浓度。加入SDS/PAGE煮沸5 min变性蛋白,将蛋白转移至NC膜上,后续加入Bax、Bcl- 2(rat)一抗及相应的二抗。采用Odyssey 扫描成像系统(LICOR,USA)对蛋白进行定量。
1.3 统计学分析

2 结果
2.1 芒果苷对低氧诱导的原代大鼠心肌细胞凋亡的影响
随着低氧处理时间的延长,心肌细胞凋亡率逐渐上升,从2 h开始起效,12 h时达最大值(图1,表1);芒果苷可显著降低低氧诱导的心肌细胞凋亡率,从50 μmol/L开始起效,150 μmol/L达最大值(图1,表1)。 因此,后续实验可采用低氧处理12 h建立低氧诱导的原代大鼠心肌细胞凋亡模型,采用150 μmol/L芒果苷进行干预处理。
2.2 芒果苷对低氧诱导的原代大鼠心肌细胞凋亡蛋白酶caspase- 3和caspase- 9活性的影响
心肌细胞经低氧处理12 h后,凋亡蛋白酶caspase- 3和caspase- 9的活性均显著上升(P<0.05),经150 μmol/L芒果苷处理后,凋亡蛋白酶caspase- 3和caspase- 9的活性较模型组均显著下降(P<0.05)(图2)。
2.3 芒果苷对低氧诱导的原代大鼠心肌细胞促凋亡蛋白Bax和抗凋亡蛋白Bcl- 2表达的影响
原代大鼠心肌细胞经低氧处理12 h后,Bax的蛋白表达量显著上升(P<0.05),Bcl- 2的蛋白表达量显著下降(P<0.05)(图3);经150 μmol/L芒果苷干预后,Bax的蛋白表达量较模型组显著下降(P<0.05),Bcl- 2的蛋白表达量较模型组显著上升(P<0.05)(图3)。
3 讨论
缺血性心脏病系由各种原因造成心脏自身供血量减少而引起的一系列心脏疾病[5]。心脏自身供血减少后将导致心肌细胞缺血缺氧进而引起一系列病理生理变化,比如能量代谢障碍、钙超载、氧化应激、线粒体结构和功能发生改变等,紧接着则会发生心肌细胞凋亡、坏死,从而导致心脏心率失常和收缩功能障碍,最终导致心脏功能受损。心肌细胞为终末分化细胞不可再生,因此若能在缺血性心脏病早期可逆性的抑制心肌细胞凋亡将会对缺血性心脏病起着非常重要的保护作用。

A.hypoxia 0 hour and mangiferin 0 μmol/L, apoptosis rate 9.23%; B.hypoxia 12 hours and mangiferin 0 μmol/L, apoptosis rate 52.19%; C.hypoxia 12 hours and mangiferin 150 μmol/L,apoptosis rate 20.34%

图1 芒果苷对低氧诱导的原代大鼠心肌细胞凋亡的影响Fig 1 Effects of mangiferin on the apoptosis of cardiomyocytes induced by hypoxia
#P<0.05 compared with control group;△P<0.05 compared with hypoxia group(12 hour).

*P<0.05 compared with control group; #P<0.05 compared with hypoxia group图2 芒果苷对低氧诱导的原代大鼠心肌细胞caspase- 3和caspase- 9活性的影响Fig 2 Effects of mangiferin on the activity of caspase- 3 and caspase- 9 in apoptotic cardiomyocytes induced by ischemia hypoxia(±s,n=9)
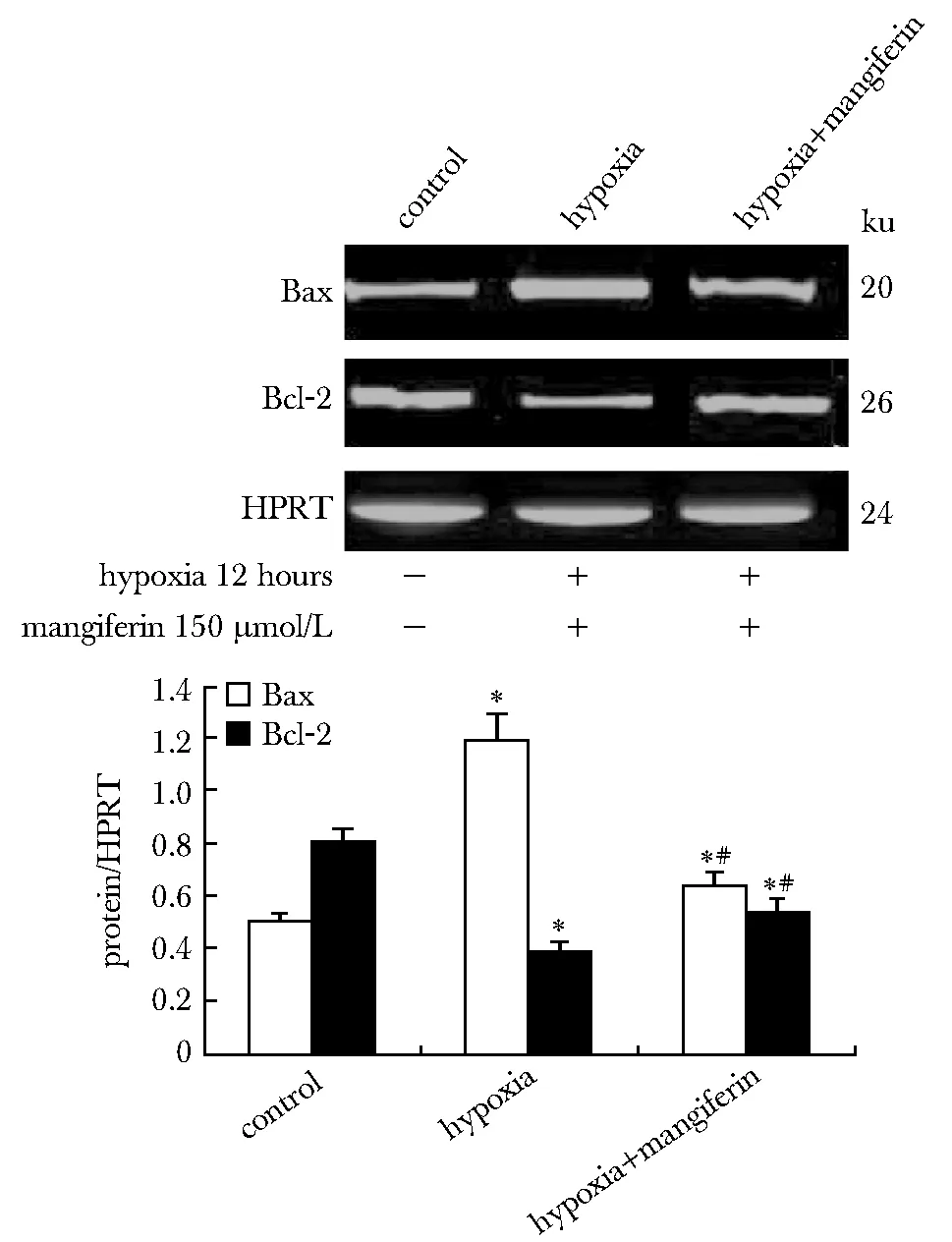
*P<0.05 compared with control group; #P<0.05 compared with hypoxia group图3 芒果苷对低氧诱导的原代大鼠心肌细胞Bax和Bcl- 2蛋白表达的影响Fig 3 Effects of mangiferin on the protein expression of Bax and Bcl- 2 in apoptotic cardiomyocytes induced by ischemia hypoxia(±s,n=9)
心肌细胞凋亡主要有3个途径:1)是死亡受体介导的凋亡途径,又称为外在途径,是由细胞表面的特定死亡受体接收到胞外的死亡信号进而激活启动细胞内的凋亡途径,从而诱导细胞凋亡,主要的死亡受体是肿瘤坏死因子受体(TNF-Rs)家族[6- 8]。2)是线粒体凋亡途径,又称为内在途径,主要机制是凋亡分子细胞色素C、Amac/Diablo蛋白、核酸内切酶和凋亡诱导因子从线粒体中释放,从而产生级联反应使细胞凋亡[9]。凋亡分子的释放受抗凋亡蛋白Bcl- 2的调控,另外促凋亡蛋白Bax可以诱导和促进线粒体凋亡分子的释放从而促进细胞凋亡。3)是内质网途径,主要由细胞内钙激活,同样受抗凋亡蛋白Bcl- 2的调控[10]。尽管3条通路的上游事件不同,但他们的下游通路均终需激活共同的凋亡效应物,即特异的胱冬酶(caspase)家族,其中caspase- 8、9、3是凋亡通路上的3个关键酶。Caspase- 8对来自于细胞外的凋亡诱导因子刺激做出应答,启动细胞解体。Caspase- 9对损伤和各种药物刺激做出应答,启动细胞色素C等凋亡分子从线粒体中释放。而caspase- 3则能放大caspase- 8和caspase- 9的信号,引起细胞全面性的自杀性解体。
芒果苷又名芒果素、知母宁,是一种主要从龙胆科和漆树科植物的叶、茎、树皮和果实中提取的氧杂蒽酮类化合物,也是中药知母的主要活性成分[11]。有研究显示芒果苷对糖尿病大鼠心肌细胞凋亡[2]和柔红霉素所致的心肌细胞凋亡[3]具有抑制作用。因此本研究设想芒果苷很可能对低氧诱导的心肌细胞凋亡亦有抑制作用,进而对缺血性心脏病有保护作用。为验证此设想,设计了芒果苷对低氧诱导的原代大鼠心肌细胞凋亡影响的研究。研究结果证实,芒果苷可显著降低低氧诱导的原代大鼠心肌细胞凋亡,其作用机制包含了下调凋亡蛋白酶的活性,抑制促凋亡蛋白的表达和上调抗凋亡蛋白的表达。至于芒果苷保护低氧诱导的原代大鼠心肌细胞凋亡是否还有其他保护通路,以及是否可以进一步保护在体缺血性心脏病,有待进一步研究。
[1] Yonezu K, Sakakura K, Watanabe Y,etal. Determinants of survival and favorable neurologic outcomes in ischemic heart disease treated by veno-arterial extracorporeal membrane oxygenation[J].Heart Vessels, 2018,33:25- 32.
[2] 陈英男.芒果苷对糖尿病大鼠心肌细胞凋亡的保护作用及其机制研究[D].辽宁:辽宁医学院,2015.
[3] 李铁瑜,彭志刚,马劼,等.芒果苷对柔红霉素所致大鼠心肌细胞凋亡的抑制作用[J].中药材,2012,35:274- 278.
[4] 程阔菊,景胜.秦皮素对苯肾上腺素诱导的大鼠心肌细胞肥大的影响[J].重庆医学, 2015,44:174- 179.
[5] Dias LD, Casali KR, Ghem C,etal. Mesenchymal stem cells from sternum: the type of heart disease, ischemic or valvular, does not influence the cell culture establishment and growth kinetics[J].J Transl Med, 2017,15:161- 170.
[6] Xiao J, Sun B, Li M,etal. A novel adipocytokine visfatin protects against H(2)O(2)-induced myocardial apoptosis: a missing link between obesity and cardiovascular disease[J].J Cell Physiol, 2013,228:495- 501.
[7] Huang TF, Wu XH, Wang X,etal. Fas-FasL expression and myocardial cell apoptosis in patients with viral myocarditis[J].Genet Mol Res, 2016,15:1- 8.
[8] Yang J, Guo X, Yang J,etal.RP105 protects against apoptosis in ischemia/reperfusion-induced myocardial damage in rats by suppressing TLR4-mediated signaling pathways[J]. Cell Physiol Biochem,2015,36:2137- 2148.
[9] Sreedhar R, Arumugam S, Thandavarayan RA,etal.Myocardial 14- 3- 3η protein protects against mitochondria mediated apoptosis[J]. Cell Signal, 2015, 27:770- 776.
[10] Zhang W, Sun Z, Meng F,etal.Schisandrin B amelior-ates myocardial ischemia/reperfusion injury through attenuation of endoplasmic reticulum stress-induced apoptosis[J].Inflammation,2017, 40:1903- 1911.
[11] Liu Y, Xu F, Zeng X,etal.Application of a liquid chromatography/tandem mass spectrometry method to pharmacokinetic study of mangiferin in rats[J].J Chromatogr B Analyt Technol Biomed Life Sci, 2010,878:3345- 3350.

