高脂饮食诱导小鼠血糖增高损伤睾丸微血管功能
张晓艳,李炳蔚,刘明明,尚 飞,刘淑英,盛有明,李宏伟,修瑞娟
(中国医学科学院 北京协和医学院 微循环研究所 卫生部微循环重点实验室,北京 100005)
近年来,高脂饮食对雄性生殖功能损害不断受到关注[1- 3]。高脂饮食可诱导大鼠发生早期糖尿病症状,表现为空腹血糖水平增高、伴或不伴有糖耐量异常[4- 6],而高血糖能损伤小鼠睾丸微血管内皮细胞,间接诱导睾丸生精功能障碍[7]。目前针对高脂饮食诱导的小鼠睾丸微循环障碍、微血管损伤对生精细胞的影响报道较少。因此,本研究利用高脂饮食饲养C57BL/6雄性小鼠20周,观察小鼠睾丸微循环和微血管形态、功能改变及生精细胞的病理组织学变化,探索高脂饮食诱导雄性生殖功能损害机制。
1 材料与方法
1.1 材料
1.1.1 试剂:羊抗兔血小板内皮细胞黏附分子- 1抗体(CD31)及增殖细胞核抗原(PCNA)(Abcam公司);TUNEL检测试剂盒(Roche公司);伊文思蓝染色剂(Evans Blue)(Sigma公司);免疫组化抗原修复液(北京康为世纪公司);高脂饲料(D12492)及普通维持饲料(中国医学科学院动物研究所)。
1.1.2 实验动物:40只SPF级7 ~ 8周雄性C57BL/6小鼠,体质量(23±2)g(中国医学科学院动物研究所[SCXK(京)2009- 0007])。饲养在室温21 ℃~23 ℃、湿度45%~55%、12 h明暗交替,自由进食水。
1.2 方法
1.2.1 小鼠分组及处理:将小鼠分为对照(control)和高脂饲料喂养20周的高脂组(high fat diet, HFD),每周测体质量及空腹血糖。
本研究方案经中国医学科学院微循环研究所伦理委员会审核批准。
1.2.2 睾丸通透性的检测:禁食水4 h,腹腔注射2%伊文思蓝。3 h后1.5%戊巴比妥钠麻醉小鼠,灌流心脏,取睾丸固定包埋,液氮速冻,-80 ℃保存。20 μm冰冻切片,荧光显微镜下观察生精小管内伊文思蓝染色。
1.2.3 睾丸微循环血流灌注水平和自律运动的检测:Moor VMS-LDF激光多普勒血流灌注监测系统检测小鼠睾丸微循环血流量及睾丸微血管自律运动。Moor VMS PC2.1软件提取各时相睾丸血流灌注水平(perfusion unit,PU),计算平均灌注量(PU/min)。以单位时间内多普勒血流图波峰及波谷频数计算睾丸微血管自律运动频率(cycle per minute, CPM, 周期/分钟),以单位时间内多普勒血流图波峰与波谷血流灌注单位差值计算睾丸微血管自律运动振幅(△PU)。
1.2.4 HE染色观察睾丸病理组织学变化:常规制片观察睾丸组织。
1.2.5 免疫组织化学染色检测CD31及PCNA表达:切片脱蜡水化,按免疫组化常规处理切片,1∶50加入CD31,1∶4 000加入PCNA抗体,4 ℃过夜;常规二抗室温下孵育20 min,DAB染色,苏木精复染,脱水透明,中性树胶封片。睾丸微血管内皮细胞、生精细胞棕黄色染色为CD31、PCNA表达阳性,应用Image-Pro Plus 6.0软件对阳性表达区域进行积分吸光度值(integrated absorbance,IA)定量分析。
1.2.6 TUNEL染色法检测:切片脱蜡至水,按TUNEL染色试剂盒说明书操作,凋亡生精细胞为深棕色染色。
1.3 统计学分析

2 结果
2.1 空腹血糖及体质量结果比较
HFD组小鼠高脂饮食20周后,体质量为(45±3)g,显著高于对照组的(32±4)g (P<0.01);空腹血糖为(9.96±1.57)mmol/L,显著高于对照组的(5.32±1.16) mmol/L (P<0.01)。
2.2 睾丸通透性实验结果
对照组仅在睾丸间质和生精小管基底膜处有红色荧光标记,生精小管内无可见荧光染色;而HFD组生精小管内有荧光物质表达(图1)。

EB.evans blue图1 两组小鼠睾丸Evanse blue染色结果Fig 1 Evans blue staining of the mice testis in two groups(×400)
2.3 睾丸微血管血流灌注水平及睾丸微血管自律运动
对照组小鼠睾丸表面微血管血流灌注持续稳定,HFD组睾丸血流灌注量降低(P<0.01),睾丸微血管自律运动频率(P<0.05)及振幅(P<0.01)均降低(图2)。
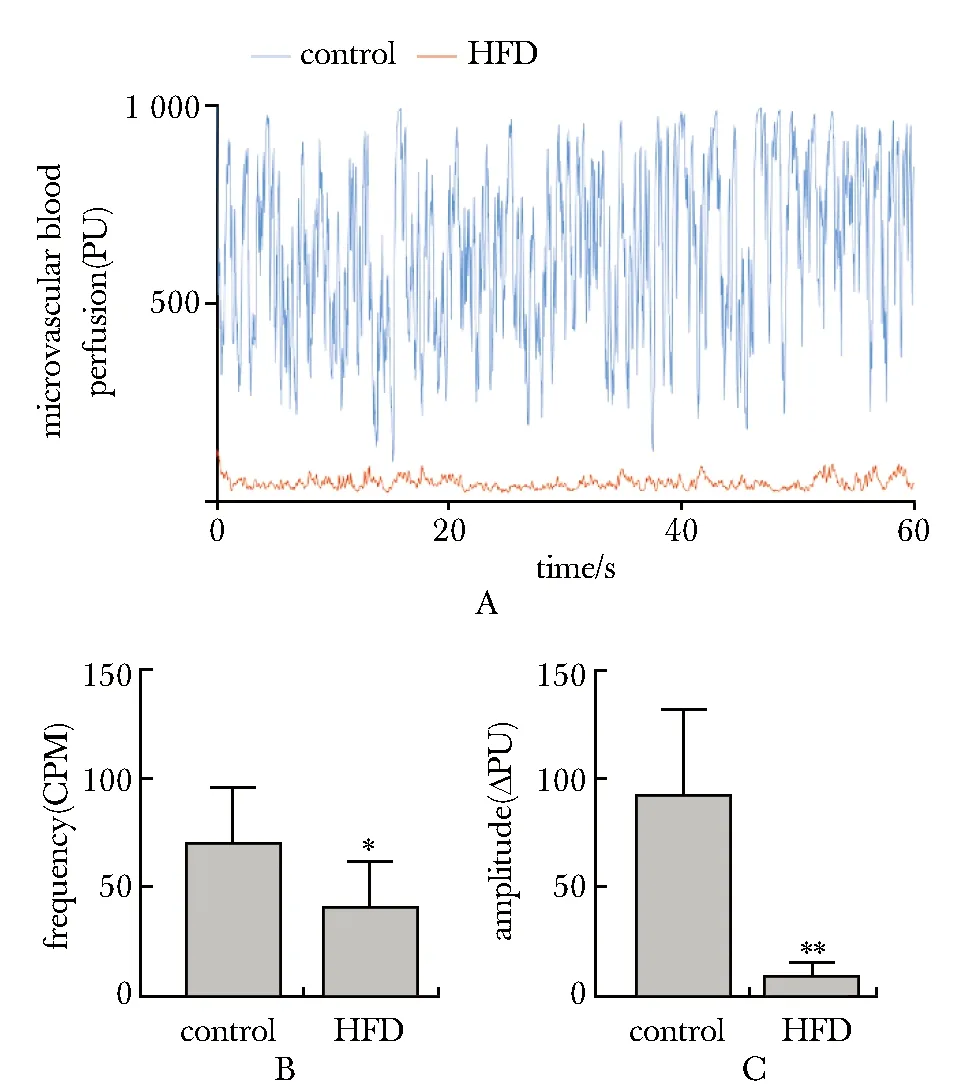
A.testicular blood perfusion in two groups;B.frequency of vasomotion;C.amplification of vasomotion; *P<0.05, **P<0.01 compared with control图2 两组小鼠睾丸微血管血流灌注水平、自律运动频率及振幅的变化Fig 2 Comparison of testicular blood perfusion, frequency and amplification of vasomotion
2.4 睾丸组织形态学观察
HFD组小鼠睾丸生精上皮破坏严重,生精小管萎缩,Sertoli细胞和各级生精细胞之间的黏附松散,生精上皮有空泡样改变(图3)。

图3 两组小鼠睾丸组织形态学观察(HE)Fig 3 Histomorphology in testis between two groups
2.5 睾丸组织CD31及PCNA免疫组化表达量
HFD组小鼠睾丸微血管内皮细胞CD31表达断续或无表达,IA值为(1.22±0.10)×107,表达量显著低于对照组的(3.23±0.13)×107(P<0.01);HFD组生精细胞PCNA表达减少,IA值为(0.74±0.04)×108,显著低于对照组的(2.18±0.17)×108(P<0.01)(图4)。
2.6 睾丸组织生精细胞TUNEL表达水平
HFD组可见各级生精细胞凋亡,IA值为(1.77±0.15)×107,显著高于对照组的(0.87±0.04)×107(P<0.01)(图5)。

图5 两组小鼠睾丸生精细胞TUNEL表达水平Fig 5 TUNEL expression level of germ cells in testis between two groups(×400, ±s, n=5)
3 讨论
睾丸微循环承担着睾丸内雄激素、氧和营养物质等的运输及代谢产物的交换释放[8],微血管内皮细胞是睾丸微循环的结构基础,完整的微血管内皮细胞对维持睾丸微循环的功能至关重要。睾丸内血流的变化与精子发生紧密相关[9], 睾丸微循环障碍可降低睾丸微血管灌注水平,致睾丸组织缺氧,严重者可使睾丸局部组织梗死并最终造成雄性不育[10]。本研究发现,HFD组小鼠睾丸微血管内皮细胞CD31表达缺失,睾丸微血管血流灌注量以及微血管自律运动频率、振幅均降低,提示HFD组小鼠睾丸微血管受损。
血睾屏障是睾丸毛细血管和生精小管之间的一种功能性结构,睾丸微血管是血睾屏障的重要组成部分。血睾屏障可保护生精细胞免受血源性毒素以及生精上皮自体免疫反应的侵害,使正常精子发生过程得以顺利进行[11- 13]。有研究报道,高脂饮食能破坏家兔血睾屏障并使家兔不育[14];本研究HFD组小鼠空腹血糖水平显著增高,提示长期高脂饮食可致C57BL/6雄性小鼠发生糖尿病前驱症状。由于糖毒性可致睾丸微血管内皮细胞受损,推测高脂饮食诱导小鼠血糖增高导致睾丸微血管内皮细胞损伤使睾丸微血管通透性增加,破坏血睾屏障完整性。伊文思蓝染色结果显示,HFD组小鼠睾丸生精小管内出现荧光染料,表明血睾屏障完整性受损。同时,组织学实验结果显示,HFD组小鼠睾丸生精上皮出现空泡样损伤,各级生精细胞均见凋亡,且生精细胞增殖不良。提示高脂饮食诱导小鼠血糖增高使睾丸微血管内皮细胞受损、破坏血睾屏障完整性,导致生精细胞凋亡及增殖水平异常,使生精上皮受损,并影响精子发生。
综上所述,高脂饮食诱导C57BL/6小鼠血糖增高,糖毒性继发损伤睾丸微血管内皮细胞,使微血管灌注功能障碍[15];受损的睾丸微血管通透性增加,破坏血睾屏障完整性,使小鼠精子发生的内环境紊乱,生精上皮受损且生精细胞增殖凋亡异常,最终可致雄性不育。通过纠正由高脂饮食诱导的高血糖,改善睾丸微血管损伤程度,可能成为临床针对高脂饮食诱导男性不育症的治疗靶点之一。
[1] Erdemir F, Atilgan D, Markoc F,etal. The effect of diet induced obesity on testicular tissue and serum oxidative stress parameters [J]. Actas Urol Esp, 2012, 36: 153- 159.
[2] Jensen TK, Heitmann BL, Blomberg JM,etal. High dietary intake of saturated fat is associated with reduced semen quality among 701 young Danish men from the general population [J]. Am J Clin Nutr, 2013, 97: 411- 418.
[3] Dupont C, Faure C, Sermondade N,etal. Obesity leads to higher risk of sperm DNA damage in infertile patients [J]. Asian J Androl, 2013, 15: 622- 625.
[4] Rato L, Alves MG, Dias TR,etal. High-energy diets may induce a pre-diabetic state altering testicular glycolytic metabolic profile and male reproductive parameters [J]. Andrology, 2013, 1: 495- 504.
[5] Utzschneider KM, Prigeon RL, Faulenbach MV,etal. Oral disposition index predicts the development of future diabetes above and beyond fasting and 2- h glucose levels [J]. Diabetes Care, 2009, 32: 335- 341.
[6] American Diabetes Association. Diagnosis and classification of diabetes mellitus [J]. Diabetes Care, 2012, 35(Suppl 1): S64- 71.
[7] 张晓艳, 刘明明, 李炳蔚, 等. 观察链脲佐菌素诱导的balb/c糖尿病小鼠睾丸微循环损害 [J]. 微循环学杂志, 2015, 3: 1- 4.
[8] Hjertkvist M, Bergh A, Damber JE. HCG treatment increases intratesticular pressure in the abdominal testis of unilaterally cryptorchid rats [J]. J Androl, 1988, 9: 116- 120.
[9] Biagiotti G, Cavallini G, Modenini F,etal. Spermatogenesis and spectral echo-colour Doppler traces from the main testicular artery [J]. BJU Int, 2002, 90: 903- 908.
[10] Gandhi J, Dagur G, Sheynkin YR,etal. Testicular compartment syndrome: an overview of pathophysiology, etiology, evaluation, and management [J]. Transl Androl Urol, 2016, 5: 927- 934.
[11] Levy S, Serre V, Hermo L,etal. The effects of aging on the seminiferous epithelium and the blood-testis barrier of the Brown Norway rat [J]. J Androl, 1999, 20: 356- 365.
[12] Fan Y, Liu Y, Xue K,etal. Diet-induced obesity in male C57BL/6 mice decreases fertility as a consequence of disrupted blood-testis barrier [J]. PLoS One, 2015, 10: e0120775. doi: 10.1371/journal.pone.0120775.
[13] Fernandez CD, Bellentani FF, Fernandes GS,etal. Diet-induced obesity in rats leads to a decrease in sperm motility [J]. Reprod Biol Endocrinol, 2011, 9: 32- 42.
[14] Morgan DH, Ghribi O, Hui L,etal. Cholesterol-enriched diet disrupts the blood-testis barrier in rabbits [J]. Am J Physiol Endocrinol Metab, 2014, 307: E1125- 1130.
[15] Foster RR, Armstrong L, Baker S,etal. Glycosaminoglycan regulation by VEGFA and VEGFC of the glomerular microvascular endothelial cell glycocalyx in vitro [J]. Am J Pathol, 2013, 183: 604- 616.

