HOX转录反义RNA表达对胸腔镜食管癌切除术后风险的预测价值研究
靳超,郎保平,张晓
(郑州大学附属洛阳市中心医院 胸外科,河南 洛阳 471002)
食管癌是临床上较为常见的恶性肿瘤之一,其死亡率在全球范围内位居第4位,流行病学调查显示,我国每年有近15万人死于食管癌。早中期食管癌最佳的治疗手段仍然是手术切除肿瘤组织。研究发现[1],食管癌切除术后患者5年生存率为27%~42%。多种因素影响患者预后生存状况,其中临床分期、分化程度、肿瘤大小以及淋巴结转移等已被认为与患者预后不佳、甚至死亡有关。HOX转录反义RNA(HOX transcript antisense RNA,HOTAIR)是目前第一被发现反式作用的lncRNA,且该RNA参与肝癌、乳腺癌、结直肠癌的发生、发展过程,可作为肿瘤早期诊断以及预后判断的一个新的分子标志物[2-3],但是该基因对食管癌切除术后复发、患者预后生存情况的预测作用在国内报道较少。本研究旨在探讨HOTAIR表达与胸腔镜食管癌切除术后复发、预后生存之间的关系,从而为临床选择合适的治疗手段提供依据,也为临床研发新的靶向药物提供依据。
1 资料与方法
1.1 临床资料
选取2011年4月-2014年4月在本院接受手术治疗的食管癌患者92例作为研究对象。其中,男性69例,女性23例;年龄42~71岁,平均(61.29±7.89)岁。纳入标准:①术前经纤维内镜行组织病理学检查确诊为食管癌;②术前经颈部彩超、胸部CT扫描等检查确诊临床分期在T3N1M0以内;③食管钡餐造影显示食管肿瘤直径在5 cm以内并无软组织阴影,若<5 cm则以食管腔内生长为主,如腔内型、蕈伞型;④未出现颈部淋巴肿大以及远处脏器转移,无肿大融合的纵隔淋巴结;⑤心肺功能良好。排除标准:①既往有胸腹手术史、放化疗史;②有严重心肺功能不全、不能耐受长时间麻醉者,或者近4周内出现心绞痛;③癫痫发作、近期出现心肌梗死或者休克、严重甲状腺功能亢进或者胸腔感染所致的胸膜肥厚等;④高血压患者。
1.2 方法
1.2.1 临床资料的收集收集患者主要临床资料有:年龄、性别、肿瘤位置、临床分期、是否出现淋巴结转移及术后是否进行辅助放化疗等。
1.2.2 胸腔镜食管癌切除术术前行常规手术准备,采用静脉复合麻醉,经双腔气管插管,从而保证右胸手术能够正常操作。患者先取平卧位,于上腹正中切长约12 cm切口,以便游离胃大、小弯以及腹段部分食管,将胃大弯侧网膜右侧血管弓保留,清扫胃左动脉旁以及贲门旁脂肪淋巴组织,离断贲门部位食管-胃组织,将胃-贲门断端缝合,将胃底缝合牵引线连接至远端食管,扩张食管裂孔,以便胃牵入胸腔或者与颈部吻合,待上述步骤完成后,将患者置于左侧卧位、前倾15°,胸壁前消毒,重新铺巾,左肺通气。于腋后线第6肋间切1.5 cm切口并置入胸腔镜,在腋后线第8肋间切1.5 cm切口、腋中线第5肋间切1.5 cm切口作为主操作孔、在锁骨中线第4肋间做1 cm切口作为肺牵拉孔,在腋前线第3肋间作1 cm切口作为食管牵拉孔或吸引孔。将食管纵隔胸膜切口后,采用7号线结扎同时配合钛夹钳闭并缝合血管,离断奇静脉。牵引食管,采用电分离钩或者超声刀将全胸段食管及食管滋养血管游离,清扫气管旁、上腔静脉旁、右支气管隆凸下、下肺静脉旁淋巴结。所有受试对象均未处理胸导管,其中52例患者行右胸顶吻合、40例行右颈部吻合。术后需要给予抗炎、补液、化痰以及常规镇痛。术后第2天经空肠管实施肠内营养,协助患者咳嗽排痰。1周后行上消化道造影,观察是否出现吻合口瘘情况发生。
1.2.3 逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测组织中HOTAIR表达术后取受试对象癌组织及癌旁组织各50 mg,术后患者给予放化疗,于化疗后1年内到医院复诊,采用纤维内镜取组织进行检查,了解患者是否出现复发,将所得组织分为术后辅助放化疗组和术后未放化疗组。经液氮吹吹打呈成粉末状,加入Trizol试剂提取组织中的RNA,将提取的RNA样品经分光光度计测定总RNA的浓度,而后行逆转录,严格按照Prime-ScriptTM逆转录试剂盒(日本TaKaRa公司)执行各项操作,反应条件为:30℃ 10 min,56℃40 min,置于-80℃冰箱冷冻保存备用。PCR扩增则按照SYBR Green说明书配置反应体系:25 μl,其中含有2.5 μl的10×缓冲液、1.5 μl氯化镁(浓度为25 mmol/L)、2 μl的 dNTP(浓度为 2.5 mmol/L)、PCR引物各1.25 μl、DNA 模板 2 μl,0.5 μl Tag DNA 合成酶,剩余加上双蒸水至25 μl。PCR扩增条件:95℃预变性 3 min,94℃变性 30 s,56℃退火 40 s,73℃延伸 30 s,共39个循环,最后73℃延伸5 min。每个样品重复3个管。目的基因相对表达量采用2-△△Ct表示。
1.2.4 随访所有受试对象均采用电话询问、门诊随诊等方式进行随访,随访截止时间为2017年5月1日,中位随访时间为48个月,随访主要询问患者并发症、生活状况、术后3年内复发以及5年内的生存情况等。
1.3 统计学方法
数据分析采用SPSS 17.0和Excel 2010统计软件,计量资料以均数±标准差(±s)表示,t检验或方差分析,计数资料以率(%)表示,采用χ2检验,采用ROC曲线分析HOTAIR表达对术后复发和生存的预测价值,用Kaplan-Meier法制作生存曲线,采用Long-rank χ2检验,影响因素的分析采用Cox比例风险模型,P<0.05为差异有统计学意义。
2 结果
2.1 HOTAIR表达
RT-PCR结果显示,癌组织HOTAIR相对表达量为(0.673±0.076),而癌旁组织为(0.387±0.058),两组比较差异有统计学意义(t=14.923,P=0.000),见图1。不同临床分期、分化程度、肿瘤大小及淋巴结转移患者的HOTAIR表达有差异,见表1。术后1年内,92例患者中有68例患者愿意到医院复诊,提取病理组织复检,其中39例为术后辅助放化疗,29例为术后未放化疗,其中术后放化疗组HOTAIR相对表达量为(0.471±0.092),而未放疗组为(0.746±0.103),两组间差异有统计学意义(t=17.709,P=0.000)。
2.2 HOTAIR表达水平与食管癌切除术后复发的关系

图1 食管癌患者术后癌组织及癌旁组织中HOTAIR表达
研究结果显示,术后3年内,HOTAIR相对表达量≤0.5组(41例)复发率29.27%低于HOTAIR相对表达量 >0.5组(51例)的 56.86%(χ2=7.005,P=0.008),而平均复发时间≤0.5组为(29.32±4.57)个月,高于HOTAIR相对表达量>0.5组的(21.22±6.09)(t=7.094,P=0.003)。
2.3 HOTAIR表达对术后复发和生存的预测价值
ROC曲线结果显示,HOTAIR表达对术后复发的预测价值:敏感性为0.797,特异性为0.816,曲线下面积(area under the curve,AUC)为 0.727(95%CI:0.684,0.884),见图2A;HOTAIR表达对术后生存的预测价值:敏感性为0.813,特异性为0.838,AUC为0.769(95%CI:0.692,0.901)。见图 2B。
表1 HOTAIR表达与临床因素的关系 (±s)

表1 HOTAIR表达与临床因素的关系 (±s)
?
2.4 食管癌切除术患者临床资料与生存率关系的单因素分析
研究结果显示,食管癌切除术后患者3及5年的生存率分别为57.61%和42.39%。经单因素分析显示,肿瘤分化程度、肿瘤大小、淋巴结转移、临床分期、术后辅助放化疗以及HOTAIR表达量升高均为术后患者3及5年生存率的影响因素。见表2和图3。

图2 HOTAIR表达对食管癌术后的预测价值
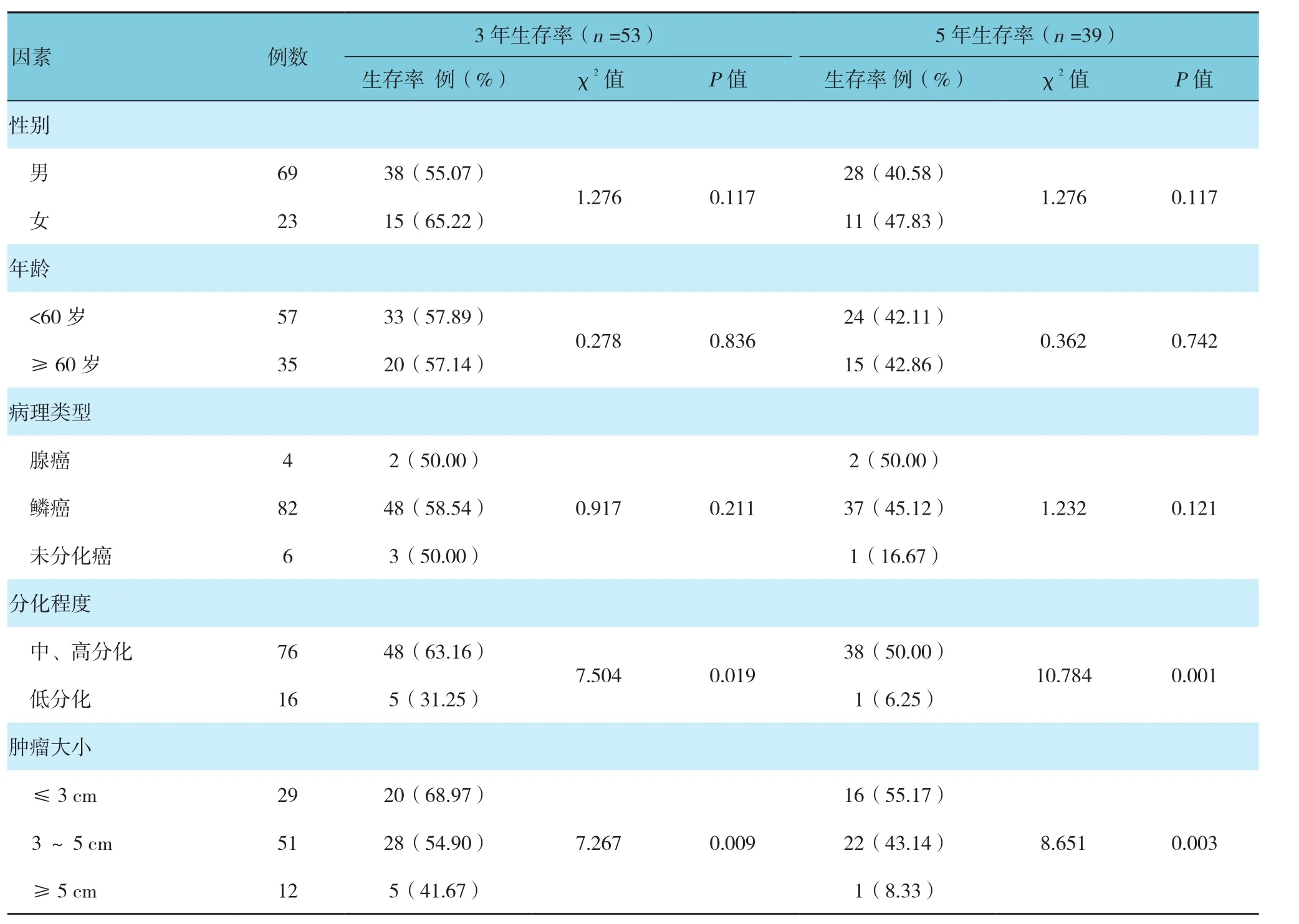
表2 食管癌切除术患者临床资料与生存率关系的单因素分析

续表2
2.5 食管癌切除术预后多因素分析
以预后5年生存情况为因变量(0为生存,1为死亡),经单因素分析中有统计学意义的因素作为自变量,做一般多因素Cox生存分析,结果显示分化程度、临床分期、肿瘤大小、淋巴结转移及HOTAIR相对表达量为预后的危险因素,而术后辅助放化疗为预后的保护因素,见表3和图3。

表3 食管癌切除术预后多因素Cox生存分析相关参数

图3 不同临床因素对食管癌术后生存率的影响
3 讨论
胸腔镜食管癌切除术相对于传统食管癌切除术避免对背阔肌、前锯肌以及肋间肌等肌群的伤害,能够完整的保持胸廓,减少手术所造成的创伤以及完整保留患者的呼吸功能。国内外有研究显示[4-5],采用胸腔镜辅助切除术与传统手术比较,近期疗效更为显著,而远期疗效两种手术基本相当。病灶组织切除范围以及淋巴结清扫状况是影响食管癌患者预后的重要因素。胸腔镜辅助手术扩大手术的视野,术者以及助手能够跟清晰的分辨食管周围的组织结构,充分暴露中各内淋巴结、尤其是双侧喉返神经的暴露较常规手术更为清晰,研究甚至指出,胸腔镜手术在清扫淋巴结方面完全达到开放手术的效果,而在局部淋巴结清扫方面效果甚至优于开放手术。此外,有研究指出[6],胸腹腔镜食管癌切除手术在减小创伤、并发症、肿瘤切除及淋巴结清扫等方面与传统手术方法基本相当;有研究显示,胸腔镜手术患者总胸引流量以及胃液引流量低于传统手术,且无明显的肺部并发症,随着胸腔镜手术的优势越来越明显,国内开展该手术治疗早中期食管癌的临床报道越来越多。
影响癌症术后预后因素主要涵盖以下几方面:一般临床资料(如性别、年龄及生活习惯等)、临床病理因素及术者操作因素。临床研究发现[7],食管癌患者多数为男性,且预后女性多优于男性,但进一步研究却发现预后男女性别之间并无差异,该结论说明雌激素对食管癌的生长有抑制作用,该机制有待进一步考证,通过本研究发现入选的92例患者中69例为男性,但进一步研究显示,两者在5年内生存率并无差异,提示性别对预后并无影响。目前对于年龄是否影响食管癌预后尚不能确定,有研究指出[8],年龄在60岁以上人群,因机体新陈代谢下降、免疫功能降低、术后机体恢复能力弱,其预后差,但也有研究发现年龄越大患者预后更好,其认为年轻患者癌细胞活性更强、恶性细胞增殖更快,预后差,当然也有一部分研究指出年龄对食管癌术后预后并无影响,本研究未发现年龄对胸腔镜食管癌切除术预后有影响,笔者认为目前对于年龄是否影响食管癌手术预后,其存在的争议主要可能缘于以下几点:①入选时不同年龄段患者身体状况、免疫功能等存在一定差异,其有可能对预后造成一定的影响;②不同年龄段患者在入选时临床分期、肿瘤侵及深度等也可能干扰年龄这一因素的影响作用。临床研究单因素分析结果显示,肿瘤位置与患者预后有关,但多因素显示肿瘤位置与预后无关,通过本研究单因素结果显示,食管癌位置与预后无关,其原因可能在于:①病灶位于食管上段患者的例数较少,统计时易出现偏差;②术者的准确操作有关。食管癌患者细胞的分化程度反映肿瘤细胞的恶性病变程度,分化程度越低,则恶性程度越高,肿瘤分化程度与食管癌预后的相关性已经得到多数学者的普遍认可[9]。淋巴结转移已经被多数认为与食管癌预后存在相关性。临床分期是食管癌预后的重要影响因素,目前,根据肿瘤浸润深度、淋巴结转移情况以及远处脏器转移等组合的TNM分期是选择合适的治疗方案、评价治疗效果以及评估患者预后的重要依据[10],临床分期对食管癌患者预后具有重要影响,一项研究显示临床病理分期每增加一期,死亡的危险增加多倍[11]。通过本研究发现,无论单因素分析还是多因素回归分析,均显示肿瘤分化程度、淋巴结转移以及临床分期均为患者预后的危险因素,这与部分的临床研究报道基本一致。
HOTAIR是lncRNAs家族中重要的一员,其主要位于人类第12号染色体HOXC12基因与HOXC11基因之间,其已经被认为与多种肿瘤的发生、发展有重要关系。研究发现,HOTAIR在乳腺癌、肝癌、胰腺癌、结直肠癌患者病灶组织中表达量高于癌旁组织、正常组织;另有体外研究发现[12],通过下调HOTAIR可以增加肝癌细胞对化疗药物的敏感性;国内也有研究指出[13],HOTAIR表达量与非小细胞肺癌临床分期、分化程度以及肿瘤大小存在相关性,且HOTAIR高表达患者生存期短。需要指出的是,目前国内对于HOTAIR表达是否影响食管癌预后的报道较少。通过本研究显示,HOTAIR与食管癌患者临床分期、分化程度、肿瘤大小等相关,需要提出的是术后辅助化疗患者HOTAIR降低,提示术后辅助放化疗可能通过抑制HOTAIR表达,从而抑制食管癌细胞的增殖转移。本研究发现,HOTAIR与患者术后复发存在相关,低表达HOTAIR患者术后3年内复发率低于高表达组,且复发时间延长,通过生存曲线以及Cox模型分析显示,HOTAIR表达与食管癌患者预后存在相关,提示HOTAIR与胸腔镜食管癌切除术后复发、生存率存在相关,为患者预后危险因素。笔者认为,食管癌患者在手术后通过检测HOTAIR表达,从而对患者预后提供一定的临床参考,也为临床医师选择更为合适的治疗方案以及临床效果评估提供一定的依据,同时笔者认为,为进一步开发更为有效的靶向分子药物治疗提供方向。
综上所述,HOTAIR为胸腔镜食管癌切除术后复发、生存状况的影响因素,通过对HOTAIR的检测可以为临床选择合理的治疗方案提供参考依据。
[1]NING B, ABDELFATAH M M, OTHMAN M O. Endoscopic submucosal dissection and endoscopic mucosal resection for early stage esophageal cancer[J]. Ann Cardiothorac Surg, 2017, 6(2): 88-98.
[2]GUPTA R A, SHAH N, WANG K C, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J]. Nature, 2010, 464(7291): 1071-1076.
[3]ISHIBASHI M, KOGO R, SHIBATA K, et al. Clinical signiAffiliatedcance of the expression of long non-coding RNA HOTAIR in primary hepatocellular carcinoma[J]. Oncol Rep, 2013, 29(3): 946-950.
[4]李小兵, 师晓天, 冯瑞庆, 等. 胸腔镜食管癌切除术临床经验总结[J]. 国际病理科学与临床杂志, 2012, 32(6): 512-515.
[5]WANG Y, CHEN C. Survival following video-assisted thoracoscopic versus open esophagectomy for esophageal carcinoma[J]. J BUON, 2016, 21(2): 427-433.
[6]TAN J T, ZHONG J H, YANG Y, et al. Comparison of postoperative immune function in patients with thoracic esophageal cancer after video-assisted thoracoscopic surgery or conventional open esophagectomy[J]. Int J Surg, 2016(30): 155-160.
[7]BOHANES P, YANG D, CHHIBAR R S, et al. Ininflammatoryuence of sex on the survival of patients with esophageal cancer[J]. J Clin Oncol,2012, 30(18): 2265-2272.
[8]DONOHOE C L, MACGILLYCUDDY E, REYNOLDS J V. The impact of young age on outcomes in esophageal and junctional cancer[J]. Dis Esophagus, 2011, 24(8): 560-568.
[9]刘尚国, 齐博, 赵宝生, 等. 相同病理分期食管癌患者预后影响因素分析[J]. 中国现代医学杂志, 2015, 25(36): 93-96.
[10]何健, 王杰军, 钱建新, 等. 第6版和第7版UICC-AJCC TNM分期系统预测食管癌根治性切除术后生存情况的比较:基于400例食管癌患者的临床分析[J]. 肿瘤, 2013, 33(2): 164-170.
[11]JAIN S, DHINGRA S. Pathology of esophageal cancer and Barrett’s esophagus[J]. Ann Cardiothorac Surg, 2017, 6(2): 99-109.
[12]张泽雨, 易升明, 张岩. 长链非编码RNA HOTAIR在非小细胞肺癌中的表达及意义[J]. 临床肺科杂志, 2015, 20(1): 102-105.
[13]KOGO R, SHIMAMURA T, MIMORI K, et al. Long noncoding RNA HOTAIR regulates polycomb-dependent chromatin modiAffiliatedcation and is associated with poor prognosis in colorectal cancers[J]. Cancer Res, 2011, 71(20): 6320-6326.

