低氧诱导因子-1α转染对骨髓间充质干细胞与β-磷酸三钙支架相容性的影响研究*
张扬,李学渊,牟怡平
(1.沈阳医学院附属中心医院 手外科,辽宁 沈阳110024;2.中国医科大学附属第一医院心内科,辽宁 沈阳110001)
骨缺损是骨科治疗面临的主要难题之一,目前的治疗方法主要包括骨移植、二次手术内固定及人工骨填充,由于前两者并发症较多[1-2],人工骨以及联合干细胞治疗越来越引起人们的重视。但由于骨缺损局部微环境处于低氧低血供的状态,因此细胞增殖和毛细血管网再造都很困难。缺氧诱导因子-1α(hypoxia inducible factor-1α,hif-1α)是1种关键的平衡氧稳态和调节缺氧反应的转录因子,其靶基因包括骨形态生成蛋白(bone morphogenetic protein,BMP-2)、基质细胞衍生因子 -1(stromal cell-derived factor-1,SDF-1)、血管内皮生长因子(vescular endothelial growth factor,VEGF)及其受体(vescular endothelial growth factor receptor,VEGFR)等,该因子参与细胞增生、血管生成及血红蛋白合成等病理生理过程。因此,hif-1α转染的骨髓间充质干细胞(mesenchymal stem cells,MSCs)可能通过增加组织功能骨的局部血管化、促进细胞增殖等作用改善MSCs在缺氧局部的功能并从而促进骨缺损的修复。本研究的目的主要是探讨hif-1α转染是否会对MSCs与β-磷酸三钙(β-tricalcium phosphate,β-TCP)支架的相容性产生影响。
1 材料与方法
1.1 MSCs培养和鉴定
鼠龄3~4周Wistar大鼠6只,体重100~120 g,雌性,直接贴壁法分离大鼠MSCs[3]。当MSCs 70%~80%铺满培养瓶底时,进行传代培养。所得细胞记为P1,同样方法获得P2、P3代细胞。应用流式细胞仪检测细胞表面抗原CD45、CD90、CD14、CD73、CD105和CD34的表达。应用成骨诱导分化条件培养液[DMEM/F12培养基,0.01 μmol/L地塞米松,10 mmol/Lβ-甘油磷酸钠,50 μmol/L维生素C,10%胎牛血清(fetal bovine serum,FBS)]培养进行成骨细胞诱导,茜素红染色鉴定[4]。
1.2 Hif-1α瞬时转染
应用感受态细菌(大肠杆菌DH5α)扩增pcDNA 3.0-HIF-1α-eGFP(本实验室保存,人HIF-1α),按质粒小提试剂盒说明书步骤操作提取质粒,核酸蛋白测定仪测定DNA浓度及纯度,DNA纯度为260/280 1.7~1.9,置入-20℃冰箱冷冻保存。标本送至大连TaKaRa生物公司测序[4]。应用脂质体LipofectamineTM2000将pcDNA3.0-HIF-1α-eGFP质粒转染至MSCs[4]。转染条件:细胞达>80%汇合、转染反应时间4 h、DNA和脂质体比为(μg/μl)1.00∶1.25。
1.3 MSCs转染后稳定筛选(有限稀释法)
瞬时转染48 h后培养基中加入遗传霉素(geneticin,G418)筛选,其终浓度为200 mg/L,每3~5天更换1次含有G418的筛选液。筛选7 d后胰酶消化细胞,离心,制成1 000个/ml的单细胞悬液。将获得的细胞悬液接种于96孔板,96孔板预先除第一排外每孔加0.1 ml不含抗生素的全培养基(11%FBS);第1排每孔加0.1 ml细胞悬液;第2排每孔加0.1 ml细胞悬液并混匀后,从中吸出0.1 ml细胞悬液,加入到第3排中;在从第3排混匀的细胞悬液中吸取0.1 ml加入到第4排孔中;以此类推,最后1排每孔中吸出的0.1 ml悬液弃去。第2天显微镜下观察标记有单个细胞的孔,继续培养,此时应用不加G418、含有青链霉素的全培养基,待细胞长满后,消化传代,移至较大培养器皿中培养。应用成骨诱导分化条件培养液(DMEM/F12培养基,0.01 μmol/L地塞米松,10 mmol/Lβ-甘油磷酸钠,50 μmol/L维生素C,10% FBS)培养进行成骨细胞诱导,茜素红染色鉴定。
1.4 样品分组
随机选取P3代MSCs细胞(A组)和pcDNA3.0-HIF-1α-eGFP质粒稳定转染的MSCs细胞(B组)各3瓶,与β-TCP支架共培养后观察细胞生长和增殖情况。
1.5 细胞与β-TCP支架共培养
β-TCP支架材料加工成体积为20 mm×15 mm×15 mm大小,超声清洗后烘干,高温高压灭菌备用。细胞消化,收集于15 ml离心管中,1 000 r/min离心5 min,弃上清液,用完全培养基重悬细胞,调整细胞浓度为2.0×107个/ml,接种到制备好的β-TCP支架上,使细胞悬液均匀浸满整个支架材料。接种完毕,转移细胞-材料复合物到培养皿中,放置到37℃、5%二氧化碳C02条件下的恒温培养箱中培养,常规换液。
1.6 扫描电镜观察
细胞接种β-TCP支架1周后对所得的样本进行电镜观察,PBS冲洗后应用2.5%的戊二醛4℃下固定1 h,梯度酒精脱水,临界点干燥。表面喷金后,扫描电镜下观察。
1.7 荧光染色观察β-TCP支架上成活细胞数
采 用 4’,6-二 脒 基 -2-苯 基 吲 哚(4’,6-diamidino-2-phenylindole,DAPI)荧光染色法。β-TCP支架用1×PBS洗3次后用4%甲醛固定20 min,PBS冲洗2次,用100 nm的DAPI(sigma)溶液染细胞核2 min。用荧光显微镜拍摄图像。每个样品随机要确定每个样品上的细胞附着的水平,在同样大的不同区域取5个细胞核的图像,然后把每个样品的细胞数/单位面积进行比较。
1.8 细胞增殖检测
采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐法(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)法。β-TCP支架在最佳培养条件下用3×104个/cm2密度孵育,后用PBS洗涤,再在MTT(sigma)溶液(0.5mg/ml)中孵育4 h。之后,移除MTT溶液,加入等量的二甲基亚砜(dimethyl sulphoxide,DMSO),低速振荡10 min,以溶解晶体,并使溶液呈现紫色。200 μl所得溶液置于96孔板内和应用酶标仪测定在570 nm处的吸光度值。
1.9 统计学方法
数据分析采用SPSS 19.0统计软件,用配对样本Wilcoxon秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 MSCs形态学观察
原代细胞接种24 h后已大部分贴壁,贴壁后MSCs呈棒状或纺锤状(见图1)。1~2 d后,细胞可形成大小不等分散的细胞簇,细胞多伸展为长梭形,胞核1、2个,圆形居中,可有1个至数个核仁。2~4 d后,细胞簇增大,呈鱼群样或漩涡状生长,与其他细胞簇逐渐融合(见图2)。培养4~5 d可传一代。
2.2 细胞表面抗原及细胞分化功能鉴定结果
流式细胞表面抗原检测结果表明P3代的MSCs表达 CD90(95.5%)、CD73(95.4%)、CD105(97.9%),基本不表达 CD45(1.2%)、CD14(0.6%)、CD34(0.4%)。分离培养的MSCs经成骨诱导分化条件培养液培养后能够成功诱导成为成骨细胞(见图3)。

图1 MSCs接种24 h呈棒状或纺锤状

图2 MSCs培养2~4 d后,细胞簇呈鱼群样生长

图3 MSCs成功诱导为成骨细胞 (茜素红染色×100)
2.3 Hif-1α转染后MSCs分化功能鉴定及荧光表达
稳定转染Hif-1α的MSCs仍能诱导分化为成骨细胞,证明转染后的MSCs仍保持细胞干性(见图4)。Hif-1α瞬时转染后12 h可见细胞有微弱荧光表达,24 h后可见绿色荧光,48 h后阳性细胞增多,荧光强度增强(见图5);72 h后荧光逐渐减弱。稳定转染后可见细胞核和细胞浆内都有GFP表达(见图6)。
2.4 在支架上生长的MSCs形态学观察结果
在培养1周时电镜下观察可见细胞贴附于材料的表面,伸展性好,一些聚集在一起,有的细胞可覆盖材料孔隙表面,生长较好,可见有突起连接并附着于孔隙内壁,并见有胶原分泌(见图7)。
2.5 Hif-1α转染前后β-TCP支架MSCs成活细胞数比较
随着培养时间的延长β-TCP支架上生长的MSCs的数目也逐渐增多,在培养3 d时细胞数目增多明显(见图8),但在Hif-1α转染前后MSCs在β-TCP支架上的生长细胞数差异无统计学意义(P=0.725),见图9。

图4 MSCs瞬时转染Hif-1α后成功诱导为成骨细胞

图5 MSCs瞬时转染Hif-1α 48 h后GFP荧光蛋白表达
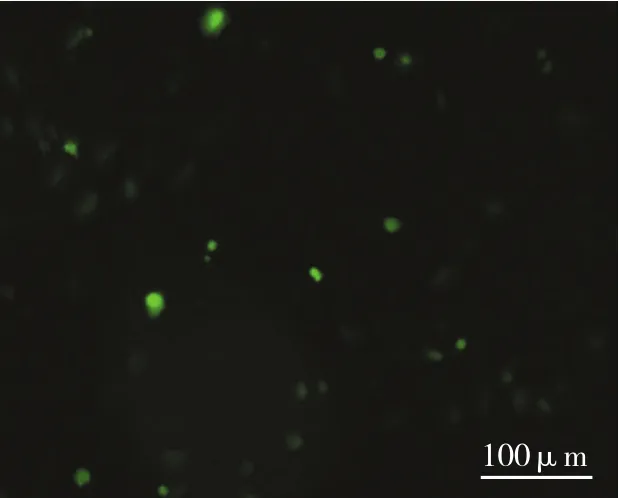
图6 稳定筛选后的转染细胞(MSCs)胞核与胞质均有绿色荧光蛋白表达 (×100)
2.6 Hif-1α转染前后β-TCP支架MSCs增殖比较
研究结果显示,MTT法检测细胞增殖的结果。Hif-1α转染前后MSCs在β-TCP支架上增殖差异无统计学意义(P=0.612)。见图10。

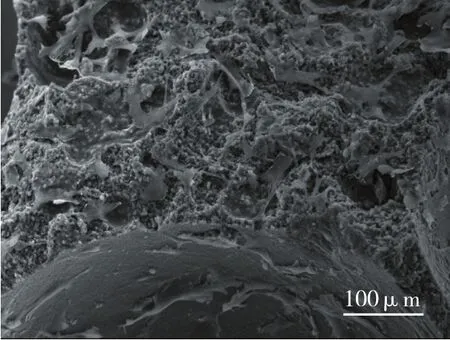
图7 生长于β-TCP支架表面的MSCs

图8 两组细胞在β-TCP支架的生长情况

图9 生长在β-TCP支架上的细胞 (DAPI荧光染色)
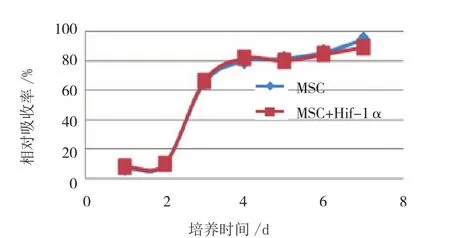
图10 两组细胞增殖情况 (MTT法)
3 讨论
目前,大部分研究结果提示人工骨支架、MSCs以及细胞因子联合治疗骨缺损效果最佳:BEHNIA等研究者证明应用纳米骨支架联合MSCs和富含血小板的生长因子治疗兔颅骨骨缺损能够有效促进骨再生[5];LUCARELLI等人应用同种异体骨联合基质干细胞和富含血小板的血浆移植治疗3 cm的羊骨骼缺损,在术后4个月的随访时骨组织计量学分析显示有42.8%~54.1%的新骨形成[6];LI等人研究得出结论,应用β-TCP联合BMP-2基因修饰的脂肪间充质干细胞治疗犬尺骨骨缺损,随访16周时骨组织计量学分析表明联合治疗组新骨形成增加,骨缺损新骨面积/总表面积为(39.95±8.55)%[7];HE等人使用聚乳酸-羟基乙酸共聚物/磷酸钙骨水泥联合BMMSCs和富含血小板的血浆治疗兔6 mm×10 mm股骨骨缺损,术后12周显示联合治疗组新骨形成较好[8];PROSECKÁE等研究者证明在应用ε聚己内酯/羥磷灰石联合MSCs和富含血小板溶液可获得最多且分布最均匀的新生骨[9];KIM等发现,在临床上ε聚己内酯-磷酸三钙联合自体纤维蛋白胶以及MSCs和重组人BMP-2的复合材料是促进新骨形成的最佳组合[10]。在相关研究中,LIU等人的研究表明,纳米羟基磷灰石/聚L-乳酸联合牙髓干细胞和重组人BMP-2共同治疗8 mm大小的兔牙槽骨的骨缺损所得骨矿物质沉积为(1.77±0.11)%,其小于应用不含重组人BMP-2的对照组,后者的骨矿物质沉积为(2.52±0.33)%[11]。联合治疗更有效的原因可能是细胞因子的应用增加细胞的生物活性和局部血管化。Hif-1α的靶基因编码的蛋白,如VEGF、BMP-2等均在此方面具有优势,因此可以考虑将Hif-1α引入复合组织人工骨中。
Hif-1α转染与其他细胞因子复合相比较的优势在于其可表达多种细胞因子,且具有稳定表达Hif-1α的干细胞可以持续且稳定的分泌细胞因子,不会因术后时间的延长而作用快速消失。而且Hif-1α能够改善低氧环境下细胞的生物活性,对骨缺损的低氧低灌注微环境下干细胞的存活提供有利条件。本研究结果证明Hif-1α转染前后MSCs的细胞干性和生物活性均无变化,后者与支架之间的相容性亦未受到影响,而且通过脂质体转染的方法可以避免应用病毒转染的继发风险,因此应用本研究的方法合成组织人工骨是可行的。
本研究的局限性在于只证实Hif-1α转染的MSCs用于联合支架治疗骨缺损的可行性,其有效性还需进一步研究证实。
[1]HENKEL J, WOODRUFF M A, EPARI DR, et al. Bone regenerationbased on tissue engineering conceptions-A 21st century perspective[J]. Bone Res, 2013, 1(3): 216-248.
[2]LIU Y, LIM J, TEOH S H. Review: development of clinically relevantscaffolds for vascularised bone tissue engineering[J].BiotechnolAdv, 2013, 31(5): 688-705.
[3]LI X Y, ZHANG Y, QI G X. Evaluation of isolation methods and culture conditions for rat bone marrow mesenchymal stem cells[J].Cytotechnology, 2013, 65(3): 323-334.
[4]张扬, 辛畅泰. HIF-1α转染方法的优化及其对间充质干细胞存活及分化功能的影响[J]. 基础医学与临床, 2014, 34(3): 365-371.
[5]BEHNIA H, KHOJASTEH A, KIANI M T, et al. Bone regeneration with a combination ofnanocrystalline hydroxyapatite silica gel, platelet-rich growth factor,and mesenchymal stem cells: a histologic study in rabbitcalvaria[J]. Oral surgery, oral medicine,oral pathology and oral radiology, 2013, 115(2): e7.
[6]LUCARELLI E, FINIM, BECCHERONI A, GIAVARESI G, et al.Stromal stemcells and platelet-rich plasma improvebone allograft integration[J]. Clin Orthop Relat Res, 2005(435): 62-68.
[7]LI H, DAI K, TANG T, et al. Bone regenerationby implantation of adipose-derived stromal cells expressing BMP-2[J]. Biochem Biophys Res Commun, 2007, 356(4): 836-842.
[8]HE F, CHEN Y, LI J, et al. Improvingbone repair of femoral and radial defects in rabbit by incorporating PRP into PLGA/CPC composite scaffold with unidirectional porestructure[J]. J Biomed Mater Res A, 2015, 103(4): 1312-1324.
[9]PROSECKÁ E, RAMPICHOVÁ M, LITVINEC A, et al. Collagen/hydroxyapatite scaffold enrichedwith polycaprolactone nanoAffiliatedbers,thrombocyte-rich solution andmesenchymal stem cells promotes regeneration in large bone defect in vivo[J]. J Biomed Mater Res A,2015, 103(2): 671-682.
[10]KIM S J, KIM M R, OH J S, et al. Effects ofpolycaprolactonetricalcium phosphate, recombinant human bonemorphogenetic protein-2 and dog mesenchymal stem cells on boneformation:pilot study in dogs[J]. Yonsei Med J, 2009, 50(6): 825-831.
[11]LIU H C, WANG D S, SU F, et al. Reconstruction of alveolar bone defects using bone morphogeneticprotein 2 mediated rabbit dental pulp stem cells seeded on nanohydroxyapatite/collagen/poly (L-lactide)[J]. Tissue Eng A, 2011, 17(19/20): 2417-2433.

