中药川贝对哮喘模型小鼠气道炎症的影响及可能机制研究*
李厚忠,高照渝,王慧,任公平,徐红纳,刘艺,巩丽虹,张羽飞
(1.牡丹江医学院,黑龙江 牡丹江 157011;2.牡丹江医学院附属红旗医院,黑龙江 牡丹江 157011;3.齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
支气管哮喘(bronchial asthma,BA)简称哮喘,是一种高发病率的慢性炎症性疾病,炎症反应在哮喘发生和进展中发挥着重要作用,被认为可能是哮喘的可能发病机制之一[1-2]。目前临床上常用的抗炎药,如糖皮质激素、白三烯受体拮抗药等,能迅速控住气道炎症,效果良好,但是仍然存在一些弊端,如停药后的复发,长期用药导致全身或局部的不良反应等[3-4]。因此寻找一种安全有效而不良反应小的治疗哮喘的药物显得格外重要。中药大多为天然植物,不良反应相对较小,可作为很好的选择。
川贝(Bulbus fritillariae cirrhosae)是具有代表性的川产道地名贵药材,为临床常用中药,其性苦、甘,微寒,有化痰止咳、清热散结、润肺之功效,多用于热痰、燥痰、肺虚劳嗽、久嗽、痰少咽燥及痰中带血等最为对证,还常用于心胸郁结、肺痿、肺痈之证[5]。本研究前期实验表明,川贝可有效降低哮喘模型模型小鼠一氧化氮(nitric oxide,NO)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、丙二醛(malondialdehyde,MDA)、白细胞介素1(interleukin,IL-1)及白细胞介素6(interleukin,IL-6)含量,升高超氧化物歧化酶(superoxide dismutase,SOD)活力等[6-7],同时也降低哮喘模型模型小鼠血管内皮生长因子(vascular endothelial growth factor,VEGF)和缺氧诱导因子1α(hypoxi-inducible factor-1α,HIF-1α)的表达[8]。本研究旨在前期研究基础上,继续观察川贝对哮喘模型小鼠气道炎症及白细胞介素8(interleukin-8,IL-8)、白细胞介素13(interleukin-13,IL-13),CXC趋化因子受体(CXC chemokine receptor 2,CXCR-2)和趋化因子配体[肿瘤生长相关因子α(growth-related oncogene-α,GRO-α)、上皮细胞嗜中性粒细胞活性蛋白78(epithelial cell-derived neutrophil-activating protein-78,ENA-78) 及 嗜 中 性 活 性 肽 2(neutral active peptides-2,NAP-2)]的影响,探讨其可能作用机制。
1 材料与方法
1.1 材料
1.1.1 试药中药川贝粉的制备:选取整齐、粉性足者。用洁净的纱布擦拭药材表面以去除药材表面的灰尘。净选后的川贝通过灭菌消毒窗消毒15 min后直接转至粉碎车间,用Fz-400型粉碎机组加工成100目细粉,收得的细粉装入洁净的容器中,封口。全部加工完后的细粉用洁净的塑料袋分装成1 kg/袋备用。临用时参照唐德才等主编的《中药学》所载成人所用剂量为3~6 g/d,根据动物体表面积等效剂量计算方法,计算小鼠给药剂量18.0 mg/kg为高剂量组,9.0 mg/kg为低剂量组。分别称取川贝粉18 mg,9 mg各溶于生理盐水5 ml,现用现配。
1.1.2 实验动物雌性BALB/c小鼠50只,6~8周龄,由哈尔滨医科大学动物实验中心提供,实验动物合格证号为:P00102008,实验动物使用许可证号:SYXK(黑)2008-033。空调恒温室内22℃,相对湿度50%,自由饮水饮食,通风换气8次/h。
1.1.3 试剂和仪器卵蛋白(OVA)(Sigma公司),兔抗人CXCR-2多克隆抗体、兔抗人GRO-α多克隆抗体、兔抗人ENA-78多克隆抗体及羊抗人NAP-2多克隆抗体(美国Santa Cruz公司),IL-8和IL-13检测试盒(美国ADL公司),其他试剂均为国产或进口分析纯。恒温水浴箱(HH-W210420L)(天津泰斯鹏仪器有限公司),微量加样器(3112)(德国eppendorf),自动平衡离心机(LDZ5-2)(北京京立离心机有限公司),电子天平(UW820S)(日本岛津电子天平),超声雾化器(402A)(江苏鱼跃医疗设备股份有限公司),光学显微镜(BH-2)(日本Olympus公司),粉碎机组(Fz-400)(天津市茂源制药机械有限公司)。
1.2 方法
1.2.1 模型复制健康清洁级BALB/c小鼠40只,腹腔内注射10% OVA+10%氢氧化铝混合液1 ml作为首次致敏,第15天将小鼠依次置于超声雾化器中,用1%OVA生理盐水喷雾激发小鼠哮喘发作,隔日1次,1次20 min,共激发10 d。以小鼠出现口唇发绀、腹肌痉挛、呼吸加快、点头呼吸或站立不稳等表现为成功激发。共复制成功30只。
1.2.2 分组及给药将成功复制的哮喘模型小鼠随机分模型组、高剂量组及低剂量组,每组10只;另设正常组(10只以生理盐水代替OVA进行腹腔注射及雾化吸入)。分组后每天灌胃给药,正常组和模型组给予等量生理盐水,高剂量组,低剂量组分别按照18.0及9.0 mg/kg剂量给予川贝粉,每天1次,连续28 d。
1.2.3 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)白细胞分类计数最后1次给药2 h后,各组小鼠用1%巴比妥钠麻醉,剪掉颈部毛发后剪开皮肤,分离气管周围的组织,气管作一横行切口,插入气管插管;心脏采血0.8~1.0 ml,EDTA抗凝,用于ELISA检测。结扎右主支气管,经气管插管10 ml生理盐水分3次灌洗左肺,回收BALF经2 000 r/min离心15 min,弃上清液,取沉渣经生理盐水重悬。Diff-Quik染色液染色BALF细胞涂片后,作细胞分类计数。切取右支气管平滑肌固定于10%的中性甲醛中,用于病理学观察。切取右肺门部位组织用于免疫组织化学和realtime PCR分析。
1.2.4 支气管平滑肌病理学观察将右支气管平滑肌组织10%中性甲醛固定后,常规酒精脱水,石蜡包埋,切片,HE染色,光镜下观察各组小鼠支气管平滑肌病理学变化。评判标准:没有炎症细胞(0分);有少量炎症细胞(1分);较多分布炎症细胞,且分布不均(2分);大量炎症细胞,少许聚集成团,且分布较均匀(3分);可见大量炎症细胞并且聚集成团(4分)。
1.2.5 血清IL-8和IL-13浓度测定采用ELISA测定IL-8和IL-13的浓度,严格按照ELISA试剂盒的操作说明书进行操作。每份样品检测3次。
1.2.6 免疫组织化学分析检测CXCR-2和GRO-α、ENA-78、NAP-2阳性细胞右肺门组织石蜡切片、脱蜡、脱水、浸泡于3% H2O2中15 min灭活内源性过氧化物酶。置于煮沸柠檬酸钠中修复抗原,暴露抗原表位并且用3%小牛血清蛋白阻断。滴加一抗、二抗及链霉素抗生物素蛋白-过氧化物酶复合物,DAB显色、镜下观察至出现棕黄色阳性信号后蒸馏水冲洗终止反应,苏木素复染、封片,拍照。随机选定3个HPF(×200倍,用Image Pro Plus 6.0 图像分析软件测出光密度(OD)值,并计算平均OD值。
1.2.7 Real-time PCR分析CXCR-2和GRO-α、ENA-78、NAP-2 mRNA转录水平Trizol试剂提取肺组织总RNA,检测RNA纯度,按照Real-time PCR试剂盒进行逆转录反应,合成单链的cDNA。cDNA产物置入-20℃冰箱冷冻保存。利用Pubmed查找相关基因序列,并利用引物合成软件Primer Premier 5.0设计引物。Real-time PCR反应体系:体积为25 μl;反应程序为:94℃变性45 s,60℃复性45 s,72℃延伸50s,共28个循环,72℃再延伸7 min。每个样本以内参基因β-actin调整。每个样本以内参基因β-actin调整。2-ΔΔCt法定量分析。每份样品检测3次。引物序列见表1。

表1 Real-time PCR引物序列
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,各组数据符合正态分布,方差齐时,采用one-way-ANOWA分析,组间两两比较采用LDS-t检验;方差不齐时采用Games-Howell检验,P<0.05为差异有统计学意义。
2 结果
2.1 BALF白细胞分类计数结果
各组小鼠BALF中性粒细胞、巨噬细胞、淋巴细胞和嗜酸性粒细胞计数比较,差异有统计学意义(P<0.05)。模型组中性粒细胞、巨噬细胞、淋巴细胞和嗜酸性粒细胞计数与正常组比较,差异有统计学意义(P<0.05);高剂量组和低剂量组中性粒细胞、巨噬细胞、淋巴细胞和嗜酸性粒细胞计数与模型组比较,差异有统计学意义(P<0.05)。见表2。
表2 各组小鼠BALF分类细胞计数 (n =10,×104/ml,±s)

表2 各组小鼠BALF分类细胞计数 (n =10,×104/ml,±s)
注:1)与正常组比较,P <0.05;2)与模型组比较,P <0.05
?

图1 各组小鼠支气管平滑肌病理学观察 (HE染色×200)
2.2 支气管平滑肌病理学观察及半定量分析结果
HE染色结果显示,正常组小鼠支气管壁完整,平滑肌呈正常厚度,支气管黏膜平整,细胞排列整齐,管腔内无上皮细胞脱落,支气管平滑肌内及其周围无明显炎症细胞浸润;模型组小鼠基层细胞增生,排列紊乱,平滑肌增厚,支气管壁和周围肺组织中有大量炎症细胞浸润,主要是嗜酸性粒细胞和淋巴细胞,支气管黏膜上皮脱落,水肿,管腔内有分泌物,以上改变也证明哮喘模型复制成功;高剂量组和低剂量组小鼠支气管平滑肌和气管壁厚度减少,支气管腔内少量黏液和脱落细胞,支气管噬酸性粒细胞和其他炎症细胞浸润有所减少,支气管噬酸性粒细胞及其他炎症细胞浸润减少,几乎消失,平滑肌和管壁厚度几乎接近正常组,支气管黏膜平整规则,管腔内偶尔可见脱落上皮细胞和少量黏液。见图1。各组小鼠炎症评分比较,差异有统计学意义(F=12.451,P=0.001)。模型组炎症评分与正常组比较,差异有统计学意义(P<0.05);高剂量组和低剂量组炎症评分与模型组比较,差异有统计学意义(P<0.05)。见表 3。
表3 各组小鼠炎症评分结果 (n =10,分,±s)

表3 各组小鼠炎症评分结果 (n =10,分,±s)
注:1)与正常组比较,P <0.05;2)与模型组比较,P <0.05
组别 炎症评分正常组 1.13±0.18模型组 3.37±0.471)高剂量组 1.93±0.172)低剂量组 1.98±0.132)F值 12.451 P值 0.001
2.3 ELISA结果
各组小鼠血清IL-8和IL-13浓度比较,差异有统计学意义(P<0.05)。模型组血清IL-8和IL-13浓度与正常组比较,差异有统计学意义(P<0.05);高剂量组和低剂量组血清IL-8和IL-13浓度与模型组比较,差异有统计学意义(P<0.05)。见表4。
表4 各组小鼠血清IL-8和IL-13浓度(n =10,pg/mL,±s)
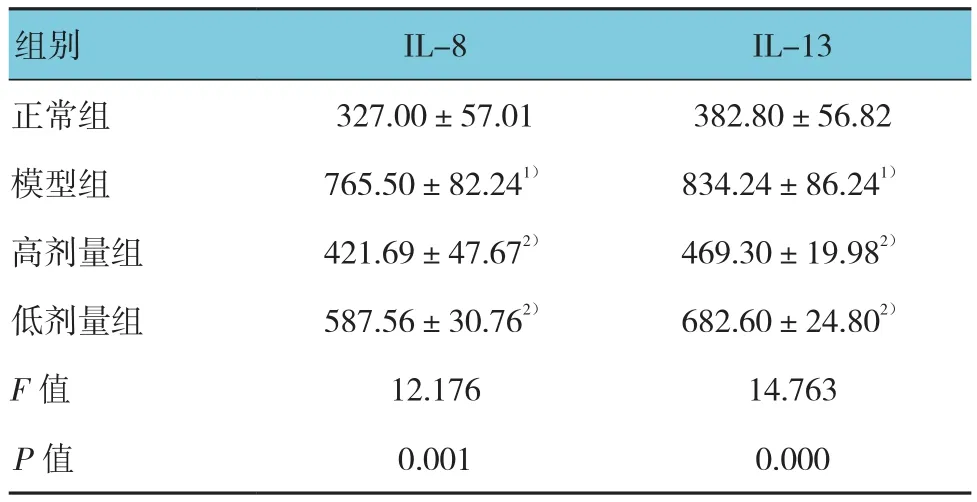
表4 各组小鼠血清IL-8和IL-13浓度(n =10,pg/mL,±s)
注 :1)与正常组比较,P <0.05 ;2)与模型组比较,P <0.05
组别 IL-8 IL-13正常组 327.00±57.01 382.80±56.82模型组 765.50±82.241) 834.24±86.241)高剂量组 421.69±47.672) 469.30±19.982)低剂量组 587.56±30.762) 682.60±24.802)F值 12.176 14.763 P值 0.001 0.000

图2 各组小鼠免疫组织化学结果 (免疫组织化学×200)
2.4 免疫组织化学结果
免疫组织化学分析结果显示,CXCR-2和GRO-α、ENA-78、NAP-2阳性细胞的胞浆呈棕黄色表达,主要为支气管上皮细胞和平滑肌细胞。正常组小鼠阳性细胞表达较低,而模型组小鼠表达较高,高剂量组和低剂量组小鼠表达降低。见图2。各组小鼠CXCR-2和GRO-α、ENA-78、NAP-2 OD值比较,差异有统计学意义(P<0.05)。模型组鼠CXCR-2和GRO-α、ENA-78、NAP-2 OD值与正常组比较,差异有统计学意义(P<0.05);高剂量组和低剂量组鼠CXCR-2和GRO-α、ENA-78、NAP-2 OD值与模型组比较,差异有统计学意义(P<0.05)。见表5。
表5 各组小鼠CXCR-2和GRO-α、ENA-78、NAP-2表达 (n =10,±s)
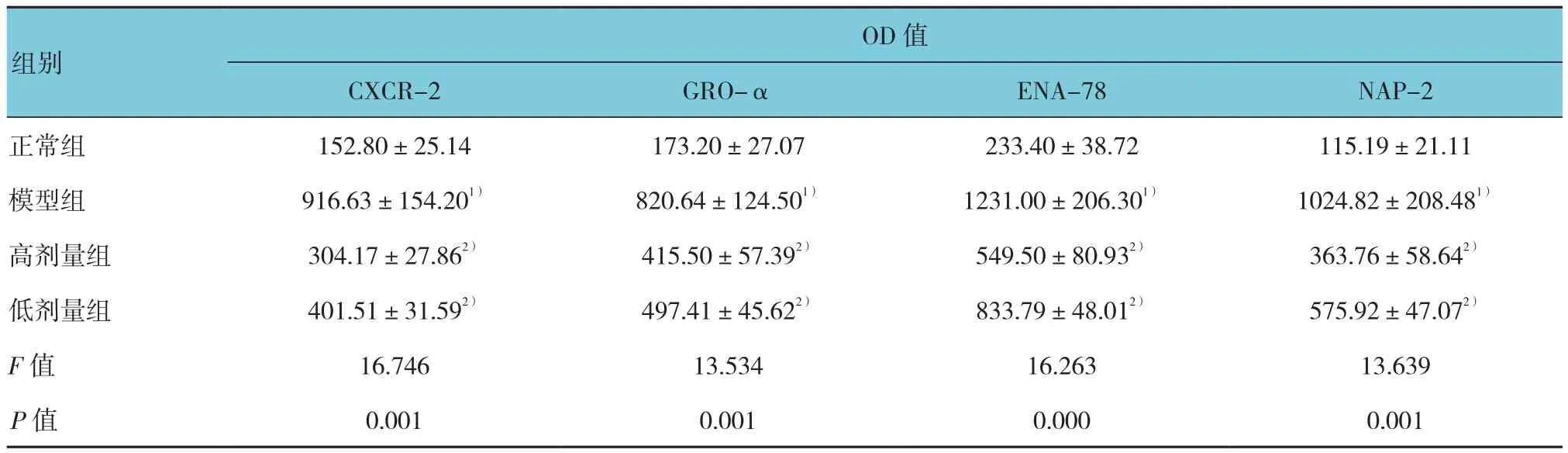
表5 各组小鼠CXCR-2和GRO-α、ENA-78、NAP-2表达 (n =10,±s)
注:1)与正常组比较,P <0.05;2)与模型组比较,P <0.05
OD值CXCR-2 GRO-α ENA-78 NAP-2正常组 152.80±25.14 173.20±27.07 233.40±38.72 115.19±21.11模型组 916.63±154.201) 820.64±124.501) 1231.00±206.301) 1024.82±208.481)高剂量组 304.17±27.862) 415.50±57.392) 549.50±80.932) 363.76±58.642)低剂量组 401.51±31.592) 497.41±45.622) 833.79±48.012) 575.92±47.072)F值 16.746 13.534 16.263 13.639 P值 0.001 0.001 0.000 0.001组别
2.5 Real-time PCR结果
各 组 小 鼠CXCR-2和 GRO-α、ENA-78、NAP-2 mRNA表达比较,差异有统计学意义(P<0.05)。模型组 鼠 CXCR-2和 GRO-α、ENA-78、NAP-2 mRNA表达与正常组比较,差异有统计学意义(P<0.05);高剂量组和低剂量组鼠CXCR-2和GRO-α、ENA-78、NAP-2 mRNA表达与模型组比较,差异有统计学意义(P<0.05)。见表 6。
表6 各组小鼠CXCR-2和GRO-α、ENA-78、NAP-2 mRNA表达 (n =10,±s)

表6 各组小鼠CXCR-2和GRO-α、ENA-78、NAP-2 mRNA表达 (n =10,±s)
注:1)与正常组比较,P <0.05;2)与模型组比较,P <0.05
mRNA表达CXCR-2 GRO-α ENA-78 NAP-2正常组 0.173±0.026 0.041±0.007 0.327±0.027 0.247±0.047模型组 0.414±0.0591) 0.743±0.1011) 1.228±0.1981) 1.189±0.1751)高剂量组 0.240±0.0262) 0.347±0.0642) 0.404±0.0612) 0.499±0.0652)低剂量组 0.301±0.0122) 0.531±0.0342) 0.729±0.0812) 0.675±0.0442)F值 10.481 24.935 7.642 17.423 P值 0.001 0.000 0.008 0.000组别
3 讨论
气道的炎症是哮喘的特征性病理改变,包括多种炎症细胞参与,如中性粒细胞、巨噬细胞、淋巴细胞和嗜酸性粒细胞等[9]。动物实验研究表明,BALF中存在大量的中性粒细胞、巨噬细胞、淋巴细胞和嗜酸性粒细胞是哮喘的典型特征[10-11]。当哮喘发作时,诱发机体的免疫反应,引起中性粒细胞、巨噬细胞、淋巴细胞和嗜酸性粒细胞活化、向炎症部位趋化、聚集,从而释放炎症介质(如内皮素、血小板活化因子及白三烯等)间接或者直接损伤气道上皮细胞,引发气道炎症[12]。故此,中性粒细胞、巨噬细胞、淋巴细胞和嗜酸性粒细胞也称为哮喘的主要炎症效应细胞,与哮喘的严重程度呈正相关,是哮喘临床诊断最为重要的指标。本研究显示,模型组小鼠BALF中存在大量的中性粒细胞、巨噬细胞、淋巴细胞和嗜酸性粒细胞,与以往研究相一致,而正常组小鼠BALF中性粒细胞、巨噬细胞,淋巴细胞和嗜酸性粒细胞较少;给予川贝,高剂量组和低剂量组小鼠BALF中性粒细胞、巨噬细胞、淋巴细胞和嗜酸性粒细胞均较模型组降低。同时,本研究病理学观察也证实川贝可降低哮喘小鼠炎症评分。以上结果提示,川贝可有效抑制哮喘模型小鼠气道炎症反应,改善哮喘症状。研究证实,IL-8和IL-13在哮喘的发病中起重要作用,且在哮喘的气道炎症形成中发挥更重要的作用[13]。IL-8是趋化因子超家族中的一员(CXCL亚家族),也是中性粒细胞主要的趋化剂和激活剂,又名中性粒细胞趋化因子,同时还是哮喘气道炎症的上调因子,对多种炎症细胞具有趋化作用,并与哮喘的严重程度密切相关[14]。IL-13是一种具有多效性的免疫调节功能的细胞因子,对哮喘的气道炎症具有激发和促进作用,是哮喘病理改变发生和发展的主要因素,可导致哮喘气道慢性持续性炎症,增加气道阻力,促进哮喘发病[15]。本研究显示,模型组小鼠血清IL-8和IL-13浓度较高,而正常组小鼠血清浓度较低;给予川贝,高剂量组和低剂量组小鼠血清IL-8和IL-13浓度降低。以上结果提示,川贝对哮喘模型小鼠抑制炎症反应的机制可能与其抑制IL-8和IL-13浓度有关。
趋化因子是一大类功能结构基本相似,具有和相应的受体结合,诱导中性粒细胞、淋巴细胞及单核细胞等细胞趋化游走的作用,从而介导炎症部位的细胞聚集活化,并参与组织损伤的小分子蛋白质[16]。CXCR-2属于趋化因子受体超家族中的重要成员之一,是趋化因子主要受体。趋化因子受体是表达在中性粒细胞、巨噬细胞等炎症细胞表面上介导相应趋化因子发挥生物学功能的关键的G蛋白偶联受体超家族。常见的趋化因子配体有GRO-α、ENA-78及NAP-2等。CXCR-2可与GRO-α、ENA-78及NAP-2等特异结合,趋化表达CXCR2的中性粒细胞、淋巴细胞等细胞的游走及脱颗粒等一系列生物学效应,在机体的防御和炎症反应等方面起重要作用,为哮喘治疗的新靶点[17]。目前,以趋化因子受体CXCR-2为靶点的药物已有所开发[18]。研究发现,在IL-13的刺激下,支气管平滑肌的CXCR-2和GRO-α、ENA-78、NAP-2均升高,且与中性粒细胞的移行和活化有关[19]。本研究显示,模型组小鼠CXCR-2和GRO-α、ENA-78、NAP-2阳性细胞和基因表达均较高,与以往研究相一致[20],而在正常组小鼠CXCR-2和GRO-α、ENA-78、NAP-2阳性细胞和基因表达均较低;给予川贝,高剂量组和低剂量组小鼠CXCR-2和GRO-α、ENA-78、NAP-2阳性细胞和基因表达降低。以上结果提示,川贝对哮喘模型小鼠抑制炎症反应的机制可能与其抑制CXCR-2和GRO-α、ENA-78、NAP-2有关。
综上所述,中药川贝可通过降低中性粒细胞、巨噬细胞,淋巴细胞和嗜酸性粒细胞计数,进而缓解小鼠哮喘的发作,减轻哮喘模型小鼠支气管平滑肌的炎症反应,其机制可能与其抑制IL-8、IL-13,CXCR-2和GRO-α、ENA-78、NAP-2有关。
[1]LICCARDI G, SALZILLO A, PICCOLO A, et al. Dysfunction of small airways and prevalence, airway responsiveness and ininflammatoryammation in asthma: much more than small particle size of pet animal allergens[J]. Ups J Med Sci, 2016, 121(3): 196-197.
[2]FARAH C S, KEULERS L A, HARDAKER K M, et al. Association between peripheral airway function and neutrophilic ininflammatoryammation in asthma[J]. Respirology, 2015, 20(6): 975-981.
[3]PARK C S. Size of inhaled corticosteroid and small airway inflammation in asthma[J]. Allergy Asthma Immunol Res, 2017,9(2): 99-100.
[4]LEAKER B R, O’CONNOR B, SINGH D, et al. The novel inhaled glucocorticoid receptor agonist GW870086X protects against adenosine-induced bronchoconstriction in asthma[J]. J Allergy Clin Immunol, 2015, 136(2): 501-502.
[5]邱彦, 刘静, 段靖, 等. 川贝水煎物对大鼠肺气肿治疗作用研究[J]. 解放军药学学报, 2014, 30(4): 317-320.
[6]李厚忠, 齐敏, 张羽飞. 中药川贝对哮喘大鼠NO、TNF-α、MDA浓度和SOD活力及支气管平滑肌炎症反应的影响[J]. 中医药学报, 2013, 41(4): 64-67.
[7]李厚忠, 任公平, 张羽飞. 中药川贝对哮喘模型小鼠肺水肿和支气管炎症的影响[J]. 中医药信息, 2014, 31(6): 19-22.
[8]李厚忠, 任公平, 张羽飞. 中药川贝对哮喘模型小鼠VEGF和HIF-1α表达的影响[J]. 中医药信息, 2014, 31(4): 23-26.
[9]BARNIG C, LEVY B D. Innate immunity is a key factor for the resolution of inflammation in asthma[J]. Eur Respir Rev, 2015,24(135): 141-143.
[10]CHOI J, CHOI B K, KIM J S, et al. Picroside II attenuates airway ininflammatoryammation by downregulating the transcription factor GATA3 and Th2-Related cytokines in a mouse model of HDM-induced allergic asthma[J]. PLoS One, 2016, 21(11): e0167098.
[11]VERHEIJDEN K A, WILLEMSEN L E, BRABER S, et al. The development of allergic inflammation in a murine house dust mite asthma model is suppressed by synbiotic mixtures of nondigestible oligosaccharides and BiAffiliateddobacterium breve M-16V[J].Eur J Nutr, 2016, 55(3): 1141-1151.
[12]KURAI J, WATANABE M, TOMITA K, et al. Influence of Asian dust particles on immune adjuvant effects and airway ininflammatoryammation in asthma model mice[J]. PLoS One, 2014, 9(11):e114879.
[13]HINKS T S, BROWN T, LAU L C, et al. Multidimensional endotyping in patients with severe asthma reveals inflammatory heterogeneity in matrix metalloproteinases and chitinase 3-like protein 1[J]. J Allergy Clin Immunol, 2016, 138(1): 61-75.
[14]张霞, 徐艳, 王玲, 等. 吸入激素对哮喘和慢性阻塞性肺病患者血清白介素-8、白介素-13变化的影响[J]. 中国老年学杂志,2008, 28(20): 2020-2022.
[15]AL-DAGHRI N M, ALOKAIL M S, DRAZ H M, et al. Th1/Th2 cytokine pattern in Arab children with severe asthma[J]. Int J Clin Exp Med, 2014, 7(8): 2286-2291.
[16]郭宇, 李燕, 陈庄. 趋化因子在哮喘中的作用及研究进展[J].现代预防医学, 2012, 39(7): 1764-1767.
[17]毕惠娟, 王健. CXCR1、CXCR2及其配体的结构和功能[J].免疫学杂志, 2010, 26(12): 1091-1095.
[18]吉海杰, 胡金凤, 陈乃宏. 以趋化因子受体为靶点的抗哮喘小分子药物研究进展[J]. 药学学报, 2011, 46(11): 1286-1290.
[19]金小红, 陈存国, 李凤仙, 等. 中重度哮喘急性发作患儿血中EAN-78的表达及甲基强的松龙对其表达的影响[J]. 中国临床药理学与治疗学, 2009, 14(5): 564-567.
[20]周兴辉, 叶辉, 罗冬娇, 等. 内皮中性粒细胞激活肽-78在哮喘大鼠中性粒细胞中的表达及意义[J]. 中华医院感染学杂志,2011, 21(18): 3791-3794.

