SDBS对大鳞副泥鳅胚胎发育及幼鱼性腺发育的影响
叶辽辽,徐 胜,袁秋芸,陈平法,温安祥
(四川农业大学生命科学学院,四川雅安 625000)
十二烷基苯磺酸钠(Sodium dodecyl benzene sulfonate,SDBS)是一种阴离子表面活性剂,易溶于水,具有强力去污、湿润、发泡等功能,被广泛用于农业、医药和日用化工等多种领域。虽有研究表明SDBS具有良好的生物降解性,但水体环境复杂多样,SDBS的微生物降解受到环境因素的影响很大,因而仍有SDBS残留[1,2]。谭渝云等[3]研究发现SDBS能通过鳃吸收或食物链富集于鱼体。过量的表面活性剂释放到环境中会对人体健康产生众多的负面影响,如腹泻、消瘦、皮肤过敏、坏死以及呼吸问题等[4],且SDBS还可对雄性小鼠和果蝇的生育能力产生显著影响[5-7]。因鳅类独特的生物学特性和对某些污染物或药物的敏感性而成为理想的实验材料[8-10]。本实验拟通过孵化实验和饲养实验分别考察不同浓度SDBS与大鳞副泥鳅(Paramisgurnusdabryanus)胚胎发育及幼鱼性腺发育的关系,以期为进一步探明SDBS对水生动物的影响提供基础资料。
1 材料与方法
1.1 实验材料
SDBS购自成都市科龙化工试剂厂。参照于淑池等[11]的泥鳅毒性实验方法,设计了0、1.0、2.5、5.0、10.0、20.0 mg/L 6个SDBS浓度梯度进行预备实验,确定SDBS浓度梯度为0、0.1、0.3、0.5、1.0、2.5、5.0 mg/L。大鳞副泥鳅亲鳅(雄鳅2尾、雌鳅4尾)由四川农业大学动物学实践教学基地提供。用LRH-A2(宁波市三生药业有限公司)和DOM(宁波第二激素厂)催产,获取受精卵用于胚胎发育实验。70日龄大鳞副泥鳅购于四川省眉山市“麦绿渔业有限公司”,用于幼鱼性腺发育实验。
1.2 SDBS对大鳞副泥鳅胚胎发育的影响
将受精卵随机分成7组,每组设3个重复,每个重复1 000粒,分组置于0、0.1、0.3、0.5、1.0、2.5、5.0 mg/L SDBS溶液中充氧孵化。受精10 h后,每2 h观察一次孵化情况,直至孵化结束。统计培育周期、孵化周期、孵化率和畸形率(培育周期[12]指同时受精的一批卵中从受精到50% 孵化出膜时所用的时间;孵化周期指同时受精的一批鱼卵从第一尾仔鱼孵出至最后一尾仔鱼孵化出时间间隔;孵化率=成形的仔鱼/受精卵数×100%;畸形率=畸形仔鱼数/成形仔鱼数×100%)。
1.3 SDBS对大鳞副泥鳅幼鱼性腺发育的影响
参照史改花等[13]对大鳞副泥鳅性腺分化的研究,选取70日龄性腺分化完全,体重3 g左右的健康大鳞副泥鳅210尾,随机分成7组,每组设3个重复,每个重复10尾(据大鳞副泥鳅胸鳍形状判断性别,雌雄各5尾),分组置于0、0.1、0.3、0.5、1.0、2.5、5.0 mg/L SDBS溶液中。根据SDBS降解速率[14],每日全部更换一次玻璃鱼缸中SDBS配制液。处理60 d后,统计各组大鳞副泥鳅的死亡情况,从每个浓度的各平行组中取雌雄鳅各3尾,制作性腺组织切片(5.0 mg/L浓度组死亡较多,将剩余大鳞副泥鳅全部制作切片),H.E染色观察。
1.4 数据处理
采用SPSS 20.0软件进行统计分析,数据用平均数±标准差表示。组间比较采用单因素方差分析,P<0.05表示差异显著。采用概率单位法计算半致死浓度LC50。
2 结果与分析
2.1 SDBS处理后大鳞副泥鳅受精卵孵化情况
SDBS≤1.0 mg/L时,各浓度组大鳞副泥鳅受精卵的培育周期、孵化周期、孵化率和畸形率与对照组均无显著差异。2.5 mg/L和5.0 mg/L浓度组的培育周期和孵化周期均显著高于对照组,孵化率分别为69.18%和12.02%,远低于对照组94.46%;鳅苗畸形率分别为4.23%和7.62%,是对照组的3~5倍,且2.5 mg/L与5.0 mg/L SDBS组之间大鳞副泥鳅的孵化率和鳅苗畸形率也存在显著差异。此外,5.0 mg/L SDBS中部分受精卵有明显的破裂现象。根据概率单位法计算,SDBS对大鳞副泥鳅受精卵的半致死浓度2d-LC50为2.935 mg/L。
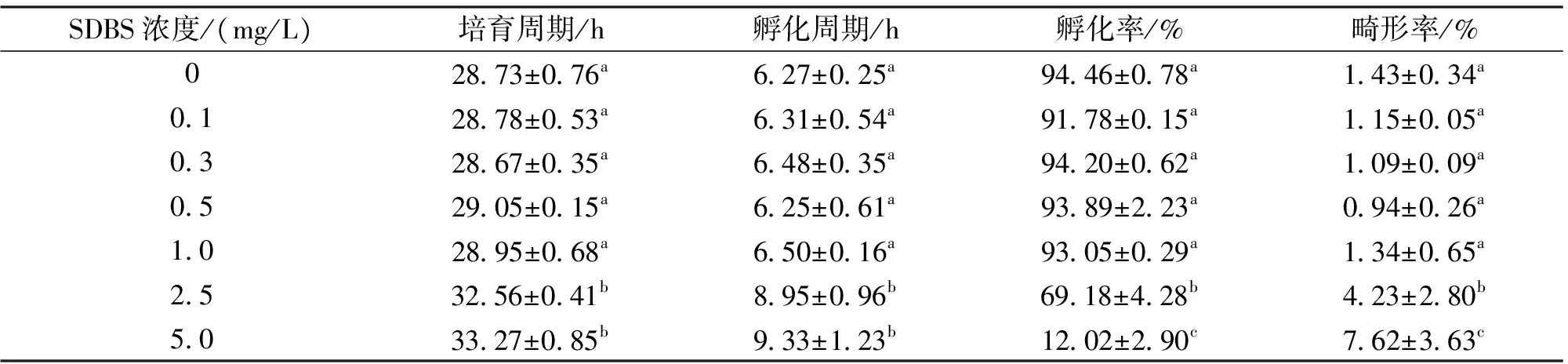
表1 不同浓度SDBS对大鳞副泥鳅受精卵孵化的影响
注:使用LSD方法进行单因素方差分析,同列数据右肩标注不同字母表示差异显著(P<0.05)。
2.2 SDBS处理60 d大鳞副泥鳅的死亡情况
0.3、0.5、1.0、2.5 mg/L SDBS组中大鳞副泥鳅相继出现不同程度的细菌性肠炎、出血等疾病,造成大鳞副泥鳅死亡。5.0 mg/L SDBS组中大鳞副泥鳅未发现染病现象,但仍有大量大鳞副泥鳅死亡,死亡个体腹部膨大,鳃和肛门出血,身体表面有大量粘液,与于淑池等[11]的急性毒性实验中毒症状一致。大鳞副泥鳅死亡情况趋势线符合三次回归式抛物线(R2> 0.9)。对回归曲线进行F检验[15],显著性水平(P=0.007)小于0.05,说明60 d内大鳞副泥鳅的死亡率与SDBS浓度存在显著相关性。根据概率单位法计算,SDBS对大鳞副泥鳅60 d的半致死浓度60 d-LC50为3.615 mg/L。

图1 SDBS处理60 d大鳞副泥鳅的死亡情况
2.3 性腺的组织学观察
2.3.1 SDBS处理60 d精巢的组织学观察
从图2可见,70日龄大鳞副泥鳅经60 d饲养,精巢已处于第Ⅴ时期。各实验组(B~D组)精小叶分布絮乱,形状不规则且小叶边界模糊,较对照组(A组)体积小,数量多,成熟度不均一,次级精母细胞较多。各实验组精巢小囊壁破裂,小叶腔中几乎充满成熟精子,只有靠近小叶腔壁处略有空隙。对照组精小叶体积较大,小叶间间介组织较薄,小叶边界明显,成熟精子较多,紧密排列在精小叶中。显示SDBS明显抑制了大鳞副泥鳅精巢的发育。

图2 SDBS处理60 d的精巢
2.3.2 SDBS处理60 d卵巢的组织学观察
各组大鳞副泥鳅卵巢中均存在第Ⅱ时相至第Ⅴ时相的卵母细胞,且各时相卵母细胞在数量和组织学形态上与对照组均无明显差别(图3)。可见,在本实验浓度下SDBS处理60 d对大鳞副泥鳅卵巢发育没有显著影响。

图3 SDBS处理60 d的卵巢
3 讨论
3.1 SDBS对大鳞副泥鳅受精卵孵化的影响
SDBS对大鳞副泥鳅受精卵半致死浓度2 d-LC50为2.935 mg/L,小于尹伊伟[16]等测得SDBS对草鱼受精卵半致死浓度(96 h-LC50为4.2 mg/L),可能与鱼的种类和实验水温等因素有关。SDBS浓度≥2.5 mg/L时显著影响了大鳞副泥鳅的胚胎发育,致使其培育周期和孵化周期延长,孵化率下降,鳅苗畸形率上升。据张博文[17]研究,SDBS可抑制人宫颈癌细胞和中华仓鼠卵巢细胞的增殖。抑制细胞分裂的原因可能是SDBS插入膜脂,与膜脂或膜蛋白的跨膜结构域等疏水部分结合,破坏了膜结构[18]。此外,SDBS能够抑制机体的抗氧化作用,使体内活性氧增多,可对DNA造成一定的损伤[19],影响DNA表达,进而影响受精卵的分裂。
3.2 SDBS对大鳞副泥鳅死亡率的影响
已有研究表明,SDBS可有效减少鱼体中NBT阳性细胞数量,降低SOD、IgM水平,使机体抗菌能力下降[20-22]。本实验中0.3~2.5 mg/L SDBS浓度组的大鳞副泥鳅主要因感染细菌性肠炎等疾病而死亡,分析是SDBS降低了大鳞副泥鳅的抗菌能力所致。但5.0 mg/L SDBS浓度组大鳞副泥鳅未感染细菌性肠炎等疾病,可能是高浓度SDBS抑制了细菌生长[23]。至于该浓度组中大鳞副泥鳅死亡率更高,推测是SDBS通过鳃和皮肤进入鱼体,富集于鳃、血液、肾、胆囊、性腺和肝胰脏等组织器官中的量更大[3,24],导致其中毒死亡。
3.3 SDBS对大鳞副泥鳅幼鱼性腺发育的影响
解剖时发现,1.0、2.5、5.0 mg/L SDBS组中大鳞副泥鳅精巢肿大,被膜紧张,有环状隆起,水肿现象明显,无法使用性腺成熟系数来评价大鳞副泥鳅性腺发育情况。观察精巢组织切片时,发现所有实验组大鳞副泥鳅精巢的结构遭到损坏,与韩俊娟等[5]对雄性小鼠的研究结论一致,推测可能是大鳞副泥鳅体内的ACP含量增高及ALP的活力下降所引起。ACP是溶酶体中一种重要的水解酶,其含量的升高可导致细胞坏死,ALP与包括性腺成熟在内的多种代谢有关,其活力的降低可引起鱼类严重的生殖功能障碍[25]。卵巢的组织学观察表明,各实验组卵巢与对照组相比均无明显差异。至于SDBS对大鳞副泥鳅雌雄性腺发育影响不同的原因尚不清楚,需进一步研究。
4 结论
SDBS浓度≥2.5 mg/L时,大鳞副泥鳅受精卵的培育周期和孵化周期延长,孵化率下降,鳅苗畸形率上升;大鳞副泥鳅死亡率随SDBS浓度增加而升高,60 d的半致死浓度为3.615 mg/L;SDBS浓度≥0.1 mg/L时能抑制精巢发育。
[1]袁平夫,廖柏寒,卢 明.表面活性剂(LAS&NIS)的环境安全性评价[J].安全与环境工程,2004,11(3):31-34.
[2]陈庆华.合成型阴离子表面活性剂在水土环境中的降解[D].重庆:西南大学,2006.
[3]谭渝云,张甬元.14C标志直链烷基苯磺酸钠在鱼体内的积累,分布和释放[J].中国环境科学,1991,11(2):125-129.
[4]Valizadeh S,Younesi H,Bahramifar N.Highly mesoporous K2CO3and KOH/activated carbon for SDBS removal from water samples:Batch and fixed-bed column adsorption process[J].Environ Nanotech Monit Manag,2016,6:1-13.
[5]韩俊娟,任春娥,韩海艳,等.十二烷基苯磺酸钠对雄性小鼠生育力的影响[J].中国卫生检验杂志,2012,22(8):1836-1842.
[6]张 颖,任春娥,乔鹏云,等.直链烷基苯磺酸钠对雄性小鼠生精功能亚慢性毒性作用研究[J].生殖医学杂志,2012,21(5):459-464.
[7]赵文红,张 鼎,周纯先,等.直链烷基苯磺酸钠对黑腹果蝇生殖能力及寿命的影响[J].中南大学学报(医学版),2011,36(2):154-158.
[8]陈玉明,卢少勇,朱 旭,等.泥鳅在污染物毒性评价中的应用[J].生态毒理学报,2013,8(4):447-455.
[9]胡伟华,何 辉,袁勇超,等.敌百虫、溴氰菊酯对大鳞副泥鳅仔鱼及多刺裸腹溞的急性毒性实验[J].淡水渔业,2017,47(1):66-70.
[10]戴瑜来,王宇希,潘彬斌,等.几种常用水产药物对大鳞副泥鳅苗种的急性毒性试验[J].淡水渔业,2015,45(4):104-107.
[11]于淑池,夏 秋.LAS与百螺敌对泥鳅的联合毒性研究[J].安徽农业科学,2008,36(24):10498-10500.
[12]苏应兵,廖咏玲,杨代勤,等.温度对泥鳅受精卵孵化和仔鱼活力的影响研究[J].安徽农业科学,2011,39(35):21822-21823,21828.
[13]史改花,杜启艳,张晓亚,等.大鳞副泥鳅性腺发生和分化的组织学研究[J].河南师范大学学报(自然科学版),2008,36(6):163-166.
[14]张学佳,纪 巍,康志军,等.烷基苯磺酸钠(LAS)在环境水体中的自然降解[J].黑龙江水专学报,2008,35(2):75-80.
[15]王钦德,杨 坚.食品试验设计与统计分析 [M].第二版.北京:中国农业大学出版社,2010:126-127.
[16]尹伊伟,张甫英,张甬元.LAS和DEHP对草鱼胚胎和鱼苗的毒性效应[J].生态科学,1992,(2):115-118.
[17]张博文.三类钠盐阴离子表面活性剂对细胞增殖的影响作用研究[D].北京:北京服装学院,2014.
[18]瞿中和,王喜中,丁明孝.细胞生物学 [M].第四版.北京:高等教育出版社,2011:61.
[19]吴继法.典型有机污染物胁迫对鲈鱼生物标志物系统影响的研究[D].北京:中国科学院研究生院(海洋研究所),2005.
[20]余坦健.苯酚和十二烷基苯磺酸钠对奥尼罗非鱼免疫功能的影响[D].广东湛江:广东海洋大学,2006.
[21]彭德姣,唐 庆,胡 南,等.直链烷基苯磺酸钠对鲤鱼的慢性毒性损伤的酶学诊断[J].环境科学动态,2004,(2):4-7.
[22]杨 帆,孙翰昌.直链十二烷基苯磺酸钠对中华倒刺鲃SOD和GSH-Px的活性影响[J].淡水渔业,2009,39(5):71-75.
[23]张振生.洗衣粉抑菌作用的初步观察及应用[J].日用化学工业,1982,(6):23-26.
[24]Tolls J,Lehmann M P,Sijm D T H M.Quantification of in vi-vo biotransformation of the anionic surfactant C-12-2-linear alkyl benzene sulfonate in fathead minnows[J].Environ Toxicol Cem,2000,19(10):2394-2400.
[25]Trivedim S P,Kumar M,Mishra A,et al.Impact of linear alkyl benzene sulphonate(LAS) on phosphatase activity in testis of the teleostean fish,Heteropneustesfossilis(Bloch)[J].J Environ Biol,2001,22(4):263.

