饲料蛋白质和脂肪水平对中华鳖生长性能、 肌肉质构指标及肝脏相关基因表达的影响
吴 凡,陆 星,文 华,田 娟,刘 伟,蒋 明,杨长庚,喻丽娟,梁宏伟
(中国水产科学研究院长江水产研究所, 武汉 430223)
中华鳖(Pelodiscussinensis),俗称甲鱼,是我国主要特种水产养殖品种之一。随着20世纪80年代末中华鳖人工繁殖技术的突破,中华鳖的养殖模式有了较大改进,已逐渐从小规模的土池养殖进入到集约的温室化养殖。集约化养殖模式下,中华鳖主要投喂人工饲料,由于我国中华鳖的营养与饲料研究起步较晚,总体来说对其饲料配方的研究还不完善,目前的研究仅见中华鳖对蛋白质,脂肪,部分维生素和矿物质的需求量及几种饲料添加剂的应用等方面[1-7]。
蛋白质和脂肪是两大重要的营养素,在维持机体生长及代谢调控等方面发挥重要作用。根据养殖阶段的不同,中华鳖对蛋白质的需求集中在 42%~50%[1-2],也有研究发现通过添加营养型添加剂可将中华鳖饲料中的蛋白质降到 40% 以下[8]。Huang等[3]以大豆油和鱼油作为脂肪源,发现4.9 g的中华鳖稚鳖对脂肪需求量为 8.8% 。在实际生产中,为保证中华鳖的快速生长,饲料脂肪含量不应低于 6%[9]。目前的研究大多关注营养素对中华鳖的存活率和生长性能的影响,但蛋白质和脂肪也能够直接影响营养物质沉积和养殖动物的肉品品质。中华鳖营养价值丰富,一直深受消费者的喜爱。近年来随着生活水平的提高,消费者对中华鳖的品质也提出了更高的要求。本研究旨在确定温室养殖条件下中华鳖饲料中适宜的蛋白质与脂肪配比,同时研究饲料蛋白质及脂肪水平对中华鳖肌肉营养成分,肌肉质构指标及肝脏相关基因表达的影响,以期为制定合理的饲料配方及改善中华鳖的品质提供理论依据。
1 材料和方法
1.1 试验设计与试验饲料
本试验采用双因素试验设计中的“3×2”因子设计,以饲料中蛋白质和脂肪水平为试验因素。
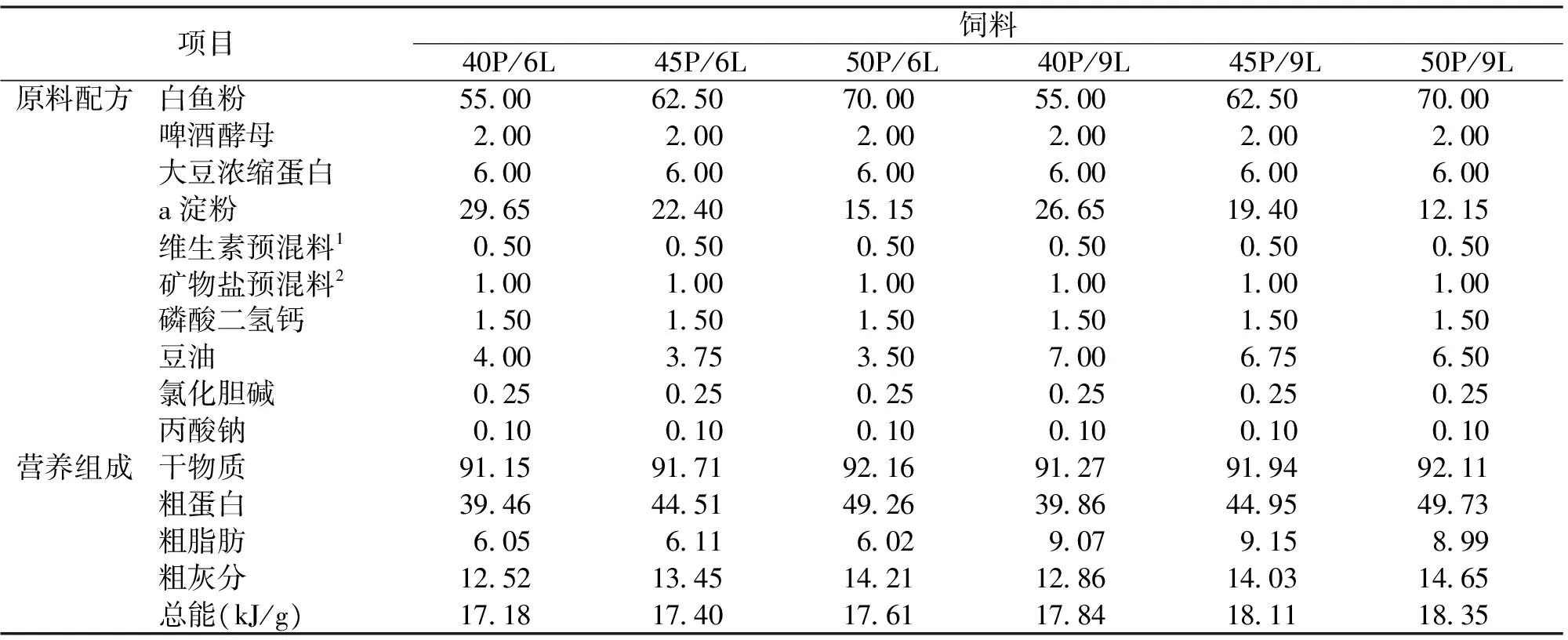
表1 饲料配方及营养成分
注:1.维生素预混料 (g/kg):维生素A,8;维生素D,1;维生素E,40;维生素K,3;维生素B1,4;维生素B2,4;维生素B6,8;烟酸,32;生物素(2%),6;泛酸钙,40;叶酸,2;维生素B12,2;维生素C,60;肌醇,100。
2.矿物盐预混物 (g/kg):亚硒酸钠,0.4;碳酸钙,350;磷酸二氢钠,200;磷酸二氢钾,200;七水硫酸镁,10;一水硫酸锰,2;二水氯化铜,1;七水硫酸锌,2;七水硫酸亚铁,2;氯化钠,12;碘化钾,0.1;六水氯化钴,0.1;六水氯化铝,1。
蛋白质设三个水平,分别为40%、45%和50%,脂肪设两个水平,分别为6%和9%,一共6组试验饲料,分别命名为40P/6L、45P/6L、50P/6L、40P/9L、45P/9L和50P/9L (P-蛋白质,L-脂肪)。饲料以白鱼粉、啤酒酵母和大豆浓缩蛋白为蛋白源,豆油为脂肪源。饲料配方及营养成分见表1。
1.2 养殖试验
养殖试验在安徽喜佳农业发展有限公司中华鳖养殖场的温室内进行,选择54 只健康的雄性日本品系中华鳖,均重 (293.11±7.84) g,分成 6 个组,每组 9 只 (3个平行,每个平行3只) ,饲养于18 个长方形塑料箱 (90 cm×60 cm×35 cm) 中,箱中水深25 cm,每个养殖箱中挂3块网片,供中华鳖攀爬栖息,箱中设置一块20 cm×30 cm的食台,食台设在水下2~3 cm。6组中华鳖分别投喂40P/6L、45P/6L、50P/6L、40P/9L、45P/9L和50P/9L的6种饲料。每天上午将饲料加水制成团状,再以手持式挤压机将饲料团挤压成直径6 mm左右的颗粒,分三次投喂 (8∶30、13∶30和18∶30) ,每次投喂量以20 min之内吃完为宜,如投喂20 min后仍有残饵,则回收烘干称重。每晚20∶00以虹吸法吸取养殖箱中粪便,并补充新水至25 cm高度。温室内温度控制在 (32±1) ℃,养殖试验进行56 d。
1.3 试验采样
养殖试验结束后,将中华鳖禁食 24 h后称重,计算增重率、特定生长率及饲料系数。将中华鳖从颈部放血,将背甲与腹甲分离,解剖取出肝脏并称重,用于计算肝体比。将肝脏取一小块样品放入 1.5 mL 离心管,迅速放入液氮中冷冻保存,用于检测肝脏igf-I,lpl基因 mRNA 表达水平。取四肢肌肉样品,分成两份,一份储存于 4 ℃ 冰箱,用于检测肌肉质构指标,另一份储存于 -20 ℃ 冰柜,用于基本营养成分检测。
1.4 检测分析
根据以下公式,计算增重率、特定生长率、饲料系数和肝体比。
增重率 (WG)=(末重-初重) ×100%/初重
特定生长率(SGR)=[ln(末重)-ln(初重)]×100%/饲养时间(d)
饲料系数 (FCR)=饲料摄入量/ (末总重-初总重)
肝体比 (HSI)=(肝脏重/个体重)×100%
将肌肉样品,切成 1.0 cm×1.0 cm×0.5 cm 规格,采用 TVT-300XP 型质构仪 (波通瑞华科学仪器北京有限公司) 进行质地剖面分析法 (texture profile analysis,TPA) 测定,探头为P-cy50s 圆柱型探头,采用两次检测法,测试前速度为2 mm/s;测试后速度为2 mm/s;测试速度为1 mm/s;测定间隔时间为5 s;压缩比为60%;触发力为98 mN;数据获得速率为200.00 pps。每只鳖取两块肌肉样品,检测肌肉的硬度、粘聚性、弹性、回复性、胶着性和咀嚼性等指标。
饲料和肌肉样品的水分含量采用105 ℃恒温干燥失重法测定;粗脂肪采用索氏抽提法测定;粗蛋白采用凯氏定氮法测定;灰分采用马福炉灰化法测定。
按照TRIZOL试剂盒 (Invitrogen) 的说明书提取肝脏总RNA。将RNA样品用RNase-free DNase I (Takara) 在 37 ℃下消化 30 min 以除去残余的DNA。用琼脂糖凝胶电泳和紫外分光光度法检测总RNA的完整性和质量。用Revert AidTM First-Stran试剂盒 (Fermentas) 将RNA反转录成第一链 cDNA。定量PCR反应根据天根生化公司的SYBR Green Real Master Mix进行(ABI 7500 荧光定量PCR仪)。根据NCBI Genebank基因序列及管家基因β-actin序列,通过Primer Premier 6.0软件设计引物序列,见表2。所有的反应采用20 μL体系。反应的热循环条件如下:95 ℃ 5 min,1循环;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸20 s,共计 40 个循环。数据以第一组为参照,使用2-△△Ct方法计算目的基因表达量[10]。
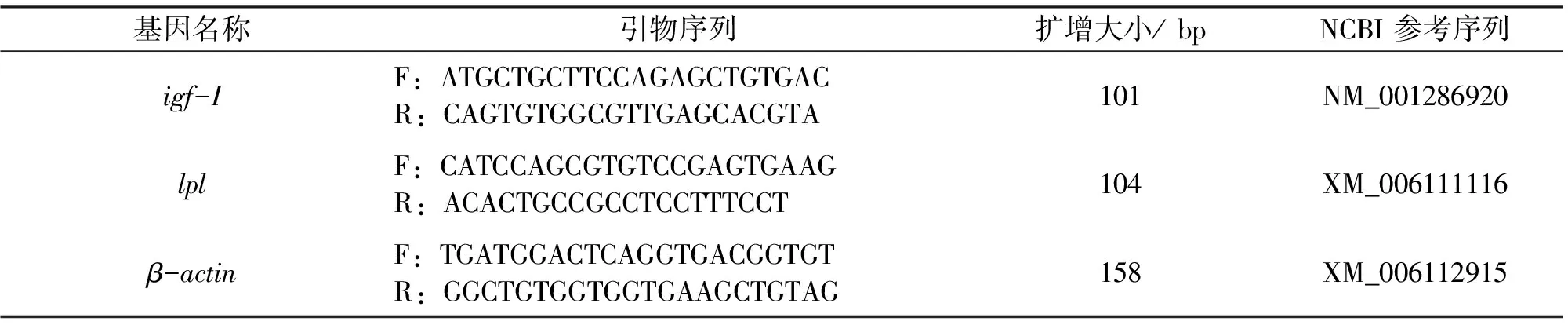
表2 定量PCR的特异性引物以及扩增片段长度
1.5 数据处理
采用Spss 18统计软件中双因素方差分析(Two-Way ANOVA)和Duncan’s氏多重比较法对试验结果的差异显著性进行分析处理,试验结果均以平均值±标准差表示,P< 0.05时表示差异显著。
2 结果
2.1 饲料蛋白质和脂肪水平对中华鳖生长性能的影响
不同饲料蛋白质和脂肪水平对中华鳖的存活率无影响,各组的中华鳖存活率均为 100%。由表3可知,饲料蛋白质水平显著影响中华鳖的增重率、特定生长率、饲料系数和肝体比。45% 和 50% 组的增重率和特定生长率无显著差异,但显著高于 40% 组,45% 组的饲料系数显著低于40%组,肝体比则呈相反趋势,随着蛋白质水平升高而上升,50% 组显著高于 40% 组。脂肪水平对增重率、特定生长率和饲料系数均无显著影响,但 9% 组的肝体比显著高于 6% 组。结果显示,饲料中蛋白质和脂肪水平对中华鳖的生长性能及肝体比均无显著的交互作用。

表3 饲料蛋白质和脂肪水平对中华鳖生长性能和饲料利用的影响
注:同一列数据有不同上标字母表示有显著差异 (P<0.05) 。下表同。
2.2 饲料蛋白质和脂肪水平对中华鳖肌肉成分的影响
由表4可知,饲料不同蛋白质水平对中华鳖肌肉水分、粗脂肪和粗灰分含量无显著影响,但显著影响肌肉粗蛋白含量,45% 和50%组显著高于40% 组,但45% 和50% 组之间并无显著差异。饲料脂肪水平对肌肉水分、粗蛋白和粗灰分含量无显著影响,9% 脂肪组的粗脂肪含量显著高于6% 组。结果显示,饲料中蛋白质和脂肪水平对中华鳖肌肉的营养成分均无显著的交互作用。
2.3 饲料蛋白质和脂肪水平对中华鳖肌肉质构指标的影响
由表5可知,饲料不同蛋白水平和脂肪水平均显著影响中华鳖肌肉硬度、黏性和咀嚼性,蛋白质水平50%组肌肉的硬度和黏性显著高于40%和45%组,咀嚼性显著高于40%组。脂肪水平9%组的硬度,黏性和咀嚼性显著低于6%组。饲料蛋白质及脂肪水平均对回复性、弹性和凝聚性无显著影响。结果显示,饲料中蛋白质和脂肪水平对中华鳖肌肉的质构指标均无显著的交互作用。
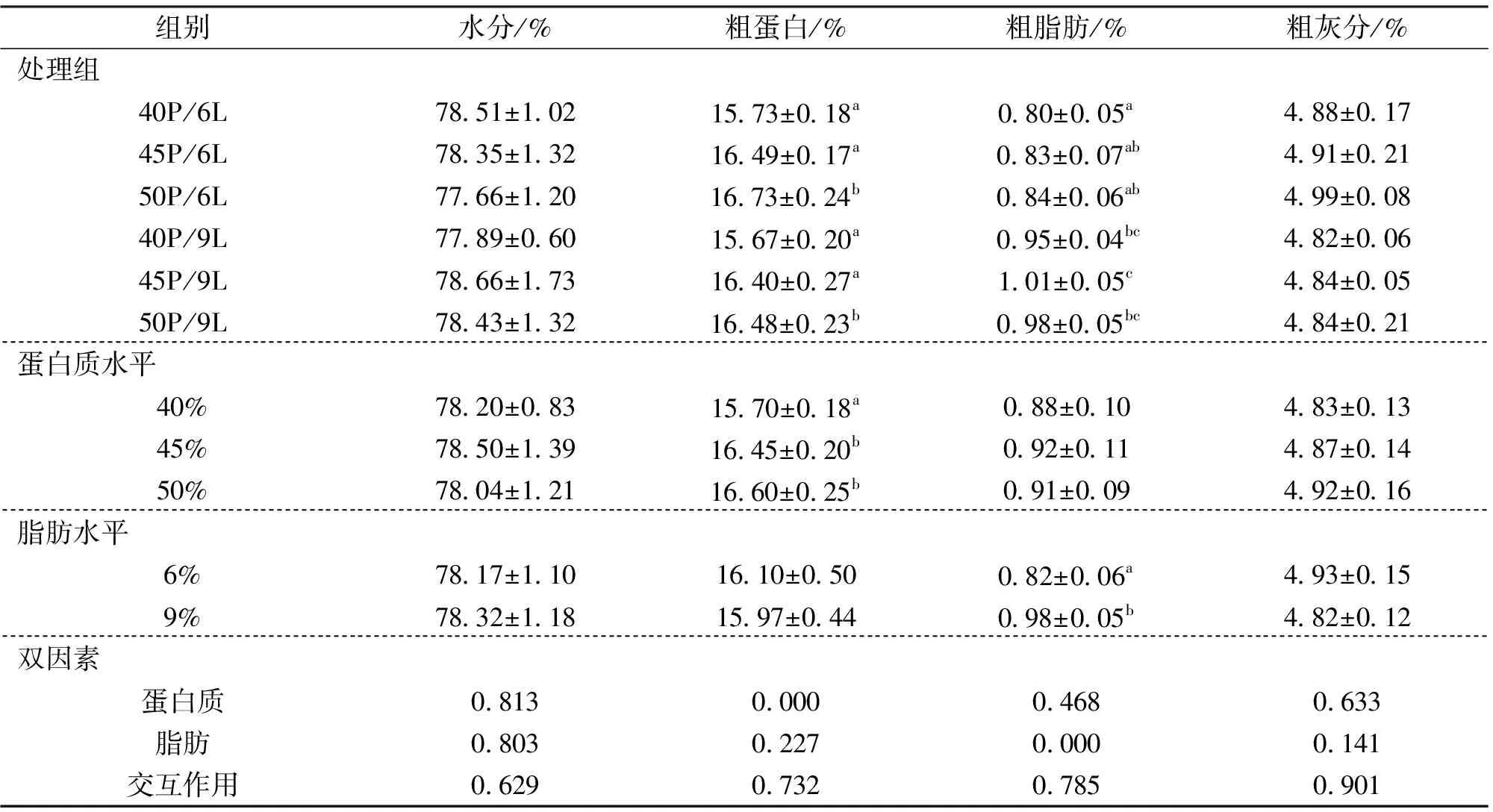
表4 饲料蛋白质和脂肪水平对中华鳖肌肉成分的影响
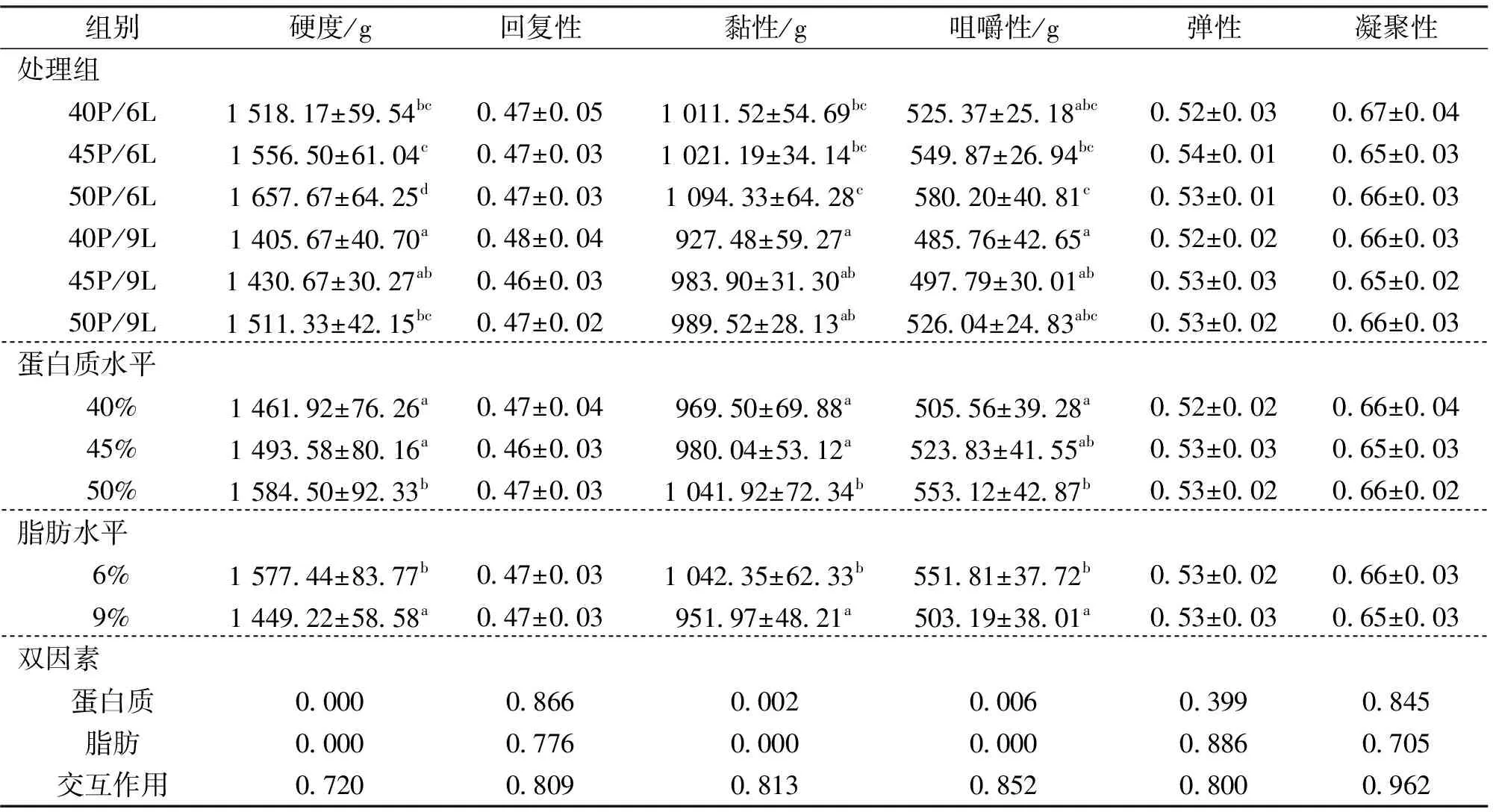
表5 饲料不同蛋白质和脂肪水平对中华鳖肌肉质构指标的影响
2.4 饲料蛋白质和脂肪水平对中华鳖肝脏相关基因表达的影响
如表6所见,饲料蛋白水平能显著提高中华鳖肝脏中igf-I基因 mRNA 表达水平,40%、45% 和 50% 组之间均存在显著差异。但对lpl基因相对表达量无显著影响。脂肪水平显著影响肝脏中igf-I和lpl基因mRNA 表达水平,9% 组显著高于 6% 组。结果显示,饲料中蛋白质和脂肪水平对中华鳖肝脏igf-I基因 mRNA 表达水平有显著的交互作用,对lpl基因mRNA 表达水平无交互作用。
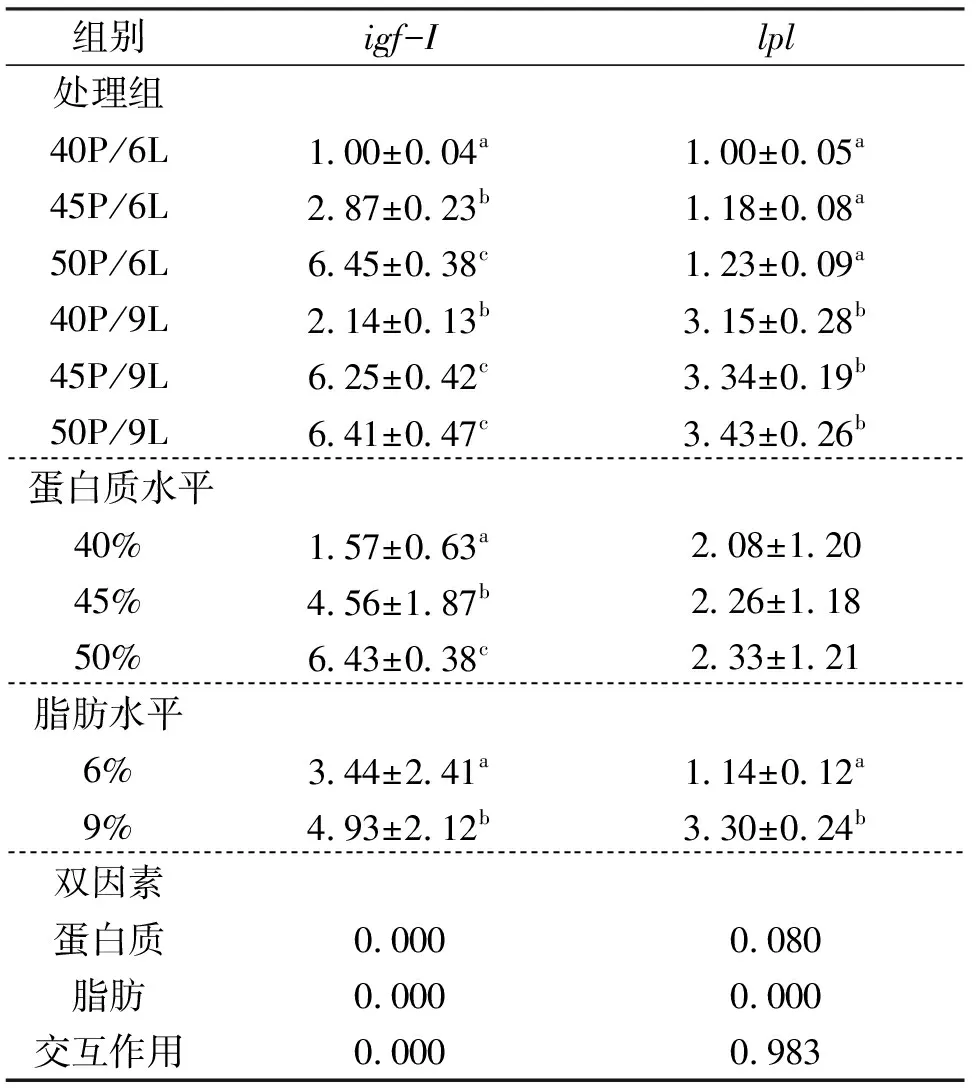
表6 饲料不同蛋白质和脂肪水平对中华鳖肝脏igf-I和lpl基因表达的影响
3 讨论
3.1 饲料蛋白质和脂肪水平对中华鳖生长性能的影响
本研究中,各个养殖箱中华鳖的存活率均为 100%,说明中华鳖可以较好的适应养殖环境及不同蛋白质及脂肪水平的饲料。中华鳖的增重率在 31.56%~41.90% 之间,这主要与爬行动物生长缓慢有关,本试验选取的初始体重300 g左右的中华鳖,其生长速度要低于稚鳖[11]。当饲料蛋白质水平由 40% 升高到 45% 时,鳖的增重率和特定生长率均显著上升,当继续上升到 50% 时,生长性能却并未继续升高。Nuangsaeng等[1]对初始体重为 5.1 g 的稚鳖的研究也有类似结果。本试验中 45% 组的饲料系数显著低于 40% 组,但 50% 组并未下降,反而比 45% 组略有上升,在团头鲂 (Megalobramaamblycephala)[12]和赤眼鳟(Squaliobarbuscurriculus)[13]中也有相同结果。说明当饲料蛋白质水平达到养殖动物的适宜需求量后再继续提高,会增加机体的代谢负担,生长指标反而进入平台期或下降期。
由于中华鳖饲料中主要使用白鱼粉等优质的动物蛋白源,过高的蛋白质水平会提高饲料成本。当蛋白质水平过高时,部分蛋白质还可能被当作能量消耗。本试验中,肝体比随着蛋白质水平升高而上升,说明过多的蛋白质可能分解供能,以能量形式储存于肝脏,并没有用于鳖的生长。结果表明 45% 的蛋白质水平可满足中华鳖的生理需求,这和以往的研究结果[1-2]相差不大,也和大鳞鲃 (Barbuscapito,43.09%~44.15%)[14]、南方鲇 (Silurusmeridionalis,45%)[15]等偏肉食性鱼类的需求量结果基本一致。
脂肪作为重要的能量物质,为鳖的生长发育提供能量,并协助脂溶性维生素的吸收和体内运输。本研究中,6% 和 9% 组并未出现显著差异,说明饲料中 6% 的脂肪即可满足鳖的生长,当脂肪水平继续上升到 9% 时,饲料中能量也相应升高,过高的能量可能影响了中华鳖的摄食,因此其生长性能并未持续上升。6%的结果要低于Huang等[3]对中华鳖稚鳖的研究结果 8.8%,生长阶段的不同应该是主要原因。稚鳖由于生长速度快于成鳖,其生长代谢旺盛,对于营养素的需求也要高于成鳖。Huang等[3]的研究中还发现,饲料中过多的脂类并未被中华鳖用于生长,而是被用于合成不饱和脂肪酸等以维持其自身的正常生长发育。本试验中随着脂肪水平的升高,肝体比显著上升,这种现象在团头鲂[12]和黑线鳕 (Melanogrammusaeglefinus)[16]中也有发现。由于肝脏是脂肪代谢的主要场所,摄入超出机体代谢范围的脂肪容易沉积在肝脏,可能会对肝脏造成不良影响[17]。
3.2 饲料蛋白质和脂肪水平对中华鳖肌肉成分的影响
在本研究中,饲料蛋白质和脂肪水平对中华鳖的水分和粗灰分含量均无显著影响,各组的含量均比较稳定。当饲料蛋白质水平≥45% 时,中华鳖肌肉的粗蛋白含量要高于 40% 组。说明当机体通过饲料摄入的蛋白质增加时,在肠道内分解为氨基酸的量也增加,因而通过血液进入肌肉组织中的氨基酸含量增多,蛋白质合成增强,因此肌肉蛋白质含量显著升高。结果表明 45% 的饲料蛋白质水平能提高中华鳖的肌肉蛋白质含量,提高其营养价值。
肌肉脂肪含量随着饲料脂肪水平的上升而升高,对细鳞鲑 (Brachymystaxlenok)[18]和斑点叉尾鮰 (IctalurusPunctatus)[19]的研究结果也有相似结果。说明肌肉营养成分主要受饲料中相应营养物质水平的影响。宋理平等[20]比较了仿生和温室养殖中华鳖的营养成分,发现仿生中华鳖的肌肉脂肪含量要低于温室鳖。由于温室鳖养殖在室内,养殖密度较大,受养殖环境限制鳖的活动也较少,更容易造成脂肪沉积,因此温室养殖条件下更应注意中华鳖饲料中的脂肪水平,避免添加量过高。
3.3 饲料蛋白质和脂肪水平对中华鳖肌肉质构指标的影响
质地剖面分析是利用质构仪模拟人的咀嚼运动对样品进行两次压缩,记录时间和力的关系,通过测试曲线分析出与质构特性相关的一系列参数,包括硬度、回复性、黏性、咀嚼性、弹性、凝聚性[21]。硬度反映了样品的内部结合力,是非常重要的质构指标,硬度低的肉品其肉质较松散,不容易得到消费者的认可[22]。本研究中,蛋白质和脂肪水平的变化均显著影响了肌肉硬度。随着饲料蛋白质水平的升高,肌肉硬度呈上升趋势,并在 50% 时出现显著差异,说明蛋白质水平的升高可能增加了肌肉间的结合力,使肌肉硬度上升。柳明等[23]研究了不同饲料营养水平对长吻鮠 (Leioeasislongirostris) 肉质的影响,发现高蛋白饲料养殖的鱼类的肌肉硬度更高,推测可能是由于肌纤维密度更高。
Haard[24]认为人工养殖鱼类的肉质不如野生鱼类结实,主要是由于人工养殖鱼类体内容易积累更多的脂肪。本研究中,肌肉脂肪含量高的组其肌肉硬度下降,这与对斑点叉尾鮰[25]的研究一致,这可能是由于高脂肪含量使得肌间脂肪含量升高,肌肉肥腻而质地松软,导致肌肉的机械强度降低。但Faergemand等[26]对虹鳟 (Oncorhynchusmykiss) 的研究表明,鱼肉脂肪含量增加并未影响肉质硬度,这可能与养殖品种的差异有关。研究中弹性、回复性、凝聚性等参数虽未受到饲料营养水平的影响,但是黏性是硬度与凝聚性的乘积,咀嚼性是硬度、凝聚性和弹性的乘积,都属于质构指标中的综合参数,因此与硬度的变化趋势一致。肉品的质构特性主要受肌纤维的组织学特性的影响,而饲料营养水平可以影响肌纤维的密度和直径等从而改善肌肉品质[27],这也提示我们从微观结构上观察肌纤维将有助于更完善的评价肉质。
3.4 饲料蛋白质和脂肪水平对中华鳖肝脏相关基因表达的影响
胰岛素样生长因子 (igf-I) 也称生长介素,是生长激素轴的组成部分,在动物的生长、代谢、繁殖等过程中发挥重要作用。营养物质可以通过调节igf-I的表达来影响动物的生长,因此饲料营养水平可以影响igf-I的表达与合成[28]。Brameld等[29]认为,蛋白质主要以氨基酸形式调控igf-I基因的表达。本研究中随着蛋白质水平的升高,肝脏igf-I基因表达显著升高,脂肪水平对中华鳖的影响也呈现相同的趋势。说明蛋白质和脂肪作为重要的营养素,显著影响了肝脏igf-I基因表达,这和柳阳对大西洋鲑 (Salmosalar) 的研究结果一致[30]。但生长性能上仅有45%蛋白组显著高于40%组,两个脂肪水平之间未产生显著差异,这可能是由于中华鳖是生长速度较慢的爬行动物,在较短的试验周期内并未出现生长上的差异,也可能是过多的蛋白质和脂肪主要用于中华鳖体内营养物质的沉积。
脂蛋白酯酶 (lpl) 作为脂质代谢的关键酶,可以促进甘油三酯分解,并释放游离脂肪酸贮存在肝脏[31]。 对瓦氏黄颡鱼 (Pelteobagrusvachelli)[32]和吉富罗非鱼 (Oreochromisniloticus)[33]的研究表明,摄食高脂饲料组的鱼类肝脏lpl基因表达水平显著升高。本研究中9%脂肪组的中华鳖肝脏lpl基因mRNA表达水平显著高于6%组,这与前人的研究结果一致,说明增加饲料脂肪含量可以诱导中华鳖肝脏分泌lpl,促进脂肪酸的消化吸收。中华鳖的肝体比和肌肉脂肪含量也呈现相同的变化趋势,说明lpl通过调控其在脂肪组织与其他组织器官表达水平的变化,决定了机体脂肪的蓄积状况。
4 结论
根据本试验中华鳖生长、肌肉营养成分、肌肉质构指标和肝脏相关基因表达的研究结果,建议中华鳖饲料适宜的蛋白质和脂肪水平分别为45%和6%,温室养殖条件下应注意脂肪的添加量,避免脂肪过多沉积,对肝脏造成不良影响。
[1]Nuangsaeng B,Boonyaratapalin M.Protein requirement of juvenile soft-shelled turtleTrionyxsinensisWiegmann[J].Aquacult Res,2015,32(s1):106-111.
[2]Zhou F,Ding X Y,Feng H,et al.The dietary protein requirement of a new Japanese strain of juvenile Chinese soft shell turtle,Pelodiscussinensis[J].Aquaculture,2013,412-413(6):74-80.
[3]Huang C H,Lin W Y,Chu J H.Dietary lipid level influences fatty acid profiles,tissue composition,and lipid peroxidation of soft-shelled turtle,Pelodiscussinensis[J].Comp Biochem Physiol Part A Mol Integrat Physiol,2005,142(3):383-388.
[4]邵庆均,张莉红,刘建新,等.饲料中VC水平对中华鳖幼鳖生长及其组织中含量的影响[J].水生生物学报,2004,28(3):269-274.
[5]周显青,牛翠娟,孙儒泳.维生素E 对中华鳖幼鳖生长、肝脏维生素E 以及血清皮质醇含量的影响[J].动物学报,2003,49(1):40-44.
[6]Chu J H,Chen S M,Huang C H.Effect of dietary iron concentrations on growth,hematological parameters,and lipid peroxidation of soft-shelled turtles,Pelodiscussinensis[J].Aquaculture,2007,269:532-537.
[7]占秀安,许梓荣.肉碱对中华鳖脂肪代谢的影响[J].浙江大学学报(农业与生命科学版),2002,28(1):70-73.
[8]高永利,郝玉江,杨振才,等.低蛋白质饲料添加肉毒碱养殖中华鳖试验研究[J].淡水渔业,2002,32(2):38-40.
[9]华 颖,邵庆均.中华鳖营养与饲料研究进展[J].饲料工业,2011,32(16):18-22.
[10]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25:402-408.
[11]蔡完其,李思发,刘至治,等.中华鳖七群体稚鳖—成鳖阶段养殖性能评估[J].水产学报,2002,26(5):433-439.
[12]蒋阳阳,李向飞,刘文斌,等.不同蛋白质和脂肪水平对 1 龄团头鲂生长性能和体组成的影响[J].水生生物学报,2012,36(5):826-836.
[13]郑惠芳,夏中生,林 岗,等.饲料蛋白质和脂肪水平对赤眼鳟生长和鱼体营养成分的影响[J].淡水渔业,2009,39(2):42-47.
[14]王常安,徐奇友,唐 玲,等.大鳞鲃幼鱼蛋白质的需求量[J].华中农业大学学报,2014,33(3):90-96.
[15]冯 健,彭 淇,吴 彬,等.南方鲇(Silurusmeridionalis)幼鱼日粮中适宜常量营养素(蛋白质、脂肪和碳水化合物)需求量研究[J].海洋与湖沼,2013,44(4):953-960.
[16]Nanton D A,Lall S P,McNiven M A.Effects of dietary lipid level on liver and muscle lipid deposition in juvenile haddock,MelanogrammusaeglefinusL[J].Aquacult Res,2001,32(S1):225-234.
[17]Jin Y,Tian L X,Zeng S L,et al.Dietary lipid requirement on non-specific immune responses in juvenile grass carp (Ctenopharyngodonidella)[J].Fish Shellfish Immunol,2013,34(5):1202-1208.
[18]徐革锋,刘 洋,郝其睿,等.不同蛋白质和脂肪水平对细鳞鲑幼鱼生长和肌肉氨基酸含量的影响[J].中国水产科学,2016,23(6):1311-1319.
[19]蒋广震,刘文斌,王煜衡,等.饲料中蛋白脂肪比对斑点叉尾鮰幼鱼生长、消化酶活性及肌肉成分的影响[J].水产学报,2010,34(7):1129-1135.
[20]宋理平,冒树泉,胡 斌,等.仿生与温室养殖中华鳖营养成分研究[J].饲料工业,2013,34(4):18-21.
[21]Cheng J H,Sun D W,Han Z,et al.Texture and structure measurements and analyses for evaluation of fish and fillet freshness quality:A review[J].Comp Revi Food Sci Food Saf,2014,13(1):52-61.
[22]Ashton T J,Michie I,Johnston I A.A novel tensile test method to assess texture and gaping in salmon fillets[J].J Food Sci,2010,75(4):182-190.
[23]柳 明,朱晓鸣,雷 武,等.不同饲料营养对池塘养殖长吻鮠生长性能和鱼肉品质的影响[J].水生生物学报,2010,34(3):598-610.
[24]Haard N F.Control of chemical composition and food quality attributes of cultured fish[J].Food Res Int,1992,25(4):289-307.
[25]马玲巧,亓成龙,曹静静,等.水库网箱和池塘养殖斑点叉尾鮰肌肉营养成分和品质的比较分析[J].水产学报,2014,38(4):532-537.
[26]Faergemand J,Rønsholdt B,Alsted N,et al.Fillet texture of rainbow trout as affected by feeding strategy,slaughtering procedure and storage post mortem[J].Water Sci Technol,1995,31(10):225-231.
[27]Periago M J,Ayala M D,Lopezalbors O,et al.Muscle cellularity and flesh quality of wild and farmed sea bass,DicentrarchuslabraxL[J].Aquaculture,2005,249(1-4):175-188.
[28]Duan C,Duguay S J,Swanson P,et al.Tissue specific expression of insulin-like growth factor I messenger ribonucleic acids in salmonids:Developmental,hormonal and nutritional regulation[M]// Perspectives in Comparative Endocrinology.1994:366-372.
[29]Brameld J M,Atkinson J L,Saunders J C,et al.Effects of growth hormone administration and dietary protein intake on insulin-like growth factor I and growth hormone receptor mRNA Expression in porcine liver,skeletal muscle,and adipose tissue[J].J Anim Sci,1996,74(8):1832-1841.
[30]柳 阳.脂肪和蛋白质水平对工业化养殖大西洋鲑的效应和机制研究[D].青岛:中国科学院研究生院,2013.
[31]Auwerx J,Leroy P,Schoonjans K.Lipoprotein lipase:recent contributions from molecular biology[J].Criti Rev Clin Lab Sci,1992,29(3-4):243.
[32]郑珂珂,朱晓鸣,韩 冬,等.饲料脂肪水平对瓦氏黄颡鱼生长及脂蛋白脂酶基因表达的影响[J].水生生物学报,2010,34(4):815-821.
[33]王爱民,杨文平,於叶兵,等.不同脂肪含量饲料对吉富罗非鱼鱼种生长性能、脂蛋白脂酶活性及其基因表达的影响[J].华中农业大学学报,2014,33(2):96-102.

