水体铅对胚胎-仔鱼期南方鲇的氧化应答及神经毒性作用
罗其勇,谢小军
(1.广西科技大学,广西柳州 545006;2.西南大学生命科学学院, 淡水鱼类资源与生殖发育教育部重点实验室,水生生物及水环境研究所,重庆 400715)
水体中重金属污染情况越来越受到人们关注,其主要源自人类活动过程中所产生的金属和金属类似物,通常具有毒性强、难降解、易于在生物体富集等特点。水产养殖业经过多年发展,因集约化养殖、高投入、高污染等不当措施带来的养殖环境的恶化,造成水产生物的病害频发。而作为养殖环境中重要的环境条件之一,重金属污染在局部区域呈现加重趋势。因此,了解水体中重金属暴露对鱼类机体毒性作用,对于指导鱼类养殖具有重要的现实意义。
重金属离子进入鱼类组织后会诱导活性氧物质(ROS)的产生,降低机体应对ROS氧化胁迫能力,造成机体氧化损伤[1-2]。机体应对ROS引起的氧化胁迫作用,会诱导抗氧化物质以清除ROS,其中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽(GSH)等,是机体应对氧化胁迫的关键物质,可以降低ROS对组织的毒害作用[3-4]。总抗氧化能力(T-AOC)作为衡量抗氧化酶系统的功能情况的综合能力的高低,用来反映机体抗氧化能力的综合性指标[3-5]。因此,上述抗氧化物质活性强弱或含量多少,常常被用来作为水生生物受重金属暴露胁迫的指标[2,4]。脂质过氧化物是生物体细胞受到氧化胁迫和损伤的产物[4,6],丙二醛(MDA)是脂质过氧化的终产物,因此,组织中MDA的含量常用来反映活性氧对组织造成脂质过氧化程度的指标[1-2,6]。
鱼体组织特别是肝和肾作为应对外来物质(如重金属,有机污染物等)引起的氧化胁迫主要解毒器官,其中组织中富含有抗氧化物质[2-4,7]。鳃组织是重金属通过水体途径暴露进入体内首要目标器官[3-5,7]。因此,这些器官常被选取作为评估鱼体受到重金属暴露而引起的氧化胁迫的标志性器官。本研究探讨了胚胎-仔鱼期南方鲇(Silurusmeridionalis)受到不同浓度Pb暴露对其鳃、肝脏和肾脏组织中的氧化胁迫作用,为阐明环境中重金属Pb造成鱼类体内氧化损伤和机体抗氧化机制变化的研究提供基础资料,以及为水产养殖过程中水环境适宜的重金属含量监控提供参考资料。
1 材料及方法
1.1 实验卵来源及养殖条件
2014年5月,在西南大学生命科学学院水生生物及水环境研究所养殖场获取性成熟南方鲇雌雄鱼(♀:9.5 kg、98.60 cm;♂:3.8 kg、78.00 cm),根据谢小军[8]提出的南方鲇人工受精法获得受精卵。将受精卵转移至实验室温度驯化,在适应驯化约4 h后挑取达囊胚早期发育阶段的胚胎附着于直径为11 cm的圆形滤网上,每个滤网附着250粒受精卵,把滤网放置于水族箱(长×宽×高=35 cm×20 cm×32 cm)中进行孵化。每个水族箱装30 L人工配制的软水,按实验设计浓度加入Pb母液配制成实验水体。每24 h更换1/2的实验用水,置换出的废弃水经活性炭处理后排放。用充气泵向水族箱充氧,实验期间水中溶氧维持在5 mg/L以上。pH为7.68±0.05。水族箱放入水浴箱中控制水温在(25±0.5)℃。光周期为12L∶12D,瞬时开断。
仔鱼出膜后,随机挑取仔鱼,根据表1设计进行铅暴露试验,其中每个浓度组5个重复,每一重复50尾仔鱼,于循环养殖系统中饲养8周,循环系统由1个蓄水箱(长×宽×高=85 cm×50 cm×70 cm)和10个养殖水箱(长×宽×高=39 cm×27 cm×25 cm)组成。饲养期间水温维持(27.5±1)℃,光周期为12L∶12D,每48 h更换1/2的实验用水,置换出的废弃水经活性炭处理后排放。
1.2 实验仪器及试剂
采用纯水系统制备的去离子水为水源,参照GB/T13267-91[9]和Mager等[10]的方法,用CaCl2·2H2O、MgSO4·7H2O、K2SO4、NaHCO3配制为水体硬度为25 mg/L的实验用水。以Pb(NO3)2为实验水体铅离子源试剂,先配制成Pb2+浓度为10 g/L的母液储藏备用,根据实验所需稀释成不同浓度,作为各实验处理组养殖用水。
实验仪器:纯水系统(LD-3000G-A2,重庆利迪实验仪器有限公司)、手持匀浆器(10 D-79219,Janke & Kunkel-Str,德国)、冷冻离心机(Centrifuge 5415R,德国Eppendorf)、酶标仪(Spectrax190,Molecular devices)、恒温水浴箱(GFL1004,德国GFL)、恒温水浴锅(HH2,金坛市白塔新宝仪器厂)。
实验试剂: MgSO4·7H2O、K2SO4、NaHCO3、Pb(NO3)2(成都市科龙化工试剂厂(AR))、CaCl2·2H2O(重庆博艺化学试剂有限公司(AR))、T-AOC试剂盒(南京建成生物技术有限公司)。
1.3 实验设计
根据渔业水质标准(GB11607-89)和我国地表水环境质量标准(GB3838-2002)规定的铅限量标准作为参考,结合初孵仔鱼96 h LC50和预实验结果,慢性实验水体设置的铅浓度分别为0、50、100、200、400 μg/L(表1)。每天8∶00和18∶00各投喂一次达饱足,投喂30 min后用虹吸法收集残饵及粪便。
实验分为4个处理组分别为:对照组(0-0)、恢复组(Pb-0)、持续组(Pb-Pb)和半持续组(0-Pb)。
对照组(0-0):胚胎期和仔鱼期,饲养的水体中都未加入硝酸铅条件下养殖8周。
恢复组(Pb-0):胚胎期受不同浓度铅暴露,实验结束后转移至未加入硝酸铅的实验水体中养殖8周,即为:50-0、100-0、200-0和400-0 μg/L。
半持续组(0-Pb):胚胎在净水中孵化出膜,出膜后转移至设计浓度的铅水体中饲养8周。即为: 0-50、0-100、0-200、0-400 μg/L。
持续组(Pb-Pb):胚胎期在不同浓度铅暴露下出膜,出膜后仔鱼在相应浓度条件下暴露8周。即为:50-50、100-100、200-200、400-400 μg/L。
在8周喂养实验结束后,实验鱼经MS222麻醉后解剖,迅速取出脑、鳃、肝脏和肾脏用于乙酰胆碱酯酶和抗氧化酶的活性测定。
1.4 各项指标测定及计算方法
1.4.1 匀浆液的制备
实验结束后,南方鲇经MS222麻醉后解剖,迅速取出脑、鳃、肝脏和肾脏组织用预冷的0.05 mol/L的磷酸盐(PBS)缓冲液冲洗后,用滤纸除去器官表面多余的液体,装入1.5 mL离心管中用液氮速冻后转移至-80 ℃保存待测。测定前把组织器官置于冰浴中解冻,取约0.2 g组织剪碎,按重量与体积比(g∶mL)为1∶10的比例加入10倍体积的PBS预冷匀浆液,冰水浴条件下机械匀浆。在温度为4 ℃的离心机中转速为9 000g离心10 min,取上清液转移到1.5 mL离心管中用于T-AOC、SOD、CAT、GSH、MDA、TChE和蛋白质含量的测定。上述操作过程均在温度为0~4 ℃条件下完成。
1.4.2 脑乙酰胆碱酯酶(TChE)活性测定
乙酰胆碱酯酶活性测定采用酶标仪参照Ellman等[11]提供的方法测定。TChE活性(nm/(min·mg protein))=((样品OD值-对照OD值)/min×反应体积)/(消光系数×样品体积×光径)/蛋白含量。

表1 南方鲇胚胎期和仔鱼期(Pb)暴露试验Tab.1 The study of lead exposure embryos and larvae of S.meridionalis μg/L
1.4.3 鳃、肝和肾组织中总抗氧化能力(T-AOC)测定
采用T-AOC试剂盒测定T-AOC活性。在27.5 ℃条件下,每分钟每毫克组织蛋白使反应体系中吸光值,每增加0.01时,定义为一个T-AOC单位(U)。
1.4.4 鳃、肝和肾组织中超氧化物歧化酶(SOD)活性测定
超氧化物歧化酶活性测定采用邻苯三酚自氧化法测定[12]。每分钟抑制每毫升反应液中抑制邻苯三酚自氧化速率达50%时的酶量定义为一个SOD活力单位。
1.4.5 鳃、肝和肾组织中过氧化氢酶(CAT)活性测定
过氧化氢酶活性测定参照Beers & Sizer[13]的方法。一个CAT活力单位定义为每分钟催化分解1 μmol过氧化氢。
1.4.6 鳃、肝和肾组织中谷胱甘肽(GSH)含量测定
谷胱甘肽含量采用分光光度法测定[14]。用还原型谷胱甘肽物质作为标准样品,采用酶标仪在412 nm处测得吸光值绘制标准曲线,再根据标准曲线计算出样品GSH含量(mg/mg protein)。
1.4.7 鳃、肝和肾组织中丙二醛含量(MDA)测定
MDA含量采用硫代巴比妥酸法测定[15]。
1.4.8 样品蛋白质含量测定
样品蛋白质采用考马斯亮蓝法测定[16],蛋白质含量用mg/L表示。
1.5 数据处理方法
采用Excel(2007)、SPSS(17.0)软件进行相关数据的整理及统计分析,统计数据以平均值±标准误(Mean±S.E)表示,差异显著性检验采用单因素方差分析(Alysisofvarianee,ANOVA)及最小显著差数法(Least significant difference,LSD)多重比较,以P<0.05作为数据均值差异达到显著性的标准。
2 结果
2.1 水体中Pb暴露对南方鲇鳃、肝脏和肾脏组织中总抗氧化能力(T-AOC)的影响
恢复组实验鱼鳃、肝脏和肾脏组织中T-AOC活性表现出恢复效应,其中400-0 μg/L铅浓度水平实验鱼鳃、肝脏和肾脏组织T-AOC活性显著高于对照组(P<0.05)。持续组和半持续组实验鱼鳃、肝脏和肾脏组织中T-AOC活性受到抑制,T-AOC活性随着水体中Pb浓度升高而逐渐降低。半持续组和持续组这三种组织中T-AOC活性均显著低于对照组(P<0.05),而相同浓度水平时,两实验组之间T-AOC活性不存在明显差异(P<0.05)(表2)。

表2 水体铅暴露对南方鲇幼鱼鳃、肝脏和肾脏组织中T-AOC活性的影响Tab.2 Effects of different lead concentration on the activity of T-AOC in gill,liver,kidney of S.meridionalis

续表2
注:数据用平均值±标准误表示(mean±S.E,n=5),a、b、c:同列中具有不同上标用来表示不同水体浓度水平,相同处理组之间差异性(P<0.05);x、y、z:表示同行中相同Pb浓度水平,不同处理组之间差异性(P<0.05)。表3,4同。
2.2 水体中Pb暴露对南方鲇鳃、肝脏和肾脏组织中超氧化物歧化酶(SOD)活性的影响
恢复组实验鱼鳃、肝脏和肾脏组织中SOD活性被轻微的诱导,在最高浓度水平(400-0 μg/L)三种组织中SOD活性显著高于对照组(P<0.05)(表3)。持续组和半持续组三种组织中SOD活性被抑制,随着浓度升高而降低,在200和400 μg/L浓度条件下,这三种组织SOD活性均显著低于对照组(P<0.05)(表3);50 μg/L浓度水平肝脏和肾脏组织SOD活性被诱导,显著高于对照组(P<0.05)(表3)。

表3 水体铅暴露对南方鲇幼鱼鳃、肝脏和肾脏组织中SOD活性的影响Tab.3 Effects of different Lead concentration on the activity of SOD in gill,liver,kidney of S.meridionalis
2.3 水体Pb暴露对南方鲇鳃、肝脏和肾脏组织中过氧化氢酶(CAT)活性的影响
恢复组实验鱼鳃、肝脏和肾脏组织中CAT活性表现出恢复效应,胚胎期受最高浓度暴露实验鱼三种组织中CAT活性显著高于对照组(P<0.05)。持续组和半持续组三种组织中CAT活性被抑制,随着Pb浓度升高而降低,在200和400 μg/L浓度条件下,这三种组织CAT活性均显著低于对照组(P<0.05);在相同浓度水平下,两处理组之间CAT活性无明显差异(P<0.05)(表4)。

表4 水体铅对暴露南方鲇幼鱼鳃、肝脏和肾脏组织中CAT活性的影响Tab.4 Effects of different Lead concentration on the activity of CAT in gill,liver,kidney of S.meridionalis
2.4 水体中Pb暴露对南方鲇鳃、肝脏和肾脏组织中谷胱甘肽(GSH)含量的影响
水体中Pb暴露会降低实验鱼鳃、肝脏和肾脏组织中GSH含量。持续组和半持续组这三种组织中GSH含量随着Pb浓度升高而降低,均显著低于对照组(P<0.05)(图1-3);相同浓度水平下,这三种组织中GSH含量在半持续组和持续组之间无明显差异(P<0.05)(图1-3)。
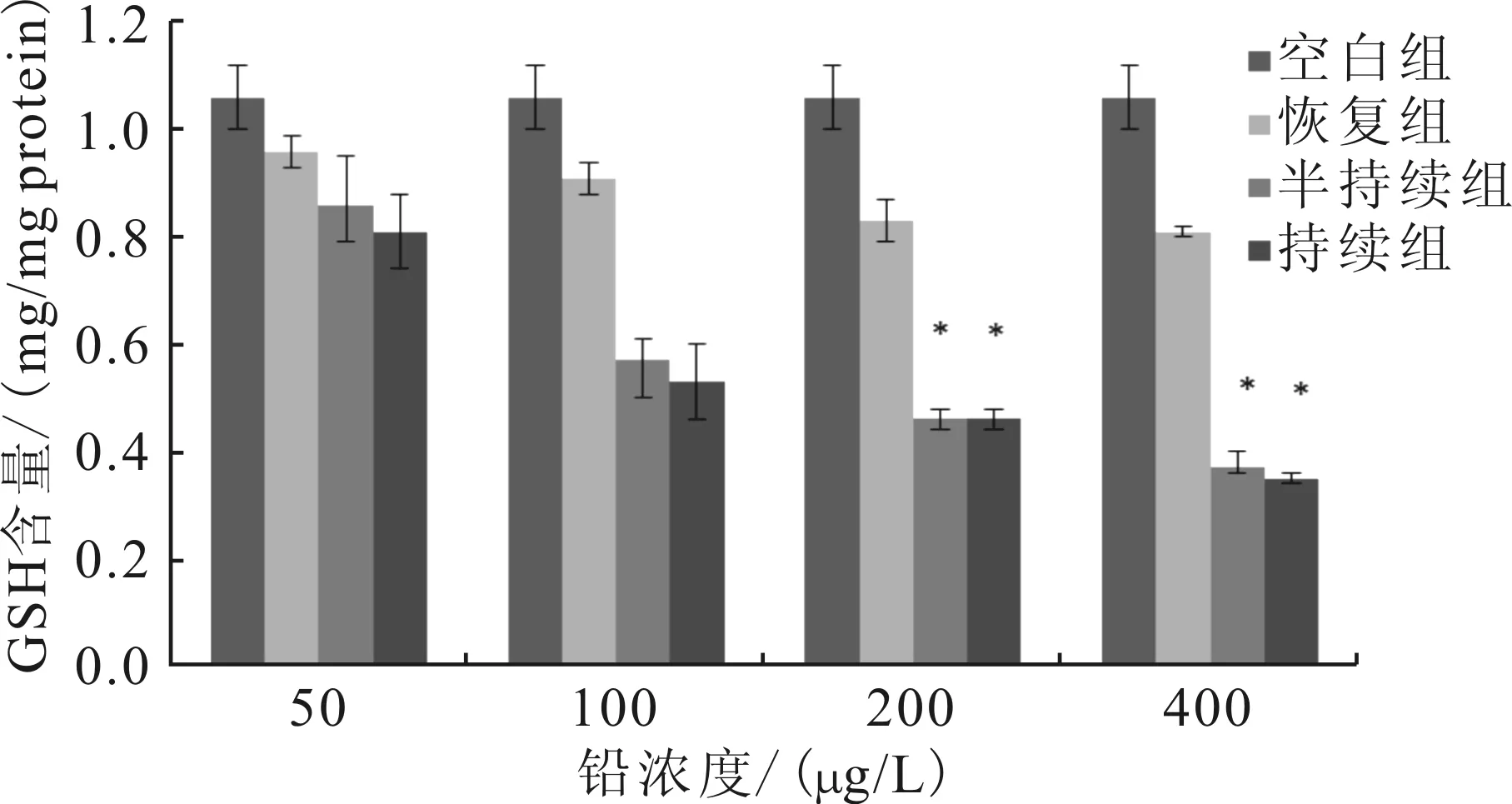
图1 水体铅暴露对南方鲇幼鱼鳃中GSH含量的影响Fig.1 Effects of different lead concentration on the contents of GSH in gill of S.meridionalis *表示处理组与空白组差异达显著水平(P<0.05)。 图2-7同。
2.5 水体中Pb暴露对南方鲇鳃、肝脏和肾脏组织的丙二醛(MDA)含量的影响
铅暴露会引起南方鲇组织氧化损伤,实验鱼鳃、肝脏和肾脏组织中MDA含量随着水体中Pb浓度升高而升高。MAD含量只在400 μg/L浓度水平时显著高于对照组(P<0.05)。相同浓度水平下,半持续组和持续组实验鱼三种组织中MDA含量差异不显著(P<0.05)(图4-6)。

图2 水体铅暴露对南方鲇幼鱼肝脏中GSH含量的影响Fig.2 Effects of different lead concentration on the contents of GSH in liver of S.meridionalis

图3 水体铅暴露对南方鲇幼鱼肾脏中GSH含量的影响Fig.3 Effects of different lead concentration on the contents of GSH in kidney of S.meridionalis

图4 水体铅暴露对南方鲇幼鱼鳃中MDA含量的影响Fig.4 Effects of different lead concentration on the contents of MDA in gill of S.meridionalis

图5 水体铅暴露对南方鲇幼鱼肝脏中MDA含量的影响Fig.5 Effects of different lead concentration on the contents of MDA in liver of S.meridionalis

图6 水体铅暴露对南方鲇幼鱼肾脏中MDA含量的影响Fig.6 Effects of different lead concentration on the contents of MDA in kidney of S.meridionalis
2.6 水体中Pb暴露对南方鲇脑组织中乙酰胆碱酯酶(TChE)活性的影响
水体中铅暴露降低了南方鲇脑组织TChE活性,其活性随着Pb浓度升高逐渐降低,且显著低于对照组(P<0.05)(图7)。半持续组和持续组实验鱼脑组织中TChE活性显著低于对照组(P<0.05)。但相同浓度条件下,半持续组和持续组之间TChE活性无明显差异(P<0.05)。

图7 水体铅暴露对南方鲇脑乙酰胆碱酯酶活性的影响Fig.7 Effects of different lead concentration on the activity of Acetlcholinesterase (TChE)in brains of S.meridionalis
3 讨论
3.1 铅对南方鲇抗氧化能力的影响
重金属进入鱼体内后,会打破体内活性氧(ROS)产生和清除的平衡,引起ROS含量升高,发生氧化胁迫[2-4]。本研究结果表明恢复组实验鱼鳃、肝脏和肾脏组织中T-AOC、SOD、CAT活性随着Pb浓度升高表现出恢复效应,MDA含量也随浓度升高而升高,而GSH含量随浓度上升呈下降趋势;表明实验鱼在胚胎期受到重金属暴露,经过后期恢复实验鱼机体抗氧化系统的能力会进行自我调整来应对Pb暴露引起的ROS毒性胁迫作用,前人也有类似报道。克林雷氏鲶(Rhamdiaquelen)受重金属暴露后再恢复饲养,肝、鳃和肾组织中T-AOC、SOD、CAT活性同样表现出恢复的趋势[17]。
持续组和半持续组三种组织中T-AOC、SOD、CAT活性以及GSH含量随暴露浓度升高而逐渐降低,而MDA含量随水体中Pb浓度升高而升高,表现出浓度剂量效应。水体中重金属暴露降低了矛尾复鰕虎[18](Synechogobiushasta)、黄河鲤[19](Oreochromisniloticus)和金鱼[20](Carassiusauratus)肝、鳃和肾组织中T-AOC、CAT、SOD活性。牙鲆[5](Paralichthysolivaceus)、金头鲷[21](Sparusaurata)受重金属暴露会引起肝、肾组织中MDA含量升高,脂质过氧化程度加剧。重金属可以对T-AOC、SOD、CAT和GSH的合成过程产生抑制以及破坏其结构,进而对其活性产生不利影响[22]。此外,当重金属在鱼体内引起ROS的含量超过自身抗氧化系统解毒清除能力,各种抗氧化物质会消耗殆尽,造成抗氧化保护机制受损[2,5]。本研究中持续组和半持续组实验鱼肝、鳃和肾脏组织中T-AOC、SOD、CAT活性水平和MDA含量随着Pb浓度,表现出浓度剂量效应(图4-6)。这提示了重金属长期暴露后,会引起大量的Pb在体内组织中累积,引起ROS含量升高超过机体自身抗氧化解毒清除的水平,造成抗氧化调节机制受损,降低了实验鱼抗氧化系统的应激能力。
相同Pb浓度条件下,持续组实验鱼鳃、肝脏和肾脏组织中T-AOC、SOD、CAT活性以及GSH含量略低于半持续组,此外,这三种组织中MDA含量略高于半持续组,表明胚胎期和仔鱼期重金属暴露存在叠加效应;但这两个处理组中,相同浓度水平中同种酶之间差异未达显著水平,由于胚胎期卵膜可以阻滞大量的重金属进入胚胎,降低重金属对胚胎期的毒害作用[23-24],因此,胚胎期和仔鱼期受重金属暴露,其毒性影响主要发生在仔鱼期;再根据恢复组、半持续组和持续组结果比较,也支持了铅暴露引起实验鱼的氧化胁迫毒性作用主要发生在仔鱼期的观点。
3.2 铅对南方鲇脑神经系统的影响
乙酰胆碱酯酶(TChE)在鱼体正常的生理过程中,如捕猎食物、逃避捕食和发现异性等,具有重要作用。因此,常选取脑组织中TChE活性,来作为其受到污染物毒害作用的指标[25-26]。有研究表明,无论是单一金属还是混合金属暴露都会对TChE活性起抑制作用[11,27]。金头鲷在受到水体Pb暴露后,脑组织中TChE活性显著降低[21]。本研究中,南方鲇脑组织中TChE活性随着水体Pb浓度升高而降低,表明Pb引起鱼体神经系统中TChE活性降低,调节功能发生紊乱,对鱼体行为产生影响。而罗其勇等[24]在仔鱼急性实验研究中,观察到水体中Pb暴露会引起南方鲇仔鱼行为异常,且随着Pb浓度升高而更加明显,这些现象可能就是鱼体神经系统中毒而引起的运动失调和行为异常。
4 结论
恢复组实验结果表明,胚胎受铅暴露经过后期的恢复饲养,实验鱼鳃、肝脏和肾脏组织中T-AOC、SOD、CAT活性、GSH以及MDA含量表现出恢复效应,表明机体抗氧化的能力会进行自我调整来应对Pb暴露引起的毒性胁迫作用。
半持续暴露和持续组实验鱼鳃、肝脏和肾脏组织中T-AOC、SOD、CAT活性和GSH含量降低,MDA含量升高,均表现出浓度剂量效应,表明重金属长期慢性暴露会对实验鱼抗氧化系统的调节能力产生不利影响;胚胎期和仔鱼期重金属暴露存在叠加效应,且对仔鱼期的毒性作用更加剧烈。脑组织中乙酰胆碱酯酶(TChE)活性随暴露浓度升高而逐渐降低,这可能是重金属暴露引起仔鱼行为异常的重要原因之一。
[1]Rotilio G,Rossi L,De Martino A,et al.Free radicals,metal ions and oxidative stress:chemical mechanisms of damage and protection in living systems [J].J Braz Chem Soc,1995,6(3):221-227.
[2]Atli G,Canli M.Enzymatic responses to metal exposures in a freshwater fishOreochromisniloticus[J].Comp Biochem Physiol Part C:Toxicol Pharmacol,2007,145(2):282-287.
[3]Pandey S,Parvez S,Sayeed I,et al.Biomarkers of oxidative stress:a comparative study of river Yamuna fishWallagoattu(Bl.& Schn.)[J].Sci Total Environ,2003,309(1):105-115.
[4]Sevcikova M,Modra H,Slaninova A,et al.Metals as a cause of oxidative stress in fish:a review [J].Vet Med,2011,56(11):537-546.
[5]Cao L,Huang W,Liu J,et al.Accumulation and oxidative stress biomarkers in Japanese flounder larvae and juveniles under chronic cadmium exposure [J].Comp Biochem Physiol Part C:Toxicol Pharmacol,2010,151(3):386-392.
[6]Radi A A R,Matkovics B.Effects of metal ions on the antioxidant enzyme activities,protein contents and lipid peroxidation of carp tissues [J].Comp Biochem Physiol Part C:Comp Pharmacol,1988,90(1):69-72.
[7]Basha P S,Rani A U.Cadmium-induced antioxidant defense mechanism in freshwater teleostOreochromismossambicus(Tilapia)[J].Ecotoxicol Environ Safety,2003,56(2):218-221.
[8]谢小军.南方大口鲶的胚胎发育[J].西南师范大学学报(自然科学版),1986,(3):76-82.
[9]GB/T13267-1991.水质、物质对淡水鱼(斑马鱼)急性毒性测定方法[S].北京:中国标准出版社,1992:9-17.
[10]Mager E M,Esbaugh A J,Brix K V,et al.Influences of water chemistry on the acute toxicity of lead toPimephalespromelasandCeriodaphniadubia[J].Comp Biochem Physiol Part C:Toxicol Pharmacol,2010,153(1):82-90.
[11]Ellman G L,Courtney K D,Andres V,et al.A new and rapid colorimetric determination of acetylcholinesterase activity [J].Biochem Pharmacol,1961,7(2):88IN191-9095.
[12]Marklund S,Marklund G.Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase [J].The FEBS J,1974,47(3):469-474.
[13]Beers R F,Sizer I W.A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase [J].J Biol Chem,1952,195(1):133-140.
[14]Griffith O W.Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine [J].Anal Biochem,1980,106(1):207-212.
[15]Ohkawa H,Ohishi N,Yagi K.Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction [J].Anal Biochem,1979,95(2):351-358.
[16]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J].Anal Biochem,1976,72(1-2):248-254.
[17]Pretto A,Loro V L,Baldisserotto B,et al.Effects of water cadmium concentrations on bioaccumulation and various oxidative stress parameters inRhamdiaquelen[J].Arch Environ Contam Toxicol,2011,60(2):309-318.
[18]Liu X J,Luo Z,Li C H,et al.Antioxidant responses,hepatic intermediary metabolism,histology and ultrastructure inSynechogobiushastaexposed to waterborne cadmium [J].Ecotoxicol Environ Safety,2011,74(5):1156-1163.
[19]Dai W,Liu S,Fu L,et al.Lead (Pb)accumulation,oxidative stress and DNA damage induced by dietary Pb in tilapia (Oreochromisniloticus)[J].Aquacult Res,2012,43(2):208-214.
[20]Kong X,Jiang H,Wang S,et al.Effects of copper exposure on the hatching status and antioxidant defense at different developmental stages of embryos and larvae of goldfishCarassiusauratus[J].Chemosphere,2013,92(11):1458-1464.
[21]Souid G,Souayed N,Yaktiti F,et al.Lead accumulation pattern and molecular biomarkers of oxidative stress in seabream (Sparusaurata)under short-term metal treatment [J].Drug Chem Toxicol,2014,38(1):98-105.
[22]Verlecar X N,Jena K B,Chainy G B N.Biochemical markers of oxidative stress inPernaviridisexposed to mercury and temperature [J].Chemico-biol Interact,2007,167(3):219-226.
[23]Jezierska B,ugowska K,Witeska M.The effects of heavy metals on embryonic development of fish (a review)[J].Fish Physiol Biochem,2009,35(4):625-640.
[24]罗其勇,闫玉莲,李 健,等.水体中铅暴露对南方鲇(Silurusmeridionalis)胚胎发育和仔鱼存活的影响[J].西南师范大学学报(自然科学版),2015,40(5):67-74.
[25]Kozlovskaya V I,Mayer F L,Menzikova O V,et al.Cholinesterases of aquatic animals [J].Rev Environ Contam Toxicol,1993,132(132):117-142.
[26]Weis J S,Weis P.Effects of exposure to lead on behavior of mummichog (FundulusheteroclitusL.)larvae [J].J Exp Mar Biol Ecol,1998,222(1):1-10.
[27]Frasco M F,Fournier D,Carvalho F,et al.Do metals inhibit acetylcholinesterase (AChE)?Implementation of assay conditions for the use of AChE activity as a biomarker of metal toxicity[J].Biomarkers,2005,10(5):360-375.

