Miller-Fisher综合征与Guillain-Barré综合征非核心临床表现、电生理及脑脊液比较
朱莹 周夏俊 管阳太
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)是一种急性起病、单相病程的免疫相关性神经根神经病[1],于1916年首先由Guillain报道,20年后Miller-Fisher描述了Miller-Fisher综合征(Miller-Fisher syndrome,MFS)的三联征,并将之称为GBS的变异型。既往研究认为MFS是GBS的特殊形式,两者病理机制基本一致。随着GQ1b等抗体的报道[2-3],提示MFS可能存在与GBS不同的病理机制。同时,一些学者发现在电生理表现方面,GBS的诊断标准并不适用于MFS患者,应该寻找更适合MFS的电生理诊断标准[4-7]。2014年由多国专家组成的分类组制定并发表了GBS谱系疾病诊断标准[1],首先由于GBS和MFS均为急性起病单相病程的免疫相关疾病,累及周围神经,且易出现脑脊液蛋白细胞分离,故将GBS和MFS归于同一个疾病谱,但是两者又有不同的核心临床表现,所以分为两个不同的亚型;专家组又同时提出GBS谱系疾病各亚型的表现并未在细节方面得到完善,自然病程特点尚有待总结。本研究对MFS与GBS患者在非核心临床表现、电生理和脑脊液检查结果的差异进行分析,以期更好地鉴别和认识GBS谱系疾病中这两类主要亚型。
1 对象和方法
1.1对象收集仁济医院2013-01—2017-03收治的MFS和经典GBS患者共116例,其中MFS 37例,年龄 24~77岁,平均(52.9±14.1)岁;典型GBS患者79例,年龄26~81岁,平均(53.9±14.6)岁。所有患者符合2014年多国专家分类组制定的GBS-MFS诊断标准[1]。(1)GBS诊断标准为:单相病程,急性起病,症状达峰时间12 h至28 d,对称性肢体麻木及乏力,可有脑神经受累,除外其他疾病;(2)MFS诊断标准为:单相病程,急性起病,症状达峰时间12 h至28 d,表现为急性共济失调、眼球活动异常、腱反射降低,且没有肌力减弱及嗜睡,除外其他疾病。
1.2方法回顾性收集患者的临床表现、电生理检查以及脑脊液检查结果资料。
1.2.1非核心临床表现:除GBS和MFS各自的核心临床表现外,对两组患者的非核心临床表现(包括前驱感染、面瘫、吞咽、构音、呼吸受累、浅感觉异常及高峰期的神经功能损害程度)进行分析,其中浅感觉异常以患者主观感受为准。高峰期的神经功能损害程度评分采用Hughes评分(Hughes scores)[8],Hughes评分≥3分提示预后不良[9]。
1.2.2电生理检查:患者均在发病2周内完成神经传导速度和肌电图检查。采用Medtronic Keypoint肌电图诊断仪,体表温度保持在34℃以上,以表面电极作记录。神经传导检查各检测4条感觉神经(右侧正中神经、尺神经、腓浅神经和左侧腓肠神经)和4条运动神经(右侧正中神经、尺神经、腓总神经和左侧胫神经)的远端潜伏期、神经传导波幅、神经传导速度。每条运动神经均加测F波,每例患者均检查双侧胫神经H反射。感觉传导检查采用正向法,记录感觉负峰波幅。以作者医院肌电图室的正常参考值为判断标准。神经传导波幅或传导速度低于正常或未引出即定义为异常。感觉异常即至少存在一根感觉神经异常,运动异常即至少存在一根运动神经异常。
1.2.3脑脊液检查:57例GBS患者和28例MFS患者于发病3周内行腰穿脑脊液检查,比较两组患者脑脊液蛋白水平及蛋白/细胞分离情况。
1.3统计学处理采用SPSS19.0统计软件进行统计分析,计量资料以均数±标准差表示,两均数间比较采用t检验;计数资料采用卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1非核心临床表现在前驱感染方面,MFS患者呼吸道感染发生率高于GBS患者(P<0.05),而GBS患者腹泻发生率高于MFS组(P<0.01);MFS组也可出现浅感觉障碍,但较GBS组出现率低(P<0.05);MFS组患者未出现面瘫,而GBS组面瘫出现率为21.5%,两组间比较差异有统计学意义(P<0.05)。MFS组高峰期Hughes评分≥3分者发生率低于GBS组(P<0.01)。两组在构音障碍、吞咽困难、呼吸受累方面比较无统计学差异(P>0.05)。结果见表1。
2.2电生理表现典型GBS患者肌电图更多累及运动神经,表现为感觉及运动神经传导同时异常或单纯运动传导异常;MFS患者肌电图很少累及运动神经,更多表现为单纯H反射异常、单纯感觉传导异常或正常肌电图表现。GBS组F波异常率为82.3%,高于MFS组的5.4%(P<0.05)。具体结果见表2。
2.3脑脊液蛋白水平分析GBS组患者蛋白细胞分离出现率及脑脊液蛋白水平均高于MFS组(均P<0.01)。GBS和MFS组发病后至腰穿的时间间隔及年龄比较差异无统计学意义(均P>0.05)。具体结果见表3。
3 讨论
本研究结果发现典型GBS和MFS在非核心临床表现、电生理及脑脊液结果均存在明显不同。
3.1非核心临床表现除2014年新的诊断标准[1]中典型GBS和MFS的核心临床表现不同外,非核心临床表现亦有不同。首先,在前驱感染方面,本研究结果显示呼吸道感染多出现在MFS患者,腹泻多出现在GBS患者。考虑其原因主要是由于GBS组中包含轴索型患者,此类患者的发病可能与空肠弯曲菌感染有关,故腹泻较多见[10-11]。其次,非核心症状方面,浅感觉异常尽管在MFS组及典型GBS组均可出现,但MFS组更为少见。面瘫仅出现在GBS组。MFS患者中GT1b及GQ1b抗体阳性率较高,上述抗体在支配眼球活动的脑神经上有分布,在面神经及周围无髓感觉纤维上无分布,故MFS患者易出现眼球活动障碍[12-13],
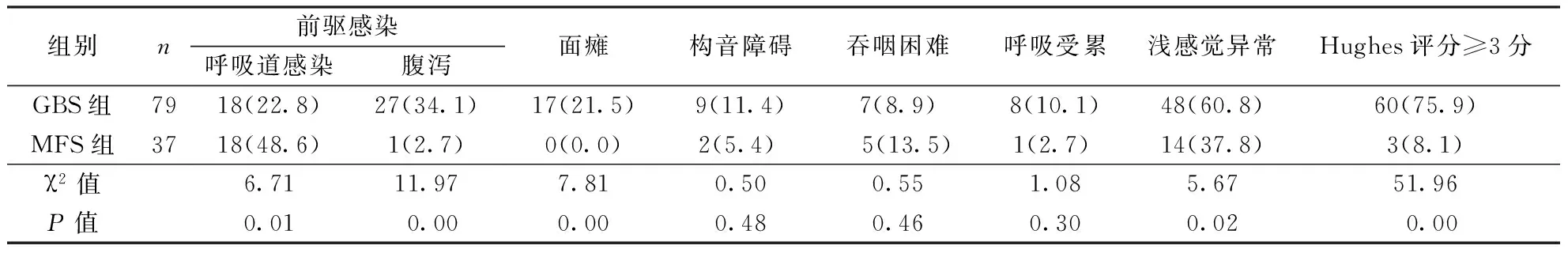
表1 两组临床特征比较〔n(%)〕
注:GBS:吉兰-巴雷综合征,MFS:Miller-Fisher综合征;表2、3同
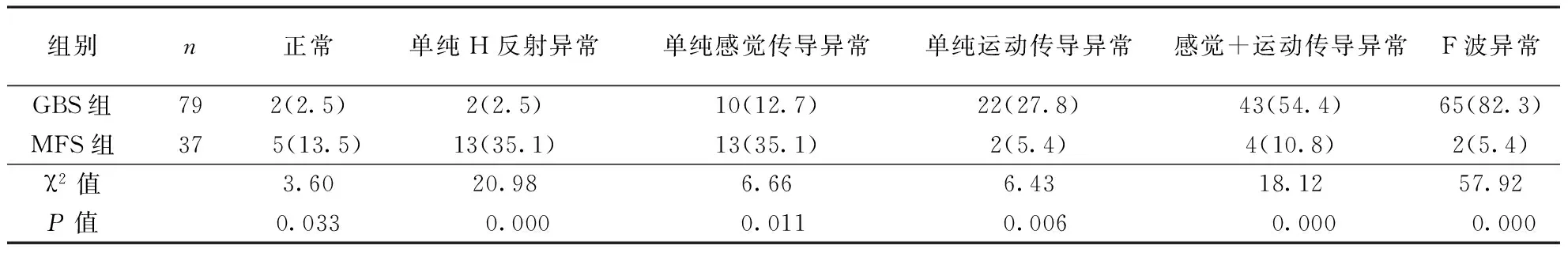
表2 两组患者肌电图表现比较〔n(%)〕
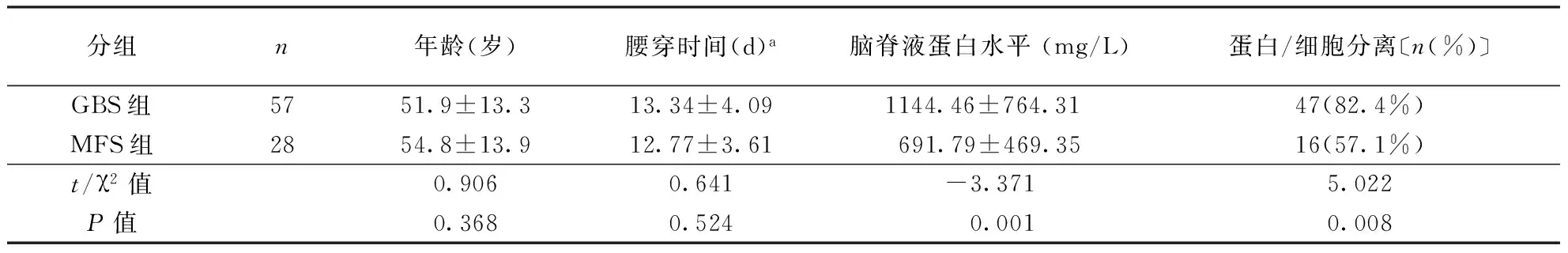
表3 两组年龄及脑脊液检查等结果比较
注:a为患者发病至行腰穿的时间间隔
而不易累及浅感觉及面神经。另外,本研究发现在疾病高峰期,GBS组Hughes评分≥3分者发生率更高,提示其残疾程度更重。Hiew等[4]发现42例GBS患者中Hughes评分≥3分者占30例,而6例MFS患者中未发现Hughes评分≥3分者。Yuki[14]通过观察92例MFS患者的治疗效果甚至发现,MFS患者使用丙种球蛋白后其恢复速度与自然康复无统计学差异。提示与MFS患者比较,GBS患者更需要积极地治疗,对两者的诊断及鉴别诊断具有重要意义。
3.2电生理方面本研究结果显示,GBS组主要表现为感觉及运动神经传导同时出现异常或单纯的运动神经传导异常,而MFS主要表现为单纯H反射异常、单纯感觉传导异常或神经传导完全正常。1958年MFS作为GBS的亚型,主要依据临床诊断,其电生理表现并不明确。随着研究的深入,较多学者提出MFS患者有其不同于GBS患者的电生理表现。Lyu等[15]研究结果显示,55例MFS患者中24例患者存在单纯感觉传导异常,31例患者神经传导完全正常。Kuwabara等[5]认为MFS患者会出现H反射异常,也可出现感觉波幅降低,但感觉神经传导速度不受影响,且很少有运动神经异常(包括F波)的报道。而Rajabally等[16]则提及GBS电生理累及运动神经更为常见的结论。本研究与上述研究结论相符。
导致GBS和MFS电生理表现差异的原因与各自致病机制有关[5,12]。MFS目前被认为与GQ1b抗体密切相关。GQ1b抗体选择性损害背根神经节、眼球运动神经、肌梭及Ia神经元[6-7](腱反射传入快纤维),很少在运动神经上表达[11]。背根神经节损害可导致感觉传导异常,Ia神经元受损可出现单纯H反射异常而感觉传导正常;而肌梭和眼球活动异常不能被电生理检查手段发现,因此其电生理检查结果可完全正常。多位学者[11,13,17]研究认为GBS患者也存在GM1、GD1a等抗体介导致病,这些抗体存在于神经轴索、末梢及前根,可导致GBS患者肌力减退,故而出现运动神经传导异常及F波异常。
3.3脑脊液检查本研究结果显示MFS组蛋白细胞分离出现率及蛋白水平均低于GBS组。van den Berg等[18]研究认为GBS患者发病第1周蛋白细胞分离率约50%,第2周约80%。本研究行腰穿检查多于患者发病近2周时完成,故蛋白细胞分离率较高。GBS是由免疫介导的急性脊神经根和周围神经炎症,神经根穿过脑脊液,所以脑脊液中蛋白增高[18-19]。Gonzalez-Quevedo等[20]研究发现脑脊液蛋白水平增高与神经根炎症程度平行,与临床严重程度相关。多项研究认为脑脊液总蛋白水平增高提示抗体、补体及神经系统炎性疾病所致的髓鞘崩解产物沉积[10,21-22]。GQ1b作用的靶点主要在肌梭、背根神经节及眼球运动神经,MFS患者脊神经根并不受累,仅脑神经受累可导致脑脊液蛋白升高;而GBS患者脊神经根受累显著,故蛋白升高也远较MFS患者显著[11]。
综上所述,尽管GBS和MFS属于同一疾病谱,均为急性起病、单相病程的免疫相关疾病,但高峰期GBS患者Hughes评分≥3分(提示预后不良[9])者较MFS者更多,残疾更重,需要尽早准确鉴别。除公认的GBS与MFS特殊的核心临床表现外,两者的非核心临床表现、脑脊液和电生理检查结果均存在一定差异,认识这些差异有利于更好地理解新的诊断标准,也有助于两者的诊断和鉴别。
[1]Wakerley BR,Uncini A,Yuki N. Guillain-Barré and Miller Fisher syndromes—new diagnostic classification[J]. Nat Rev Neurol,2014,10(9):537-544.
[2] Shahrizaila N,Yuki N. Bickerstaff brainstem encephalitis and Fisher syndrome:anti-GQ1b antibody syndrome[J]. J Neurol Neurosurg Psychiatry,2013,84(5):576-583.
[3] Ito M,Kuwabara S,Odaka M,et al. Bickerstaff’s brainstem encephalitis and Fisher syndrome form a continuous spectrum:clinical analysis of 581 cases[J]. J Neurol,2008,255(5):674-682.
[4] Hiew FL,Ramlan R,Viswanathan S,et al. Guillain-Barré syndrome,variants & forms fruste:Reclassification with new criteria[J]. Clin Neurol Neurosurg,2017,158:114-118.
[5] Kuwabara S,Sekiguchi Y,Misawa S. Electrophysiology in Fisher syndrome[J]. Clin Neurophysiol,2017,128(1):215-219.
[6] Dachy B,Deltenre P,Deconinck N,et al. The H reflex as a diagnostic tool for Miller Fisher syndrome in pediatric patients[J]. J Clin Neurosci,2010,17(3):410-411.
[7] Sekiguchi Y,Misawa S,Shibuya K,et al. Patterns of sensory nerve conduction abnormalities in Fisher syndrome:more predominant involvement of group Ia afferents than skin afferents[J]. Clin Neurophysiol,2013,124(7):1465-1469.
[8] Gupta D,Nair M,Baheti NN,et al. Electrodiagnostic and clinical aspects of Guillain-Barré syndrome:An analysis of 142 cases[J]. J Clin Neuromuscul Dis,2008,10:42-51.
[9] 郑珊珊,赵佩佩,臧丽丽,等.Guillain-Barré综合征预后的评估及其预测因素[J].临床神经病学杂志,2014,3(27):232-234.
[10] Sahin S,Cinar N,Karsidag S. Are cerebrospinal fluid protein levels and plasma neutrophil/lymphocyte ratio associated with prognosis of Guillain-Barré syndrome?[J].Neurol Int,2017,9(2):7032.
[11] Willison HJ,Jacobs BC,van Doorn PA. Guillain-Barré syndrome[J]. Lancet,2016,388(10045):717-727.
[12] 王志丽,杨利,谭利明.Miller Fisher综合征和Bickerstaff脑干脑炎:抗GQ1b抗体综合征[J]?中国神经免疫学和神经病学杂志,2014,3(21):130-137.
[13] Fukami Y,Wong AH,Funakoshi K,et al. Anti-GQ1b antibody syndrome:anti-ganglioside complex reactivity determines clinical spectrum[J]. Eur J Neurol,2016,23(2):320-326.
[14] Yuki N. Fisher syndrome and Bickerstaff brainstem encephalitis (Fisher-Bickerstaff syndrome) [J]. J Neuroimmunol,2009,215(1-2):1-9.
[15] Lyu RK,Chang KH,Chu CC,et al. Sensory conduction study in fisher syndrome:patterns of abnormalities and their clinical correlation[J]. Eur Neurol,2013,70(1-2):27-32.
[16] Rajabally YA,Durand MC,Mitchell J,et al. Electrophysiological diagnosis of Guillain-Barré syndrome subtype:could a single study suffice?[J]. J Neurol Neurosurg Psychiatry,2015,86(1):115-119.
[17] Greenberg MI,Vearrier D. Guillain-Barré syndrome[J]. N Engl J Med,2012,367(10):974.
[18] van den Berg B,Walgaard C,Drenthen J,et al. Guillain-Barré syndrome:pathogenesis,diagnosis,treatment and prognosis[J]. Nat Rev Neurol,2014,10(8):469-482.
[19] Steiner I,Rosenberg G,Wirguin I. Transient immuno-suppression:a bridge between infection and the atypical autoimmunity of Guillain-Barré syndrome?[J]. Clin Exp Immunol,2010,162(1):32-40.
[20] Gonzalez-Quevedo A,Carriera RF,O’Farrill ZL,et al. An appraisal of blood-cerebrospinal fluid barrier dysfunction during the course of Guillain-Barré syndrome[J]. Neurol India,2009,57(3):288-294.
[21] Goverman J. Autoimmune T cell responses in the central nervous system[J]. Nat Rev Immunol,2009,9(6):393-407.
[22] Kahlmann V,Roodbol J,van Leeuwen N,et al. Validated age-specific reference values for CSF total protein levels in children[J]. Eur J Paediatr Neurol,2017,21(4):654-660.

