Mn-ZnS量子点室温磷光检测尿液中硫酸庆大霉素
王 娅,庄布军,吴伯岳,高卫真,
(1.天津医科大学第二医院药学部,天津300211;2.天津医科大学药理学系,天津300070;3.天津医科大学药学院,天津300070)
氨基糖苷类抗生素以其抗菌活性高、抗菌谱广且水溶性好[1]等优点被广泛应用于临床。其中硫酸庆大霉素是常用的该类药物之一,主要用于革兰阴性菌感染的治疗[2]。但其耳毒性和肾毒性[3-4]是制约该药物临床使用的重要因素。硫酸庆大霉素的血药浓度与其毒性密切相关[5],中毒的谷浓度仅为2 mg/L[6],其药代动力学存在较为明显的个体差异,患者的感染程度、年龄和肾功能状况等都会改变其血药浓度[7]。因此,为了保证患者用药的安全性和有效性,有必要进行治疗药物监测(TDM),为制定个体化给药方案提供依据[8]。目前液相色谱-质谱联用法[9]、高效液相色谱法[10-11]是较为常用的检测硫酸庆大霉素浓度的方法。但这些方法成本较大且操作比较复杂繁琐[12]。荧光检测是常用的定量分析方法,具有准确、灵敏及操作简便等优点,而磷光具有较荧光更长的寿命,可以更有效地避免生物体液的自发荧光等的干扰[13]。量子点是一种半导体纳米微晶,因其良好的耐光漂白性、吸收光谱宽、发射光谱窄等[14]优点,被广泛应用于荧光检测,Mn掺杂的ZnS量子点具有室温磷光性质,故本实验基于硫酸庆大霉素对其磷光的敏化作用建立一种简便、灵敏且线性范围广的检测硫酸庆大霉素的方法。
1 材料与方法
1.1 材料
1.1.1 实验试剂 实验用水为娃哈哈纯净水,所有化学试剂的纯度至少是分析纯。所用试剂及其供应源:硫酸庆大霉素(上海晶纯生化科技股份有限公司,上海,规格:1 g),硫酸庆大霉素注射液(江苏康宝制药有限公司,江苏,规格:2 mL),无水乙醇(天津市光复科技发展有限公司,天津,规格:500 mL),氢氧化钠(NaOH,天津市光复科技发展有限公司,天津,规格:500 g),乙酸锰[Mn(Ac)2,天津市光复科技发展有限公司,天津,规格:500 g],二水合乙酸锌[Zn(Ac)2·2H2O,上海萨恩化学技术有限公司,上海,规格:500 g],巯基丙酸(MPA,上海萨恩化学技术有限公司,上海,规格:100 mL),硫化钠(天津市风船化学试剂科技有限公司,天津,规格:500 g),Tris-HCl缓冲溶液(1×10-2mol/L,pH=7.4,配制:10 mL 0.1 mol/L三羟甲基氨基甲烷(Tris)溶液与42.0 mL 0.1 mol/L盐酸混匀,用HCl调pH至7.4并用水定容至100.0 mL容量瓶,密闭保存于室温中待用)。
1.1.2 实验仪器 F-380荧光分光光度计(天津市港东科技股份发展有限公司,天津),JA5003A电子精密天平(上海精天电子仪器有限公司,上海),真空干燥箱(上海一恒科学仪器有限公司,上海),X85-2S恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司,上海)。
1.2 方法
1.2.1 量子点(quantum dots,QDs)的合成 参考已发表的文献[15-16],用以指导Mn掺杂ZnS QDs的合成。在100 mL三颈烧瓶中加入50 mL 4×10-2mol/L的MPA,2 mL 1×10-2mol/L 的 Mn(Ac)2和 5 mL 0.10mol/L的Zn(Ac)2水溶液。用1 mol/L的NaOH溶液调节pH=11,室温磁力搅拌并用氩气脱氧30 min,之后将新配制的Na2S溶液(5 mL 0.10 mol/L)用注射器加入到三颈烧瓶中。继续通氩气20 min,随后将反应液在50℃中陈化2 h。将所得QDs溶液使用等体积无水乙醇进行沉淀、离心并在室温下置于真空干燥箱中干燥24 h,制备水溶性良好的Mn掺杂ZnS QDs粉末。最后把干燥的QDs粉末在水中复溶,即得到QDs的水溶液。
1.2.2 硫酸庆大霉素标准溶液和注射液的配制 于电子天平上准确称量100.00 mg硫酸庆大霉素溶于烧杯中,超声5 min待完全溶解后定容于100.0 mL的容量瓶中,配制成硫酸庆大霉素初浓度C0=1.0×103mg/L。超声后静置,待溶液分散均匀后,用水稀释,配制为C1=20 mg/L的硫酸庆大霉素储备溶液备用。用倍比稀释法将1支2 mL 8万单位(80 mg)的硫酸庆大霉素注射液依次稀释,至终浓度C2=20 mg/L备用。
1.2.3 硫酸庆大霉素的检测 向一系列10 mL比色管中依次加入0.50 mLTris-HCl(pH=7.4,0.01 mol/L)、0.50mLMPA包裹的Mn掺杂ZnSQDs(C=0.20mg/L)、不同浓度的硫酸庆大霉素储备溶液(使最终浓度 依 次 为 C=0.10,0.50,1.00,2.00,5.00,10.00 mg/L)、然后用水定容至5.0 mL。于室温下静置30 min,以310 nm为激发波长,选择激发和发射的狭缝宽度分别为10 nm和20 nm,PMT电压为700 V,测定560~610 nm范围内的磷光光谱,并做出相对磷光强度与硫酸庆大霉素浓度的标准曲线。
1.2.4 尿样中硫酸庆大霉素的检测 尿样采自于健康志愿者人群,检测前不做任何处理。向10mL比色管中依次加入 Tris-HCl(0.50mL,pH=7.4,1×10-2mol/L)、MPA 包裹的 Mn掺杂ZnS QDs(0.50 mL,0.20 mg/L)、不同浓度的硫酸庆大霉素溶液、尿液(1×10-2mL),然后用水定容至5.0 mL,室温静置30 min,以310 nm为激发波长,选择激发和发射的狭缝宽度分别为10nm和20 nm,PMT电压为700 V,测定560~610 nm范围内的磷光光谱。本实验平行测定3次,将测到的磷光光谱数据代入已做出的标准曲线中,即可得到尿样中硫酸庆大霉素的浓度。
1.2.5 硫酸庆大霉素注射液的检测 与尿样中硫酸庆大霉素的检测中其他条件完全相同,将尿液和不同浓度的硫酸庆大霉素替换为对应浓度的硫酸庆大霉素注射液。同样进行平行测定3次。
2 结果
2.1 影响磷光检测的因素
2.1.1 缓冲溶液类型对室温磷光检测的影响 为了考察缓冲溶液对室温磷光检测的影响,本实验对实验室常用的PBS、Tris-HCl缓冲溶液中的磷光相对强度进行检测。由图1可知,在Tris-HCl缓冲体系中,磷光增敏的程度比较大,灵敏度相对较高。
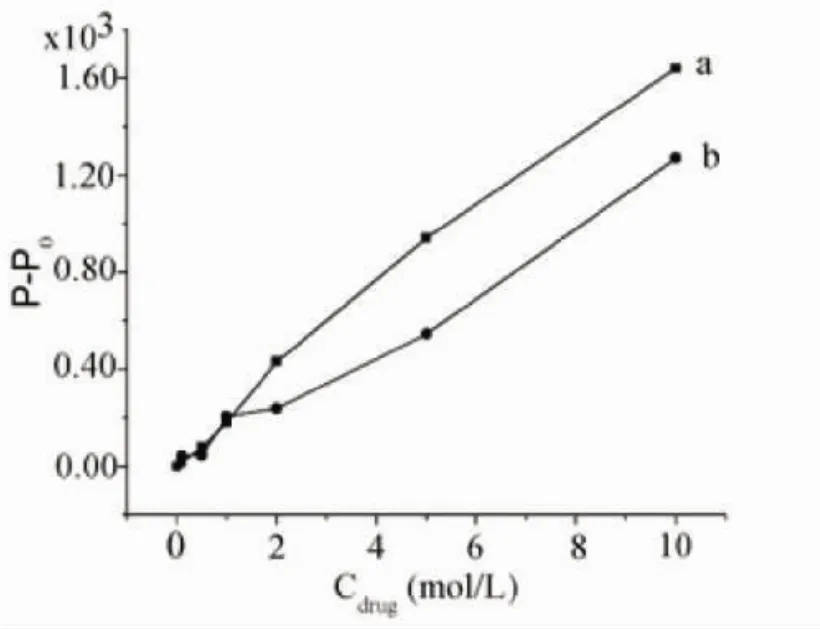
图1 缓冲溶液类型对磷光检测的影响Fig 1 Effect of the type of buffer on the phosphorescence detection
2.1.2 缓冲溶液pH对室温磷光检测的影响 在影响QDs强度与稳定性的因素中,溶液的pH最为重要。本实验考察了在其他条件不变时,反应体系pH值在5.0~9.5范围内检测体系的稳定性。由图2可知,溶液pH在7.0~7.5之间时,磷光强度虽相比于其它pH较低,但QDs的磷光强度具有较好的稳定性。
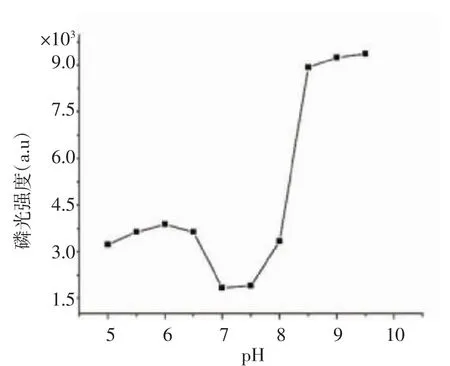
图2pH对Mn掺杂ZnS QDs稳定性的影响Fig 2 Effect of pH on the RTP stability of the Mn-doped ZnS QDs
2.1.3 体系反应时间对室温磷光检测的影响 考察不同反应时间下,硫酸庆大霉素对体系磷光强度的影响。其他条件不变时,测量反应体系静置10~50 min内磷光强度的变化,每隔5 min测量1次。由图3可知,静置时间在30 min左右时,磷光强度开始变得稳定,且在随后的20 min内保持稳定。
2.1.4 QDs浓度对室温磷光检测的影响 在保证其他条件不变,一定浓度硫酸庆大霉素存在的情况下,我们加入不同浓度的QDs并检测其磷光强度。低浓度的硫酸庆大霉素会对Mn掺杂ZnS QDs产生磷光增敏。但当Mn掺杂ZnS QDs的浓度过高或者过低时,硫酸庆大霉素引起磷光的增敏都会大大降低(图4)。当Mn掺杂ZnS QDs的浓度为2×10-2mg/L左右时,其磷光强度增强幅度较大。

图4QDs浓度对Mn掺杂ZnS QDs相对磷光强度的影响Fig 4 Effect of QDs concentration on the relative phosphorescence intensity of the Mn-doped ZnS QDs
2.1.5 溶液加入顺序对室温磷光检测的影响 比色管中含有以下成分:Mn掺杂ZnS QDs溶液、硫酸庆大霉素溶液、Tris-HCl缓冲溶液、尿液以及水溶液,分别以3种不同的顺序加入到比色管中,静置30 min后测量磷光强度。结果显示,加入顺序对磷光检测体系几乎没有影响(图5)。本实验选择的顺序是先加入Tris-HCl缓冲溶液,再加入Mn掺杂ZnS的QDs溶液、硫酸庆大霉素溶液,尿液,最后用水定容至比色管刻度。
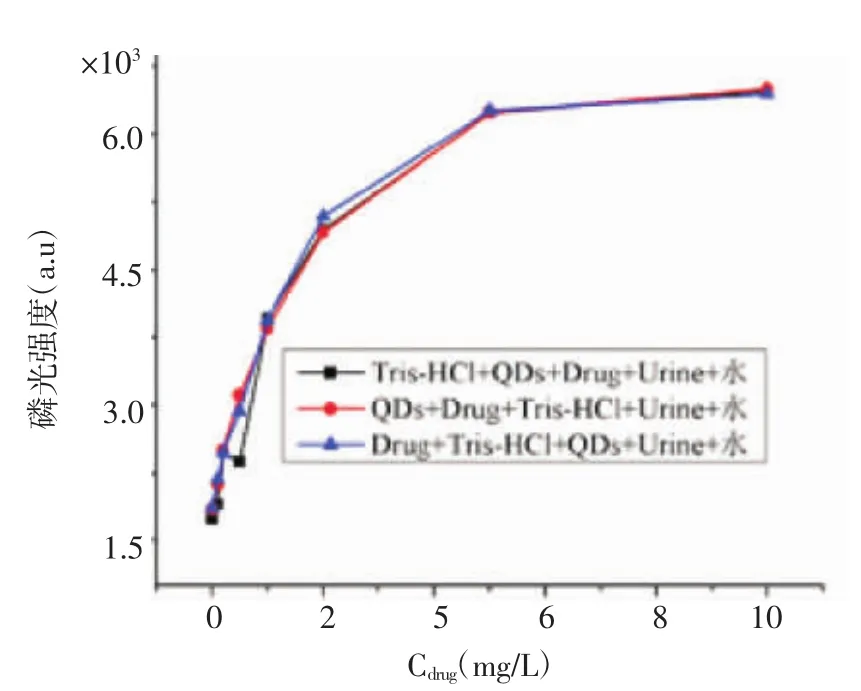
图5 加入顺序对磷光检测体系的影响Fig 5 Effect of the order of addition on the phosphorescence detection system stability
2.1.6 共存离子对室温磷光检测的影响 考察了几种常见的离子对Mn掺杂ZnS QDs磷光检测硫酸庆大霉素的影响。当硫酸庆大霉素的浓度为0.20 mg/L 时,500 倍的 Na+、K+,5 倍的 Ca2+、Mg2+对其室温磷光强度影响均不大(表1)。
2.2 Mn掺杂ZnS QDs对硫酸庆大霉素的磷光响应 在pH=7.4的Tris-HCl缓冲体系中检测,于室温下放置30 min。不同浓度硫酸庆大霉素的加入对Mn掺杂ZnS QDs磷光发射光谱的影响如图6所示。由图6 A可知,随着硫酸庆大霉素浓度的增加,Mn掺杂ZnS QDs的磷光峰值显著升高;由图6 B可知,校正曲线(y=3.85×10-4x+1.54×10-4)的线性范围为 0.10~10.00 mg/L,R2=0.998 5。

表1 共存离子的影响Tab 1 Effect of coexisting ions
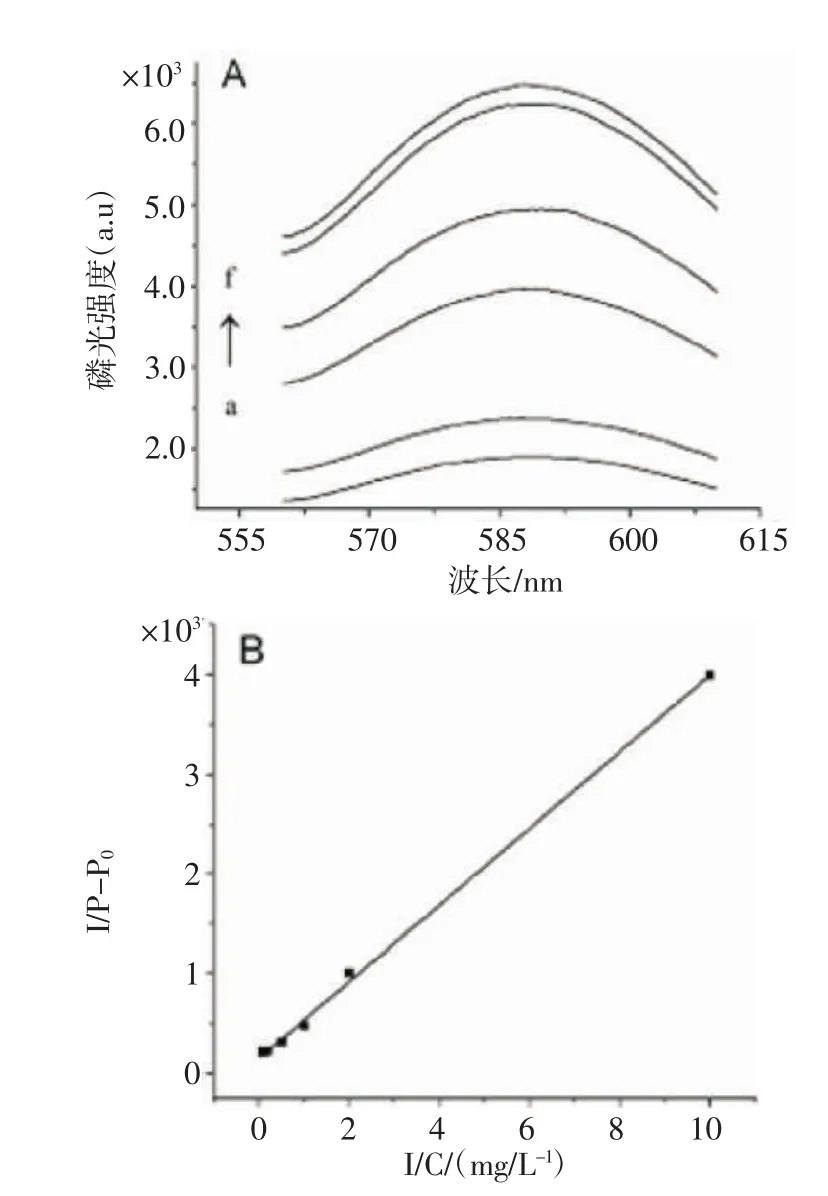
图6 不同浓度硫酸庆大霉素对Mn掺杂ZnS QDs磷光光谱(A)和标准曲线(B)的影响Fig6 Influence of the concentration of added gentamicin sulfate on the phosphorescence spectra(A)and on the calibration curve(B)of the Mn-doped ZnS QDs
2.3 Mn掺杂ZnS QDs对硫酸庆大霉素的测定 在荧光分光光度计上选择激发波长310 nm、发射波长560~610 nm进行磷光扫描,并测定最大发射波长下的磷光强度,再将最大磷光强度代入校正曲线中(y=3.85×10-4x+1.54×10-4)计算尿液中硫酸庆大霉素以及硫酸庆大霉素注射液浓度,结果列于表2。
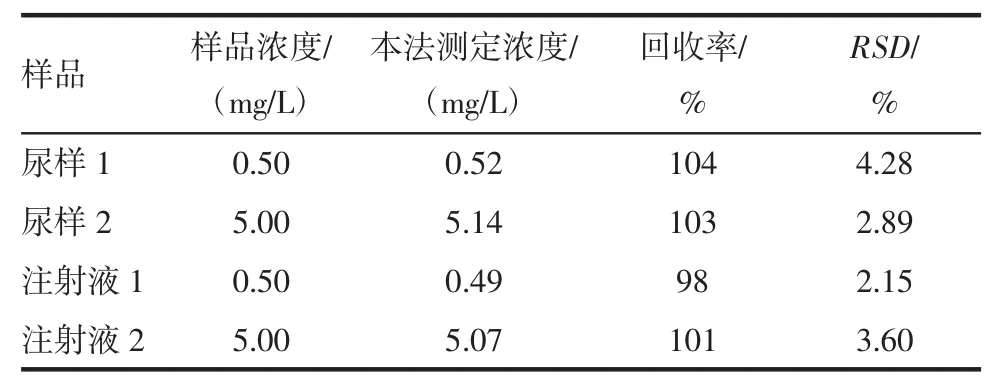
表2 硫酸庆大霉素测定结果Tab 2 Results for determination of gentamicin sulfate
3 讨论
本实验先对有可能影响QDs在检测体系中稳定性和磷光强度的因素进行了考察,验证了缓冲溶液pH及类型、体系反应时间、QDs的浓度及溶液加入顺序等条件对检测体系的影响。该QDs用于检测硫酸庆大霉素浓度,需要保证其磷光强度和稳定相较好的反应体系,由图1可知,不同类型的缓冲溶液对Mn掺杂ZnS QDs磷光强度的影响存在差别,本实验最终选用Tris-HCl作为缓冲溶液。由图2可知,体系的pH对Mn掺杂ZnS QDs稳定性和磷光强度影响很大,pH过大或者过小QDs的磷光强度均不稳定,而硫酸庆大霉素为酸性溶液,不同浓度的硫酸庆大霉素溶液会使体系的pH产生变化,因此需要加入适当的缓冲溶液维持体系在一个相对稳定的pH环境中。同时,由于硫酸庆大霉素对Mn掺杂ZnS QDs的磷光存在增敏效果,为了获得更高的灵敏度,应该尽可能降低空白样品(只含有QDs而不含有被测物)的磷光强度。因此,本实验选用的反应体系为pH=7.4的Tris-HCl溶液,由图3可知,QDs在体系中静置时间较短时,其磷光强度呈不规则变化,这是由于反应时间短,QDs和硫酸庆大霉素的相互作用不充分,反应时间在30~50 min时磷光强度相对稳定,而时间过长,又违背了快速检测原则,基于此本实验选择的体系反应时间为30 min。由图4可知,QDs浓度过低时,硫酸庆大霉素引起磷光增敏的灵敏度会大大降低;而浓度过高时,随着药物浓度的增加,磷光强度会超出磷光测量的最大范围,同时QDs也会发生自淬灭现象,导致灵敏度也会降低,因此本实验选择2×10-2mg/L的Mn掺杂ZnS QDs用于硫酸庆大霉素的室温磷光检测。由图5及表1可知,溶液的加入顺序和共存离子对Mn掺杂ZnS QDs的室温磷光检测结果影响不大。由图6A可知,硫酸庆大霉素对Mn掺杂ZnS QDs的磷光强度存在明显的增敏作用。硫酸庆大霉素的浓度与QDs的磷光强度成良好的线性关系,其线性范围为 0.10~10.00 mg/L,R2=0.998 5(图 6B)。基于此建立了一种高灵敏度且简便的硫酸庆大霉素的检测方法。庆大霉素在人体内几乎不被代谢,大多是以原型从尿中排出体外,因此尿液药物浓度可高达100.0 mg/L[13]。由表2可知,用该方法可以测定尿液中硫酸庆大霉素以及硫酸庆大霉素注射液的浓度。尿样的采集无创且便捷,如果可以用尿药浓度间接反映血药浓度,从而指导患者用药,将大大降低患者反复取血的痛苦等缺点。至于尿药浓度是否可反映血药浓度的变化情况需进一步研究。关于血药浓度与尿药浓度对比实验,是我们下一步将要展开的工作。本文基于硫酸庆大霉素对Mn掺杂ZnS QDs的磷光增敏现象,建立了一种简便、快速测定尿液硫酸庆大霉素浓度的新方法,该方法有望用于生物体液中硫酸庆大霉素的检测。
[1] 朱立勤,娄建石,焦建杰,等.庆大霉素不同给药方案的药代动力学和肾功能损害的实验研究[J].中国药理学通报,2006,22(8):1009
[2] Garneau-Tsodikova S,Labby K J.Mechanisms of resistance to aminoglycoside antibiotics:Overview and perspectives[J].Medchemcomm,2016,7(1):11
[3] Li J,Woo C W.Finding ways to solve or preventaminoglycoside-inducedototoxicity[J].Ann Transl Med,2016,4(24):533
[4] Gerlach A T,Stawicki S P,Cook CH,et al.Risk factors for aminoglycoside-associated nephrotoxicity in surgical intensive care unit patients[J].Int J Crit Illn Inj Sci,2011,1(1):17
[5] Touw D J,Westerman E M,Sprij A J.Therapeutic drug monitoring of aminoglycosides in neonates[J].Clin Pharmacokinet,2009,48(2):71
[6] 曾萍,杨镒宇,陶建平,等.危重病患儿口服庆大霉素血药质量浓度监测的意义[J].实用儿科临床杂志,2006,21(6):339
[7] 彭小林,范亚新,张亮,等.氨基糖苷类抗生素治疗药物浓度监测的研究进展[J].中国感染与化疗杂志,2017,17(1):104
[8] Mahmoudi L,Mohammadpour A H,Ahmadi A,et al.Influence of sepsis on higher daily dose of amikacin pharmacokinetics in critically ill patients[J].Eur Rev Med Pharmacol Sci,2013,17(3):285
[9]Rodriquez M,Cretoso D S,Euterpio M A,et al.Fast determination of underivatized gentamicin C components and impurities by LC-MS using a porous graphitic carbon stationary phase[J].Anal Bioanal Chem,2015,407(25):7691
[10]李玮,胡昌勤,王明娟.高效液相色谱法测定庆大霉素C组分的不同检测方式测定结果的比较[J].色谱,2007,25(4):557
[11]杨利红,常艳,姚尚辰,等.HPLC法同时测定庆大霉素的组分纯度和效价活性[J].药学学报,2012,12:105
[12]潘进,邱凌峰,方圣琼,等.衍生化紫外分光光度法测定硫酸庆大霉素含量[J].环境工程,2015,33:295
[13]Tan L,Li Y,Tang Y,et al.Room temperature phosphorescence sensor for Hg2+based on Mn-doped ZnS quantum dots[J].J Nanosci Nanotechnol,2012,12(10):7788
[14]Zhao M X,Zeng E Z.Application of functional quantum dot nanoparticles as fluorescence probes in cell labeling and tumor diagnostic imaging[J].Nanoscale Res Lett,2015,10(1):171
[15]Wu P,He Y,Wang H F,et al.Conjugation of glucose oxidase onto Mn-doped ZnS quantum dots for phosphorescent sensing of glucose in biological fluids[J].Anal Chem,2010,82(4):1427
[16]Zhang Z,Miao Y,Zhang Q,et al.Facile and sensitive detection of protamine by enhanced room-temperature phosphorescence of Mndoped ZnS quantum dots[J].Anal Biochem,2015,478:90

