组蛋白甲基转移酶EZH2抑制剂联合抗癌药物对膀胱癌细胞功能影响的研究
孟旭英,李珍瑾,郭剑超
(天津医科大学第二医院内分泌科,天津 300211)
膀胱癌是泌尿系统最严重肿瘤之一,排在十大常见肿瘤的第9位,几乎可以发生在任何年龄,儿童中也时有发生[1]。年龄越大,膀胱癌的发病率也越高,以50~70岁为最高,其中男性发病率高于女性3~4倍,在三大泌尿系肿瘤疾病中,中国人群发病率最高[2]。随着科技的发展,技术的提高,多数膀胱癌可以得到准确的诊断和有针对性的治疗,然而,随之而来,诊断和治疗的局限性也日趋凸显,需要新的理念以及治疗方法来改善。EZH2属于核心酶PRC2的一个亚基,通过对组蛋白H3的第27位赖氨酸进行三甲基化,从而促进转录沉默[3-6]。相关证据表明EZH2的甲基化功能不仅仅是主要的表观遗
传阻遏物,而且通过不同途径激活基因表达在表观遗传学癌症的治疗中也具有临床意义[7],目前许多可以专门抑制EZH2酶活性的小分子抑制剂已经开发出来[8-9]。组蛋白甲基化修饰与肿瘤的发生发展密切相关[10]。本实验采用MTT、划痕实验以及流式检测细胞凋亡法研究组蛋白甲基化酶EZH2的特异性抑制剂与针对DNA的化疗药物丝裂霉素C(MMC)的单独使用以及联合使用对膀胱癌T24细胞株功能的影响,探讨该抑制剂与药物联合使用以及应用于临床的可行性。
1 材料和方法
1.1 材料 人膀胱癌T24细胞系购自美国ATCC细胞库。鼠源β-actin单克隆抗体、兔源EZH2单克隆抗体、兔源H3单克隆抗体、兔源H3K27me3单克隆抗体(密理博有限公司)、羊抗兔二抗、羊抗鼠二抗(美国Cell signing公司),胎牛血清(上海玉博生物科技有限公司),SYBR®Green Master Mix(诺唯赞生物科技有限公司),高糖DMEM培养基(上海玉博生物科技有限公司),胰蛋白酶(上海生工生物工程有限公司),ECL发光液(碧云天生物技术有限公司),EZH2特异性抑制剂UNC1999(美国Selleck Chemicals公司),丝裂霉素C(日本KyowaHakko公司)。
1.2 方法
1.2.1 细胞培养与给药方法 T24细胞无菌培养于含10%的胎牛血清、1%双抗的DMEM高糖培养基,37℃、5%CO2条件下培养以及传代。给药时保证UNC1999 的终浓度为 10 μmol/L,作用 48 h;MMC的终浓度 为 0.1 mg/L,作用 48 h。
1.2.2 实时荧光定量PCR法检测EZH2的表达 分为(1) 对照组;(2)MMC 组;(3)UNC1999 组;(4)MMC+UNC1999组。各组分别用药物处理,到达时间后收集细胞,Trizol法提取总的RNA,之后取出1 μg RNA逆转录,Q-PCR法扩增cDNA片段,序列如下:EZH2 上游 5′gttggcggaagcgtgtaaagactin 3′,下游5′gtatccttcgctgcttccattc3′;β -actin 上 游 5′TTGCTGACAGGATGCAGAAG 3′,下游 5′ATCCACATCTGCTGGAAGGT 3′。Q-PCR 反应体系:Mix 10 μL,primer F 0.4 μL,primer R 0.4 μL,Rox 0.4 μL,CDNA 2μL,ddH2O6.8μL。反应条件:94℃5min;94℃15s,60℃ 1 min,共循环 40次,95℃ 15 s,60 ℃ 1 min,95 ℃ 30 s,60 ℃ 15 s。
1.2.3 Western blot检测 EZH2 以及 H3K27me3 蛋白的表达 各组细胞经不同的药物处理方案处理,胰酶消化,收集细胞于1.5 mL离心管中,1 200 r/min离心5min,弃上清,加入1mLPBS清洗2次,1200r/min离心5 min,弃去上清,加入RIPA裂解液,漩涡震荡,充分混匀,冰浴30min,4℃,12000r/min,离心15min,将上清转移到1.5 mL离心管中,BCA法对蛋白质进行定量。加入6×Lodding buffer,混匀,100℃,煮沸5 min,保证蛋白质充分变性。配置聚丙烯酰胺凝胶,按定量的结果,取50 μg上样量,80 V待Marker分开,接着120 V至溴酚蓝到达凝胶底部,转膜,300 mA 1.5 h,之后用含 5%脱脂牛奶的TBST封闭 2 h,兔单抗 EZH2(1∶2 000),H3K27me3(1∶1 000),H3(1∶3 000),鼠单抗 β-actin(1∶1 000),4℃过夜,之后用TBST于摇床上洗3次,每次5 min,羊抗兔和羊抗鼠二抗(1∶3 000) 室温孵育 1.5 h,用TBST洗3次,每次5 min,ECl化学发光液显色,Tanon 4500全自动化学发光图像分析仪扫描。
1.2.4 MTT法检测细胞的增殖能力 正常培养的T24细胞,待细胞密度汇集到80%以上对细胞进行传代,调整浓度为5×104/mL,接种于96孔培养板,每孔150 μL,待细胞贴壁良好后,开始稀释药品,按照之前的分组与给药方式处理细胞。另外正常组加入等量的不含药物的培养基作为阴性对照,不加细胞的培养液作空白对照。各组均设6个复孔。MTT法测定药物的细胞毒作用,药物作用完成后,每孔加入5 g/L的MTT溶液10 μL,再培养3 h,期间观察,之后小心用移液枪吸弃培养液,于每孔加150 μL的DMSO,酶标仪选择490 nm波长测定吸光度,用空白对照调零。计算细胞抑制率(%)。
1.2.5 划痕实验检测细胞迁移能力 处于对数生长期的细胞,相同的浓度接种于6孔板中,按照方案用药物处理,待作用时间到达后方可弃去培养基,用PBS洗3次,弃去,加入相同的无药物的培养,接着用10 μL枪头在6孔板孔中部划线,待48 h后进行拍摄,比较各组细胞的迁移情况。
1.2.6 Annexin V-FITC/PI双染法检测细胞凋亡 取对数生长期的细胞,按照分组接种于6孔板中,分别用药物处理,到达时间后收集细胞,PBS洗涤2次,取3×105个细胞,加入195 μL结合液重悬细胞,之后加入5 μL AnnexinV-FITC,混匀,常温避光孵育10 min,离心,弃上清。加入200 μL结合液轻轻重悬细胞,加入20 μL PI混匀,将样品用锡纸包裹,1 h内上流式细胞仪进行检测。
2 结果
2.1 Q-PCR法检测EZH2基因的表达量 结果见图1。UNC1999组、丝裂霉素C组与对照组相比EZH2表达水平明显下调,而UNC1999和MMC组为最低,结果具有统计学意义(P<0.001、P<0.01),说明MMC以及UNC1999均引起EZH2表达水平的下调。
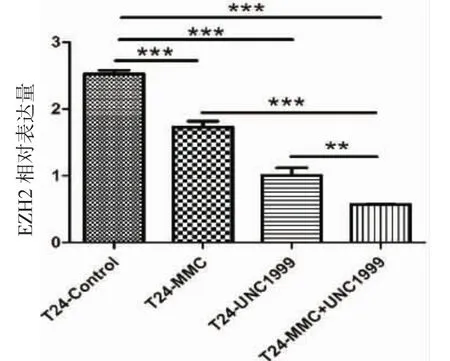
图1 各组EZH2基因表达比例柱形图Fig 1 Comparison of the expression levels of EZH2 gene in each treatment group
2.2 Western法检测EZH2以及下游H3K27me3蛋白的表达水平 结果见图2。UNC1999以及丝裂霉素C单独作用于T24细胞均引起EZH2蛋白水平的降低,而两者联合作用为最低,同时下游H3K27me3表达水平与EZH2改变相同。
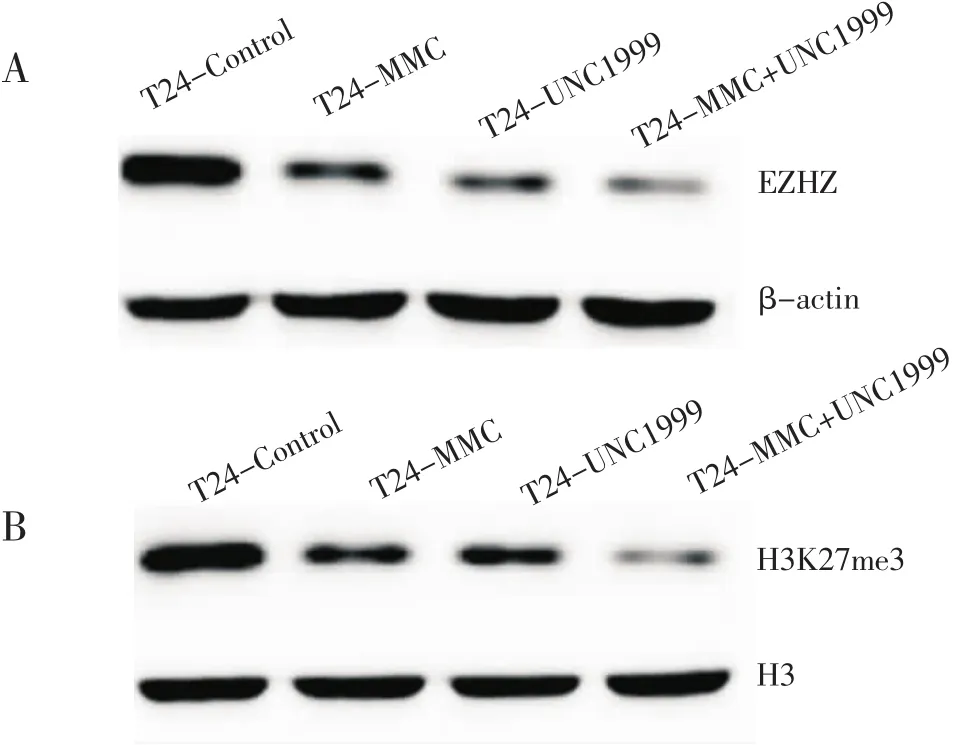
图2 各处理组EZH2蛋白表达水平(A)以及H3K27me3蛋白表达水平(B)Fig 2 EZH2 protein expression level(A)and H3K27me3 protein expression level(B)
2.3 MTT法检测4组T24细胞的增殖能力 图3示,UNC1999抑制剂组以及丝裂霉素C组与对照组相比,T24细胞的增殖能力均降低,而两者联合作用为最低,此结果具有统计学意义(P<0.001,P<0.01)。
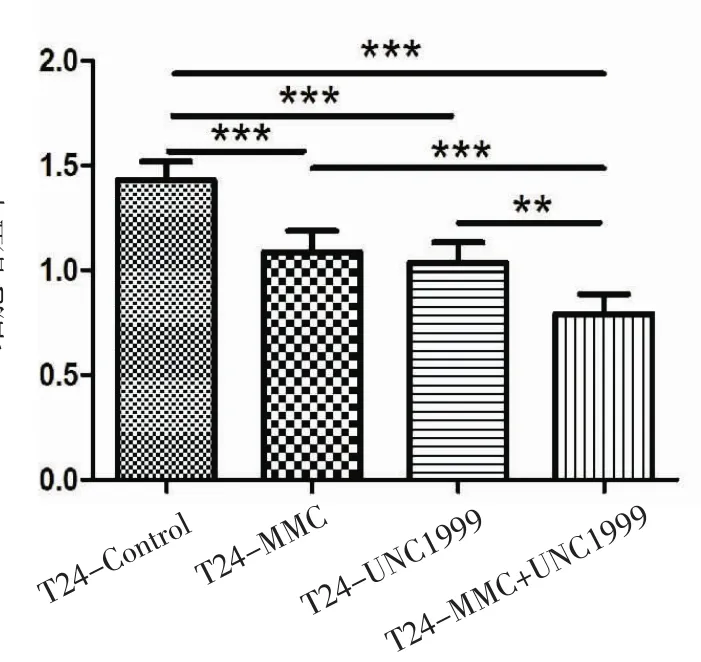
图3 各处理组T24细胞增殖比例柱形图Fig 3 ProliferationratioofT24cellsineachtreatmentgroup
2.4 划痕实验检测4组T24细胞的迁移 图4示,UNC1999以及丝裂霉素C单独作用于T24细胞均引起T24细胞迁移能力的下降,而两者联合作用为最低,此结果具有统计学意义。

图4 药物处理后4组细胞的迁移情况Fig 4 Migration of four groups after drug treatments
2.5 流式细胞仪检测细胞的凋亡 图 5示,UNC1999以及丝裂霉素C单独作用于T24细胞均引起T24细胞的凋亡水平上调,而两者联合作用为最大。
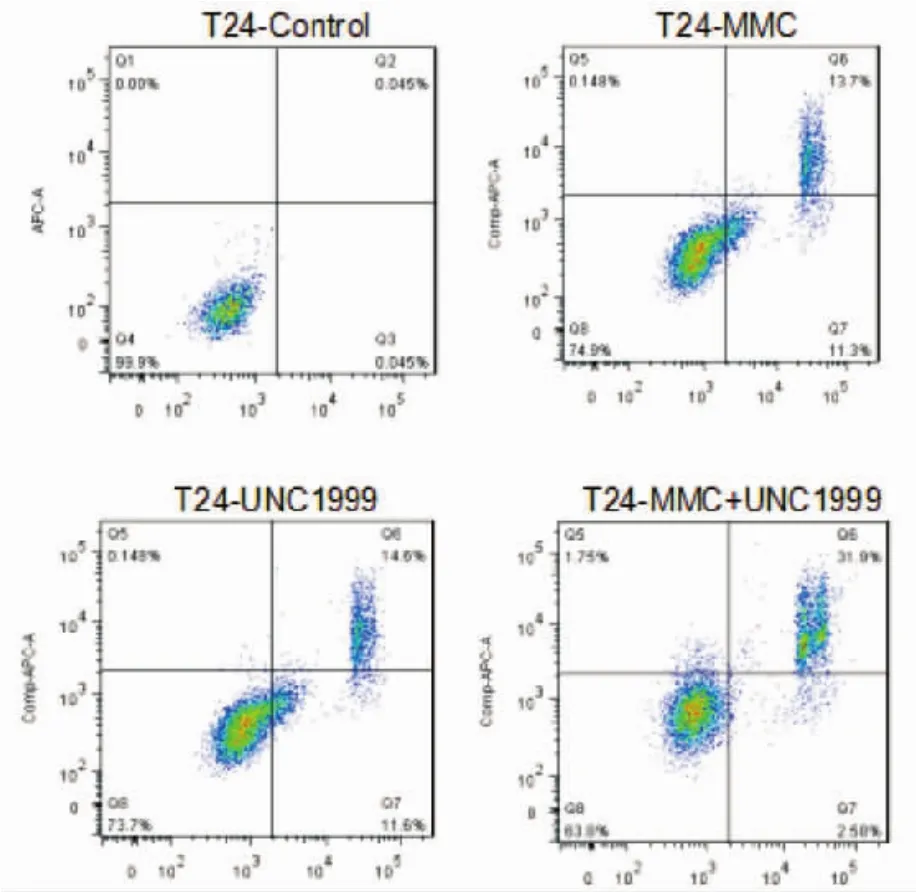
图5 药物处理后4组细胞的凋亡水平Fig 5 Apoptosis of four groups after drug treatments
3 讨论
人类癌症基因组测序显示编码染色质的各种组蛋白修饰基因的变异与癌症[11-13]的发生发展密切相关。近些年发现的证据表明组蛋白甲基化修饰基因EZH2与许多癌症存在密切关系[14-18]。EZH2是主要的组蛋白甲基转移酶,能对组蛋白第27位赖氨酸进行三甲基化,对相关基因进行调控,参与多种癌症的发生发展,其中包括前列腺,肺和膀胱癌。它不仅与癌细胞增殖相关,同时与癌细胞干细胞以及转移也密切相关。另外,EZH2也参与了前列腺癌和乳腺癌的发展,可以作为侵略性癌症类型的标志物预测临床结果[19]。EZH2转基因小鼠通过促进乳腺肿瘤病毒引起肿瘤的发生[20]。除此之外,胰腺以及乳腺癌干细胞的维持也需要EZH2表达[21]。因此,EZH2是一种有希望的癌症治疗靶点。
MMC属于针对膀胱癌的主要的化疗药物之一[22],属于细胞周期的非特异性药物,主要作用部位位于细胞核,通过破坏DNA的结构与功能来抑制或杀灭癌细胞。从理论上来说,单一用药对于清除由异源细胞群体发育而来的肿瘤块难度很大[23],而且单一用药会引起药物毒性,特别在大剂量的应用时负面情况更加明显。
当前,对于膀胱癌的治疗主要采用单一的化疗药物处理,治疗难度大,后期容易引起毒性,目前研究组蛋白甲基化修饰与相应的癌症的发生发展是研究的热点,但是关于组蛋白甲基化修饰基因抑制剂与膀胱癌化疗药物联合使用的相关研究比较少,在这项研究中,我们通过采用EZH2的特异性抑制剂UNC1999以及化疗药物MMC处理T24膀胱癌细胞,探讨单独用药以及联合用药对细胞的增殖迁移以及凋亡能力的影响,不单从基因角度阐明甲基化修饰对于膀胱癌细胞的发生发展的重要性,也将特异性的组蛋白甲基化修饰基因EZH2的小分子抑制剂与抗癌药物的使用联合起来,评估二者联合使用以及单独使用的效果,为后面针对膀胱癌治疗的用药方案提供参考。
[1] Boström M M,Irjala H,Mirtti T,et al.Tumor-Associated macrophages provide significant prognostic information in urothelial bladder cancer[J].PLoS One,2015,10(7):e0133552
[2] Hemdan T,Malmström P U,Jahnson S,et al.Emmprin expression predicts response and survival following cisplatin containing chemotherapy for bladder cancer:a validation study[J].J Urol,2015,194(6):1575
[3] Margueron R,Reinberg D.The polycomb complex PRC2 and its mark in Life[J].Nature,2011,469(7330):343
[4] Di Croce L,Helin K.Transcriptional regulation by Polycomb group proteins[J].Nat Struct Mol Biol,2013,20(10):1147
[5] Perdigoto C N,Valdes V J,Bardot E S,et al.Epigenetic regulation of skin:focus on the Polycomb complex[J].Cell Mol Life Sci,2012,69(13):2161
[6] Müller J,Hart C M,Francis N J,et al.Histone methyltransferase activity of a Drosophila Polycomb group repressor complex[J].Cell,2002,111(2):197
[7] Deb G,Singh A K,Gupta S.EZH2:not EZHY(easy)to deal[J].Mol Cancer Res,2014,12(5):639
[8]Knutson S K,Wigle T J,Warholic N M,et al.A selective inhibitor of EZH2blocksH3K27methylationandkillsmutantlymphomacells[J].Nat Chem Biol,2012,8(11):890
[9] Knutson S K,Kawano S,Minoshima Y,et al.Selective inhibition of EZH2 by EPZ-6438 leads to potent antitumor activity in EZH2-mutant non-Hodgkin lymphoma[J].Mol Cancer Ther,2014,13(4):842
[10]ChenW,ZhengR,BaadePD,etal.CancerstatisticsinChina,2015[J].CACancerJClin,2016,66(2):115
[11]Dalgliesh G L,Furge K,Greenman C,et al.Systematic sequencing of renal carcinoma reveals inactivation of histone modifying genes[J].Nature,2010,463(7279):360
[12]Gui Y T,Guo G W,Huang Y,et al.Frequent mutations of chromatin remodeling genes in transitional cell carcinoma of the bladder[J].Nat Genet,2011,43(9):U84
[13]Ho A S,Kannan K,Roy D M,et al.The mutational landscape of adenoid cystic carcinoma[J].Nat Genet,2013,45(7):791
[14]Varambally S,Dhanasekaran S M,Zhou M,et al.The polycomb group protein EZH2 is involved in progression of prostate cancer[J].Nature,2002,419(697):624
[15]Raman J D,Mongan N P,Tickoo S K,et al.Increased expression of the polycomb group gene,EZH2,in transitional cell carcinoma of the bladder[J].Clin Cancer Res,2005,11(24 Pt 1):8570
[16]Hinz S,Weikert S,Magheli A,et al.Expression profile of the polycomb group protein enhancer of Zeste homologue 2 and its prognostic relevance in renal cell carcinoma[J].J Urol,2009,182(6):2920
[17]Kim K H,Kim L,Choi S J,et al.The clinicopathological significance of epithelial mesenchymal transition associated protein expressioninheadandnecksquamouscellcarcinoma[J].KoreanJPathol,2014,48(4):263
[18]AhaniN,ShirkoohiR,RokoueiM,etal.Overexpressionofenhancerof zestehumanhomolog2(EZH2)geneinhumancytomegaloviruspositiveglioblastomamultiformetissues[J].MedOncol,2014,31(11):252
[19]Yu J,Yu J,Rhodes D R,et al.A polycomb repression signature in metastatic prostate cancer predicts cancer outcome[J].Cancer Res,2007,67(22):10657
[20]Gonzalez M E,Moore H M,Li X,et al.EZH2 expands breast stem cells through activation of NOTCH1 signaling[J].Proc Natl Acad Sci U S A,2014,111(8):3098
[21]Van Vlerken L E,Kiefer C M,Morehouse C,et al.EZH2 is required for breast and pancreatic cancer stem cell maintenance and can be usedasafunctionalcancerstemcellreporter[J].StemCellsTranslMed,2013,2(1):43
[22]De Santis M,Bachner M.New developments in first-and secondline chemotherapy for transitional cell,squamous cell and adenocarcinoma of the bladder[J].Curr Opin Urol,2007,17(5):363
[23]Stirzaker C,Song J Z,Davidson B,et al.Transcriptional gene silencing promotes DNA hypermethylation through a sequential change in chromatin modifications in cancer cells[J].Cancer Res,2004,64(11):3871

