PRRX1的表达对卵巢癌血管生成拟态形成及患者预后的影响
范 丹 ,宋文静 ,2,张艳辉 ,戚 红 ,古 强 ,2,董学易 ,2,刘 芳 ,2,赵秀兰 ,2,孙保存 ,2,
(1.天津医科大学病理学教研室,天津300070;2.天津医科大学总医院病理科,天津300052;3.天津医科大学肿瘤医院病理科,天津300060)
卵巢癌是女性生殖器官三大恶性肿瘤之一,其发病率居宫颈癌和宫体癌之后,其死亡率居首位,是女性最主要的恶性肿瘤之一。卵巢癌起病隐匿、进展快,缺乏有效的早期诊断手段,约70%的患者一经发现即已为晚期,治疗及预后极其差[1]。因此,对卵巢癌发生机制和疾病进展的研究一直是妇科恶性肿瘤研究中的难点与热点问题[2]。血管生成拟态(VM)是由肿瘤细胞自身变形模仿内皮细胞组成的微循环管道,内壁无内皮细胞衬覆,与宿主血管连接使肿瘤细胞获得血液供应,对患者的生存预后有很大影响。最近,配对相关同源框1(paired related homoeobox 1,PRRX1)蛋白已被证实为一个新的上皮间质转化(EMT)的诱导因子,其在乳腺癌、肺癌中表达可抑制肿瘤转移,提示良好预后;而在胃癌、结直肠癌中的表达与转移和预后差相关[3-6],但目前对该因子在卵巢癌中表达及其具体的临床意义的研究少有报道。本研究旨在初步探讨PRRX1在卵巢癌中表达情况及其与VM的关系,以及PRRX1通过何种途径影响VM形成,从而阐明PRRX1对卵巢癌转移及预后的影响。
1 资料与方法
1.1 病例情况 62例卵巢癌标本来自于天津医科大学附属肿瘤医院1991年1月-1999年12月期间收治的卵巢癌患者。年龄21~80岁,其中<50岁者22例,≥50岁者40例。这些病例均进行了病理学诊断:浆液性42例,黏液性9例,子宫内膜样癌11例;高分化24例,中分化12例,低分化26例;FIGO分期Ⅰ期20例,Ⅱ期9例,Ⅲ期33例;39例出现转移或复发,23例未出现转移和复发;43例患者出现腹水,19例患者未出现腹水;VM阳性组21例,VM阴性组41例。
1.2 实验方法
1.2.1 免疫组化 免疫组化采用SP法染色。所有标本均为石蜡包埋组织,5μm厚切片,经二甲苯脱蜡,无水乙醇脱水,3%H2O2封闭内源性过氧化酶30min,梯度乙醇水化,微波热修复10 min,自然冷却后自来水冲洗和PBS平衡后,山羊血清于室温封闭30min,一抗孵育4℃过夜。次日室温恢复1 h后PBS洗3次,加二抗孵育1 h,PBS洗3次,DAB显色,自来水冲洗,苏木精复染核,脱水封片。PRRX1(1∶100)为兔抗人多克隆抗体来自 Novus Biologicals公司;Wnt5a(1∶100)为兔抗人抗体来自 R&D Biosystems公司;β-catenin(1:150)为小鼠抗人单克隆抗体来自北京中杉金桥公司;CD31(1∶50)为兔抗人单克隆抗体来自北京中杉金桥公司。
1.2.2 CD31与PAS双重染色 免疫组化常规染完CD31后,滴加过碘酸钠孵育15min于室温中,自来水冲洗5min后蒸馏水洗5次,然后滴加雪夫试剂,置于37℃孵箱避光20min,自来水冲洗20 min后蒸馏水洗5遍,苏木精复染核、自来水洗5min,脱水后封片。1.3 结果判断 结果判定根据细胞浆或细胞核出现的棕黄色颗粒样染色的细胞数和染色强度判定阳性表达情况。具体计数方法参考Sood等的评分方法:每例标本选择10个含有阳性细胞的高倍视野(×400)分别计数100个肿瘤细胞,取其平均值计算阳性细胞百分率。0分:阳性细胞<5%;1分:阳性细胞5%~25%;2分:阳性细胞25%~50%;3分:阳性细胞>50%。染色强度:1分:浅黄色;2分:深黄色;3分:棕黄色。总计分=阳性细胞百分率计分+染色强度计分,总计分≤2分为阴性,>2分为阳性。
1.4 统计学分析 采用SPSS17.0软件进行统计学分析。计数资料组间率的差异比较采用χ2检验、Pearson相关分析,使用Kaplan-Meier法进行生存分析。组间差异比较以P<0.05为显著性检验水准。
2 结果
2.1 PRRX1蛋白的表达与卵巢癌患者临床病理指标的相关性 在卵巢癌中PRRX1表达于癌细胞胞核,62例卵巢癌组织中PRRX1的阳性病例数为33例,有VM形成的为21例(图1)。PRRX1表达与卵巢癌患者的FIGO分期、转移及VM的形成密切相关且具有统计学意义(P<0.05),与患者的年龄、肿瘤大小、组织学类型和分级无明显统计学差异(P>0.05)(表1)。
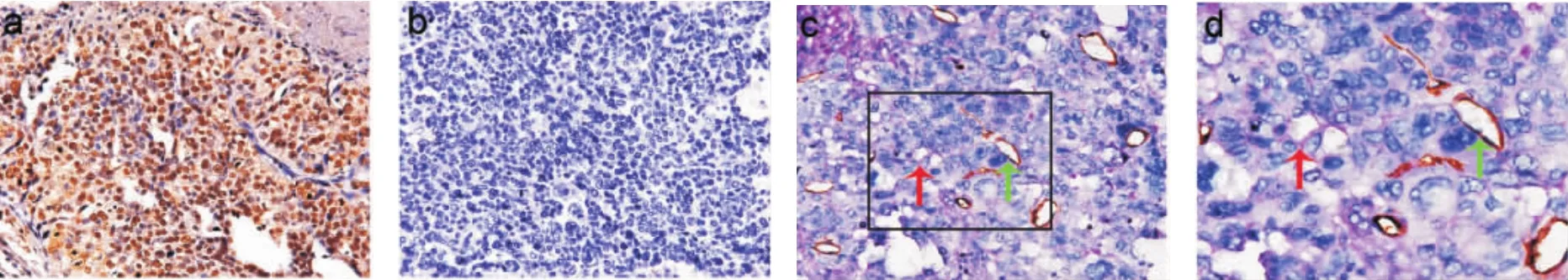
图1 卵巢癌组织PRRX1的表达和CD31/PAS的双染(×200)Fig 1 PRRX1 expression and CD31/PAS double staining in ovarian cancer(×200)
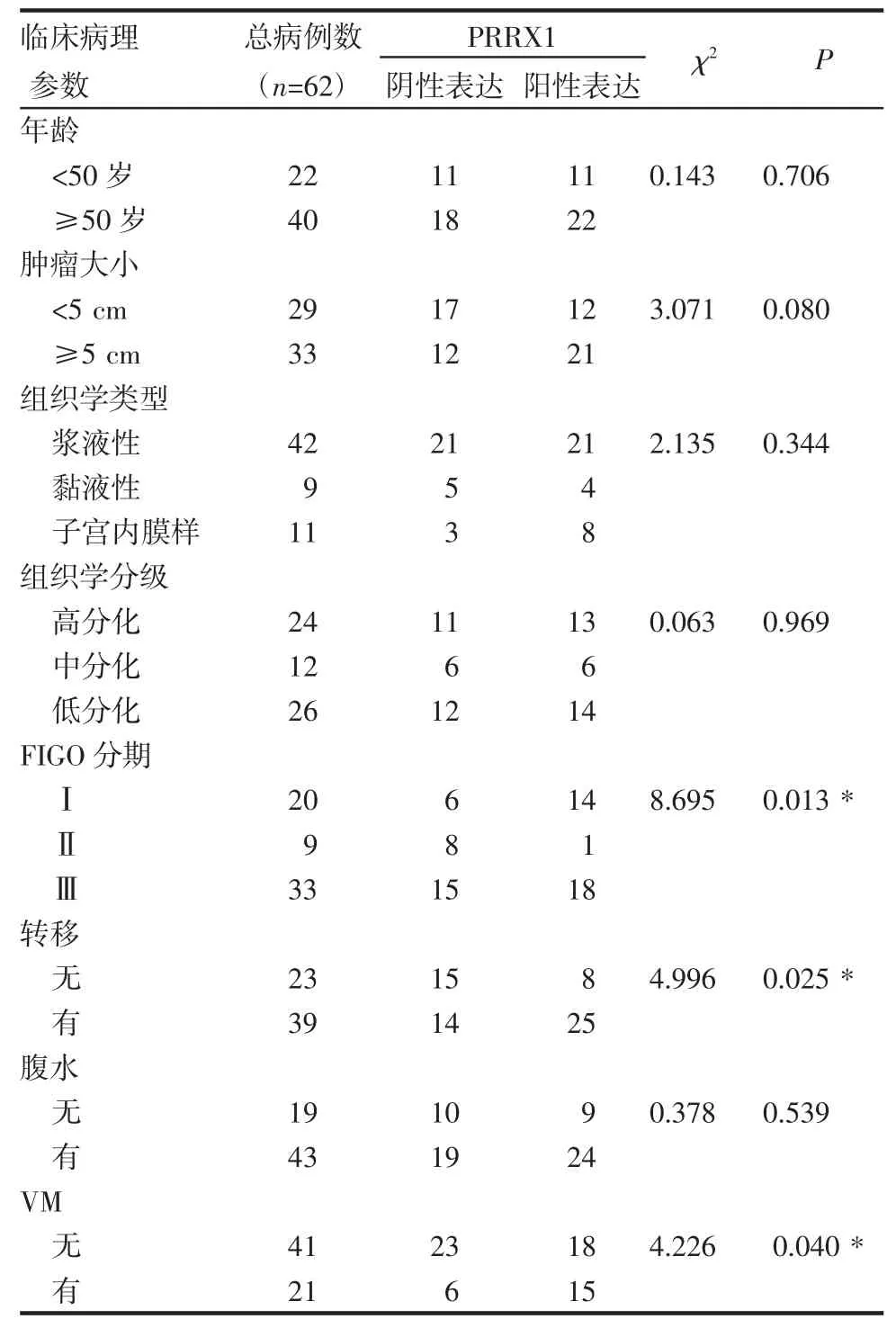
表1 PRRX1蛋白的表达与卵巢癌患者临床病理特征的关系Tab 1 RelationshipbetweenPRRX1 expression and the clinicopathology of patients with ovariancancer
2.2 PRRX1表达与卵巢癌预后的关系 62例卵巢癌患者根据PRRX1的表达情况分为阳性表达组和阴性表达组,Kaplan-Meier生存分析显示PRRX1阴性表达的卵巢癌患者生存时间明显长于PRRX1阳性表达卵巢癌患者,具有统计学意义(P=0.038)。PRRX1阳性表达和存在VM的患者生存时间比PRRX1阴性表达或无VM形成的患者短(P=0.002)且预后差(图2)。
2.3 Wnt5a、β-catenin在卵巢癌中的表达及其与PRRX1的关系 Wnt5a主要表达于癌细胞胞浆;β-catenin主要表达于癌细胞胞膜或胞浆,部分胞核阳性。在62例卵巢癌组织中Wnt5a、β-catenin浆、β-catenin核的阳性病例数分别为16例、39例、25例 (图 3)。χ2和 Pearson相关分析结果显示PRRX1表达与β-catenin核阳性表达密切相关(rs=0.309,P=0.014),PRRX1 表达与 Wnt5a、β-catenin浆阳性表达不相关(rs=0.110,P=0.396;rs=0.217,P=0.090)(表2、3)。
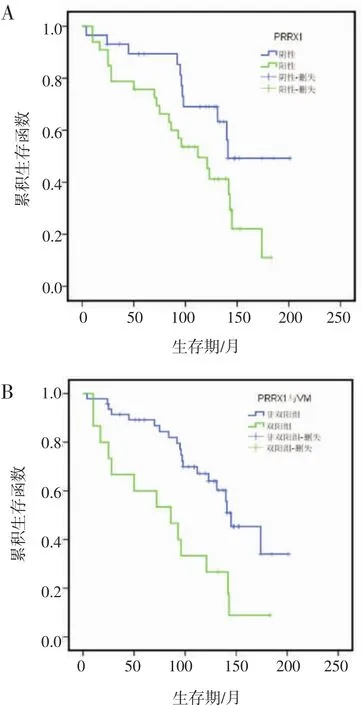
图2 卵巢癌中PRRX1表达和VM形成中的生存曲线图Fig 2 The survival curve of PRRX1 expression and VM formation in ovarian cancer
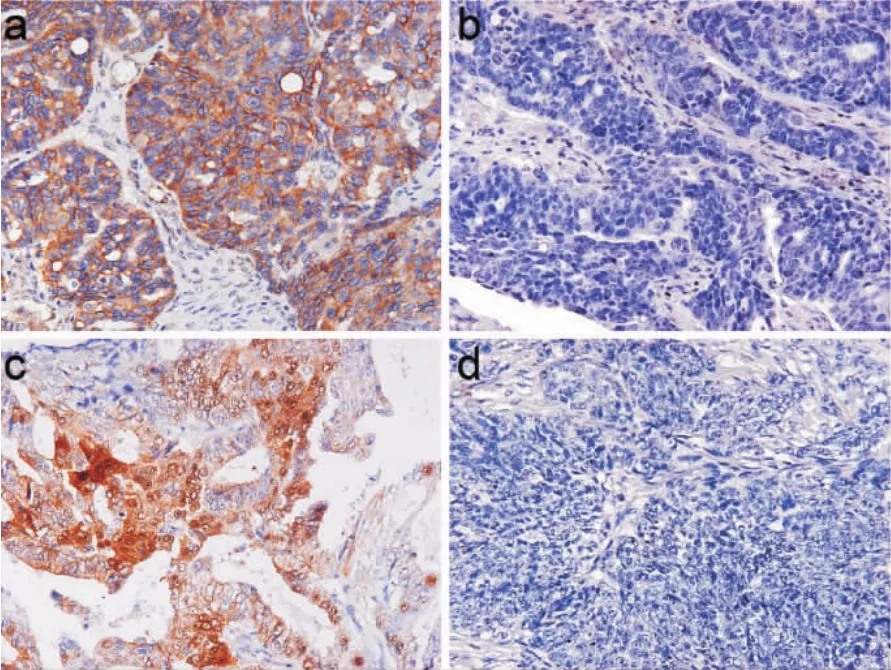
图3 卵巢癌组织Wnt5a和β-catenin的表达(×200)Fig 3 Wnt5a and β-catenin expressions in ovarian cancer(×200)
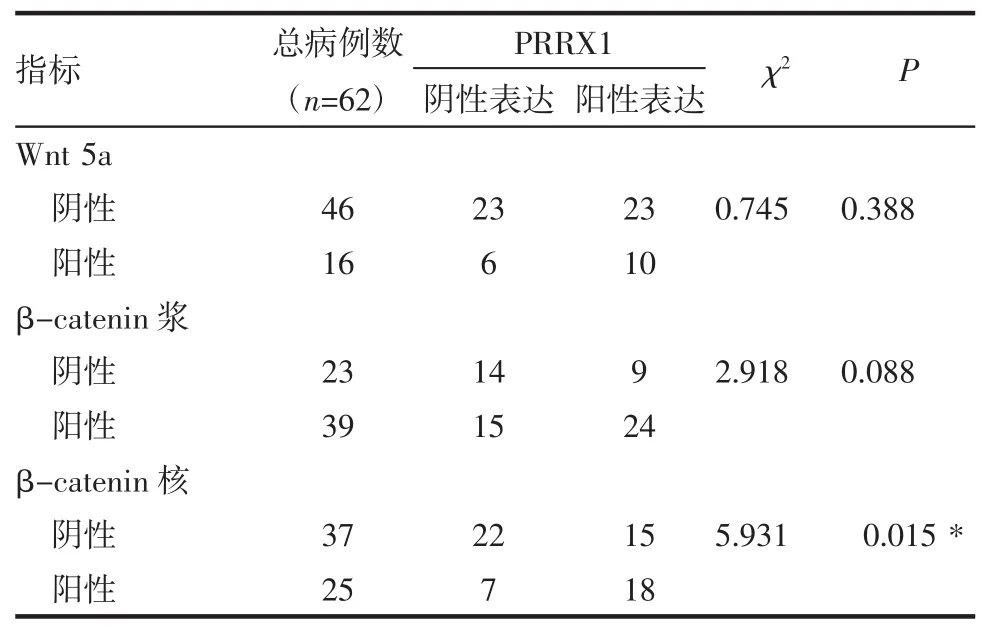
表2 卵巢癌中PRRX1与Wnt5a、β-catenin浆、β-catenin核表达的相关性Tab 2 CorrelationsbetweenPRRX1andWnt5a,β-cateninof patientswithovariancancer

表3 卵巢癌中PRRX1与Wnt5a、β-catenin浆、β-catenin核表达的Pearson相关性Tab 3 PearsoncorrelationbetweenPRRX1andWnt5a,β-catenin ofpatientswithovariancancer
2.4 PRRX1 表达和 Wnt5a、β-catenin 浆、β-catenin核表达与卵巢癌患者生存预后的关系 62例卵巢癌患者PRRX1阳性表达和β-catenin核阳性表达的患者生存时间短于PRRX1阴性表达或β-catenin核阴性表达的患者(P=0.023);而PRRX1阳性表达与Wnt5a阳性表达、β-catenin的浆阳性表达的患者生存时间与PRRX1阴性表达或Wnt5a阴性表达、β-catenin的浆阴性表达的患者生存时间相比,差别无意义(P=0.840;P=0.137)。
3 讨论
卵巢癌患者的主要死因是肿瘤的转移和复发,而肿瘤的生长和转移都具有血管依赖性,因此肿瘤血管生成和VM的形成对患者的生存预后起重要作用[7]。VM是由肿瘤细胞自身变形模仿内皮细胞组成的微循环管道,内壁无内皮细胞衬覆。其形成有3个关键环节:肿瘤细胞的自身变形,肿瘤细胞及细胞外基质的重塑和其与宿主血管连接使肿瘤细胞获得血液供应[8]。研究表明,肿瘤细胞的“可塑性”是VM形成的关键[9]。EMT是指在特定的生理和病理条件下上皮来源细胞向间质源性细胞转化的一种现象,与肿瘤的侵袭转移密切相关[10]。而形成VM的肿瘤细胞失去上皮细胞特性而获得内皮细胞的功能和表型,这一过程和EMT有关。已有研究表明EMT的转录调节蛋白Twist、ZEB-1的表达对肿瘤组织VM形成具有调节作用[11-12],因此推测有些诱导EMT的转录调控因子可能促进VM形成。在本组实验中,PRRX1作为一个新的EMT的诱导因子,与VM的形成密切相关且具有统计学意义(P<0.05),在PRRX1阳性表达和存在VM的患者中,其生存时间短且预后差。
PRRX1是同源框转录因子paired-type家族中的一员,可调节间充质前体细胞的分化[13],已被证实为一个新的EMT的诱导因子,是一种DNA相关蛋白,其功能是转录共激活,通过增加血清反应因子的DNA结合活性进行转录活化。PRRX1作为一个新发现的EMT诱导物与经典的EMT诱导物[14]不同,关键区别在于干细胞样特性诱导:PRRX1诱导EMT的发生并不伴随干性的获得[15]。PRRX1的缺失可使乳腺癌细胞发生MET(mesenchymal–epithelial transition)并获得干性样表型[15];相反,结直肠癌中PRRX1表达促进EMT发生和干性样特性的获取[6]。对PRRX1功能的研究显示该基因作为一种转录因子可调控多种基因的表达[16],PRRX1参与软骨细胞的分化过程[17],其在肢芽形成和骨骼发育中起重要作用[18],由肿瘤坏死因子(TNF)激活的PRRX1可抑制类风湿性关节炎、更年期人群和老年人中的骨形成[19]。在老鼠胚胎的心脏和骨骼肌中PRRX1高度表达,PRRX1的缺失会使老鼠在围产期时死于颅面和肢体畸形[20]。在正常成人的大脑中PRRX1在神经细胞谱系转换和维持成人神经干细胞自我更新中起到关键作用[21],PRRX1通过调控内皮细胞分化而参与肌腱蛋白-C表达和肺血管形成过程[22]。另外PRRX1促进胰腺再生并致癌[23]。但该蛋白在肿瘤发生和发展中的作用尚不完全清楚。有研究表明,在恶性胶质瘤中PRRX1的缺失可抑制恶性胶质瘤细胞侵袭和神经球形成,而其表达诱导激活Notch信号参与恶性胶质瘤细胞的浸润[24]。但也有研究显示该基因的缺失可引起体内癌细胞的转移[15]。这可能是因为在不同系统的肿瘤之间PRRX1的表达和功能存在差异。在胃癌[5]中,PRRX1过表达导致EMT分子标记物N-cadherin、E-cadherin和vimentin以及核内β-catenin、Wnt/β-catenin 靶基因 c-Myc 的水平的变化,而且Wnt/β-catenin信号的抑制剂XAV939抵消了PRRX1过表达的作用。说明PRRX1是通过激活Wnt/β-catenin信号诱导EMT的发生。在本组实验中,发现PRRX1的表达与β-catenin核阳性表达有关,初步推断在卵巢癌中PRRX1可使βcatenin入核从而激活Wnt通路。
Wnt(Wingless)基因是在小鼠乳腺癌中首先发现的,在多种组织中广泛表达且具有高度的保守性,在胚胎发育过程中调节细胞的增殖、分化、迁移、极性和凋亡,与人类某些常见的恶性肿瘤的发生、发展关系密切[25]。Wnt蛋白大致分为两类:一类是Wnt1类,激活Wnt经典通路,即Wnt/β-catenin信号通路;另一类为Wnt5a类,可触发Wnt非经典通路(不依赖β-catenin的Wnt通路),包括Wnt/Ca2+和Wnt/PCP信号通路等[26-27]。Wnt5a基因是一种分泌性糖蛋白,是Wnt非经典家族中的重要成员,目前对其作用机制的研究存在较大分歧:Wnt5a既能活化经典的Wnt/β-catenin通路又能活化非经典Wnt/Ca2+通路,并且二者之间相互作用,导致Wnt5a在不同肿瘤中的生物学作用不一致,在甲状腺癌[28]中起抑癌作用而在胃癌[29]中起到促癌的作用。βcatenin蛋白作为Wnt经典通路的重要成员,其蛋白稳定性和活性的调节是Wnt通路中的关键事件之一。通路传导模式是:细胞外的Wnt蛋白与细胞膜上的受体Frizzled/LRP结合启动Wnt信号,然后通过磷酸化并激活细胞浆内的Dsh蛋白,抑制GSK3IS/APC/Axin 复合物对 β-catenin 的磷酸化。胞浆内未被磷酸化的β-catenin蛋白可以逃逸被泛素水解系统降解的命运,继而进入细胞核内,与转录因子LEF/TCF共同作用,激活靶基因的转录。因此,β-catenin蛋白在细胞内的异常累积不仅是Wnt通路激活的标志事件,还是多种肿瘤中的常见事件之一[30-31]。在生理或者病理条件下,Wnt/β-catenin经典的信号通路还参与EMT的形成和调控[32]。当Wnt/β-catenin通路活化使β-catenin向细胞核内聚集破坏了 E-cadherin/α-catenin/β-catenin 复合体的稳定性,E-cadherin作用减弱,促进EMT发生[33-34]。Wnt/β-catenin是参与调控EMT的重要信号通路,而EMT在VM的形成过程中具有重要作用,因此,我们推测Wnt/β-catenin信号通路活化促进EMT发生进而影响VM形成。在结肠癌[35]中证实了Wnt/β-catenin信号通路活化促进肿瘤细胞EMT发生并在VM形成过程中发挥重要作用,而Wnt/β-catenin信号通路抑制剂Dkk1可逆转结肠癌细胞EMT,抑制结肠癌细胞向内皮细胞转化,抑制VM形成。在肝癌[36]中,XAV939 可通过抑制 Wnt/β-catenin 信号通路,降低其下游血管拟态相关因子ZEB-1和MMP-7的表达,从而抑制人肝癌细胞血管生成拟态的形成。亦说明了Wnt/β-catenin信号通路对VM的形成起促进作用。
综上,PRRX1作为一个新的EMT的诱导因子,可通过激活Wnt/β-catenin信号诱导EMT的发生,而Wnt/β-catenin信号通路活化促进EMT发生进而影响VM形成。在卵巢癌组织中,PRRX1表达与卵巢癌患者VM的形成、生存预后密切相关,且与βcatenin核表达相关,因此初步推测PRRX1可能是通过经典的Wnt/β-catenin信号通路调节VM形成从而影响卵巢癌患者预后,为卵巢癌中VM形成和转移的机制研究提供新思路。本实验只是推测PRRX1可能是通过经典Wnt通路对VM进行调控,因此还需要进行大量的体外实验来验证并探讨具体的机制。
[1] Jemal A,Murray T,Samuels A,et al.Cancer statistics,2003[J].CA Cancer J Clin,2003,53(1):5
[2] Eisenkop S M,Friedman R L,Spirtos N M.The role of secondary cytoreductive surgery in the treatment of patients with recurrent epithelial ovarian carcinoma[J].Cancer,2000,88(1):144
[3] Lv Z D,Yang Z C,Liu X P,et al.Silencing of Prrx1b suppresses cellular proliferation,migration, invasion and epithelialmesenchymal transition in triple-negative breast cancer[J].J Cell Mol Med,2016,20(9):1640
[4] Lv Z D,Kong B,Liu X P,et al.miR-655 suppresses epithelial-tomesenchymal transition by targeting Prrx1 in triple-negative breast cancer[J].J Cell Mol Med,2016,20(5):864
[5] Guo J,Fu Z,Wei J,et al.PRRX1 promotes epithelial-mesenchymal transition through the Wnt/β-catenin pathway in gastric cancer[J].Med Oncol,2015,32(1):393
[6] Takahashi Y,Sawada G,Kurashige J,et al.Paired related homoeobox 1,a new EMT inducer,is involved in metastasis and poor prognosis in colorectal cancer[J].Br J Cancer,2013,109(2):307
[7] Zhao H,Gu X M.Study on vasculogenic mimicry in malignant esophageal stromal tumors[J].World J Gastroenterol,2008,14(15):2430
[8] Folkman J.Role of angiogenesis in tumor growth and metastasis[J].Semin Oncol,2002,29(6,Supplement 16):15
[9]Mihic-Probst D,Ikenberg K,Tinguely M,et al.Tumor cell plasticity andangiogenesisinhumanmelanomas[J].PLoSOne,2012,7(3):e33571[10]Fan Y L,Zheng M,Tang Y L,et al.A new perspective of vasculogenic mimicry:EMT and cancer stem cells (Review)[J].Oncol Lett,2013,6(5):1174
[11]Sun T,Zhao N,Zhao X L,et al.Expression and functional significance of Twist1 in hepatocellular carcinoma:its role in vasculogenic mimicry[J].Hepatology,2010,51(2):545
[12]Liu Z,Sun B,Qi L,et al.Zinc finger E-box binding homeobox 1 promotesvasculogenic mimicryin colorectalcancerthrough induction of epithelial-to-mesenchymal transition[J].Cancer Sci,2012,103(4):813
[13]Kern M J,Argao E A,Birkenmeier E H,et al.Genomic organization and chromosome localization of the murine homeobox gene Pmx[J].Genomics,1994,19(2):334
[14]Mani S A,Guo W J,Liao M J,et al.The epithelial-mesenchymal transition generates cells with properties of stem cells[J].Cell,2008,133(4):704
[15]Ocaña O H,Córcoles R,Fabra A,et al.Metastatic colonization requires the repression of the epithelial-mesenchymal transition inducer Prrx1[J].Cancer Cell,2012,22(6):709
[16]Regadas I,Matos M R,Monteiro F A,et al.Several cis-regulatory elementscontrolmRNA stability,translation efficiency,and expressionpatternofPrrxl1(pairedrelatedhomeoboxprotein-like1)[J].JBiolChem,2013,288(51):36285
[17]Takimoto A,Mohri H,Kokubu C,et al.Pax1 acts as a negative regulator of chondrocyte maturation[J].Exp Cell Res,2013,319(20):3128
[18]Ten Berge D,Brouwer A,Korving J,et al.Prx1 and Prx2 in skeletogenesis:roles in the craniofacial region,inner ear and limbs[J].Development,1998,125(19):3831
[19]Lu X,Beck G R,Gilbert L C,et al.Identification of the homeobox protein Prx1(MHox,Prrx-1)as a regulator of osterix expression and mediatoroftumornecrosisfactorαactioninosteoblast differentiation[J].J Bone Miner Res,2011,26(1):209
[20]Martin J F,Bradley A,Olson E N.The paired-like homeo box gene MHox is required for early events of skeletogenesis in multiple lineages[J].Genes Dev,1995,9(10):1237
[21]Shimozaki K,Clemenson G D,Gage F H.Paired related homeobox protein 1 is a regulator of stemness in adult neural stem/progenitor cells[J].J Neurosci,2013,33(9):4066
[22]Ihida-Stansbury K,Mckean D M,Gebb S A,et al.Paired-related homeobox gene Prx1 is required for pulmonary vascular development[J].Circ Res,2004,94(11):1507
[23]Reichert M,Takano S,Von Burstin J,et al.The Prrx1 homeodomain transcription factor plays a central role in pancreatic regeneration and carcinogenesis[J].Genes Dev,2013,27(3):288
[24]Sugiyama M,Hasegawa H,Ito S,et al.Paired related homeobox 1 is associated with the invasive properties of glioblastoma cells[J].Oncol Rep,2015,33(3):1123
[25]Wodarz A,Nusse R.Mechanisms of Wnt signaling in development[J].Annu Rev Cell Dev Biol,1998,14:59
[26]Lucero O M,Dawson D W,Moon R T,et al.A re-evaluation of the“oncogenic”Nature of Wnt/beta-catenin signaling in melanoma and other cancers[J].Curr Oncol Rep,2010,12(5):314
[27]Kim H J,Schleiffarth J R,Jessurun J,et al.Wnt5 signaling in vertebrate pancreas development[J].BMC Biol,2005,3:23
[28]Kremenevskaja N,Von Wasielewski R,Rao A S,et al.Wnt-5a has tumor suppressor activity in thyroid carcinoma[J].Oncogene,2005,24(13):2144
[29]Kurayoshi M,Oue N,Yamamoto H,et al.Expression of Wnt-5a is correlated with aggressiveness of gastric cancer by stimulating cell migration and invasion[J].Cancer Res,2006,66(21):10439
[30]Clevers H,Nusse R.Wnt/β-Catenin signaling and disease[J].Cell,2012,149(6):1192
[31]Cselenyi C S,Jernigan K K,Jahinci E,et al.LRP6 transduces a canonical Wnt signal independently of Axin degradation by inhibiting GSK3’s phosphorylation of beta-catenin[J].Proc Natl Acad Sci U S A,2008,105(23):8032
[32]Arend R C,Londo?o-Joshi A I,Straughn J M,et al.The Wnt/βcatenin pathway in ovarian cancer:a review[J].Gynecol Oncol,2013,131(3):772
[33]Aberle H,Schwartz H,Kemler R.Cadherin-catenin complex:protein interactions and their implications for cadherin function[J].J Cell Biochem,1996,61(4):514
[34]Oyama T,Kanai Y,Ochiai A,et al.A truncated beta-catenin disrupts the interaction between E-cadherin and alpha-catenin:a cause of loss of intercellular adhesiveness in human cancer cell lines[J].Cancer Res,1994,54(23):6282
[35]Qi L,Song W,Liu Z,et al.Wnt3a promotes the vasculogenic mimicry formation of colon cancer via Wnt/β-Catenin signaling[J].Int J Mol Sci,2015,16(8):18564
[36]汤晓颖,庞林宾,宋立文,等.XAV939抑制人肝癌HepG2细胞血管生成拟态的形成[J].基础医学与临床,2015,35(3):345

