卵巢癌细胞系OVCAR3过表达SND1稳定株的构建
杨 扬 ,白 虹 ,辛灵彪
(1.天津市血液中心,天津300110;2.天津医科大学免疫学系,天津300070;3.天津医科大学生物化学与分子生物学系,天津300070)
卵巢上皮性癌是女性常见的恶性肿瘤之一,其死亡率居妇科恶性肿瘤之首,其发生发展的机制一直被广泛研究探讨。卵巢在盆腔内位置很深,卵巢上皮性癌的起病非常隐匿,早期无临床症状,诊断难度很大,且该病治疗困难,即便采用联合化疗也很难提高5年生存率[1]。人类SND1(staphylococcal nuclease and tudor domain containing 1)蛋白在乳腺癌、前列腺癌、直肠结肠癌、肝细胞癌和神经胶质细胞恶性肿瘤中均有过度表达[2]。分子生物学的研究已经揭示了SND1蛋白的多功能性,包括其参与基因转录和转录后调控[3],构成RNA诱导沉默复合物(RNA-induced silencing complex,RISC)[4], 调 节mRNA的剪切、编辑和稳定[5],保持细胞活性等[6]。SND1所具有的这一系列复杂的分子功能可能是它
促进癌症发生的机制。然而SND1与卵巢上皮性癌的发生是否有关联尚不清楚,因此SND1是否促进了卵巢癌的发生以及其具体机制值得探讨。本研究使用SND1慢病毒感染并筛选出能稳定表达SND1的OVCAR3细胞株,为进一步探讨SND1在卵巢癌的发生、发展和转移中的作用机制提供基础。
1 材料与方法
1.1 主要材料和试剂 人卵巢癌细胞系OVCAR3和293T细胞系均为本实验室保存。OVCAR3细胞系用含0.01 mg/mL胰岛素、20%胎牛血清(BI公司)的1640培养基(BI公司)常规培养,293T细胞系用含10%胎牛血清(BI公司)的DMEM培养基(BI公司)常规培养。慢病毒载体质粒pLVX-FLAGSND1由本实验室构建。包装质粒1(pMD2.G)和包装质粒2(psPAX2)由天津医科大学生物化学与分子生物学教研室提供。Ampicillin和Hygromycin B购自罗氏公司。转染试剂Polyethyleneimine购自Sigma公司。鼠源SND1单克隆抗体由本实验室制备。鼠源FLAG M2抗体购自Sigma公司。辣根过氧化氢酶标抗鼠IgG购自美国KPL公司。BCA蛋白浓度检测试剂盒购自Pierce公司。ECL Western显色试剂盒购自碧云天公司。
1.2 Hygromycin B最低致死浓度测定 按3×105/孔将OVCAR3细胞接种于24孔板上,24 h细胞贴壁后,按 0、0.5、1、1.25、1.5μg/mL 浓度梯度将 Hygromycin B加入每孔中,共设3组重复。培养3d后结果显示,Hygromycin B对OVCAR3细胞的最低致死浓度为1 μg/mL,所以选择 1 μg/mL 的 Hygromycin B 进行抗药筛选。
1.3 慢病毒毒粒制备 准备293T细胞,待混合率为70%~80%左右准备包装病毒。转染前1 d将293T细胞接种于10 cm细胞培养皿中,置于含10%FES的高糖DMEM培养基,37℃、5%CO2的培养箱中培养。将重组质粒分别与包装质粒1(pMD2.G)和包装质粒 2(psPAX2)按照体系比(μg)22.5∶7.9∶14.6加入500 μL opti-MEM中混匀,另用500 μL opti-MEM将100 μL转染试剂Polyethyleneimine混匀,后在37℃加热使其完全溶解。将混有质粒的opti-MEM加入至混有Polyethyleneimine的opti-MEM中,轻弹混匀,室温静置5~20 min。取出事先铺好的293 T细胞,弃旧培养基,加入10 mL新完全培养基,再将混合好的质粒和转染试剂的opti-MEM逐滴缓慢加入至新培基中,4~6 h后换液。24 h后收病毒上清至离心管,4℃保存。后更换新的完全培基继续培养,48 h后再收集病毒上清至同一离心管中,4℃500×g离心10 min后,用0.45 μm的滤器过滤,置于-80℃长期保存用于感染。
1.4 OVCAR3细胞的感染及稳定株筛选 准备待转染慢病毒的目的细胞OVCAR3,转染前24 h以1×106/孔铺到6孔板中,使其融合率为60%左右。将制备好的病毒液缓慢加入培养皿中,再加200 μL FBS和12 μg polybrene。感染24 h后,更换新鲜完全培养基。48 h后加入1 μg/mL Hygromycin B进行筛选,并且以不加慢病毒、只加药的OVCAR3细胞培养基做对照,此皿细胞全部死亡即为筛选完成。FLAG-SND1病毒感染组称为OVCAR3-pLVXFLAG-SND1,空载体包装病毒感染组称为OVCAR3-pLVX。
1.5 Western blot检测FLAG-SND1表达量 重组质粒包装毒粒感染目的细胞OVCAR3,筛选稳定细胞株检测相应SND1蛋白表达量。用RIPA裂解重组慢病毒感染的OVCAR3细胞(OVCAR3-pLVXFLAG-SND1)离心取上清作为样品,野生型OVCAR3细胞(OVCAR3-CN)裂解液作为阴性对照,BCA蛋白定量试剂盒测定样品蛋白浓度,取等量蛋白样品进行SDS-PAGE电泳,湿转印至PVDF膜后,用5%脱脂奶粉封闭,一抗、二抗孵育后,加入曝光底物进行曝光。Western blot以β-actin为内参。
2 结果
OVCAR3慢病毒稳定株的筛选与鉴定:选取包装病毒感染 OVCAR3细胞,48 h后加 1 μg/mL Hygromycin B进行筛选。3 d后,不加慢病毒只加药的细胞全部死亡,结束筛选,将OVCAR3慢病毒稳定株冻存保存。剩余的细胞制备成细胞裂解液,Western印迹鉴定SND1蛋白表达情况,同时选择野生型OVCAR3细胞作为空白对照,见图1。结果显示OVCAR3稳定株的SND1蛋白表达明显增加,证明OVCAR3慢病毒稳定株构建成功。
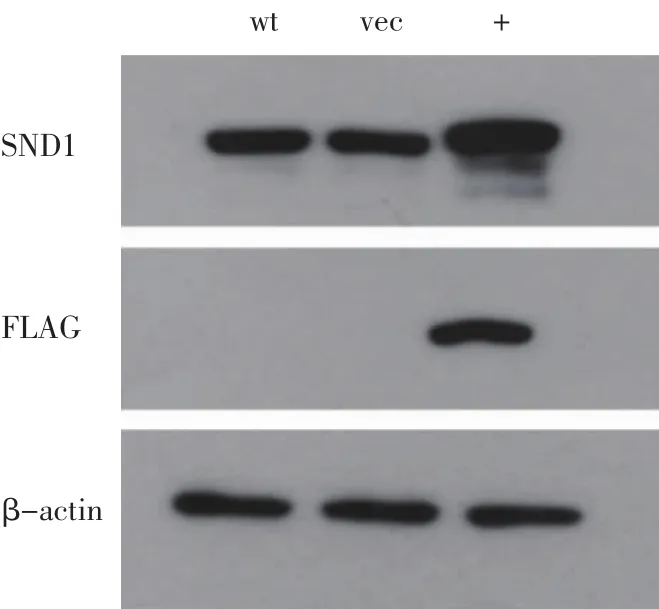
图1 OVCAR3慢病毒稳定株Western-blot表达鉴定图Fig 1 The expression level of SND1 detected by western-blot
3 讨论
SND1蛋白分子量为100 kDa,所以又称之为p100蛋白,它的N端由4个相同结构的葡萄球菌核酸酶样 (staphylococcal nucleases-like,SN-like)的SN结构组成,C端具有Tudor-SN5(TSN)结构域,所以又被称为Tudor-SN(Tudor staphylococcal nuclease)蛋白[7]。SND1是一种具有复杂功能的蛋白,它参与基因转录的调控和转录后的基因表达,维持mRNA的稳定,参与mRNA的剪切以及维持细胞活性等[4-6]。1995年,SND1作为EB病毒核蛋白2(Epstein-Barr virus nuclear protein 2,EBNA2)的转录协同调控因子被首次发现[8]。EBNA2可以激活转录因子介导B淋巴细胞的转化。SND1是STAT5和STAT6的转录激活因子,SND1的SN端结构和Tudor端结构共同参与STAT5的协同免疫作用,但是只有SN端结构参与STAT6的活化[9]。SND1还作为一个衔接分子建立起CREB蛋白(cAMP-response element binding protein)和STAT6之间的桥梁。本实验室之前破解了SND1蛋白N端TSN结构域的晶体结构,并且证实SND1不仅参与基因转录调控,还可以促进剪接体的装配和pre-mRNA剪接加工过程。另外,SND1在RNA诱导沉默复合体(RNA-induced silencing complex,RISC)中发挥核酸酶样作用来调节转录后的基因表达水平,从而影响siRNA和miRNA的表达[10]。研究证明,SND1增强了RISC的活性可能会促进癌症的形成。
通过对SND1敲除的小鼠模型的研究发现SND1蛋白通过影响基因表达在胚胎形成和细胞分化的早期发挥关键性作用[11]。越来越多的研究证实SND1蛋白的过度表达与促进癌症形成有关,它的具体机制有待深入研究。SND1是RISC复合物的组成成分,而RISC与肝细胞癌的发展息息相关。SND1通过多种方式影响着肝癌形成,大多数肝细胞癌患者血液中的SND1呈现高表达,并且升高的程度与肝癌的严重程度呈正相关[12];进一步的研究证实,SND1蛋白的过度表达能促进癌症的侵袭、增殖、转移和血管再生。在一个乳腺癌的肺转移模型中普遍检测出SND1表达的上调,大量临床数据显示,SND1的表达水平与乳腺癌肺转移的发生率和生存率相关;星型胶质细胞上调基因1(astrocyte elevated gene-1,AEG-1)作为一种致瘤性的细胞因子影响着肿瘤的发生、转移、血管再生、抗药性和细胞凋亡,SND1已被证实与AEG-1相互作用。c-Myb是一种不成熟的造血干细胞的变异生长因子,可以促进乳腺癌的淋巴转移,它的功能也早已发现与SND1蛋白相关,在出现转移的患者中,c-Myb与SND1同时高表达。在174例前列腺癌患者的研究中,发现SND1蛋白与癌症的组织学分期呈正相关。SND1与结肠直肠癌也极具相关性,从196例结肠癌的免疫组织化学的分析得出,伴随着肿瘤分期和疾病的进展,细胞质表达SND1和AEG-1蛋白也逐渐增多[13]。在结肠癌患者中,SND1通过转录后的修饰下调了结肠腺瘤息肉易感基因(adenomatousPolyposis Coli,APC)的蛋白表达水平,破坏了细胞极性和细胞间的粘附力。最近的一项关于恶性神经胶质细胞肿瘤的研究发现,患者大脑中SND1 mRNA的水平较正常人显著升高,这可以为该病的治疗提高新的靶点[14]。本实验室之前的研究已经发现TGF-β信号通路可以调控SND1蛋白的表达。鉴于现有的报道,SND1在多种恶性疾病中均有异常表达,我们推测SND1在卵巢癌的发生发展中也可能发挥一定的调控作用。
慢病毒载体是逆转录病毒载体的一种亚型,是在HIV-1病毒基础上改建而来的病毒载体系统,能将目的基因高效地导入人或者动物的原代细胞或细胞系中。慢病毒载体基因组是正链RNA,目的基因整合到宿主细胞基因组中,可以随着细胞基因组的分裂而分裂,因此慢病毒介导的基因表达持续而且稳定[15]。本实验利用慢病毒表达载体pLVX-FLAGSND1与慢病毒包装质粒共同转染293T细胞,在细胞中进行慢病毒包装。用包装好的慢病毒颗粒感染OVCAR3细胞,经过抗药性筛选,建立过表达SND1的OVCAR3稳定株。通过Western印迹鉴定证实SND1在慢病毒毒粒感染后的OVCAR3细胞中稳定表达,证实已成功构建OVCAR3慢病毒稳定株。
本次实验成功地构建了能够稳定表达SND1的OVCAR3稳定株,为从分子水平上研究SND1对卵巢癌细胞的调控作用提供了体外细胞系模型,为研究SND1与卵巢癌发生、发展及转移的关系奠定了基础,也为进一步研究卵巢癌的治疗提供了新的方向。
[1] Gutierrez-Beltran E,Denisenko T V,Zhivotovsky B,et al.Tudor staphylococcal nuclease:biochemistry and functions[J].Cell Death Differ,2016,23(11):1739
[2] Miller M B,Bi W L,Ramkissoon L A,et al.MAPK activation and HRAS mutation identified in pituitary spindle cell oncocytoma[J].Oncotarget,2016,7(24):37054
[3] Tong L,Wang C,Hu X,et al.Correlated overexpression of metadherin and SND1 in glioma cells[J].Biol Chem,2016,397(1):57
[4]Yu L,Liu X,Cui K,et al.SND1 Acts downstream of TGFβ1 and upstream of smurf1 to promote breast cancer metastasis[J].Cancer Res,2015,75(7):1275
[5] Gao X,Fu X,Song J,et al.Poly(a)(+)mRNA-binding protein Tudor-SN regulates stress granules aggregation dynamics[J].FEBS J,2015,282(5):874
[6] Jariwala N,Rajasekaran D,Srivastava J,et al.Role of the staphylococcal nuclease and Tudor domain containing 1 in oncogenesis(review)[J].Int J Oncol,2015,46(2):465
[7] Guo F,Wan L,Zheng A,et al.Structural insights into the tumorpromoting function of the MTDH-SND1 complex[J].Cell Rep,2014,8(6):1704
[8] Kannan N,Eaves C J.Tipping the balance:MTDH-SND1 curbs oncogene-induced apoptosis and promotes tumorigenesis[J].Cell Stem Cell,2014,15(2):118
[9]Permuth J B,Reid B,Earp M,et al.Inherited variants affecting RNA editing May contribute to ovarian cancer susceptibility:results from a large-scale collaboration[J].Oncotarget,2016,7(45):72381
[10]Aviram N,Ast T,Costa E A,et al.The SND proteins constitute an al-ternative targeting route to the endoplasmic reticulum[J].Nature,2016,540(7631):134
[11]Jang J S,Wang X,Vedell P T,et al.Custom gene capture and Next-Generation sequencing to resolve discordant ALK status by FISH?and IHC in lung adenocarcinoma[J].J Thorac Oncol,2016,11(11):1891
[12]Wang N,Du X,Zang L,et al.Prognostic impact of Metadherin-SND1 interaction in colon cancer[J].Mol Biol Rep,2012,39(12):10497
[13]Cappellari M,Bielli P,Paronetto M P,et al.The transcriptional coactivator SND1 is a novel regulator of alternative splicing in prostate cancer cells[J].Oncogene,2014,33(29):3794
[14]Heinrich E M,Wagner J,Krüger M,et al.Regulation of miR-17-92a cluster processing by the microRNA binding protein SND1[J].FEBS Lett,2013,587(15):2405
[15]Fashe T,Saarikettu J,Isomäki P,et al.Expression analysis of Tudor-SN protein in mouse tissues[J].Tissue Cell,2013,45(1):21

