NKp46-Cre介导的YFP报告基因系统标记小鼠NK细胞的特异性和效率检测
于明航 ,李 杨 ,阎 晗 ,王 瑾 ,黄 珊 ,袁顺宗 ,尹 洁 ,李泽兴 ,王 玺
(1.天津医科大学细胞生物学系,天津300070;2.中国人民解放军307医院头颈肿瘤科,北京100853)
自然杀伤细胞(natural killer cells,NK cells)是机体进行免疫防疫的第一道防线,主要是抵抗细菌、真菌、病毒以及病原微生物的入侵[1-3],同时NK细胞在抗肿瘤免疫方面也扮演着重要的角色[4-6]。但是NK细胞在发育和功能等方面还有许多的未知机制。利用转基因小鼠研究NK的发育与功能是一个
非常有效的工具。NKp46-Cre转基因小鼠是对表达NKp46受体的NK细胞进行特异性敲除的工具鼠[7-8]。在本次研究中,主要是利用ROSA26R-YFP小鼠与NKp46-Cre小鼠杂交,通过对小鼠体内细胞YFP的表达验证NKp46-Cre的敲除效率以及是否具有特异性,目的是构建YFP基因报告系统,为进一步研究NK细胞的功能与发育做好基础。
1 材料与方法
1.1 材料 ROSA26R-YFP转基因小鼠(哈佛医学院惠赠),NKp46-Cre转基因小鼠(中国解放军307医院袁顺宗老师惠赠);鼠尾碱性裂解液(25 mmol/L NaOH;EDTA.Na20.2 mol/L),鼠尾酸性中和液(Tris-HCl 40 mmol/L,pH=5)Tag DNA 聚合酶(康成);普通PCR 仪(ABI);流式细胞仪(BD);Percific Blue-CD3e(BD),APC-CD19(BD);PE-NKp46(BD);引物由北京奥科合成,引物序列见表1。
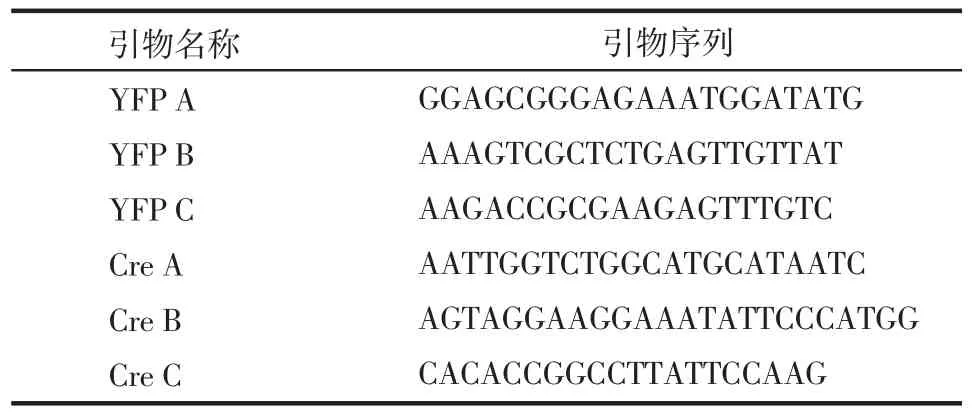
表1PCR引物Tab 1 PCR primers
1.2 实验方法
1.2.1 基因型鉴定 ROSA26R-YFP(+/-)小鼠与NKp46-Cre(+/-)小鼠杂交,子代在出生25 d左右进行耳标编号,并剪鼠尾进行基因型鉴定。将鼠尾浸泡含有75 μL的碱性裂解液的离心管中,将离心管置于100℃金属水浴锅30 min;冰上裂解5 min;5 min后向样品中加入75 μL的酸性中和液并将鼠尾吹打均匀,Nanodrop 2000测浓度;按照Tag DNA聚合酶试剂盒进行配制PCR体系;95℃10 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35 个循环;72 ℃10 min。PCR产物在2%琼脂糖凝胶电泳进行,结束后在凝胶成像仪中记录结果。
1.2.2 流式细胞术检测各个组织器官YFP的表达 颈椎脱臼法处死ROSA26R-YFP(+/+)NKp46-Cre(+/-)和 ROSA26R-YFP(-/-)NKp46-Cre(-/-)的小鼠,分别取两种小鼠的脾脏、骨髓、淋巴结和心脏,将组织在1640培养基中研磨,用细胞筛网过滤,制成单个悬浮细胞,通过细胞计数,选取1×106个细胞进行流式上机,最后用FlowJo软件进行分析。
1.2.3 流式细胞术检测脾脏中各个免疫细胞的YFP的阳性效率 按1.2.2的方法提取脾脏的淋巴细胞;将YFP双阳性的带有NKp46-Cre的小鼠淋巴细胞每1×106个细胞制成单个悬浮细胞于3个管,分别标记 CD3、CD19、NKp46;分别加入1μL 抗体标记的 Percific Blue-CD3e,APC-CD19,PE-NKp46,并且每管都加入1 μL NKp46的抗体,室温避光30 min;300g,5min离心收集细胞,最后用 300μL 的PBS重悬,另外需要一个含有2×106个细胞Negative管,500 μL PBS重悬,最后将样品转入流式管,准备流式上机,最后用 FlowJo(7.6)软件进行分析。
1.3 统计学方法 采用SPSS20.0软件进行统计分析。符合正态分布的计量数据用±s表示,2组间样品均数比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 基因型鉴定 ROSA26R-YFP(+/-)小鼠与NKp46-Cre(+/-)小鼠杂交后代共有14只小鼠,提取基因组DNA并进行基因型鉴定。已知YFP野生型的PCR条带为600 bp(YFP-),而YPF阳性的PCR条带为320 bp(YFP+),Cre野生型的PCR条带为454bp(Cre-),而YPF阳性的PCR条带为282bp(Cre+),基因型结果鉴定见图1、表2。根据表格选择对照组和实验组。
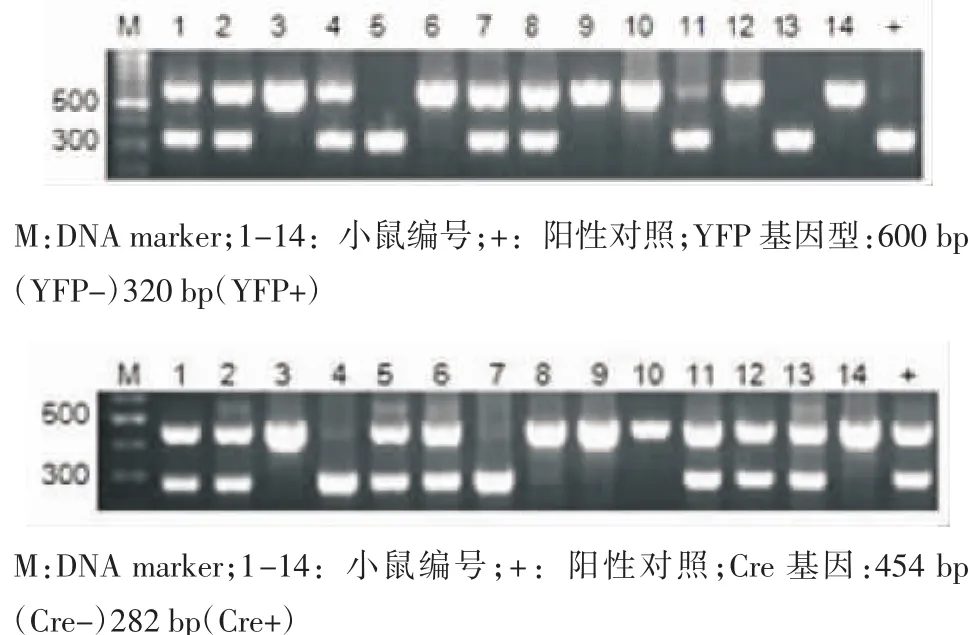
图1ROSA2R-YFP(+/-)与NKp46-Cre(+/-)杂交小鼠后代基因型鉴定结果Fig 1 The YFP genotyping results of the hybrid mice ROSA26RYFP(+/-)and NKp46-Cre(+/-)
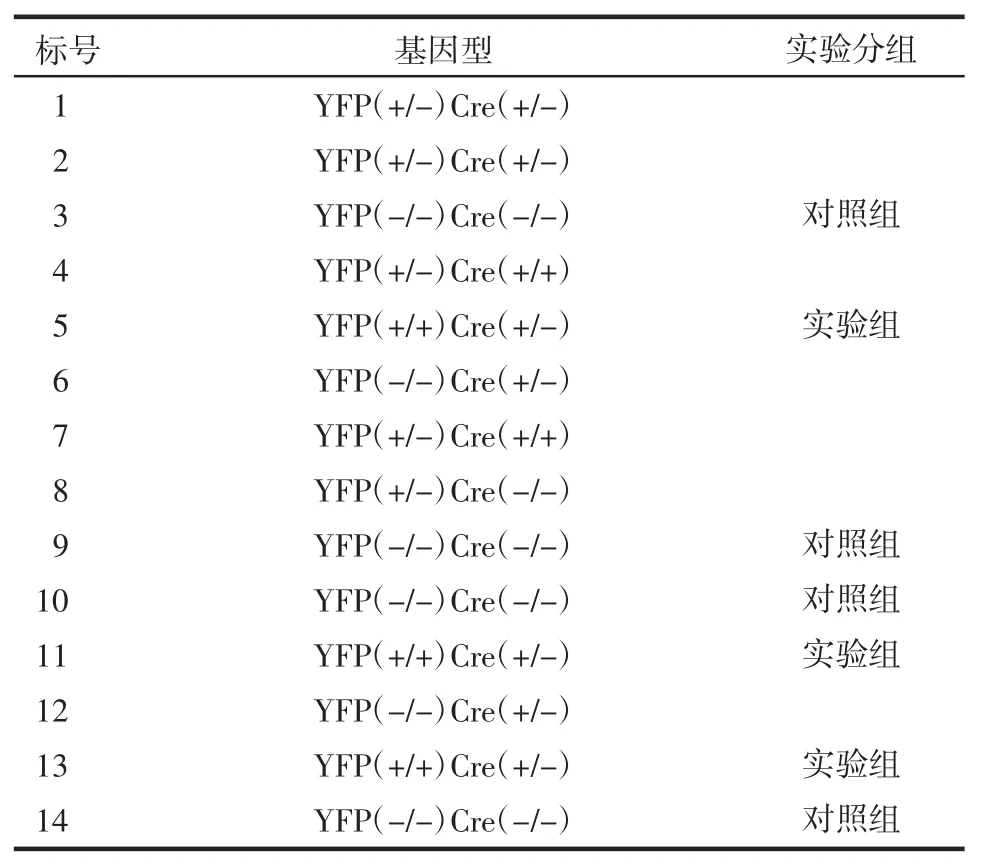
表2ROSA2R-YFP(+/-)与NKp46-Cre(+/-)杂交小鼠后代基因型鉴定结果Tab 2 ThegenotypingresultsofthehybridmiceROSA26R-YFP(+/-)and NKp46-Cre(+/-)
2.2 各个组织器官中YFP阳性的表达 流式细胞术检测根据基因型鉴定结果分成的实验组ROSA26R-YFP(+/+)NKp46-Cre(+/-)和对照组ROSA26R-YFP(-/-)NKp46-Cre(-/-)小鼠的免疫器官(脾脏、淋巴结、骨髓)和非免疫器官(心脏)中细胞YFP阳性的表达,见图2。双阳性小鼠淋巴结、骨髓、脾脏中YFP的阳性细胞数百分比分别为0.589%±1.02%、1.89%±1.28%、4.53%±1.54%;阴性对照 YFP(-/-)Cre(-/-)小鼠相对应的器官 YFP 阳性百分比分别为0.008%±0.003%、0.126%±0.08%、0.12%±0.004%;与对照组相比均有统计学差异。两组小鼠的心脏细胞中基本没有YFP的表达,其中YFP的表达百分比分别为 0.009%±0.0002%、0.03%±0.012%,两组之间没有明显统计学差异。NKp46-Cre介导的YFP的表达在免疫器官中具有特异性。
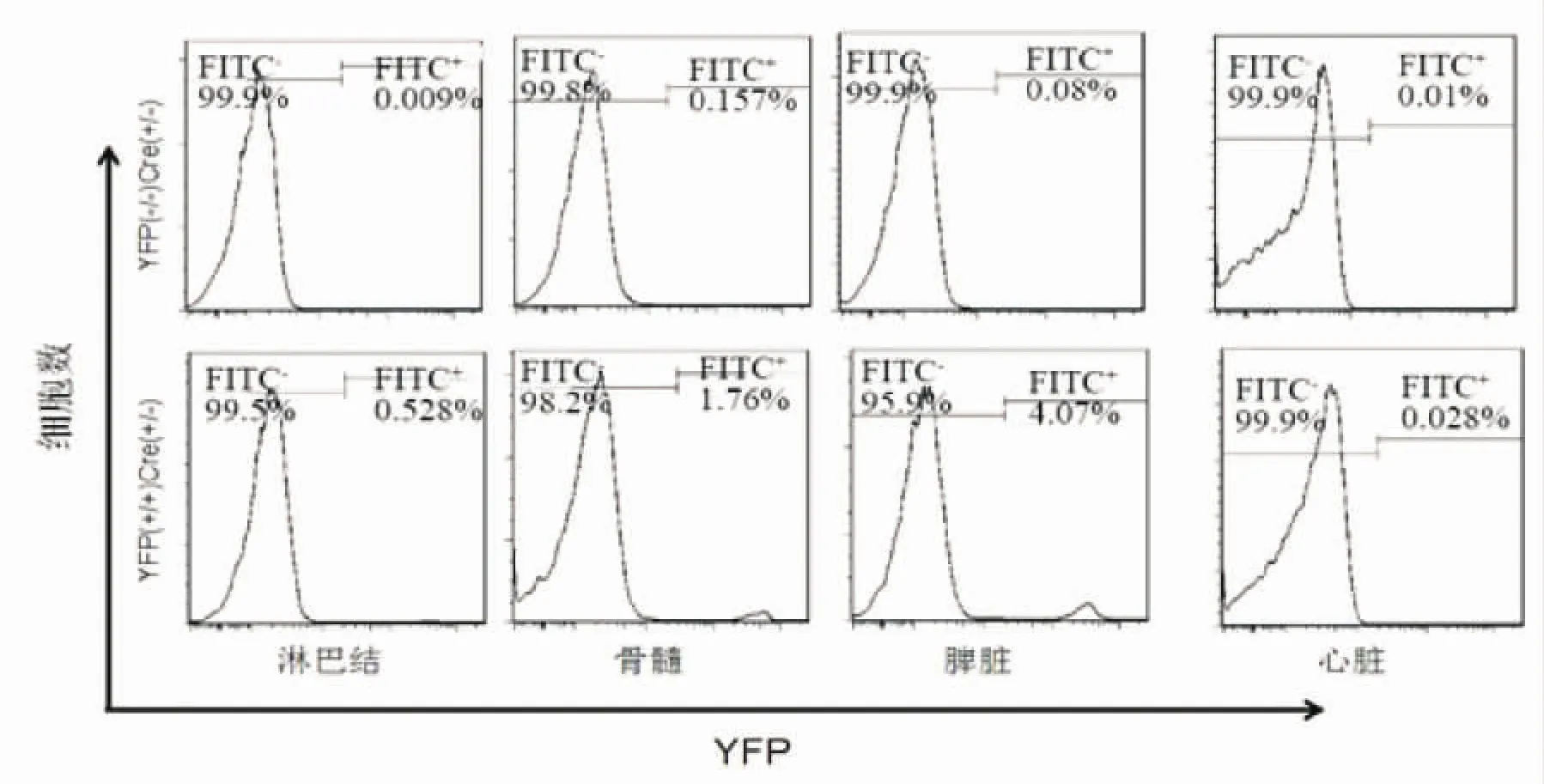
图2 免疫器官(淋巴结、骨髓、脾脏)和非免疫器官(心脏)的YFP表达情况Fig 2 The expression levels of YFP in immune organs and non-immune organs
2.3 脾脏淋巴细胞系中YFP阳性的表达效率 流式细胞术检测ROSA26R-YFP(+/+)NKp46-Cre(+/-)小鼠脾脏中淋巴细胞系(T cells、B Cells、NK cells)的YFP标记阳性细胞的百分比。ROSA26R-YFP阳性细胞标记NK细胞、T细胞、B细胞的百分比,分别为89.4%±1.08%、0.89%±0.56%、0.82%±0.82%,在各种细胞中差异均有统计学意义,说明NKp46-Cre系统介导的YFP荧光报告系统可以准确代表小鼠体内的NK细胞(图3)。
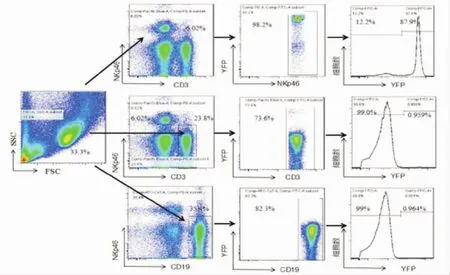
图3 免疫器官脾脏淋巴细胞系中YFP的表达情况Fig 3 The percentages of YFP in spleen lymphocyte lineage of immune organ
3 讨论
自然杀伤细胞是固有免疫系统中一类重要的免疫细胞,它主要分布于次级淋巴组织器官以及外周血中[9-11],NK细胞不像T细胞,它不需要预先致敏就能发挥杀伤作用或分泌细胞因子、趋化因子等能力[12-14]。截止到目前为止,对NK细胞的发育分化以及功能方面的调控仍然存在很多的未知,而现在转基因小鼠的应用,对于NK细胞的进一步研究提供了非常有效的工具。
NKp46-Cre转基因小鼠是一种专门介导表达NKp46受体的NK细胞的敲除小鼠[7]。现阶段,Cre重组酶介导的基因敲除检测主要集中在基因组的基因型鉴定,RT-PCR以及Western等技术在DNA、mRNA和蛋白水平上进行验证,而这些实验对于做免疫功能实验较为困难,并且不利于活体实验的研究。因此,在本次实验中引入了ROSA26R-YFP荧光报告基因小鼠与NKp46-Cre小鼠杂交,借助Cre重组酶系统切除ROSA26R-YFP荧光报告基因前面的终止子从而表达YFP蛋白[15],形成观察NK细胞的一种有效手段。
在本次实验中,我们得到了ROSA26R-YFP(+/-)或ROSA26R-YFP(+/+)的NK细胞,并且在各个免疫器官(脾脏、淋巴结、骨髓)中得到YFP的阳性表达,证实了YFP阳性NK细胞的阳性表达率在80%以上,而在ROSA26R-YFP(+/+)纯合的小鼠中的阳性率更高达90%左右。虽然YFP标记NK细胞并不是100%,可能还是与Cre重组酶的敲除效率有关,但其结果证实YFP阳性细胞可代表NK细胞,为了以后进一步的研究我们会采取ROSA26R-YFP(+/+)纯合的小鼠进行实验。
综上所述,本次实验结果表明YFP基因报告系统可行,在以后的实验中可以选择YFP阳性的细胞进行实验,对NK细胞的发育进行实时监测,有利于分析NK细胞的分化和增殖,而对于功能方面利用YFP阳性细胞进行杀伤实验,也有着重要的作用,因此,这个系统的建立可以更加深入地探讨NK细胞地发育和功能方面的问题,为免疫细胞的研究提供了方向。
[1] Zhang C,Tian Z.NK cell subsets in autoimmune diseases[J].J Autoimmun,2017,83:22
[2] Post M,Cuapio A,Osl M,et al.The Transcription factor ZNF683/HOBIT regulates human NK-cell development[J].Front Immunol,2017,8:535
[3] Holmes M L,Huntington N D,Thong R P,et al.Peripheral natural killer cell maturation depends on the transcription factor Aiolos[J].EMBO J,2014,33(22):2721
[4] Bollino D,Webb T J.Chimeric antigen receptor-engineered natural killer and natural killer T cells for cancer immunotherapy[J].Transl Res,2017,187:32
[5]Sun J C,Lanier L L.NK cell development,homeostasis and function:parallels with CD8(+)T cells[J].Nat Rev Immunol,2011,11(10):645[6] Lopez-Soto A,Gonzalez S,Smyth M J,et al.Control of metastasis by NK cells[J].Cancer Cell,2017,32(2):135
[7] Narni-Mancinelli E,Chaix J,Fenis A,et al.Fate mapping analysis of lymphoid cells expressing the NKp46 cell surface receptor[J].Proc Natl Acad Sci U S A,2011,108(45):18324
[8] Deng Y,Kerdiles Y,Chu J,et al.Transcription factor Foxo1 is a negative regulator of natural killer cell maturation and function[J].Immunity,2015,42(3):457
[9] Male V,Brady H J.Transcriptional control of NK cell differentiation and function[J].Curr Top Microbiol Immunol,2014,381:173
[10]Moretta L,Montaldo E,Vacca P,et al.Human natural killer cells:origin,receptors,function,and clinical applications[J].Int Arch Allergy Immunol,2014,164(4):253
[11]Paolini R,Bernardini G,Molfetta R,et al.NK cells and interferons[J].CytokineGrowthFactorRev,2015,26(2):113
[12]Levy E M,Roberti M P,Mordoh J.Natural killer cells in human cancer:from biological functions to clinical applications[J].J Biomed Biotechnol,2011,2011:676198
[13]Hsu H T,Mace E M,Carisey A F,et al.NK cells converge lytic granules to promote cytotoxicity and prevent bystander killing[J].J Cell Biol,2016,215(6):875
[14]Leavy O.Maturation and function of NK cells[J].Nat Rev Immunol,2012,12(3):150
[15]Guan C,Ye C,Yang X,et al.A review of current large-scale mouse knockout efforts[J].Genesis,2010,48(2):73

