不同产羔数小尾寒羊FOXL2和FIGLA基因的表达研究*
周 梅,曹晓涵,贺小云,孙 庆,狄 冉,胡文萍,王翔宇,张效生,张金龙, 刘秋月*,储明星*
(1.中国农业科学院 北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193;2.天津市畜牧兽医研究所,天津 300381)
绵羊的产羔数性状是由微效多基因控制的,且遗传力很低,这极大地制约了养羊业的发展。我国除小尾寒羊和湖羊等少数绵羊品种产多羔以外,其余绝大部分绵羊品种均产单羔。因此,对影响绵羊产羔数性状相关基因进行研究对于提高绵羊繁殖效率、加快绵羊育种进程、提高绵羊产业的经济效益均非常重要。
叉头框转录因子(forkhead box L2,FOXL2)是叉头框核转录因子3基因家族成员之一,在哺乳动物卵巢生长和成熟过程中发挥非常关键的作用[1-2]。FOXL2基因在进化上高度保守,它与类固醇激素合成因子(steroidogenic factor-1,SF-1)相互作用对于雌性动物的卵泡发育非常重要[3]。卵泡特定的神经蛋白转录因子(folliculargenesis specific BHLH transcription factor,FIGLA)基因编码的是一种螺旋-环-螺旋型的碱性转录因子,它是一种在生殖细胞中特异性表达的转录因子,能够参与卵泡生成和性腺分化等过程[4-5]。FIGLA基因在雌性生殖细胞中的表达要远远高于雄性生殖细胞,并且能够在卵子发生过程中上调雌性特异性相关基因的表达,同时下调雄性特异性相关基因的表达[6]。
研究表明,FOXL2和FIGLA基因均在哺乳动物下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis,HPG)表达量较高,而HPG是控制哺乳动物性激素分泌的最重要的系统,下丘脑分泌的促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)对促卵泡素(follicle-stimulating hormone,FSH)和促黄体素(luteinizing hormone,LH)等重要生殖激素的分泌有着非常关键的调控作用[7],因此,推测FOXL2和FIGLA基因可能通过调节相关生殖激素的分泌,进而影响卵泡发育和卵子发生,最终对排卵活动产生影响。绵羊的产羔数直接受到排卵数的影响,因此猜测FOXL2和FIGLA基因可能与绵羊产羔数性状有关。本研究对FOXL2和FIGLA基因在多羔和单羔小尾寒羊8个组织间的表达水平进行研究,以揭示其影响绵羊产羔数的机制,为绵羊分子育种提供依据。
1 材料与方法
1.1 样品采集和主要试剂
单、多羔小尾寒羊均来自天津市畜牧兽医研究所种羊场。从每个群体分别挑选2~3岁健康状况良好且处于非繁殖状态的成年母羊各3只。在同期发情后第7天对挑选的绵羊进行屠宰,采集大脑、小脑、下丘脑、垂体、卵巢、输卵管、子宫体和子宫角8种组织,尽快将采集的新鲜组织装入2 mL的RNase-Free冻存管中,并立即置于液氮中保存,带回实验室后全部转移至-80 ℃保存备用。
RNA提取试剂盒购于天根生化科技有限公司(北京),反转录试剂盒(PrimeScriptTMRT Reagent Kit)和荧光定量染料(SYBR○RPremix Ex TaqTMⅡ)均购于TaKaRa公司(大连);Taq PCR Master Mix购于拓英坊科技有限公司(北京)。
1.2 组织总RNA的提取和检测
采用动物组织总RNA提取试剂盒(天根,北京)加Trizol(Invitrogen, 美国)提取各组织总RNA,并用Nanodrop2000检测RNA的浓度和OD值;利用1.2%的琼脂糖凝胶电泳检测RNA的完整性。
1.3 引物设计
根据GenBank提供的绵羊FOXL2和FIGLA基因mRNA序列(登录号分别为:NM_023067.3, NM_001004311.3),利用Primer 3软件进行跨外显子引物设计,以β-actin(NM_001009784)作为内参基因。引物由北京天一辉远生物科技有限公司合成。引物名称和序列、退火温度以及扩增片段大小见表1。

表1 绵羊FOXL2和FIGLA基因的引物信息Table 1 Primer information of FOXL2 and FIGLA genes in sheep
1.4 cDNA合成
利用反转录试剂盒反转录合成cDNA,反转录体系总体积为20 μL:PrimeScript RT Enzyme Mix Ⅰ 1.0 μL,Oligo dT Primer 1.0 μL,Random 6 mers 1.0 μL,5×PrimeScript Buffer (for Real Time) 4.0 μL,RNA 1.0 μL,再用RNase-Free ddH2O将总体积补至20 μL。反转录反应条件为:37 ℃ 15 min,85 ℃ 5 s,获得cDNA第一链。反转录产物进行5倍稀释,用于检测目的基因的表达。
1.5 PCR反应
PCR反应体系反应体系总体积为20 μL:Taq PCR Master Mix 10 μL,上下游引物各0.5 μL,cDNA 模板1.0 μL,ddH2O 8.0 μL。反应程序为:95 ℃预变性5 min;95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min;4℃保存。1.5%琼脂糖凝胶电泳检测PCR产物大小。
1.6 实时荧光定量PCR
1.6.1 实时荧光定量PCR体系和程序 反应体系总体积为20 μL:SYBR Premix Ex TaqⅡ 10 μL,上下游引物各0.8 μL,cDNA 模板2.0 μL,ddH2O 6.4 μL。反应程序为:95 ℃预变性5 s,95 ℃变性5 s,60 ℃ 30 s,40个循环;反应结束后对熔解曲线进行分析。
1.6.2 标准曲线的建立 将cDNA样本5倍稀释后,进行2倍梯度稀释获得5个浓度梯度(1、1/2、1/4、1/8、1/16)的cDNA样品。用这些cDNA作为模板对目的基因和持家基因进行荧光定量PCR,以浓度梯度的对数值(10为底数)为横坐标,以检测所得Ct值为纵坐标,绘制目的基因和持家基因标准曲线。
1.6.3 实时荧光定量检测与数据分析 荧光定量检测利用Roche Light Cycler○R480Ⅱ型荧光定量PCR仪进行,以β-actin为内参基因,每个样品设3个重复。采用2-ΔΔCt法计算目的基因相对表达量,用SPSS20.0统计软件对数据进行分析,用一般线性模型及最小显著差异(least significant difference, LSD)法进行单因素方差分析。
2 结果与分析
2.1 总RNA提取与cDNA合成
利用1.2%琼脂糖凝胶电泳对RNA完整性进行检测,试验结果表明,提取的RNA均无明显降解(图1),能够满足后续试验要求,以反转录之后的cDNA为模板对FOXL2、FIGLA和β-actin进行PCR扩增,设计的FOXL2、FIGLA和β-actin三对引物扩增效果良好(图2),目的片段与预期的97 bp、131 bp和97 bp一致,且条带单一,可以用于后续的荧光定量试验。
图1 8个组织RNA电泳检测
M. DL2000 DNA Marker;1.大脑;2.小脑;3.下丘脑;4.垂体;
5.卵巢;6.输卵管;7.子宫体;8.子宫角
Fig.1 Electrophoresis of the RNA from eight tissues
M. DL2000 DNA Marker;1. brain;2. cerebellum;3. hypothalamus;
4. pituitary;5. ovary;6. oviduct;7. uterus body;8. uterine horn
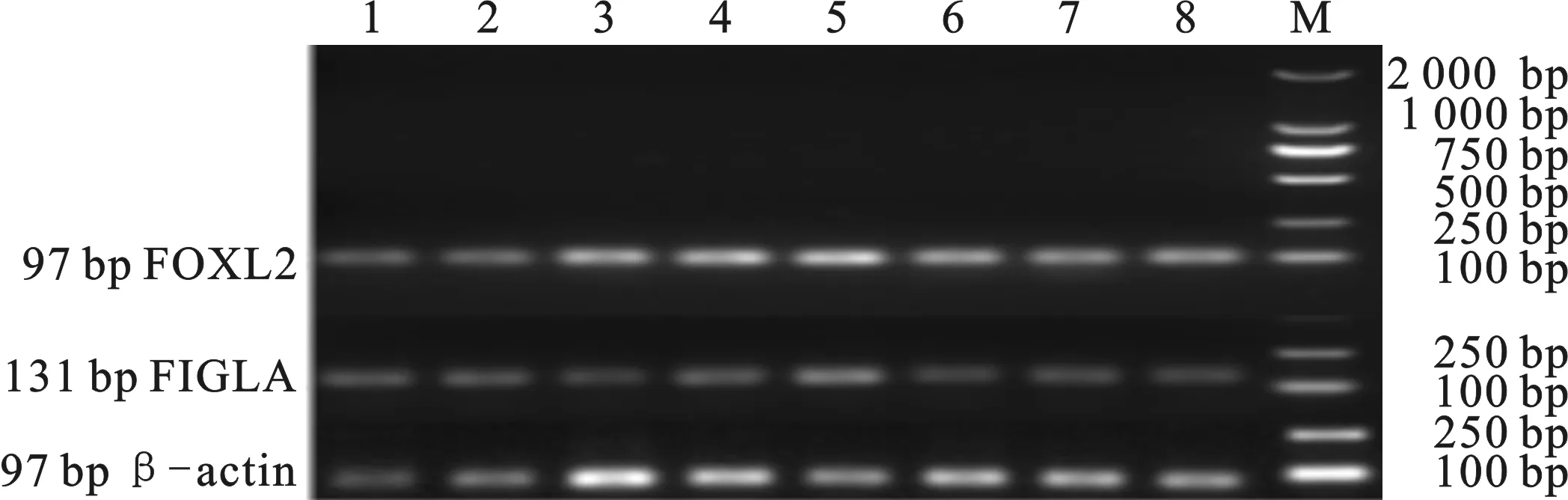
图2 FOXL2、FIGLA和β-actin在8个组织中的PCR产物电泳检测
M.DL2000 DNA Marker;1.大脑;2.小脑;3.下丘脑;4.垂体;
5.卵巢;6.输卵管;7.子宫体;8.子宫角
Fig.2 Electrophoresis of the PCR products of FOXL2、FIGLA
and β-actin in eight tissues M.DL2000 DNA Marker;1. cerebrum;2. cerebellum;3. hypothalamus;4. pituitary;5. ovary;6. oviduct;7. uterus body ;8. uterine horn
2.2 FOXL2和FIGLA基因在单、多羔小尾寒羊繁殖相关组织中的表达
运用荧光定量PCR对多羔和单羔小尾寒羊8个繁殖相关组织FOXL2和FIGLA基因的表达进行了研究,结果见表2。由表2可见,FOXL2基因和FIGLA基因在单、多羔小尾寒羊8个组织中均能表达,其中,FOXL2基因在多羔小尾寒羊各组织中表达量由高到低是卵巢、垂体、子宫体、输卵管、子宫角、下丘脑、小脑以及大脑;而在单羔小尾寒羊各组织中表达量由高到低是卵巢、垂体、下丘脑、子宫角、子宫体、输卵管、小脑以及大脑;且FOXL2基因在多羔小尾寒羊小脑和子宫体中的表达量显著高于单羔组(P<0.05),但在多羔小尾寒羊垂体和卵巢中的表达量显著低于单羔组(P<0.05),在多羔小尾寒羊下丘脑中的表达量极显著低于单羔组(P<0.01),在其它各组织间的表达差异不显著(P>0.05)。FIGLA基因在多羔小尾寒羊各组织中表达量由高到低是卵巢、下丘脑、输卵管、垂体、子宫体、大脑、子宫角以及小脑;而在单羔小尾寒羊各组织中表达量由高到低是卵巢、垂体、输卵管、下丘脑、子宫体、小脑、子宫角以及大脑;在多羔小尾寒羊大脑中的表达量显著高于单羔组(P<0.05),在其它各组织间表达差异均不显著(P>0.05)。

表2 FOXL2和FIGLA基因在多羔和单羔小尾寒羊各组织中的表达Table 2 Expression of FOXL2 and FIGLA gene in each tissue between multiparous and uniparous Small Tail Han Sheep
注:同组不同肩标小写字母之间表示差异显著(P<0.05),同组不同肩标大写字母之间表示差异极显著(P<0.01)。
Note:Values with different small letter superscripts in the same group mean significant difference(P<0.05), different capital letter superscripts mean extremely significant difference (P<0.01).
3 讨 论
本研究通过提取非繁殖状态的多羔和单羔小尾寒羊繁殖相关组织RNA,并用RT-PCR技术检测了FOXL2和FIGLA基因在大脑、小脑、下丘脑、垂体、卵巢、输卵管、子宫体以及子宫角8个组织中的表达情况,发现无论单羔还是多羔小尾寒羊,FOXL2和FIGLA mRNA均在卵巢中表达量最高,在下丘脑、垂体、输卵管、子宫体和子宫角中呈中等丰度表达,在大脑和小脑中表达量相对较低。也就是说,FOXL2和FIGLA基因均在HPG各组织中表达量较高,这与Leung等[8]曾报道的FOXL2基因在HPG中表达量较高是吻合的,而HPG是控制哺乳动物性激素分泌的最重要的系统[9],其中下丘脑和垂体是哺乳动物生殖内分泌活动的控制中心,卵巢是雌性动物最重要的生殖器官,是卵子生成及多种生殖激素(如雌激素、孕激素)等分泌的场所,对雌性动物的生殖能力有决定性的影响。而FOXL2和FIGLA基因均在HPG轴高表达,这表明二者很有可能在绵羊生殖活动中发挥重要作用。
研究表明,无论垂体、卵巢还是子宫组织FOXL2基因功能的缺失均会导致雌性小鼠丧失生殖能力[10]。FOXL2基因对于卵巢功能的的维持非常重要,能够激活雌激素信号通路,对颗粒细胞的增殖和分化尤其重要[8,11]。然而,过表达FOXL2基因会对正常大鼠颗粒细胞产生促凋亡作用,同时还能通过调节转化生长因子β(transforming growth factor β,TGFβ)信号通路中活化素和卵泡抑制素的表达实现抑制颗粒细胞增殖的作用[8,12]。FIGLA基因对于卵泡形成很重要,并且能够激活小鼠卵子发生过程中卵母细胞相关基因的表达[13]。另外,FIGLA基因还具有双重作用,FIGLA基因敲除雌性小鼠的卵巢中因无法形成原始卵泡而使其丧失生殖能力,而雄性FIGLA基因敲除小鼠的表型则不会有明显变化[6]。
本研究发现FOXL2基因在多羔小尾寒羊小脑和子宫体中的表达量显著高于单羔组(P<0.05),但在多羔小尾寒羊垂体和卵巢中的表达量显著低于单羔组(P<0.05),在多羔小尾寒羊下丘脑中的表达量极显著低于单羔组(P<0.01),推测FOXL2基因可能在产羔数性状中起到一定的调控作用。FOXL2基因可能通过上调其在单羔小尾寒羊中的表达量从而抑制卵泡发育或卵子发生过程中相关基因的转录,进而对绵羊的产羔数产生影响。FIGLA基因仅在多羔小尾寒羊大脑中的表达量显著高于单羔组(P<0.05),在其它各组织间表达差异均不显著(P>0.05),但其在单、多羔小尾寒羊HPG中表达量整体较高,表明该基因在动物生殖活动中扮演重要角色,但其本身功能与产羔数无关,可能通过调控其他基因的表达或相关激素的分泌而对绵羊的产羔数产生影响,这还有待于进一步研究。
[1] QIN Ning, FAN Xiancong, XU Xiaoxing, et al. Cooperative effects ofFOXL2 with the members of TGF-β superfamily on FSH receptor mRNA expression and granulosa cell proliferation from hen prehierarchical follicles[J]. PLoS ONE, 2015, 10(10): e0141062.
[2] BELLESSORT B, BACHELOT A, HEUDE É, et al. Role ofFOXL2 in uterine maturation and function[J]. Human Molecular Genetics, 2015, 24(11): 3 092-3 103.
[3] JIN Hanyong, WON M, PARK S E, et al.FOXL2 is an essential activator of SF-1-Induced transcriptional regulation of Anti-Müllerian hormone in human granulosa cells[J]. PLoS ONE, 2016, 11(7): e0159112.
[4] QIU Yongxiu, SUN Shaohua, CHARKRABORTY T, et al. Figla favors ovarian differentiation by antagonizing spermatogenesis in a teleosts, Nile tilapia (oreochromis niloticus)[J]. PLoS ONE, 2015, 10(4): e0123900.
[5]KLEPPE L, EDVARDSEN R B, FURMANEK T, et al. bmp15l, figla, smc1bl, and larp6l are preferentially expressed in germ cells in Atlantic salmon (salmo salar L.)[J]. Molecular Reproduction and Development, 2017, 84(1): 76-87.
[6]LIN R S, JIMENEZ-MOVILLA M, DEAN J. Figla-Cre transgenic mice expressing myristoylated EGFP in germ cells provide a model for investigating perinatal oocyte dynamics[J]. PLoS ONE, 2014, 9(1): e84477.
[7]HERNDON M K, NILSON J H. Maximal expression ofFOXL2 in pituitary gonadotropes requires ovarian hormones[J]. PLoS ONE, 2015, 10(5): e0126527.
[8] LEUNG D T, FULLER P J, CHU S. Impact ofFOXL2 mutations on signaling in ovarian granulosa cell tumors[J]. International Journal of Biochemistry & Cell Biology, 2016, 72: 51-54.
[10] PANNETIER M, CHASSOT A A, CHABOISSIER M C, et al. Involvement ofFOXL2 and RSPO1 in ovarian determination, development, and maintenance in mammals[J]. Sexual Development : Genetics, Molecular Biology, Evolution, Endocrinology, Embryology, and Pathology of Sex Determination and Differentiation, 2016, 10(4): 167-184.
[11] GEORGES A, L'HTE D, TODESCHINI A L, et al. The transcription factorFOXL2 mobilizes estrogen signaling to maintain the identity of ovarian granulosa cells[J]. ELife, 2014, 3: e04207.
[12] CHENG J C, CHANG H M, QIU Xin, et al.FOXL2-induced follistatin attenuates activin A-stimulated cell proliferation in human granulosa cell tumors[J]. Biochemical and Biophysical Research Communications, 2014, 443(2): 537-542.
[13] FU Liyuan, ZHANG Mingxiang, MASTRANTONI K, et al. Bovine Lhx8, a germ Cell-Specific nuclear factor, interacts with figla[J]. PLoS ONE, 2016, 11(10): e0164671.

