多糖的氧化改性及在生物医药领域的应用
訾娅鑫,雷金凤,徐志朗,李德富,穆畅道
(四川大学 化学工程学院,四川 成都 610065)
多糖是一类重要的生物大分子物质,它几乎存在于所有生命有机体中。多糖来源广泛、可环境降解、可再生、对人体安全无毒,并且具有结构和功能的多样性[1]。化学改性是进一步提高多糖物化性能的有效方法,可以改善多糖的力学性能、生物相容性、水溶性、生物降解可控性和可塑性等。多糖的化学改性一般有氧化、硫化、酯化、醚化和酰胺化等几种[2-3]。其中,氧化是多糖化学改性中最为简单和广泛的方法之一。
多糖特殊的链构象可以赋予其良好的生物活性。如,灵芝多糖和香菇多糖具有抗菌、抗氧化、降血糖和抗癌等活性,常被用作功能性食品或保健品的添加剂[4]。多糖较大的分子结构也赋予了多糖增稠、凝胶、黏合和成膜性等特点,使其广泛应用于食品和医药等行业。例如,淀粉是理想的药物赋形剂[5],海藻酸钠可用于皮肤用膏剂的增稠[6],κ-卡拉胶通常在食品加工中作为乳化剂、胶凝剂、悬浮稳定剂、增稠剂等食品辅助剂使用[7]。
氧化可以改善多糖的多种性能,使其在生物医药领域有着更丰富及精确的应用。例如,氧化纤维素由于具有优良的促凝血性而被用作止血材料,氧化壳聚糖由于具有良好的生物降解性被用于手术缝合线的原材料[8]。此外,双醛淀粉由于可与体内代谢产物尿素、氨等发生化学反应形成席夫碱,而被制成口服剂用于治疗肾衰竭的尿毒症病人[9]。本文中,笔者将对氧化多糖的不同制备方法及在生物医药领域的3个相关用途进行综述。
1 氧化多糖的制备方法
1.1 高碘酸盐氧化法
高碘酸盐氧化是一种高度专一的选择性氧化反应,可以特异性地将多糖链中葡萄糖残基上的邻二羟基氧化裂解为具有高度还原性的二醛基,得到双醛多糖[10]。图1为多糖分子链末端(非还原端)、(1,4)-连接及(1,3)-连接的葡萄糖残基的高碘酸盐氧化过程示意图[10]。高碘酸盐氧化多糖的过程中,末端葡萄糖残基(非还原端)的C2—C3和C3—C4被双重氧化,C2和C4位形成醛基,C3被氧化为甲酸释放;以(1,4)-连接的葡萄糖残基在C2—C3发生断裂形成双醛基;以(1,3)-连接的葡萄糖残基(非末端)不能被氧化。此外,从单糖分子的构象分析,邻二羟基在环中的取向为平伏键-平伏键或平伏键-直立键时可以被氧化,而以直立键-直立键存在时,由于中间复合物无法形成而不能被氧化[10]。
高碘酸盐氧化法被广泛用于制备双醛多糖,如双醛海藻酸钠、双醛壳聚糖、双醛透明质酸、双醛裂褶菌多糖和双醛纤维素等[10-11]。通常,在酸性条件下,高碘酸盐的氧化选择性更高,反应速度更快,所得双醛多糖产品的醛基含量更高。不过,酸性条件易催化断裂糖苷键(图2),造成多糖的降解和氧化产物产率的降低[12-13]。如,采用高碘酸盐氧化制备双醛羧甲基纤维素,当反应体系的pH为2时,双醛羧甲基纤维素的醛基含量达到最高,但产率不超过50%;当增加反应体系pH时,双醛羧甲基纤维素醛基含量相应减少,但产率大幅提高[14]。此外,高碘酸盐本身不稳定,见光易分解,所以氧化过程需在遮光条件下进行。
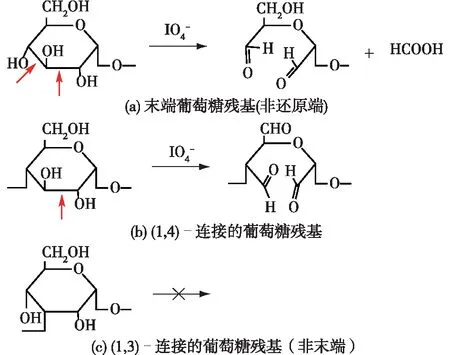
图1 高碘酸盐氧化多糖分子中不同类型葡萄糖残基Fig.1 General principles of periodate oxidation of polysaccharides illustrated by residues of glucose

图2 酸催化断裂双醛羧甲基纤维素β-(1,4)糖苷键的机制Fig.2 Mechanism of acid-catalyzed hydrolysis of DCMC by cleavage of β-(1,4)-glycosidic bond
1.2 次氯酸钠氧化法
次氯酸钠常用于淀粉、纤维素、卡拉胶和果胶等多糖的氧化,其中,单独使用次氯酸钠氧化淀粉的研究最为广泛和透彻[15-16],而其他多糖多采用2,2,6,6-四甲基哌啶-1-氧自由基(TEMPO)/NaBr/NaClO体系达到对伯羟基特异性氧化的目的[17]。工业生产中,通常采用次氯酸钠对淀粉进行氧化,以得到颜色增白,糊化温度和黏度降低,稳定性、成膜性和透明度均优良的氧化淀粉。次氯酸钠氧化淀粉的机理十分复杂,不但与反应条件有关,还与淀粉的品种和存在形式密切相关。次氯酸钠氧化淀粉的各种反应位点如图3所示[15]。在氧化反应过程中,当氧化淀粉羧基含量较少时(低于0.1%),氧化主要发生在C1碳原子上,有少部分发生在C6碳原子上,C2和C3碳原子上不发生氧化。随着氧化淀粉中羧基含量的增加(0.6%~2.5%),C1、C2、C3和C6碳原子都发生氧化,而且主要在C1、C2和C3碳原子上[18]。次氯酸钠氧化淀粉的影响因素主要包括反应体系pH、温度、时间、次氯酸钠浓度、淀粉分子结构和淀粉来源等[19]。表1列举了部分不同来源淀粉的次氯酸钠氧化优化工艺条件[15]。次氯酸钠在不同酸碱条件下氧化淀粉的速率不同,在酸性、碱性条件下反应较慢,在中性或微酸、微碱环境下反应较快。在酸性条件下,淀粉被质子化或水解,次氯酸钠以HOCl或Cl2形式存在;在碱性条件下,淀粉和碱形成盐,次氯酸钠主要以ClO-的形式存在;在中性、微酸或微碱性介质中,次氯酸钠主要呈非解离状态,淀粉呈中性。非解离的次氯酸盐容易与呈中性的淀粉产生淀粉次氯酸酯和水,酯分解产生氧化产物和氯化氢[18,20]。氧化淀粉的制备过程中,其氧化度会随次氯酸钠溶液中有效氯含量的增加而提高,随直链淀粉含量增加而降低[15]。不过,在碱性条件下可以得到羧基含量更高的氧化淀粉[21]。

图3 次氯酸钠氧化淀粉的各反应位点Fig.3 Reaction sites for oxidation of starch with sodium hypochlorite
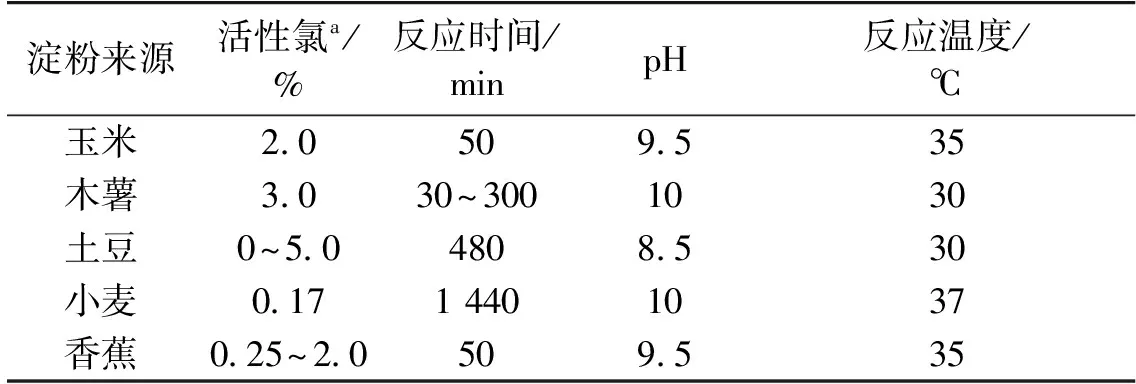
表1 次氯酸钠氧化不同来源淀粉的优化工艺条件
注:a—基于淀粉质量的次氯酸钠中活性氯的添加量,质量分数。
TEMPO/NaBr/NaClO体系是应用最多的选择性氧化多糖伯羟基的体系[22-24]。在TEMPO-介导的氧化反应中,TEMPO经过单电子氧化后转化成相应的硝酰基阳离子,成为具有强氧化性的氧化剂,可以快速地将多糖的C6伯羟基氧化成醛基而其他羟基不受影响,同时,NaClO和NaBr反应生成的NaBrO会进一步将醛基氧化成羧基[25]。图4为TEMPO/NaBr/NaClO体系选择性氧化κ-卡拉胶C6伯羟基的机制[23]。Chang等[26]研究了10种天然多糖在TEMPO/NaBr/NaClO体系中的氧化条件(温度和pH)和产品性能(产率、选择性、氧化度和水溶性等)之间的对应关系,结果发现:在0 ℃和pH 10.8的条件下,TEMPO/NaBr/NaClO对多糖的伯羟基氧化选择性最高,小麦淀粉和普鲁兰多糖高达100%,纤维素的选择性最低为84%,而且产率均很高,平均达到95%左右。
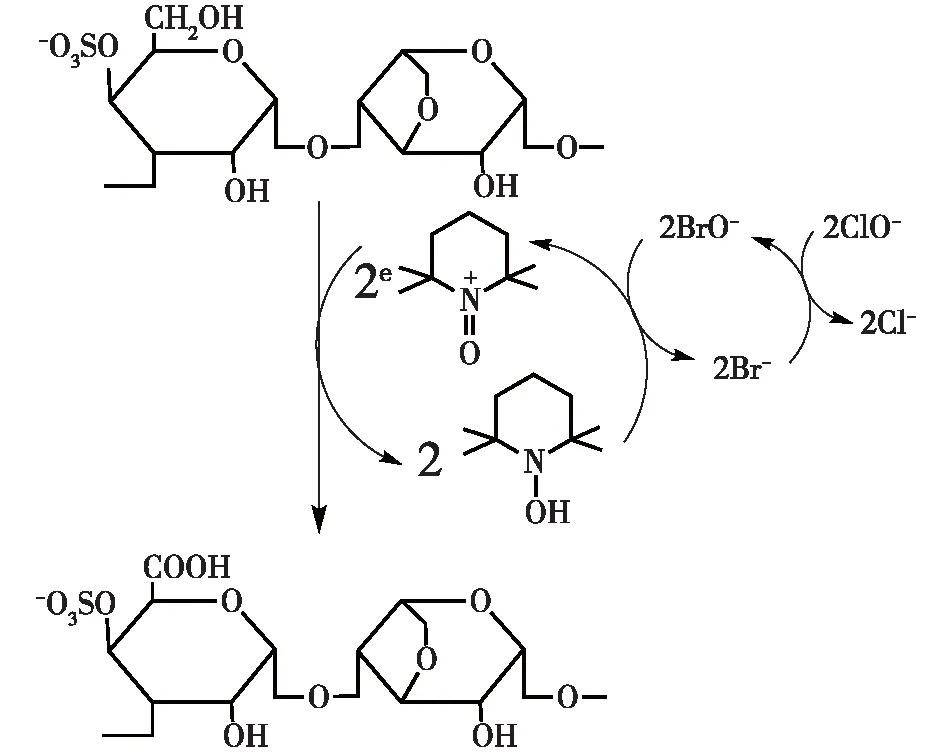
图4 TEMPO/NaBr/NaClO对κ-卡拉胶C6 伯羟基的选择性氧化机制Fig.4 General mechanism of oxidation of κ-carrageenan with TEMPO/NaBr/NaClO
1.3 过氧化氢氧化法
次氯酸钠虽然价格低廉、氧化效果好,但其易分解放出氯气,影响操作者健康。与次氯酸钠相比,过氧化氢的分解产物为O2和H2O,其氧化多糖的过程中不产生任何有毒有害的副产物,绿色环保,受到研究者的青睐。在无氯氧化中,过氧化氢是被研究最为广泛的氧化剂。
单独采用过氧化氢氧化多糖所需的时间较长,得到的产品氧化度较低,而引入金属催化剂可以大大提升氧化反应速率[27]。金属离子中催化效率以Cu2+最为突出,0.5%(质量分数)的CuSO4就足以让玉米淀粉氧化反应的时间从72 h减少到1 h[28]。金属离子催化的过氧化氢氧化多糖的机理较为复杂,推测是通过自由基链式反应完成,反应机制如图5所示[15]。在金属离子的催化作用下,过氧化氢迅速分解产生羟基自由基(·OH),这些高反应活性的自由基容易与多糖链中葡萄糖环上C—H中的H结合形成新的自由基(R·CHOH),其进一步经历酸或碱的催化重排后使糖苷键裂解和羰基形成[29]。过氧化氢氧化法中,主要是多糖的伯羟基被氧化生成醛基,还有少量被继续氧化生成羧基[15]。改进制备工艺也会得到羧基含量远高于醛基含量的产品。本课题组曾采用干湿结合的两步氧化法制备得到羧基含量(8.16%)远高于醛基含量(0.36%)的氧化直链淀粉[30]。不过,过氧化氢氧化体系的金属离子催化剂用量需要被严格控制,过低不足以提高反应效率,过高会使多糖染色并且伴随其他副反应的发生[15]。
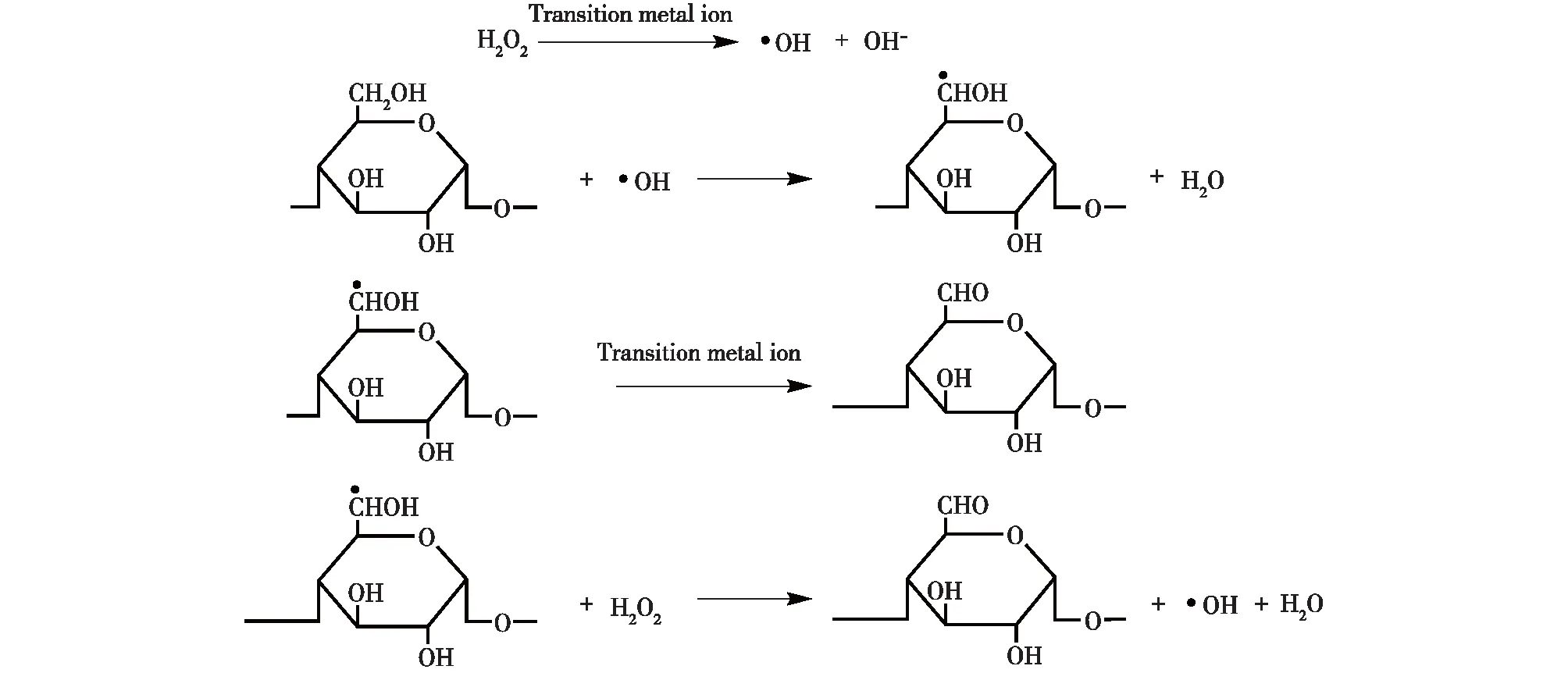
图5 过氧化氢氧化淀粉的过程Fig.5 Hydrogen peroxide oxidation of starch
2 氧化多糖在生物医药领域的应用
目前,氧化多糖已被广泛应用于食品、医药、造纸、纺织和冶金等行业。此外,氧化多糖分子上的醛基可以与蛋白质的氨基发生席夫碱交联反应,使其可以用作蛋白基生物材料的交联剂。氧化多糖分子上的羧基和醛基还可以赋予氧化多糖广谱抗菌性能。而且,氧化多糖作为包合物主体,可将疏水性药物通过包合作用引入水环境中,实现药物的增溶和缓释。本文中,笔者将主要对氧化多糖在蛋白基生物材料交联剂、包合物制备和新型抗菌剂等生物医药领域的应用进行介绍。
2.1 用作蛋白基生物材料交联剂
双醛多糖的醛基可以与蛋白质的氨基发生席夫碱反应起到交联作用,从而提升蛋白质的结构和热稳定性[31],而且,双醛多糖具有良好的生物降解性和生物相容性[32],因此,双醛多糖可以用作蛋白基生物材料的交联剂。
双醛葡甘聚糖和双醛硫酸软骨素曾作为交联剂用于制备有望用作创伤敷料的胶原和明胶基医用水凝胶[33-34]。双醛普鲁兰多糖交联改性的胶原材料对细胞的三维培养和组织构建有很强的适用性[35]。笔者所在课题组也曾使用双醛淀粉(DAS)[36]和双醛羧甲基纤维素钠(DCMC)[37]交联改性胶原,制备海绵状的医用冷冻凝胶,所得样品及反应机制如图6所示[36]。胶原与双醛多糖之间可以发生席夫碱反应,而且交联后胶原分子仍保持其三股螺旋结构,所以冷冻凝胶延续了胶原蛋白低免疫原性和高生物活性的特点。此外,本课题组曾使用DCMC交联改性明胶制备凝胶纤维,结果发现该凝胶纤维的力学性能、酶降解稳定性和血液相容性均有所提升,而且具有三维多孔网络结构和低细胞毒性,可用于生物医学材料[32]。戊二醛常用于蛋白基生物材料的交联改性,但小分子醛类物质在体内容易扩散并抑制细胞生长、引发炎症及钙化等不良反应[37]。双醛多糖具有良好的交联活性和生物相容性,其大分子的本质使其在体内不易扩散,可以取代戊二醛等传统小分子醛类用于交联改性蛋白基生物材料,在医学领域有良好的应用前景。
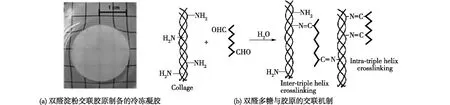
图6 双醛淀粉交联胶原制备的冷冻凝胶照片及双醛多糖与胶原交联机制Fig.6 Photograph of the DAS/collagen cryogel and schematic illustration for the reaction of collagen with dialdehyde polysaccharide
2.2 在包合物制备中的应用
多种多糖分子在溶液中会形成特殊的空腔结构,可包合客体小分子。氧化多糖可将医药领域中具有杀菌、消炎和抗病毒等功能的疏水性及易挥发性的活性药物进行包合,实现缓释、控释和靶向给药的目的[38],而且,化学氧化使多糖的水溶性得到大幅提升,从而可以将包合物应用于水环境。
氧化多糖中使用空腔结构实现包合的代表性物质为氧化直链淀粉,其可以在水中形成疏水性的螺旋腔,空腔内部可以通过疏水作用和范德华力将客体分子进行包合。本课题组曾使用氧化直链淀粉包合具有抗菌活性的疏水性的芳樟醇,将其成功引入到水环境中,既提升了芳樟醇在水溶液中的稳定性,又起到了缓释作用,可更长久和有效地发挥芳樟醇的抗菌作用[30,39]。而且,笔者所在课题组进一步将氧化直链淀粉/芳樟醇包合物与胶原复合,成功制备了一种抗菌型医用敷料,结果表明:氧化直链淀粉包合可以有效地将芳樟醇引入到胶原介质中。该复合医用敷料具有广谱抗菌性、良好的血液相容性和细胞相容性,能促进伤口愈合,防止出现炎症和疤痕[40]。
另外,许多氧化多糖可以与Ca2+等形成具有三维结构的水凝胶,在溶胶-凝胶的转变过程中可将小分子活性物质引入网状的凝胶中实现包合。此外,氧化多糖具有大量的反应活性基团(—COOH、—NH2和—OH等),可以通过进一步化学改性得到种类繁多的两亲分子衍生物[41],其在特殊的溶液中能够自组装形成纳米结构的稳定胶束来实现对小分子活性物质的包合。其中,胶束疏水性的核可以为疏水性的药物提供安全存储区,而亲水性的壳可以在水环境中很好地保护核[42]。
2.3 用作新型抗菌剂
近年来,氧化多糖作为一种新型绿色抗菌剂受到越来越多的关注。氧化再生纤维素(oxidized regenerated cellulose,ORC)是通过将纤维素C6位的伯羟基特异性氧化为羧基而制得,它是氧化多糖中最具代表性的医用抗菌止血剂[43-44]。Dineen等[43]发现ORC对金黄色葡萄球菌、铜绿假单胞菌和乙酸钙不动杆菌有良好的抑制效果。不过,ORC的抗菌活性主要是通过其羧基引起的pH效应实现的,其抗菌活性很容易通过调节环境pH而失去[43,45]。除羧基化多糖外,醛化多糖也具有良好的抗菌活性。双醛裂褶菌多糖对枯草芽孢杆菌、铜绿假单胞菌、大肠杆菌、霍乱弧菌、伤寒沙门氏菌、奇异变形杆菌、金黄色葡萄球菌、肺炎克雷伯菌和痢疾杆菌等革兰氏阳性和阴性菌都具有很好的抑制效果,且浓度越高抗菌活性越强[46]。此外,双醛淀粉对金黄色葡萄球菌和大肠杆菌均有良好的抑制作用[9]。笔者所在课题组曾系统研究了氧化κ-卡拉胶的抗菌性能,发现氧化κ-卡拉胶可以破坏细菌的细胞外膜,抑制革兰氏阳性和阴性菌的生长,具有广谱抗菌性[47]。醛化多糖的抗菌活性主要与其醛基有关。醛基是一个活性基团,它与细菌的细胞外表面具有多种相互作用,特别是与未质子化的氨基发生席夫碱反应,从而抑制细菌的物质运输和酶系统,造成细菌的凋亡[47]。氧化多糖对人体无毒无害,可环境降解、可再生,是一种理想的新型绿色抗菌剂。
3 结论与展望
氧化是多糖化学改性中最为简单和广泛的方法之一,它将多糖的大量羟基转变为醛基和羧基,从而改善多糖的分散性、黏合性、透明度和成膜性等。目前,氧化多糖已被广泛应用于食品、医药、造纸、纺织和冶金等行业。此外,氧化多糖分子上的醛基可以与蛋白质的氨基发生席夫碱交联反应,使其可以用作蛋白基生物材料的交联剂。氧化多糖分子上的羧基和醛基还可以赋予氧化多糖广谱抗菌性能,而且,氧化多糖作为包合物主体可将疏水性药物通过包合作用引入水环境中,实现药物的增溶和缓释。因此,氧化多糖在生物医药领域具有良好的应用前景。不过,现有的多糖氧化方法尚存一些无法避免的缺陷;次氯酸钠氧化效率较高,但是氧化过程释放的含氯物质会影响操作者健康;过氧化氢是一种绿色清洁的氧化剂,但氧化过程使用的金属催化剂也会造成环境污染;高碘酸盐氧化得到的双醛多糖活性较高,但价格较高,目前只用于实验室。因此,需要进一步研究开发新型成本低廉、高效的绿色多糖氧化技术。
[1] REDDY K,KRISHNA MOHAN G,SATLA S,et al.Natural polysaccharides:versatile excipients for controlled drug delivery systems[J].Asian J Pharm Sci,2011,6(6):275-286.
[2] YANG J,XIE Y,HE W.Research progress on chemical modification of alginate:a review[J].Carbohydr Polym,2011,84:33-39.
[3] D′AYALA G G,MALINCONICO M,LAURIENZO P.Marine derived polysaccharides for biomedical applications:chemical modification approaches[J].Molecules,2008,13(9):2069-2106.
[4] 董群,方积年.多糖在医药领域中的应用[J].中国药学杂志,2001,36(10):649-652.
[5] 王松涛,张静,林晓,等.一种基于乳糖与糊化淀粉的新型共处理辅料研究[J].中国中药杂志,2014,39(22):4329-4334.
[6] 张莉华,李科,卜方方.海藻酸钠在药物制剂中的应用进展[J].中南药学,2016,14(1):52-56.
[7] 袁超,桑璐媛,刘亚伟.k-卡拉胶的功能特性及其应用研究进展[J].河南工业大学学报(自然科学版),2016,37(4):118-123.
[8] 邓乐君,樊鸿浩,李伟达,等.可吸收止血材料的生物相容性研究进展[J].中国生物医学工程学报,2016,35(2):241-246.
[9] SONG L,SANG Y,CAI L,et al.The effect of cooking on the antibacterial activity of the dialdehyde starch suspensions[J].Starch-Stärke,2010,62(9):458-466.
[10] KRISTIANSEN K A,POTTHAST A,CHRISTENSEN B E.Periodate oxidation of polysaccharides for modification of chemical and physical properties[J].Carbohydr Res,2010,345(10):1264-1271.
[11] 王琴梅,张亦霞,李卓萍,等.多醛基海藻酸钠交联剂的制备及性能[J].应用化学,2010,27(2):155-158.
[12] 朱颖,刘文杰,左迎峰,等.双醛淀粉酸解氧化制备工艺优化研究[J].西南林业大学学报,2017,37(3):199-203.
[13] 杨扬,刘金刚,苏艳群.利用高碘酸钠选择性氧化阔叶木浆[J].中国造纸,2015,34(4):16-21.
[14] LI H,WU B,MU C,et al.Concomitant degradation in periodate oxidation of carboxymethyl cellulose[J].Carbohydr Polym,2011,84:881-886.
[15] VANIER N L,EL HALAL S L M,DIAS A R G,et al.Molecular structure,functionality and applications of oxidized starches:a review[J].Food Chem,2017,221:1546-1559.
[16] 李德富,李宏利,林炜,等.改性淀粉的制备与应用研究进展[J].中国皮革,2007,36(1):32-37.
[17] SAITO T,ISOGAI A.TEMPO-mediated oxidation of native cellulose:the effect of oxidation conditions on chemical and crystal structures of the water-insoluble fractions[J].Biomacromolecules,2004,5(5):1983-1989.
[18] 冯国涛,单志华.变性淀粉的种类及其应用研究[J].皮革化工,2005,22(3):25-29.
[19] DIAS A R G,DA ROSA ZAVAREZE E,ELIAS M C,et al.Pasting,expansion and textural properties of fermented cassava starch oxidised with sodium hypochlorite[J].Carbohydr Polym,2011,84:268-275.
[20] 周凤超,孔保华,刘骞,等.次氯酸钠氧化马铃薯粉和淀粉的机理及应用探究[J].食品工业,2016,37(2):244-247.
[21] SANGSEETHONG K,LERTPHANICH S,SRIROTH K.Physicochemical properties of oxidized cassava starch prepared under various alkalinity levels[J].Starch-Stärke,2009,61(2):92-100.
[22] DING B,QING Y Y,CHENG J,et al.TEMPO-mediated selective oxidation of substituted polysaccharides:an efficient approach for the determination of the degree of substitution at C-6[J].Carbohydr Res,2008,343(18):3112-3116.
[23] COSENZA V A,NAVARRO D A,PUJOL C A,et al.Partial and total C-6 oxidation of gelling carrageenans:modulation of the antiviral activity with the anionic character[J].Carbohydr Polym,2015,128:199-206.
[24] 李一鸣,张岩,曹云峰,等.壳聚糖 C6 位选择性氧化的研究进展[J].纤维素科学与技术,2012,20(2):76-81.
[25] DE NOOY A,BESEMER A,VAN BEKKUM H.Highly selective TEMPO mediated oxidation of primary alcohol groups in polysaccharides[J].Recueil des Travaux Chimiques des Pays-Bas,1994,113(3):165-166.
[26] CHANG P S,ROBYT J F.Oxidation of primary alcohol groups of naturally occurring polysaccharides with 2,2,6,6-tetramethyl-1-piperidine oxoammonium ion[J].J Carbohydr Chem,1996,15(7):819-830.
[27] 黄小雷,刘文,刘群华,等.过氧化氢氧化纤维素的研究[J].中国造纸,2015,34(11):18-21.
[28] ZHANG Y,WANG X,ZHAO G,et al.Preparation and properties of oxidized starch with high degree of oxidation[J].Carbohydr Polym,2012,87:2554-2562.
[29] SANGSEETHONG K,TERMVEJSAYANON N,SRIROTH K.Characterization of physicochemical properties of hypochlorite-and peroxide-oxidized cassava starches[J].Carbohydr Polym,2010,82:446-453.
[30] ZHOU Y,LI X,LV Y,et al.Effect of oxidation level on the inclusion capacity and solution stability of oxidized amylose in aqueous solution[J].Carbohydr Polym,2016,138:41-48.
[31] 贺丽蓉,李宏利,张凯,等.双醛淀粉的制备及其提高胶原的热稳定性研究[J].中国皮革,2009,38(15):23-27.
[32] LI D,YE Y,LI D,et al.Biological properties of dialdehyde carboxymethyl cellulose crosslinked gelatin-PEG composite hydrogel fibers for wound dressings[J].Carbohydr Polym,2016,137:508-514.
[33] ZHANG X,YANG Y,YAO J,et al.Strong collagen hydrogels by oxidized dextran modification[J].ACS Sustainable Chem Eng,2014,2(5):1318-1324.
[34] DAWLEE S,SUGANDHI A,BALAKRISHNAN B,et al.Oxidized chondroitin sulfate-cross-linked gelatin matrixes:a new class of hydrogels[J].Biomacromolecules,2005,6(4):2040-2048.
[35] 冯玉杰,卢伟,岩小丽,等.双醛普鲁兰改性胶原支架材料的制备与表征[J].中外医疗,2010,29(21):10-12.
[36] MU C,LIU F,CHENG Q,et al.Collagen cryogel cross-linked by dialdehyde starch[J].Macromol Mater Eng,2010,295(2):100-107.
[37] TAN H,WU B,LI C,et al.Collagen cryogel cross-linked by naturally derived dialdehyde carboxymethyl cellulose[J].Carbohydr Polym,2015,129:17-24.
[38] YE Y,ZHU M,MIAO K,et al.Development of antimicrobial gelatin-based edible films by incorporation oftrans-anethole/β-cyclodextrin inclusion complex[J].Food Bioprocess Tech,2017,10:1844-1853.
[39] ZHOU Y,YE Y,ZHANG W,et al.Oxidized amylose with high carboxyl content:a promising solubilizer and carrier of linalool for antimicrobial activity[J].Carbohyd Polym,2016,154:13-19.
[40] LYU Y,REN H,YU M,et al.Using oxidized amylose as carrier of linalool for the development of antibacterial wound dressing[J].Carbohydr Polym,2017,174:1095-1105.
[41] 杜简心,马健,朱江.长链烷基疏水改性双醛淀粉的制备优化研究[J].重庆文理学院学报,2016,35(5):79-83.
[42] WALI A R M,ZHOU J,MA S,et al.Tailoring the supramolecular structure of amphiphilic glycopolypeptide analogue toward liver targeted drug delivery systems[J].Int J Pharm,2017,525(1):191-202.
[43] DINEEN P.The effect of oxidized regenerated cellulose on experimental infected splenotomies[J].J Surg Res,1977,23(2):114-116.
[44] 贺金梅,王凤文,张华威,等.医用可吸收止血材料的功能化改性研究进展[J].现代化工,2010,30(12):11-15.
[45] SPANGLER D,ROTHENBURGER S,NGUYEN K,et al.In vitro antimicrobial activity of oxidized regenerated cellulose against antibiotic-resistant microorganisms[J].Surg Infect,2003,4(3):255-262.
[46] JAYAKUMAR G C,KANTH S V,CHANDRASEKARAN B,et al.Preparation and antimicrobial activity of scleraldehyde fromSchizophyllumcommune[J].Carbohydr Res,2010,345(15):2213-2219.
[47] ZHU M,GE L,LYU Y,et al.Preparation,characterization and antibacterial activity of oxidizedκ-carrageenan[J].Carbohydr Polym,2017,174:1051-1058.

