酵母细胞工厂生产脂肪酸及其衍生物
高教琪,段兴鹏,周雍进
(中国科学院 大连化学物理研究所 生物技术研究部,辽宁 大连 116023)
脂肪酸及其衍生物(脂肪醇、脂肪酸烷基酯和烷烃等)在能源、医药和化妆品等领域具有广泛的应用潜力。由脂肪酸衍生的生物燃料和油脂化合物能够有效地缓解由于化石资源短缺而导致的能源危机[1]。与燃料乙醇相比,脂肪酸衍生的生物燃料,特别是脂肪酸烷基酯和烷烃等具有更高的能量密度、与现有燃料更加相似的储藏运输特性和燃烧性能等,目前逐渐成为汽油、柴油和航空燃料最主要的替代产品[2]。除此之外,游离脂肪酸还广泛用于生产肥皂、表面活性剂和润滑油等工业产品[3],而脂肪醇也是目前去污剂、护肤品等化妆品和医药领域的主要生产原材料[4]。目前,脂肪酸及其衍生物主要来源于天然动植物油脂的提取。但是,随着脂肪酸及其衍生物市场需求量的不断增大,从天然动植物提取脂肪酸及其衍生物势必会对动植物的生存、生物多样性以及生态效应造成不可逆转的影响[5]。因此,目前亟需一种更加高效和环境友好的脂肪酸及其衍生物的生产模式。

红色箭头表示酿酒酵母特有途径,绿色箭头表示解脂耶氏酵母特有途径,黑色箭头表示二者共有途径。ME—苹果酸酶;ICDH—异柠檬酸脱氢酶;ACL—ATP-柠檬酸裂解酶;ACS—乙酰辅酶A合酶;ACC—乙酰辅酶A羧化酶;FAA1—脂酰辅酶A合成酶;TGL—三酰基甘油脂酶;Δ9—Δ9脱氢酶;Δ12—Δ12脱氢酶;DGA1/2—二酰基甘油酰基转移酶;LRO1—磷脂-二酰基甘油酰基转移酶;POX1-6—过氧化物酶体乙酰辅酶A氧化酶;WS/DGAT—蜡酯合成酶/乙酰辅酶A二酰基甘油酰基转移酶;AL-FAR—醇脂酰辅酶A还原酶;AH-FAR—醛脂酰辅酶A还原酶;ADO—醛去甲酰氧化酶图1 酵母脂肪酸及其衍生物代谢途径Fig.1 Metabolic pathways of fatty acid-derived chemicals in yeasts cells
利用微生物发酵来生产诸多天然产物是一种可再生且环境友好的生产模式,近年来受到广泛关注。随着代谢工程与合成生物学技术的不断完善,利用分子生物学等手段,对微生物原始代谢途径进行优化并组装外源代谢途径,而构建的微生物细胞工厂成为生产多种天然产物的有效替代手段[6]。其中,大肠杆菌(Escherichiacoli)是目前最常见的细胞工厂,具有诸多优势,例如较快的生长和代谢速率、兼性厌氧的生长条件以及完善的基因操作平台等,是一种优良的工业微生物菌株[7]。同时,大肠杆菌细胞工厂在生产脂肪酸及其衍生物等领域(例如脂肪酸、高级醇和烷烃[8-9])均取得了重要进展。
尽管酵母细胞工厂能够实现脂肪酸及其衍生物合成,但是如何提高其产量,使其达到甚至超过大肠杆菌细胞工厂的产量,并最终实现工业化应用,这是国内外一直以来的研究重点[15-16]。因此,本文主要综述近年来利用酵母细胞工厂发酵生产脂肪酸及其衍生物的研究进展,介绍了酿酒酵母、解脂耶氏酵母和圆红冬孢酵母在脂肪酸及其衍生物生产等方面的应用;在此基础上,提出了提高酵母产脂肪酸及其衍生物产量的合成生物学策略,结合现阶段存在的机遇与挑战,评述了酵母细胞工厂在脂肪酸及其衍生物生产领域的应用前景,以期为其进一步研究和工业化进程奠定理论基础。
1 酿酒酵母:传统的细胞工厂
酿酒酵母具备完善的基因操作平台,成为除大肠杆菌以外研究最为广泛的生产脂肪酸及其衍生物的细胞工厂。野生型酿酒酵母脂肪酸合成途径如图1所示。概括来说,糖类化合物经糖酵解过程生成的丙酮酸在丙酮酸脱氢酶或丙酮酸脱氢酶旁路的作用下生成乙酰辅酶A,随后在乙酰辅酶A羧化酶催化下与CO2发生羧化反应形成丙二酰辅酶A,最后利用脂肪酸合酶经过多轮反应实现碳链的逐渐延长,形成含有16~18个碳的脂酰辅酶A。脂酰辅酶A是生成脂肪酸、脂肪酸酯(油脂)、脂肪醇以及烷烃的前体物质。由于缺少Δ12脱氢酶的编码基因,酿酒酵母只能依靠自身Δ9脱氢酶形成单不饱和脂肪酸及衍生物[17]。尽管野生型酿酒酵母能够实现脂肪酸及其衍生物的合成,但合成效率很低,无法满足产物积累及生产需求。因此,近年来,借助代谢途径的改造和优化,结合合成生物学策略,酿酒酵母细胞工厂在脂肪酸及其衍生物生产领域取得了较大进展(表1)。
1.1 酿酒酵母产脂肪酸
脂肪酸或者脂酰辅酶A是后续脂肪醇和烷烃合成的前体。因此,借助代谢工程改造,增加脂肪酸或者脂酰辅酶A的产量至关重要。
首先,通过引入ATP-柠檬酸裂解酶途径,提高前体物质乙酰辅酶A供应。野生型酿酒酵母主要有两条乙酰辅酶A合成途径:胞浆中的丙酮酸脱羧途径和线粒体中的丙酮酸脱氢。胞浆中的丙酮酸脱羧途径碳代谢流主要流向了乙醇,而线粒体中大部分的乙酰辅酶A直接进入三羧酸(TCA)循环[18],因此,在胞浆中脂肪酸的合成过程中,前体物质乙酰辅酶A的量明显不足。在产油酵母中,乙酰辅酶A的来源有另外一条途径:ATP-柠檬酸裂解酶途径,也就是说,进入TCA循环的柠檬酸可以在特定情况下转运到胞浆中,之后在ATP-柠檬酸裂解酶的作用下生成草酰乙酸和乙酰辅酶A(图1),同时,这一过程伴随着ATP的消耗。Zhou等[16]和Tang等[19]的研究结果提供了以提高前体物质乙酰辅酶A供应的角度增加脂肪酸合成的代谢工程策略。异源ATP-柠檬酸裂解酶基因主要来自家鼠(Musmusculus)[16,19]和产油酵母解脂耶氏酵母[12],且该基因在酿酒酵母中能够表达和行使功能,为脂肪酸及其衍生物的生产奠定了良好基础。
其次,对脂肪酸合成途径关键代谢基因进行优化。对酿酒酵母脂肪酸及其衍生物合成途径中关键基因的优化能够促进乙酰辅酶A前体到终产物的转化过程,具体见图2。首先是乙酰辅酶A羧化酶(由ACC1基因编码)。脂肪酸合成起始于乙酰辅酶A与丙二酰辅酶A的转化,该羧化反应由乙酰辅酶A羧化酶催化完成,是脂肪酸合成过程的重要步骤。因此,ACC1基因表达的优化至关重要。酿酒酵母含有内源的ACC1基因,所以很多研究都选择将这一内源基因进行过表达,从而促进脂肪酸合成的启动强度[16,20-23];其次是脂肪酸合酶(FAS)。脂肪酸合成的第2个步骤是在FAS作用下乙酰辅酶A与丙二酰辅酶A的酶促反应。FAS是一个复杂的复合酶系,在酵母中含有6个酶活性中心和1个酰基载体功能域ACP,并定位于2个多功能肽链(FAS1和FAS2)。因此,对FAS的优化过程也相对复杂,包括对其来源[16,20-21]以及结构[24-25]的双重优化。FAS酶活力的提高能够促进脂肪酸的合成,甚至在其结构上的改造能够控制脂肪酸的碳链长度[24-26];另外,对脂肪酸碳链延长系统的修饰能获得超长链脂肪酸衍生物[21]。
最后,逆反应途径或竞争途径基因敲除也能够使产物积累达到最大化。脂肪酸生成的逆反应包括脂肪醛形成脂肪酸(由醛脱氢酶HFD1催化)[11,16,22,27],脂肪酸到脂酰辅酶A(由脂酰辅酶A合成酶FAA1和FAA4催化)[16,20,23,28-30]以及脂酰辅酶A形成乙酰辅酶A(由脂酰辅酶A氧化酶POX1催化)[16,27](图2)。因此,这些逆反应途径或竞争途径中关键酶的敲除能够显著增加脂肪酸以及脂酰辅酶A等的积累,获得脂肪酸及其衍生物的高产菌株。
在酿酒酵母细胞工厂生产脂肪酸方面,通过整合上述部分策略进行了代谢途径改造,虽然能够实现脂肪酸的积累,但是产量相对较低,摇瓶发酵水平普遍在0.5 g/L以下。因此,Zhou等[16]整合了相对全面的代谢途径改造策略,在此基础上对关键基因的来源及表达强度进行了进一步的优化,使摇瓶水平上的脂肪酸产量超过1.0 g/L,批式补料发酵甚至达到了10.4 g/L,是近年来报道的最为理想的发酵结果之一。除此之外,过表达FAS系统中与脂肪酸碳链延长相关基因ScfabF,能够提高脂肪酸产量至0.85 g/L左右[31]。同时,增强β-氧化途径的逆反应过程也为脂肪酸产量的提高提供了新的策略[32]。
首先,为企业培养动手能力强、综合素质高的技能型人才是本专业办学的目标,因此学院建立了由酒店高管、行业领军人才、骨干教师等参与的专业建设指导委员会。每年对酒店市场的需求及行业的变化进行相关调研,根据调研情况编制和调整基于双证融通的合理化培育英才的计划和措施,重点关注学生职业素养、服务意识、团队协作等方面的能力提升。逐步形成了酒店企业技能标准、酒店前厅部客房部技能、餐饮服务技能等专业教学和职业技能标准的“双证融通课程”。
1.2 酿酒酵母产脂肪醇
酿酒酵母细胞工厂生产脂肪醇的途径主要有两条(图2)。一是由脂酰辅酶A在FAR的催化下直接合成脂肪醇,二是脂肪酸利用羧酸还原酶(CAR)、乙醇脱氢酶(ADH)或乙醛还原酶(ALR),经由脂肪醛形成脂肪醇。由于高等动植物具备天然合成脂肪醇的能力,目前这些脂肪醇合成基因主要来自于这些高等动植物,如拟南芥、鸟类等,并且能够在酿酒酵母中实现脂肪醇的生产[11,20-22,33]。脂肪醛作为脂肪醇和烷烃的前体化合物,还可以经脂肪酸还原得来。目前来源于海鱼分枝杆菌(Mycobacteriummarinum)的car基因能够有效地提高脂肪酸的转化,并更有利于脂肪醇和烷烃的合成[16,27]。同时,油脂(TAGs)的合成是前体物质脂酰辅酶A积累的最大竞争途径(图1),因此,通过敲除TAGs合成途径中的关键酶DGA1,可以减少脂酰辅酶A的消耗,增加产物的积累[22,33]。
但是,目前酵母脂肪醇的产量明显低于脂肪酸,普遍在0.1 g/L左右(表1)。但是,Feng等[12]认为脂肪醇的积累可能与细胞内的磷脂代谢相关,并通过敲除相关基因,首次将酵母脂肪醇产量提高到0.33 g/L,批式补料条件下达到1.1 g/L。最近,D′espaux等[22]通过整合多种合成生物学策略,成功将酵母脂肪醇摇瓶发酵产量提高到1 g/L以上,并在批式补料条件下达到6 g/L,基本与脂肪酸产量相当。
1.3 酿酒酵母产烷烃
烷烃作为航空燃料的重要组成部分,提高其产量至关重要[34]。最普遍的烷烃合成途径主要依靠脂肪酸或脂酰辅酶A还原和脱羧作用,经由脂肪醛最终形成烷烃(图1)。在酵母中实现烷烃的生产需在高产脂肪酸菌株的基础上表达脂肪醛去甲酰氧化酶,因此,其组分通常为含有13、15和17个碳的烷烃(表1)。同时,在酵母中表达某些高等植物来源的烷基合成酶能够实现超长碳链烷烃的生产[35]。尽管如此,目前酵母细胞工厂的烷烃生产过程还处于初步阶段,产量基本在毫克级别,若完成酵母产烷烃的工业化生产还需更多理论研究支持。

CL—ATP-柠檬酸裂解酶;ACC1—乙酰辅酶A羧化酶;FAS—脂肪酸合成酶;POX1—过氧化物酶体乙酰辅酶A氧化酶; FAR—脂酰辅酶A还原酶;FAA1/4—脂酰辅酶A合成酶;’tesA—硫酯酶;HFD1—醛脱氢酶;AAR—脂酰ACP/CoA还原酶;ALR—醛还原酶;ADH—醇脱氢酶图2 酿酒酵母细胞工厂构建策略提高脂肪酸及其衍生物产量Fig.2 Enhancement of fatty acid-derived chemicals production by engineered cell factories of S. cerevisiae
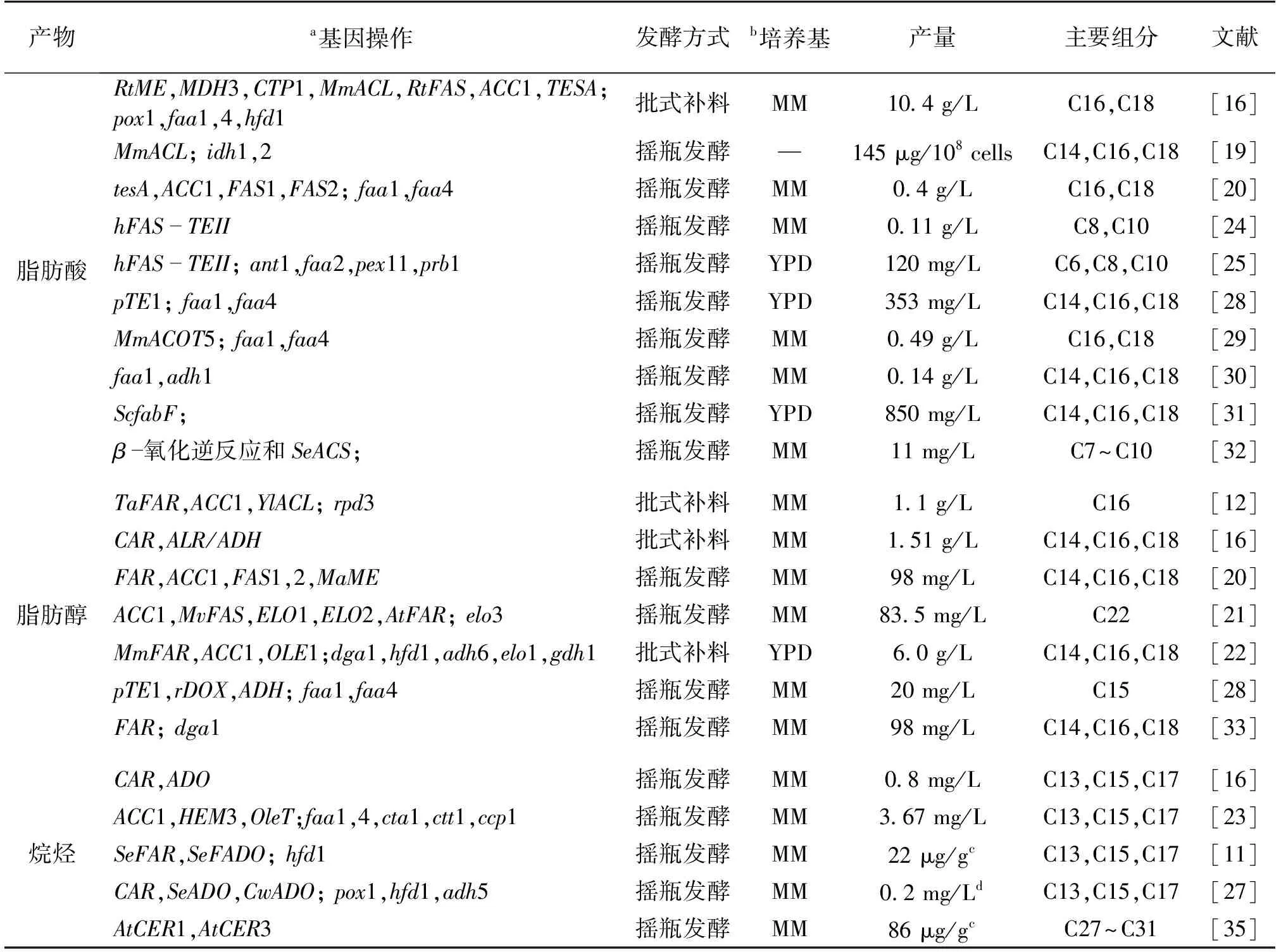
表1 酿酒酵母细胞工厂产脂肪酸、脂肪醇和烷烃
注:a—分号前基因为过表达(大写),分号后基因为敲除(小写);b—MM为基本培养基,YPD为复合培养基;c—以1 g细胞干质量计;d—以OD600时测的生物量为参照。
2 解脂耶氏酵母:新兴的产油细胞工厂
作为一种新型的非传统酵母,解脂耶氏酵母广泛存在于含有疏水介质的环境中。由于其较高的安全性(GRAS),解脂耶氏酵母被广泛应用于食品和药物等生产过程[36]。与酿酒酵母不同,解脂耶氏酵母作为一种产油酵母而被广泛关注。解脂耶氏酵母油脂含量甚至能够超过其自身细胞干质量的50%以上。因此,作为细胞工厂,解脂耶氏酵母在生产脂肪酸、脂肪醇和烷烃等油脂类生物燃料和化合物方面具有更加突出的优势。近年来,随着代谢工程和合成生物学研究工作的不断深入[37],使人为改造解脂耶氏酵母的代谢途径以及关键基因成为可能,并取得了重大突破。作为新型的产油细胞工厂,在油脂、脂肪醇和烷烃生产领域解脂耶氏酵母正逐步成为国内外的研究热点。
2.1 解脂耶氏酵母产脂肪酸及油脂
作为产油酵母,解脂耶氏酵母生产脂肪酸或者油脂是最为重要的应用方向。解脂耶氏酵母脂肪酸和油脂的合成途径如图1所示。其中,脂肪酸的合成途径与酿酒酵母类似,均是以乙酰辅酶A为前体化合物,通过乙酰辅酶A羧化酶(ACC1,YALI0C11407g)[38]和脂肪酸合酶(FAS,YALI0B15059g和YALI0B19382g)[39]的催化形成脂酰辅酶A,区别是在产油酵母存在特有的乙酰辅酶A合成途径(ATP-柠檬酸裂解酶,ACL,YALI0E34793g和YALI0D24431g)[39]。除此之外,解脂耶氏酵母和酿酒酵母在脂肪酸合成方面的差异主要表现在还原力(NADPH)来源以及脂肪酸的合成种类等[17]上面。
解脂耶氏酵母油脂的合成是在脂肪酸的基础上进行的酯化反应(图1),合成的油脂主要储存在脂质体中,其中三酰基甘油(TAG)占85%,甾醇酯(SE)占8%。主要的TAGs合成有两条途径:一是二酰基甘油(来源于CDP-DAG途径)在LR01(lro1基因)(YALI0E16797g)作用下的磷脂化反应,该过程主要发生在菌体的对数生长期;二是以脂酰辅酶A为前体物质,经过DGA1(YALI0E32769g)和DGA2(YALI0D07986g)合成TAGs,主要发生在菌体生长的稳定期(图1)。
野生型的解脂耶氏酵母能够有效地积累油脂,通过发酵条件和培养方式的优化,油脂含量能够达到40%左右[40]。为了进一步优化解脂耶氏酵母油脂合成过程,经过改造的工程菌株展现了更强的油脂积累性能。研究表明,过表达dga1和dga2能够显著提高油脂积累量[41],而gut2[42]、pox1-6[42]和yal1[43]等基因的敲除也有利于解脂耶氏酵母油脂的积累(表2)。Qiao等[15]通过改变还原力NADPH和前体物质乙酰辅酶A的供应,有效地将油脂产量提高到98.9 g/L以上,占到细胞干质量的70%,是目前为止最理想的结果。有趣的是,通过改变脂肪酸合酶(FAS)的结构与构象,能够有效地改变油脂中不同游离脂肪酸种类之间的比例,特别是控制中长链脂肪酸的产量[44]。
2.2 解脂耶氏酵母产脂肪醇
与酿酒酵母相似,解脂耶氏酵母脂肪醇的生产主要是以脂酰辅酶A为前体,在脂酰辅酶A还原酶(FAR)的催化作用下完成(图1)。因此,目前对解脂耶氏酵母产脂肪醇的研究也主要集中在对FAR基因的优化(来源和表达强度)[13-14,45]。Wang等[14]通过引入来源于猫头鹰的FAR基因(Tafar1)实现了解脂耶氏酵母产脂肪醇,并通过优化Tafar1表达强度,发现包含5个拷贝Tafar1的菌株,其脂肪醇产量提高63倍以上,但其中90%以上脂肪醇存在于胞内;而通过在发酵过程中添加正癸烷相,能够有效地将解脂耶氏酵母胞内脂肪醇萃取到胞外,并最终提纯到正癸烷相,回收率在90%以上,提供了一种有效的产物和菌体的分离手段,有利于产量提高[45];但是,单纯通过FAR基因优化很难实现高产脂肪醇的目的。因此,敲除竞争反应相关基因以及增加前体供应均能够显著提高解脂耶氏酵母产脂肪醇的能力,其中以敲除油脂生成途径基因dga1[14]和β-氧化途径相关基因pex10[13]效果最为明显。
由于解脂耶氏酵母能够天然利用多种疏水性底物,特别是脂肪醇和烷烃,因此,为了提高脂肪醇的产量,避免其自身的消耗至关重要。有研究表明,乙醇脱氢酶ADH1-7和脂肪醇氧化酶FAO1均与解脂耶氏酵母的脂肪醇代谢相关,其中ADH1、ADH3和FAO1发挥主要作用。敲除突变菌在以烷烃为底物时能够积累更多的脂肪醇类。总之,提高脂肪醇合成基因FAR表达量、降低竞争途径对前体脂酰辅酶A的消耗以及敲除脂肪醇的代谢途径相关基因等策略均能够促进解脂耶氏酵母脂肪醇生产能力,为其进一步应用奠定基础。
2.3 解脂耶氏酵母产烷烃
由于其较强的天然烷烃代谢能力,解脂耶氏酵母并不是一个理想的烷烃合成工厂。解脂耶氏酵母基因组中含有12个烷烃代谢的相关基因,不同的碳链长度具有不同的特异性[34]。但是,借助适当的代谢工程与合成生物学策略,Blazeck等[46]首先在解脂耶氏酵母中实现了戊烷的生产。区别于常规烷烃合成途径,一种大豆来源的脂肪氧合酶(Gmlox1)能够将亚油酸转化为戊烷并通过进一步的优化和β-氧化途径阻断(mfe1基因敲除),实现了解脂耶氏酵母积累烷烃的目的,产量达到4.98 mg/L[46]。最近,通过过表达海鱼分枝杆菌来源的羧酸还原酶(MmCAR)、梭状芽孢杆菌来源的磷酸泛酰巯基乙胺基转移酶(BsuSfp)以及原绿球藻来源的醛去甲酰氧化酶(PmADO),烷烃的产量提高到23.3 mg/L,但由于较强的β-氧化作用,十三烷在产物组成中占有较高比例[47]。随着代谢途径研究的不断深入[48-50],解脂耶氏酵母细胞工厂生产烷烃类化合物终将取得令人满意的结果。
3 产油酵母:圆红冬孢酵母
生物柴油能够有效地缓解由于化石资源短缺而导致的全球范围内的能源危机,而其主要来源于油脂的转酯化反应(脂肪酸甲基酯和脂肪酸乙基酯等)。除了上述的解脂耶氏酵母,圆红冬孢酵母是另一种极具发展前景的产油酵母类型。与解脂耶氏酵母相比,圆红冬孢酵母能够利用葡萄糖积累更高含量的油脂[51],而且能够天然利用包括木糖和纤维二糖在内的多种糖类[52]。因此,圆红冬孢酵母具有广泛的工业化应用前景,近年来也受到国内外学者的广泛关注。作为油脂生产菌种,圆红冬孢酵母能够在摇瓶发酵水平上积累0.436 g油脂(以1 g细胞干质量计),在发酵罐水平上积累0.535 g油脂,其中油脂组成包含35%饱和脂肪酸、46%的单不饱和脂肪酸以及其余的多不饱和脂肪酸[53]。
与解脂耶氏酵母相比,圆红冬孢酵母的基因工程改造的难度更大,但是借助农杆菌介导的方法,能够实现圆红冬孢酵母产油途径的代谢工程改造过程[54-55]。通过过表达圆红冬孢酵母自身的乙酰辅酶A(由ACC1编码)和二酰基甘油酰基转移酶(由dga1编码),油脂的积累量达到0.612 g(以1 g细胞干质量计)[54]。在此基础上,通过过表达硬脂酰辅酶A脱氢酶,进一步提高了油脂的生产强度,并使其批式补料条件下的产量达到0.755 g(以1 g细胞干质量计)[55]。
中国科学院大连化学物理研究所赵宗保研究员课题组长期以来一直致力于圆红冬孢酵母产油过程的相关研究。从培养条件和发酵条件优化[56-58],到圆红冬孢酵母的基因工程改造[59]以及后续的转酯化反应[60],均进行了大量的深入研究,为以圆红冬孢酵母为底盘微生物进行油脂发酵的工业化进程奠定了重要基础。值得一提的是,早在2013年,赵宗保研究员的课题组就开展了圆红冬孢酵母多组学的测序研究工作,为其后续的基因工程改造提供了良好的理论支持[61]。同时,尽管农杆菌介导的方法能够实现圆红冬孢酵母的基因工程改造,但其耗时、耗力,不利于合成生物学策略的开展。因此,他们提出了一种改良的电转化方法,在保证高转化效率的前提下,极大地降低了操作难度,加快了实验进程[62],为圆红冬孢酵母后续的复杂合成生物学改造过程奠定了良好基础。
4 合成生物学策略提高酵母脂肪酸及其衍生物产量
4.1 提高前体物质供应
乙酰辅酶A是脂肪酸合成的起始,也是整个过程的重要前体物质。因此,提高乙酰辅酶A供应量能够有效地提高脂肪酸产量。野生型酿酒酵母的乙酰辅酶A生物合成途径如图1和图2所示,由于ACS基因反馈抑制以及较高的能量消耗,乙酰辅酶的合成成为脂肪酸合成过程的限速步骤,也直接影响了其产量。采用合成生物学策略及技术提高乙酰辅酶A供应实施方式如表3所示,一方面重构酵母细胞代谢流,减少乙醇和甘油生成途径的代谢通量,提高乙酰辅酶A生物合成流量;另一方面,异源表达乙酰辅酶A生物合成途径,增强乙酰辅酶产量、削弱ACS的反馈抑制作用以及减少乙酰辅酶A生物合成过程ATP的消耗等[63]。
4.2 辅因子平衡
酵母细胞中,脂肪酸、脂类和氨基酸的合成过程需要消耗大量的还原力,特别是脂肪酸的合成,每延长两分子碳链需要消耗两分子的还原力,这主要由辅因子NADPH提供[64]。为了维持细胞内辅因子的平衡,维持细胞生长,需要为酵母细胞提供充足的还原力。酵母细胞主要依靠氧化磷酸化和异柠檬酸的氧化(idp2和idp3)来生成基本的NADPH。但是,如果从提高脂肪酸及其衍生物产量的角度看,还需要进一步提高NADPH供应。目前提高酿酒酵母细胞NADPH供应的策略主要是异源表达相关代谢途径,包括来源于芽孢杆菌的3-磷酸甘油醛脱氢酶[65]、来源于克鲁维酵母(Kluyveromycessp.)的3-磷酸甘油醛脱氢酶[66]以及来源于圆红冬孢酵母(Rhodospuridiumtoruloides)和高山被孢霉(Mortierellaalpina)的苹果酸酶[16,20],它们均能够通过提高细胞内NADPH供应提高相应的产物生产能力。但是,由于NADPH的生成及消耗途径的复杂性,可能还需要更多新策略以提高产量(表3和图3)。
4.3 脂肪醇和烷烃生产的代谢途径调控
代谢途径构建及优化需要考虑代谢途径本身以及与细胞内代谢平衡,最终实现产量的最大化。该策略已经引起了广泛关注并应用于脂肪酸衍生物的合成(表3)。
脂肪酸及其衍生物,特别是烷烃,对细胞有较大的毒害作用,影响细胞生长[63]。通过某些诱导性启动子,在细胞生长到一定阶段后启动产物的合成基因,能够显著提高目标产物的生成[21]。除了与细胞生长相关,动态调控的另一个层面主要涉及基因表达量的动态调控,细胞根据需要调节相关基因的表达强度,从而提高产物浓度。Verho等[65]和Teo等[66-67]成功将细菌中的基因调控系统,如FadR和AND-Gate等,应用于酿酒酵母细胞,结合合成启动子,成功实现基因表达过程的动态调控,有望应用于脂肪酸及其衍生物的合成。
脂肪醇和烷烃的生产过程主要在胞浆中完成,二者之间存在竞争反应。因此,选择利用细胞内的亚细胞器结构将合成途径封闭起来是一种有效的合成生物学策略。尽管线粒体是目前研究最为广泛的代谢途径区域化的亚细胞器[68],但是过强的醛还原酶或醇脱氢酶(ALR/ADH)基因表达不适合烷烃的生产,而过氧化物酶体由于其不含有ALR/ADH,并且含有提供NADPH的异柠檬酸脱氢酶IDH3[69],成为烷烃的理想合成场所,烷烃产量提高了1倍,通过提高过氧化物酶体数量,烷烃产量进一步提高了3倍[70]。该策略还进一步用于端位烯烃和脂肪醇的合成[70-71],表明了该策略具有通用性。

表3 合成生物学策略提高酵母脂肪酸及其衍生物产量
5 结论
以脂肪酸、脂肪醇和烷烃为代表的先进燃料对于缓解能源危机、促进人类的可持续发展至关重要。除此之外,脂肪酸及其衍生物在表面活性剂、去污剂以及化妆品的生产方面也具有广泛应用前景。从生物多样性以及生态效应的角度出发,以微生物发酵来生产脂肪酸及其衍生物是一种可再生且环境友好型的生产模式。随着研究的不断深入以及技术的日益成熟,酵母细胞工厂正成为继大肠杆菌后的新型脂肪酸及其衍生物的高效生产平台。
从酿酒酵母出发,通过引入异源ATP-柠檬酸裂解酶途径、优化关键代谢基因以及敲除竞争途径的相关基因等,成功实现了酿酒酵母细胞工厂生产脂肪酸、脂肪醇和烷烃。特别是脂肪酸和脂肪醇,其摇瓶水平上的产量已经突破克级,批式补料条件能够进一步提升其产量,极大推进了其工业化进程;而从解脂耶氏酵母出发,充分利用其产油酵母的特性,结合代谢工程以及合成生物学的改造,使其油脂含量得到进一步提升,并实现了脂肪酸和脂肪醇的生产过程。同时,解脂耶氏酵母独特的脂肪酸代谢途径也为今后的基础研究打下了坚实的理论基础。
在此基础上,随着合成生物学领域相关策略与技术的蓬勃发展,通过提高前体物质供应、辅因子平衡以及代谢调控策略能够将酵母脂肪酸及其衍生物的产量进一步提高,为今后实现酵母细胞工厂产脂肪酸及其衍生物的工业化生产提供了良好的理论基础和实践方向。
[1] ZHOU Y J,BUIJS N A,SIEWERS V,et al.Fatty acid-derived biofuels andchemicals production inSaccharomycescerevisiae[J].Front Bioeng Biotechnol,2014,2:32.
[2] PERALTA-YAHYA P P,ZHANG F,DEL CARDAVRE S B,et al.Microbial engineering for the production of advanced biofuels[J].Nature,2012,488:320-328.
[3] TEE T W,CHOWDHURY A,MARANAS C D,et al.Systems metabolic engineering design:fatty acid production as an emerging case study[J].Biotechnol Bioeng,2014,111(5):849-857.
[4] LIU R,ZHU F,LU L,et al.Metabolic engineering of fatty acyl-ACP reductase-dependent pathway to improve fatty alcohol production inEscherichiacoli[J].Metab Eng,2014,22:10-21.
[5] FILLET S,ADRIO J L.Microbial production of fatty alcohols[J].World J Microbiol Biotechnol,2016,32(9):152.
[6] ZHU Q,JACKSON E N.Metabolic engineering ofYarrowialipolyticafor industrial applications[J].Curr Opin Biotechnol,2015,36:65-72.
[7] WANG C,PFLEGER B F,KIM S W.ReassessingEscherichiacolias a cell factory for biofuel production[J].Curr Opin Biotechnol,2017,45:92-103.
[8] CAO Y X,XIAO W H,LIU D,et al.Biosynthesis of odd-chain fatty alcohols inEscherichiacoli[J].Metab Eng,2015,29:113-123.
[9] CHOI Y J,LEE S Y.Microbial production of short-chain alkanes[J].Nature,2013,502:571-574.
[10] NIELSEN J.Yeast cell factories on the horizon[J].Science,2015,349:1050-1051.
[11] BUIJS N A,ZHOU Y J,SIEWERS V,et al.Long-chain alkane production by the yeastSaccharomycescerevisiae[J].Biotechnol Bioeng,2015,112(6):1275-1279.
[12] FENG X,LIAN J,ZHAO H.Metabolic engineering ofSaccharomycescerevisiaeto improve 1-hexadecanol production[J].Metab Eng,2015,27:10-19.
[13] RUTTER C D,RAO C V.Production of 1-decanol by metabolically engineeredYarrowialipolytica[J].Metab Eng,2016,38:139-147.
[14] WANG G,XIONG X,GHOGARE R,et al.Exploring fatty alcohol-producing capability ofYarrowialipolytica[J].Biotechnol Biofuels,2016,9(1):107.
[15] QIAO K,WASYLENKO T M,ZHOU K,et al.Lipid production inYarrowialipolyticais maximized by engineering cytosolic redox metabolism[J].Nat Biotechnol,2017,35(2):173-177.
[16] ZHOU Y J,BUIJS N A,ZHU Z,et al.Production of fatty acid-derived oleochemicals and biofuels by synthetic yeast cell factories[J].Nat Commun,2016,7:11709.
[17] FAKAS S.Lipid biosynthesis in yeasts:a comparison of the lipid biosynthetic pathway between the model nonoleaginous yeastSaccharomycescerevisiaeand the model oleaginous yeastYarrowialipolytica[J].Eng Life Sci,2017,17(3):292-302.
[18] KRIVORUCHKO A,ZHANG Y,SIEWERS V,et al.Microbial acetyl-CoA metabolism and metabolic engineering[J].Metab Eng,2015,28:28-42.
[19] TANG X,FENG H,CHEN W N.Metabolic engineering for enhanced fatty acids synthesis inSaccharomycescerevisiae[J].Metab Eng,2013,16:95-102.
[20] RUNGUPHAN W,KEASLING J D.Metabolic engineering ofSaccharomycescerevisiaefor production of fatty acid-derived biofuels and chemicals[J].Metab Eng,2014,21:103-113.
[21] YU T,ZHOU Y J,WENNING L,et al.Metabolic engineering ofSaccharomycescerevisiaefor production of very long chain fatty acid-derived chemicals[J].Nat Commun,2017,8:15587.
[22] D′ESPAUX L,GHOSH A,RUNGUPHAN W,et al.Engineering high-level production of fatty alcohols bySaccharomycescerevisiaefrom lignocellulosic feedstocks[J].Metab Eng,2017,42:115-125.
[23] CHEN B,LEE D Y,CHANG M W.Combinatorial metabolic engineering ofSaccharomycescerevisiaefor terminal alkene production[J].Metab Eng,2015,31:53-61.
[24] LEBER C,DA SILVA N A.Engineering ofSaccharomycescerevisiaefor the synthesis of short chain fatty acids[J].Biotechnol Bioeng,2014,111(2):347-358.
[25] LEBER C,CHOI J W,POLSON B,et al.Disrupted short chain specificβ-oxidation and improved synthase expression increase synthesis of short chain fatty acids inSaccharomycescerevisiae[J].Biotechnol Bioeng,2016,113(4):895-900.
[26] ZHU Z,ZHOU Y J,KRIVORUCHKO A,et al.Expanding the product portfolio of fungal type I fatty acid synthases[J].Nat Chem Biol,2017,13(4):360-362.
[27] KANG M K,ZHOU Y J,BUIJS N A,et al.Functional screening of aldehyde decarbonylases for long-chain alkane production bySaccharomycescerevisiae[J].Microb Cell Fact,2017,16(1):74.
[28] JIN Z,WONG A,FOO J L,et al.EngineeringSaccharomycescerevisiaeto produce odd chain-length fatty alcohols[J].Biotechnol Bioeng,2016,113(4):842-851.
[29] CHEN L,ZHANG J,LEE J,et al.Enhancement of free fatty acid production inSaccharomycescerevisiaeby control of fatty acyl-CoA metabolism[J].Appl Microbiol Biotechnol,2014,98(15):6739-6750.
[30] LI X,GUO D,CHENG Y,et al.Overproduction of fatty acids in engineeredSaccharomycescerevisiae[J].Biotechnol Bioeng,2014,111(9):1841-1852.
[31] JUNG Y,KIM S,LEE S,et al.Effect of heterologous expression of genes involved in the elongation cycle of fatty acid synthesis on fatty acid production inSaccharomycescerevisiae[J].Biotechnol Bioproc E,2015,20(1):1-9.
[32] LIAN J,ZHAO H.Reversal of theβ-oxidation cycle inSaccharomycescerevisiaefor production of fuels and chemicals[J].ACS Synth Biol,2014,4(3):332-341.
[33] TANG X,CHEN W N.Enhanced production of fatty alcohols by engineering the TAGs synthesis pathway inSaccharomycescerevisiae[J].Biotechnol Bioeng,2015,112(2):386-392.
[35] BERNARD A,DOMERGUE F,PASCAL S,et al.Reconstitution of plant alkane biosynthesis in yeast demonstrates that arabidopsis ECERIFERUM1 and ECERIFERUM3 are core components of a very-long-chain alkane synthesis complex[J].Plant Cell,2012,24(7):3106-3118.
[36] ZINJARDE S S.Food-related applications ofYarrowialipolytica[J].Food Chem,2014,152:1-10.
[37] MADZAK C.Yarrowialipolytica:recent achievements in heterologous protein expression and pathway engineering[J].Appl Microbiol Biotechnol,2015,99(11):4559-4577.
[38] TAI M,STEPHANOPOULOS G.Engineering the push and pull of lipid biosynthesis in oleaginous yeastYarrowialipolyticafor biofuel production[J].Metab Eng,2013,15:1-9.
[39] VORAPREEDA T,THAMMARONGTHAM C,CHEEVADHANARAK S,et al.Alternative routes of acetyl-CoA synthesis identified by comparative genomic analysis:involvement in the lipid production of oleaginous yeast and fungi[J].Microbiology,2012,158(1):217-228.
[40] FONTANILLE P,KUMAR V,CHRISTOPHE G,et al.Bioconversion of volatile fatty acids into lipids by the oleaginous yeastYarrowialipolytica[J].Bioresour Technol,2012,114:443-449.
[41] BLAZECK J,HILL A,LIU L,et al.HarnessingYarrowialipolyticalipogenesis to create a platform for lipid and biofuel production[J].Nat Commun,2014,5:3131.
[42] BEOPOULOS A,MROZOVA Z,THEVENIEAU F,et al.Control of lipid accumulation in the yeastYarrowialipolytica[J].Appl Environ Microbiol,2008,74(24):7779-7789.
[43] WANG J,ZHANG B,CHEN S.Oleaginous yeastYarrowialipolyticamutants with a disrupted fatty acyl-CoA synthetase gene accumulate saturated fatty acid[J].Process Biochem,2011,46(7):1436-1441.
[44] RIGOUIN C,GUÉROULT M,CROUX C,et al.Production of medium chain fatty acids byYarrowialipolytica:combining molecular design and TALEN to engineer the fatty acid synthase[J].ACS Synth Biol,2017,6(10):1870-1879.
[45] WANG W,WEI H,KNOSHAUG E,et al.Fatty alcohol production inLipomycesstarkeyiandYarrowialipolytica[J].Biotechnol Biofuels,2016,9(1):227.
[46] BLAZECK J,LIU L,KNIGHT R,et al.Heterologous production of pentane in the oleaginous yeastYarrowialipolytica[J].J Biotechnol,2013,165(3):184-194.
[47] XU P,QIAO K,AHN W S,et al.EngineeringYarrowialipolyticaas a platform for synthesis of drop-in transportation fuels and oleochemicals[J].Proc Natl Acad Sci USA,2016,113(39):10848-10853.
[48] IWAMA R,KOBAYASHI S,OHTA A,et al.Fatty aldehyde dehydrogenase multigene family involved in the assimilation ofn-alkanes inYarrowialipolytica[J].J Biol Chem,2014,289(48):33275-33286.
[49] TENAGY,PARK J S,IWAMA R,et al.Involvement of acyl-CoA synthetase genes inn-alkane assimilation and fatty acid utilization in yeastYarrowialipolytica[J].FEMS Yeast Res,2015,15(4):fov031.
[50] FUKUDA R.Metabolism of hydrophobic carbon sources and regulation of it inn-alkane-assimilating yeastYarrowialipolytica[J].Biosci Biotechnol Biochem,2013,77(6):1149-1154.
[51] BEOPOULOS A,CESCUT J,HADDOUCHE R,et al.Yarrowialipolyticaas a model for bio-oil production[J].Prog Lipid Res,2009,48(6):375-387.
[52] BOMMAREDDY R R,SABRA W,MAHESHWARI G,et al.Metabolic network analysis and experimental study of lipid production inRhodosporidiumtoruloidesgrown on single and mixed substrates[J].Microb Cell Fact,2015,14(1):36.
[53] SARAN S,MATHUR A,DALAL J,et al.Process optimization for cultivation and oil accumulation in an oleaginous yeastRhodosporidiumtoruloidesA29[J].Fuel,2017,188:324-331.
[54] ZHANG S,SKERKER J M,RUTTER C D,et al.EngineeringRhodosporidiumtoruloidesfor increased lipid production[J].Biotechnol Bioeng,2016,113(5):1056-106.
[55] ZHANG S,ITO M,SKERKER J M,et al.Metabolic engineering of the oleaginous yeastRhodosporidiumtoruloidesIFO0880 for lipid overproduction during high-density fermentation[J].Appl Microbiol Biotechnol,2016,100(21):9393-9405.
[56] 沈宏伟,靳国杰,胡翠敏,等.恒化培养稀释率和碳氮比对圆红冬孢酵母油脂积累的影响[J].生物工程学报,2012,28(1):56-64.
[57] 李永红,刘波,赵宗保,等.圆红冬孢酵母菌发酵产油脂培养基及发酵条件的优化研究[J].生物工程学报,2006,22(4):650-656.
[58] YANG X,JIN G,GONG Z,et al.Recycling biodiesel-derived glycerol by the oleaginous yeastRhodosporidiumtoruloidesY4 through the two-stage lipid production process[J].Biochem Eng J,2014,91:86-91.
[59] ZHANG C,SHEN H,ZHANG X,et al.Combined mutagenesis ofRhodosporidiumtoruloidesfor improved production of carotenoids and lipids[J].Biotechnol Lett,2016,38(10):1733-1738.
[60] JIN G,ZHANG Y,SHEN H,et al.Fatty acid ethyl esters production in aqueous phase by the oleaginous yeastRhodosporidiumtoruloides[J].Bioresour Technol,2013,150:266-270.
[61] ZHU Z,ZHANG S,LIU H,et al.A multi-omic map of the lipid-producing yeastRhodosporidiumtoruloides[J].Nat Commun,2012,3:1112.
[62] LIU H,JIAO X,WANG Y,et al.Fast and efficient genetic transformation of oleaginous yeastRhodosporidiumtoruloidesby using electroporation[J].FEMS Yeast Res,2017,17(2):fox017.
[63] LIAN J,ZHAO H.Recent advances in biosynthesis of fatty acids derived products inSaccharomycescerevisiaevia enhanced supply of precursor metabolites[J].J Ind Microbiol Biotechnol,2015,42(3):437-451.
[64] GUO Z,ZHANG L,DING Z,et al.Minimization of glycerol synthesis in industrial ethanol yeast without influencing its fermentation performance[J].Metab Eng,2011,13(1):49-59.
[65] VERHO R,LONDESBOROUGH J,PENTTILM,et al.Engineering redox cofactor regeneration for improved pentose fermentation inSaccharomycescerevisiae[J].Appl Microbiol Biotechnol,2003,69(10):5892-5897.
[66] TEO W S,HEE K S,CHANG M W.Bacterial FadR and synthetic promoters function as modular fatty acid sensor-regulators inSaccharomycescerevisiae[J].Eng Life Sci,2013,13(5):456-463.
[67] TEO W S,CHANG M W.Development and characterization of AND-gate dynamic controllers with a modular synthetic GAL1 core promoter inSaccharomycescerevisiae[J].Biotechnol Bioeng,2014,111(1):144-151.
[68] AVALOS J L,FINK G R,STEPHANOPOULOS G.Compartmentalization of metabolic pathways in yeast mitochondria improves the production of branched-chain alcohols[J].Nat Biotechnol,2013,31(4):335-341.
[69] ROTTENSTEINER H,THEODOULOU F L.The ins and outs of peroxisomes:co-ordination of membrane transport and peroxisomal metabolism[J].Biochim Biophys Acta,2006,1763(12):1527-1540.
[70] ZHOU Y J,BUIJS N A,ZHU Z,et al.Harnessing yeast peroxisomes for biosynthesis of fatty-acid-derived biofuels and chemicals with relieved side-pathway competition[J].J Am Chem Soc,2016,138(47):15368-15377.
[71] SHENG J,STEVENS J,FENG X.Pathway compartmentalization in peroxisome ofSaccharomycescerevisiaeto produce versatile medium chain fatty alcohols[J].Sci Rep,2016,6:26884.
[72] SHIBA Y,PARADISE E M,KIRBY J,et al.Engineering of the pyruvate dehydrogenase bypass inSaccharomycescerevisiaefor high-level production of isoprenoids[J].Metab Eng,2007,9(2):160-168.
[73] KOZAK B U,VAN ROSSUM H M,BENJAMIN K R,et al.Replacement of theSaccharomycescerevisiaeacetyl-CoA synthetases by alternative pathways for cytosolic acetyl-CoA synthesis[J].Metab Eng,2014,21:46-59.
[74] KOZAK B U,VAN ROSSUM H M,LUTTIKM A,et al.Engineering acetyl coenzyme A supply:functional expression of a bacterial pyruvate dehydrogenase complex in the cytosol ofSaccharomycescerevisiae[J].Mbio,2014,5(5):e01696-14.
[75] KOCHARIN K,SIEWERS V,NIELSEN J.Improved polyhydroxybutyrate production bySaccharomycescerevisiaethrough the use of the phosphoketolase pathway[J].Biotechnol Bioeng,2013,110(8):2216-2224.
[76] GUO Z,ZHANG L,DING Z,et al.Minimization of glycerol synthesis in industrial ethanol yeast without influencing its fermentation performance[J].Metab Eng,2011,13:49-59.

