超声内镜引导下细针穿刺对胰腺癌的诊断价值
石 娟, 董卫国
武汉大学人民医院消化内科,湖北 武汉 430060
胰腺癌的早期诊断至今仍是临床医师面临的难题。由于解剖学位置和早期症状没有特征性,虽然目前有CT、磁共振成像(magnetic resonance imaging,MRI)等影像学检查手段,但胰腺癌的诊断率仍然很低。多数胰腺癌患者到晚期才被确诊,增加了治疗难度,也给患者身心带来极大痛苦,给其家庭造成经济压力。对于胰腺癌的影像学诊断,CT对胰腺癌的灵敏度较高,实际能检出者多属中晚期病变,多数无法手术。慢性胰腺炎可呈肿块型表现,单凭影像学检查很难与胰腺癌鉴别[1]。超声内镜(endoscopic ultrasonography,EUS)是一个在过去30年中、在消化道内镜检查中的最重要的创新,克服了腹部超声在胰腺可视化困难而广泛应用,多年来,EUS一直被认为是胰腺和肝外胆道检查最实用的技术。可以提供胰管及其周围组织的高分辨率图像,由于传感器与腺体较短的距离,可以区分2~3 mm的结构,且因为是高频率的探头(7.5~20 MHz),虽然穿透深度浅,但却获得了更高的空间分辨率。结合细针穿刺技术(fine needle aspiration, FNA)可以对EUS发现的肿瘤进行穿刺,迅速获得新鲜标本,进行细胞学、组织学检查,更有助于胰腺癌的早期诊断和鉴别诊断[2]。超声内镜引导下的细针穿刺(endoscopic ultrasonography fine needle aspiration,EUS-FNA)应用于临床诊断已近20年,成为许多疾病的重要诊断依据。本研究对35例疑诊为胰腺癌患者行EUS-FNA,并评价EUS-FNA在胰腺癌中诊断的价值。
1 资料与方法
1.1一般资料对2015年7月至2017年1月于武汉大学人民医院消化内科经腹部超声、CT、MRI等影像学检查明确为胰腺实性占位性病变,且拟行EUS-FNA检查的患者的临床资料。所有病例均行血常规、肝肾功能、凝血功能、血尿淀粉酶、肿瘤标志物(CA199、CEA、CA50、CA242)、IG4等相关实验室检查且所有患者均没有严重的心肺脑功能不全及相关性疾病。该研究共收集35例符合要求的患者,男23例,女12例,年龄46~80岁。
1.2仪器与方法术前患者进行血红蛋白、白细胞、凝血酶原时间、血小板、心电图及生化的常规检查,均处于正常范围内,禁食8 h。
患者采取平卧体位,插入EUS对患者进行检查,显示病变,并选择合适的穿刺位置,应用彩色多普勒功能扫查穿刺区域内的血管,以避免误伤血管对其咽喉局部麻醉。先采用环扫型EUS探查,观察病变位置、大小、形态及其与周围血管、脏器的关系,确定穿刺位置,解除手柄锁,推进穿刺针约1 cm直至在声像图上见到消化道壁处的针尖。在声像图上针尖显示为线状强回声,并可有金属产生的“彗星”尾,随后更换线阵型EUS,选择最佳穿刺部位及路径,经内镜活检孔插入穿刺针(美国COOK公司),将穿刺针连同针芯准确刺入病灶内,接10 ml负压注射器快速提插抽吸5~15次,穿刺2~4针,每针结束后,缓慢释放负压,拔出穿刺针。以肉眼看到组织条定为取材满意。穿刺物置于培养液中送细胞学检查,细小组织条置于质量浓度为100 g/L的甲醛溶液中固定,常规行病理学检查。
术后患者卧床休息,禁食24 h,给予补液、抑酸等对症处理,密切观察患者心率和血压变化,注意随访有无腹痛等不适。
1.3诊断结果与随访经手术治疗的患者最终诊断结果以手术病理结果而定,对未行手术的患者进4~10个月的随访,根据临床表现和(或)影像学检查结果确定。
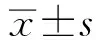
2 结果
2.1临床表现该研究中20例患者有吸烟史,10例有饮酒史,1例有急性胰腺炎史,另外4例既往体健,无其他病史。该研究35例患者中,31例有上腹部不适和腹痛,1例有腹胀的表现,1例呕吐,1例黄疸,1例无症状偶然发现。影像学诊断病灶,12例位于胰头部,5例位于胰颈部,8例位于胰体部,10例位于胰尾部(见表1)。
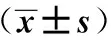


胰腺部位性别男女CA199/(U/ml)癌胚抗原头部1022161±119225±12颈部412492±72120±9体部532641±87924±10尾部462200±135621±17
2.2EUS-FNA诊断与临床诊断结果对比4例穿刺病理结果为阴性的患者中,3例手术病理结果证实为胰腺癌,1例患者CA199浓度正常,无明显症状,穿刺病理结果提示炎性细胞浸润,考虑炎性假瘤。EUS-FNA诊断胰腺癌的敏感度为91%,特异度为100%,阳性预测值为100%,穿刺病理学阳性率为88%(31/35)。
2.3病灶部位、病灶大小与病理阳性率的关系胰腺头部穿刺病理阳性率为91%、胰腺颈部穿刺病例阳性率为100%,胰腺体部穿刺病理阳性率为87%,胰腺尾部穿刺病理阳性率为80%。而病灶直径在1.0~2.0 mm的穿刺病理阳性率为87%,在2.0~3.0 mm穿刺病理阳性率为91%,>3.0 mm穿刺病理阳性率为75%。不同部位、不同大小胰腺癌与穿刺病理阳性率差异无统计学意义(P>0.05,见表2~3)。

表2 患者病灶部位与穿刺病理阳性率的关系Tab 2 The relationship between the lesion area and positiverate of biopsy pathology

表3 患者病灶大小与穿刺病理阳性率的关系Tab 3 The relationship between the lesion size and positiverate of biopsy pathology
2.4术后随访术后患者给予禁食24 h,心电、血压监护,并给予质子泵抑制剂和生长抑素(或类似物),24 h复查血常规及血淀粉酶浓度。大血管出血、穿孔、感染、胆瘘均未发生,提示EUS-FNA安全性较高。
3 讨论
尽管外科治疗在过去几十年中取得了进步,胰腺癌仍然预后不佳。且胰腺癌的发病率呈上升趋势,仍然是全球癌症相关死亡的主要原因之一。流行病学研究[3-4]表明,胰腺癌5年生存率小于5%。主要原因是胰腺癌往往是迟发性的症状,加上胰腺癌生长迅速,因此,诊断出胰腺癌往往已是晚期,小胰腺癌的诊断更加困难。患者诊断为胰腺癌时已经出现转移,因此排除根治性手术切除的可能性,手术切除可能是治愈胰腺癌的手段之一。仅有20%左右的患者出现可切除性和指数评价,手术切除后患者的5年生存率仍然不高,仅为20%[5]。此外,考虑到胰腺外科手术费用昂贵,即使是最有经验的外科医师,也会有较高的病死率及并发症发生率。因此,早期准确诊断对胰腺癌治疗和预后至关重要。
B超检查是通过显示胰腺实质内的低回声占位和通过胰管、胆管的扩张间接提示胰腺占位病变。B超对操作者的主观感受要求高,加之胰腺深居后腹部,尤其是胰头的检查受十二指肠内气体的影响,B超显示困难,所以B超检查对早期胰腺癌的检查存在局限性[6]。CT扫描能清楚显示肿瘤大小、形态,区分肿瘤 与正常胰腺、肿瘤与周围血管之间的关系,传统CT值测量不准确并产生硬化伪影,从而影响图像质量及病灶对比度,且对直径<3 cm的病灶,CT下细针穿刺操作较为困难[7]。EUS与经腹超声、CT和MRI相比,具有更为优越的实质分辨率,有研究[8]显示,EUS在诊断胰腺癌的的敏感度为98%,高于普通超声检查(75%)、CT(80%)、胰腺血管造影89%等。对于<1 cm的肿瘤,EUS也有不错的成像结果,但普通超声和CT的敏感性都降低。有研究[9]表明,通过EUS诊断壶腹周围肿瘤的灵敏度达97%,而螺旋CT略低(90%)。EUS通过内镜介导将超声探头送到十二指肠、胃体或胃底等接触胰腺头、体、尾的部位进行近距离的超声检查,可以使用较高频率探头,同时避免了肠道内气体的影响,对胰腺癌的诊断能力强,可以发现1 cm以下的病变,有利于胰腺早癌的诊断,EUS检查术已成为诊断胰腺疾病、特别是“小胰腺癌”的有效方法。EUS对小胰腺癌诊断的敏感度和准确性均高于CT[10-11]。
EUS-FNA在1992年首次由VILMANN等[12]报道,现在已被越来越多地用于诊断胰腺肿瘤,不仅准确、安全且经济。目前,穿刺组织病理检查有直接涂片法、细胞保存液细胞学法和组织条病理学法。超声可以实时动态能清楚显示,穿刺针道可保证穿刺进入靶向病灶,穿刺针进入后再拔出针芯抽吸,所以只要病灶定位准确,穿出组织必定来源于胰腺,所以有很高的特异性及准确性。CT引导下的细针活检由于穿刺路径长加上并非实时定位,因此假阴性率20%以上,ERCP的细胞刷检查的假阴性率30%以上。由于对直径<3 cm的病灶,CT下细针穿刺操作困难,就方法学来说,EUS下细针穿刺优于CT下细针穿刺和ERCP的细胞刷检查。且对比研究显示,EUS-FNA对胰腺肿瘤诊断的敏感性优于CT下细针穿刺。EUS下细针穿刺诊断胰腺病变的敏感度为64%~94%,特异度为71%~100%,准确率为78%~95%[13]。
EUS-FNA除能观察形态学外还可做细胞学分析,且EUS下细针穿刺可以鉴别胰腺肿瘤的组织学,这对于接下来肿瘤的诊断和治疗具有重要意义。近年来分子生物学的发展,其分子标志物的筛查为EUS-FNA开辟了新途径[14],细针穿刺联合基因检测K-ras其诊断灵敏度、特异度、阳性预测值均高于单一细胞学检测[15]。但EUS下细针穿刺操作过程由于操作者操作习惯和技术水平的差异如穿刺是否负压、是否使用针芯、进针快慢,通过细针穿刺取得组织的量少,对病理科依赖性强,及医院之间医疗仪器的不同,使得EUS下细针穿刺对胰腺癌诊断的敏感度、特异度及准确率差异较大。根据指南推荐,我们采用负压穿刺、22 G针穿刺[16]。
EUS下细针穿刺相对安全,其并发症发生率低(0~2.5%),主要是出血、穿孔、腹痛,术前7 d内有抗血小板药物应用史可能会增加穿刺出血的风险,对于这部分患者进行细针穿刺出血风险的评估显得越来越重要[17-18]。综上,我们认为EUS下细针穿刺是安全有效的操作,对胰腺癌的诊断有较高价值,值得推广。
[1] 徐桂芳, 邹晓平, 张伟杰, 等. 肿块型慢性胰腺炎11例的临床及影像学特征[J]. 中华胰腺病杂志, 2010, 10(4): 241-244. DOI: 10.3760/cma.j.issn.1674-1935.2010.04.006.
XU G F, ZOU X P, ZHANG W J, et al. Clinical and imaging features of mass forming chronic pancreatitis [J]. Chin J Pancreatol, 2010, 10(4): 241-244. DOI: 10.3760/cma.j.issn.1674-1935.2010.04.006.
[2] 刘欣. 超声内镜在胰腺癌诊治中的应用进展[J]. 胃肠病学和肝病学杂志, 2013, 22(6): 607-610. DOI: 10.3969/j.issn.1006-5709.2013.06.036.
LIU X. Progress of endoscopic ultrasound in the diagnosis and treatment of pancreatic cancer [J]. Chin J Gastroenterol Hepatol, 2013, 22(6): 607-610. DOI: 10.3969/j.issn.1006-5709.2013.06.036.
[3] WOLFGANG C L, HERMAN J M, LAHERU D A, et al. Recent progress in pancreatic cancer [J]. CA Cancer J Clin, 2013, 63(5): 318-348. DOI: 10.3322/caac.21190.
[4] 张虎, 张平. 晚期胰腺癌综合治疗的研究进展[J]. 胃肠病学和肝病学杂志, 2015, 24(7): 894-898. DOI: 10.3969/j.issn.1006-5709.2015.07.037.
ZHANG H, ZHANG P. Research progress of comprehensive treatment in advanced pancreatic cancer [J]. Chin J Gastroenterol Hepatol, 2015, 24(7): 894-898. DOI: 10.3969/j.issn.1006-5709.2015.07.037.
[6] HANADA K, OKAZAKI A, HIRANO N, et al. Effective screening for early diagnosis of pancreatic cancer [J]. Best Pract Res Clin Gastroenterol, 2015, 29(6): 929-939. DOI: 10.1016/j.bpg.2015.09.017.
[7] RÖSCH T. Endoscopic ultrasonography: imaging and beyond [J]. Gut, 2003, 52(8): 1220-1226.
[8] SAISHO H, YAMAGUCHI T. Diagnostic imaging for pancreatic cancer: computed tomography, magnetic resonance imaging, and positron emission tomography [J]. Pancreas, 2004, 28(3): 273-278.
[9] CHANG K J, NGUYEN P, ERICKSON R A, et al. The clinical utility of endoscopic ultrasound-guided fine-needle aspiration in the diagnosis and staging of pancreatic carcinoma [J]. Gastrointest Endosc, 1997, 45(5): 387-393.
[10] 刘玉美. 超声内镜对胰腺小肿瘤的诊断价值[J]. 中国癌症杂志, 2017, 27(3): 233-236. DOI: 10.19401/j.cnki.1007-3639.2017.03.012.
LIU Y M. The role of endoscopic ultrasound in detection of small pancreatic tumors [J]. China Oncology, 2017, 27(3): 233-236. DOI: 10.19401/j.cnki.1007-3639.2017.03.012.
[11] VARADARAJULU S, ELOUBEIDI M A. The role of endoscopic ultrasonography in the evaluation of pancreatico-biliary cancer [J]. Surg Clin North Am, 2010, 90(2): 251-263. DOI: 10.1016/j.suc.2010.01.002.
[12] VILMANN P, JACOBSEN G K, HENRIKSEN F W, et al. Endoscopic ultrasonography with guided fine needle aspiration biopsy in pancreatic disease [J]. Gastrointest Endosc, 1992, 38(2): 172-173.
[13] HORWHAT J D, PAULSON E K, MCGRATH K, et al. A randomized comparison of EUS-guided FNA versus CT or US-guided FNA for the evaluation of pancreatic mass lesions [J]. Gastrointest Endosc, 2006, 63(7): 966-975. DOI: 10.1016/j.gie.2005.09.028.
[14] 许莹, 潘振国, 李倩君, 等. GSK3β、CXCR4、MMP-2与胰腺癌侵袭和转移的关系[J]. 胃肠病学和肝病学杂志, 2016, 25(11): 1308-1311. DOI: 10.3969/j.issn.1006-5709.2016.11.027.
XU Y, PAN Z G, LI Q J, et al. Relationship of invasion and metastasis of pancreatic cancer with GSK3β, CXCR4 and MMP-2 [J]. Chin J Gastroenterol Hepatol, 2016, 25(11): 1308-1311. DOI: 10.3969/j.issn.1006-5709.2016.11.027.
[15] 王小玮, 高军, 顾俊骏, 等. 胰腺超声内镜细针穿刺活检物中K-ras基因定量检测对胰腺癌诊断价值的研究[J]. 中华消化内镜杂志, 2011, 28(3): 126-130. DOI: 10.3760/cma.j.issn.1007-5232.2011.03.003.
WANG X W, GAO J, GU J J, et al. Quantitative detection of K-ras gene mutation in samples from endoscopic ultrasound-guided fine-needle aspiration for pancreatic cancer [J]. Chin J Dig Endosc, 2011, 28(3): 126-130. DOI: 10.3760/cma.j.issn.1007-5232.2011.03.003.
[16] 葛楠, 孙思予, 金震东. 中国内镜超声引导下细针穿刺临床应用指南[J]. 中华消化内镜杂志, 2017, 34(1): 3-13. DOI: 10.3760/cma.j.issn.1007-5232.2017.01.002.
[17] YOON W J, BRUGGE W R. The safety of endoscopic ultrasound-guided fine-needle aspiration of pancreatic cystic lesions [J]. Endoscopic Ultrasound, 2015, 4(4): 289-292. DOI: 10.4103/2303-9027.170408.
[18] LEE L S, SALTZMAN J R, BOUNDS B C, et al. EUS-guided fine needle aspiration of pancreatic cysts: a retrospective analysis of complications and their predictors [J]. Clin Gastroenterol Hepatol, 2005, 3(3): 231-236.

