鄱阳湖CDOM三维荧光光谱的平行因子分析
刘丽贞,黄 琪,吴永明,吴代赦,游海林 (.江西省科学院鄱阳湖研究中心,江西 南昌 0096;2.江西师范大学鄱阳湖湿地与流域研究教育部重点实验室,江西 南昌 0022;.南昌大学资源环境与化工学院,江西 南昌 00)
水体溶解性有机物(DOM)是全球地球化学循环中重要且十分活跃的组分,是有机成份的最主要部分.而有色溶解有机物(CDOM)作为DOM 中的重要组成部分,因其具有独特的荧光特性,对研究DOM的组成、来源以及环境行为具有重要意义.三维荧光光谱(EEMs)技术可以快捷准确地获取水体中 CDOM 的荧光组分的组成及浓度等信息,且具有快捷、不破坏样品结构、用量少、灵敏度高等特点,并结合平行因子分析被广泛应用到水环境CDOM研究中[1-6].鄱阳湖是中国最大的淡水湖泊,是典型的大型吞吐性湖泊.由于水位变化明显,具有典型的通江湖泊特征.随着环湖周边地区经济的快速发展以及人类活动的营养盐排放的增加,鄱阳湖水质表现出下降的趋势.目前已有大量关于湖泊CDOM 的研究[3,7-9],然而对于水位幅度变化大的通江湖泊鄱阳湖中的 CDOM 研究仍然较少.本研究根据鄱阳湖水文节律特征,应用EEMs结合平行因子分析技术获得 CDOM 的荧光组分,分析其时空变化特征以及荧光光谱参数意义,探讨 CDOM 荧光组分与氮磷营养盐的关系,旨在为深入了解通江湖泊中有机物和营养盐的生物地球化学循环提供参考.
1 采样和方法测定
1.1 样品采集
针对鄱阳湖独特的水文节律(即枯水期---涨水---丰水---退水期),本研究于2016年枯水期(1月)、涨水期(4月)、丰水期(7月)和退水期(10月)进行水样采集共119个样品,采样点如图1所示,其中入湖河口样点为三角形样点.采集的水样放入装有冰块的保温箱避光低温保存,立即运回实验室,对样品进行Whatman GF/F玻璃纤维滤膜过滤处理,滤液需进一步使用0.2μm的滤膜过滤,全部滤后液于-20℃冰箱冷冻避光保存待测.
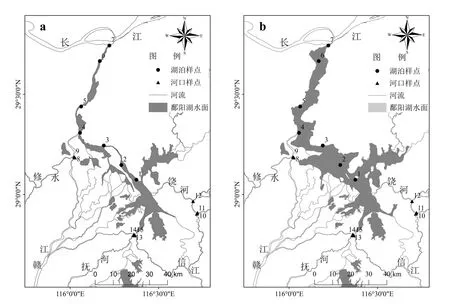
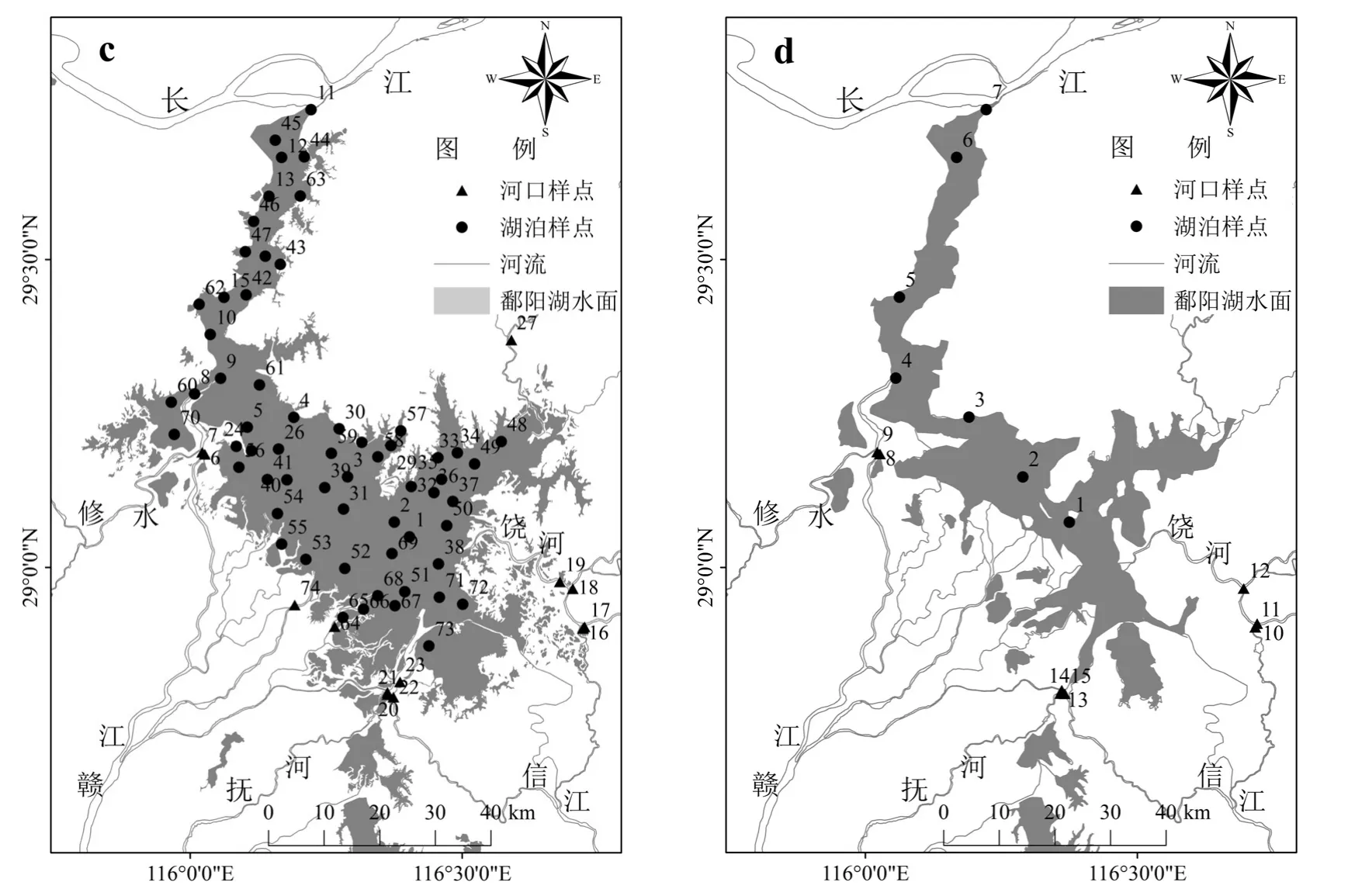
图1 采样点分布Fig.1 The distribution of sample sites
1.2 CDOM三维荧光光谱的测定
使用日立F-7000荧光光谱分析仪,配以1cm石英比色皿,以 Mill-Q 超纯水为空白,进行荧光扫描,激发波长扫描范围为200~450nm,发射波长扫描范围为 250~550nm.拉曼散射、内滤效应校正以及样品荧光强度标准化过程参考文献[6,10]进行.
荧光指数FI(370)是指激发波长Ex为370nm时,荧光发射光谱Em在450nm和500nm处的荧光强度比值[11].生物源指数BIX是指激发波长Ex为310nm时,发射波长在380nm与430nm 处荧光强度的比值[12];腐殖化指数 HIX为激发波长Ex为254nm时,发射波长在435~480nm与300~345nm波段内的荧光强度积分值的比率[12,14].
1.3 氮磷营养盐的测定
总氮(TN)、总磷(TP)、溶解性总氮(DTN)和溶解性总磷(DTP)的测定均参照《湖泊富营养化调查规范》[13],即TN、TP、DTN和DTP的测定采用过硫酸盐氧化法,并用紫外分光光度计测定.
1.4 统计分析
采用ArcGIS10.3绘制参数空间分布图和采样点分布图.运用Origin 8.5进行数据拟合分析,使用SPSS 11.5进行均值、标准差、相关分析以及方差分析. P < 0.05为达到显著检测水平, P <0.01为极显著水平.使用Matlab软件运用平行因子分析法(PARAFAC)模型[4,6,15]对 117个水样(119个样品中剔除2个异常样品)中CDOM的三维荧光光谱图进行识别荧光组分特征.利用将数据库随机等分为2个子数据库的方法 (split-half analysis) 来验证组分识别的正确性.其中PARAFAC模型计算公式如下所示:
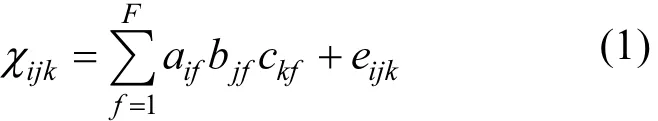
式中:χijk为第i个样点在激发波长Ex为k、发射波长Em为j处的荧光强度;aif为因子得分,反映第 f个组分浓度占 i个样品的浓度比例; bjf、ckf与为载荷,分别是与第f个组分的第k个激发光谱相对值和第j个发射光谱相对值;eijk是残差元素;F为模型中选择的组分因子数量.
2 结果与讨论
2.1 鄱阳湖水质特征
综合分析一年四季调查数据(图2)可看出,鄱阳湖TN和TP浓度范围值在0.48~4.13mg/L和0.011~0.612mg/L之间变化.高浓度N、P营养盐出现在退水期,相对于其他水情条件,TN、DTN、TP和 DTP均值以退水期最高.通过潜在性富营养化评价得出[16],2016年鄱阳湖氮磷营养盐污染仍为严重,其中以退水期氮磷富营养化最为严重.由 N/P比值(Redfield 比值)可以反映出[17],2016年鄱阳湖N/P均值大于16,表现为磷限制,氮污染相对比较严重.其中表现为磷限制的点位占总点位数的 63.2%.以涨水期氮污染最为严重,点位比例高达 93.3%,退水期次之(69.2%),丰水期最低(56.8%).
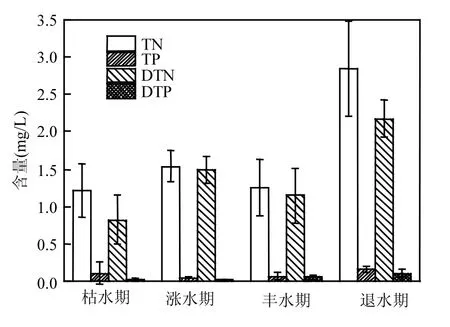
图2 2016年鄱阳湖氮磷营养盐Fig.2 The nitrogen and phosphorus concentrations in Poyang Lake in 2016
2.2 鄱阳湖水体CDOM的荧光组成和分布
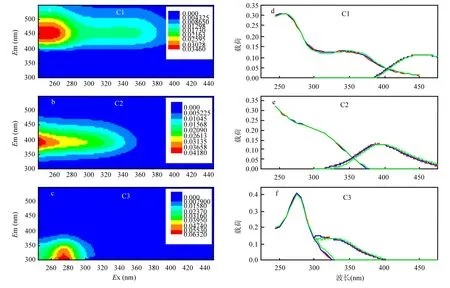
图3 鄱阳湖CDOM的3个组分的EEMS及最大激发/发射波长分布Fig.3 EEMs and the maximum excitation/emission wavelength distribution of three components of CDOM of Poyang Lake
运用 PARAFAC,将鄱阳湖117个样品三维荧光光谱分解得到3个荧光组分(图3).各组分特征与已有研究结果较为接近(表 1).其中组分C1(245/391nm),具有单一的激发峰和发射峰,主要代表了短波腐殖质,位于传统的 A 峰(230~260/380~460nm)区域[18],被认为微生物作用类腐殖质[4].C2具有两个激发峰和一个发射峰,其中255/453nm代表了短波陆源腐殖质,340/453nm代表了长波陆源腐殖质,位于传统的 C峰(320~360/380~460nm)区域[18],代表传统典型的陆源类腐殖质.组分 C3(275/304nm)代表了类蛋白组分特征,为类酪氨酸组分,位于传统的B峰(275/ 305~310nm)区域.水体中溶解态类酪氨酸比类色氨酸更容易光降解[19],且在本研究中采集的水样都为水体表层0.5m处的水体.而在本研究中通过PARAFAC分析得出,与2012年鄱阳湖水体DOM中荧光物质有所不同[20],在2016年鄱阳湖水体CDOM中发现类蛋白物质仅为类酪氨酸物质,未能解析分离出色氨酸物质,此结果表明鄱阳湖水体存在大量类酪氨酸物质的来源,具体来源机制则有待下一步研究探索.

表1 鄱阳湖CDOM的荧光组成特征Table 1 Fluorescence feature of the 3fluorescent components of chromophoric dissolved organic matters in Poyang Lake
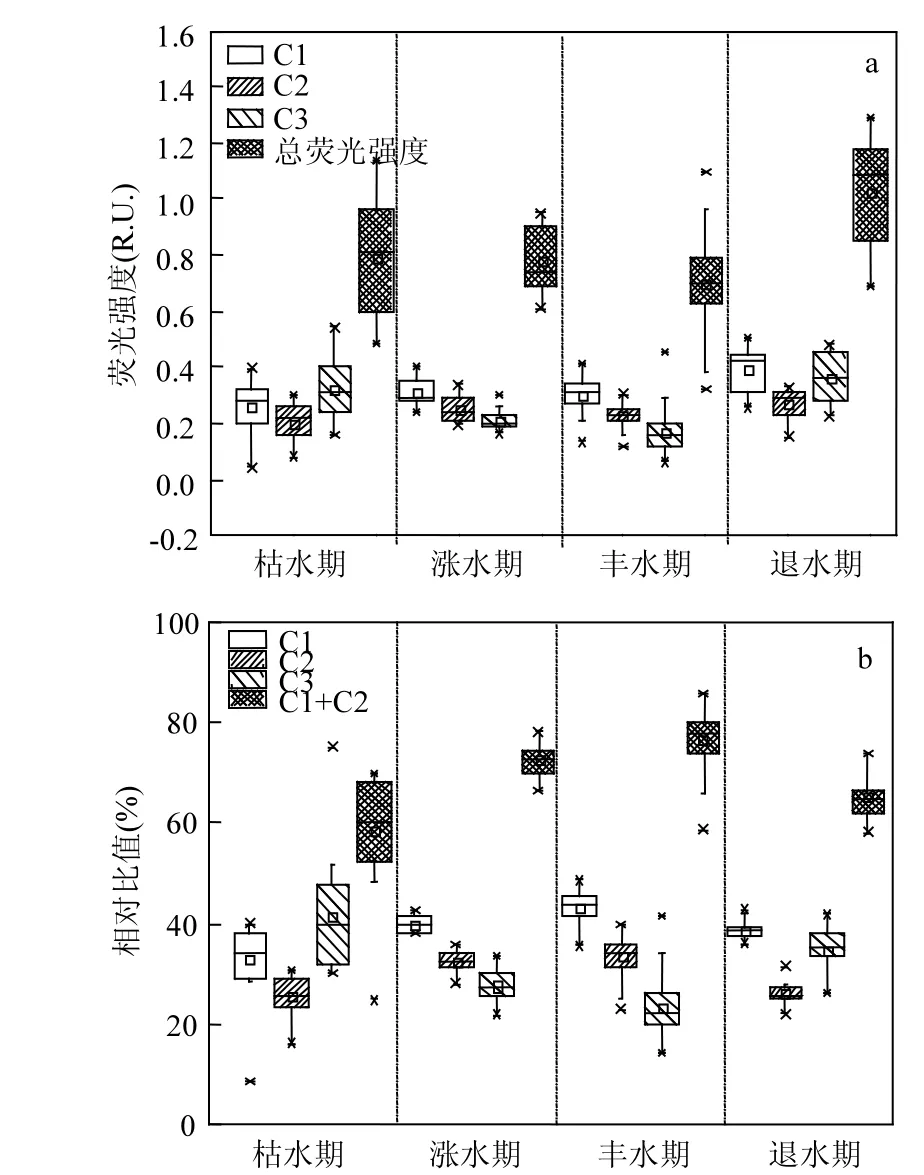
图4 不同水文节律下鄱阳湖CDOM各组分的荧光强度和相对丰度Fig.4 Fluorescence intensities (RU.) and relative abundance (%) of three CDOM fluorescence components in different water-level periods
在 CDOM 组成中,以类腐殖质物质为主.其中微生物作用类腐殖质C1占40.8%,陆源类腐殖质C2占30.8%,类酪氨酸物质C3占28.4%.如图4通过比较 2016年不同水文时期的荧光强度(C1、C2、C3组分,总类腐殖质,以及总荧光),都以退水期为最大.其中微生物作用类腐殖质C1、陆源类腐殖质 C2以及总类腐殖质(C1+C2)荧光强度随着节律变化顺序为:退水期>涨水期>丰水期>枯水期,各自对应的贡献大小顺序为:丰水期>涨水期>退水期>枯水期.类酪氨基酸组分C3荧光强度随着节律变化依次为:退水期>枯水期>涨水期>丰水期,各自对应的贡献大小顺序为枯水期>退水期>涨水期>丰水期.类腐殖质和类酪氨酸与高氮磷营养盐在退水期最高的规律一致,即在退水期的荧光强度值最大.而在两个极端水文条件下表现出不同规律,即类腐殖质在枯水期荧光强度和贡献都为最低,在丰水期贡献率最大.原因在于丰水期鄱阳湖流域降水较多,难降解的陆源性类腐殖质随雨水和地表径流持续输入鄱阳湖.且由于江西省内降水多为酸雨,类腐殖质物质在酸雨条件下很容易从土壤中转移至水体中[25].这很有可能是导致类腐殖质物质在丰水期的贡献率最大的原因,相比而言,类酪氨酸物质在总荧光物质下的贡献便不高.而类酪氨酸在丰水期,其荧光强度和贡献为最低,在枯水期贡献率最大.鉴于类蛋白物质直接与污水水质相关[1-2,26],丰水期鄱阳湖纳污能力最大,而枯水期时鄱阳湖的纳污能力最小[27],来自滨湖区城镇污水中含有大量的类蛋白物质可导致枯水期类酪氨酸物质贡献大.同时也由上可反映出,类腐殖质和类酪氨酸的来源具有差异性.通过分析各个水情条件下的类酪氨酸C3和类腐殖质(C1和C2)相关关系,我们发现,C1和 C2之间都呈现非常显著的相关关系(P<0.001, R>0.94).在枯水期和涨水期间, C1和C2组分都与C3没有显著相关性(P>0.05).而在丰水期和退水期间,C1和C2以及C3之间呈现显著相关性(P<0.05).这说明微生物作用类腐殖质和陆源类腐殖质具有极相似来源性,而与类酪氨酸物质的来源因水情条件不同具有差异性.
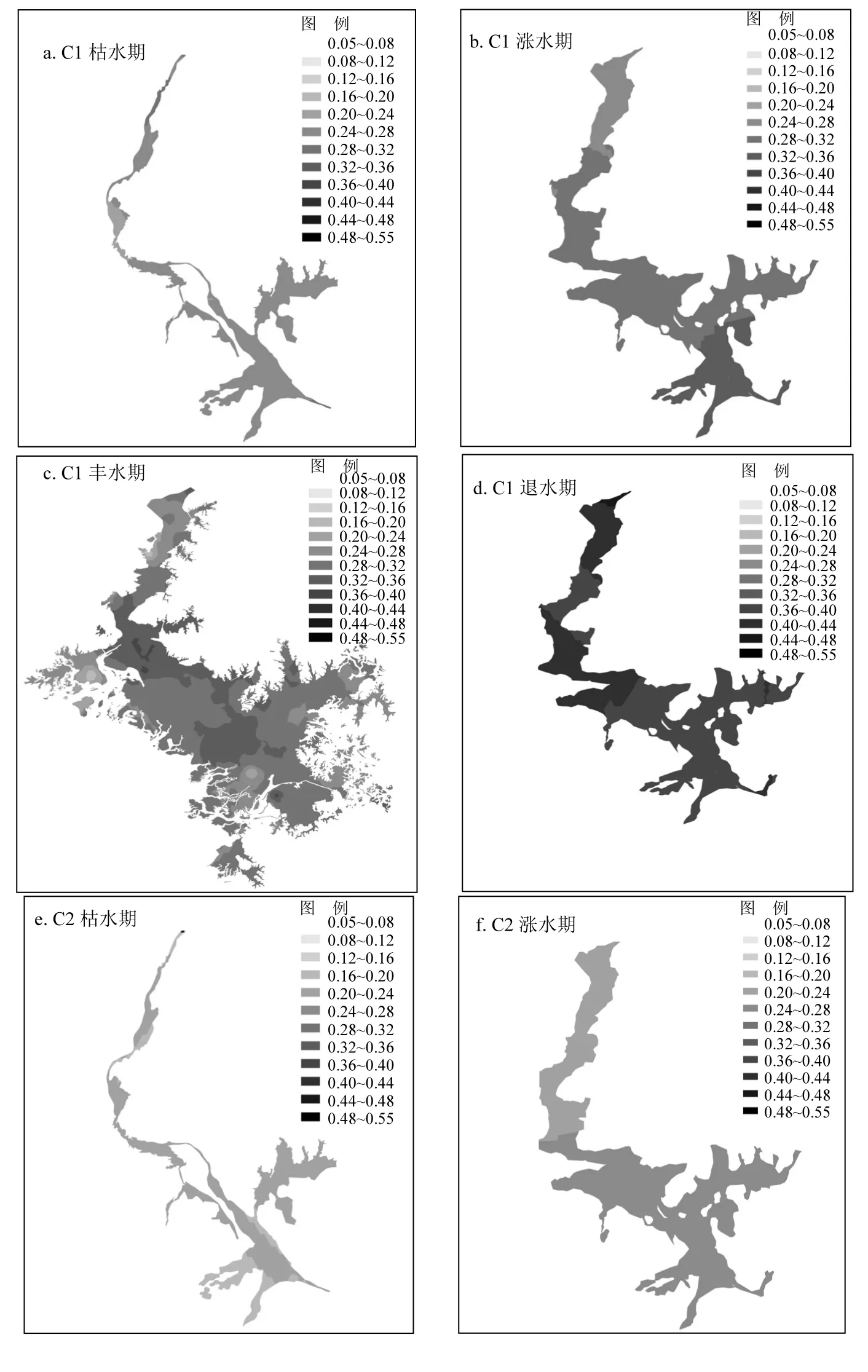

图5 鄱阳湖不同水文节律下各荧光组分的空间分布特征Fig.5 The spatial distribution of CDOM components in Poyang Lake in different water-level periods
由图5可看出,CDOM各荧光组分的荧光强度分布因水文条件不同而有所差异.总体而言,荧光组分在同一水文条件下,荧光强度变化趋势相似.在 2016年枯水期和退水期,各组分的荧光强度值范围波动都较小,且各荧光组分的高荧光强度值出现在北部入长江口处.这可能受到入江湖口城镇的陆源输入影响[28].在涨水期时,各荧光组分强度则以南部湖面较高,北部湖面较低,呈现南高北低的趋势.并通过方差检验得出,河口区的C2荧光组分(陆源类腐殖质)、总荧光强度(C1+C2+C3)以及总类腐殖质(C1+C2)荧光强度显著高于湖区(P<0.05).这表明,涨水期CDOM物质空间分布受河流输入的影响较大,CDOM由河口输入至湖区的荧光物质随着水流由南向北扩散输送.这是由于涨水期间入湖河流的水量逐渐增加,水体含有大量CDOM也随着河流输入鄱阳湖.值得注意的是,尽管类腐殖质(C1和 C2)和类酪氨酸(C3)在枯水期和涨水期的空间分布格局类似,但如前面分析得出,这两大类物质之间并没有显著相关性,具有不同的来源特征.在丰水期时,各组分高荧光强度值发生在鄱阳湖南部和中部区域,其中微生物类腐殖质 C1和陆源类腐殖质C2在南部主要集中在南矶湿地水域附近以及中部吴城湿地水域附近,这可能是水涨引起的湿地植物淹没死亡降解释放CDOM至水体中,从而导致各荧光组分荧光强度增加.有研究表明中部区域鄱阳湖初级生产力以老爷庙附近最高,且附近水体有养殖区域[29],受人类活动影响较大,这可能造成鄱阳湖中部区域荧光强度增强的原因.类酪氨酸C3组分在都昌县城附近的荧光强度较高,这说明受人类活动较大.
2.3 荧光光谱参数
为进一步探讨鄱阳湖水体中CDOM的来源属性和腐殖化程度[3,12,30],采用荧光指数 FI(370),生物源指标BIX和腐殖化指标HIX来研究鄱阳湖水体中 CDOM 的来源性质特征.结果发现,鄱阳湖在整年中, FI(370)指数变化范围为1.3~1.87,均值为1.64,介于1.4与1.9之间,这表明鄱阳湖水中 CDOM 呈现外源和内源的特征.其中枯水期FI(370)指数的变化范围为 1.3~1.46,平均值为1.41,接近1.4,这表明枯水期鄱阳湖中CDOM以陆源性有机物输入为主.对于涨水期, FI(370)指数变化范围1.66~1.87,均值为1.72,尽管由图4可知,涨水期CDOM荧光物质受河流输入影响较大,然而FI指数并没有呈现出外源特征,这与河口中FI(370)均值不高有关(FI均值为 1.73).通过生物源指标BIX显示,整年中,鄱阳湖水体CDOM中BIX变化范围为0.76~1.26,最高值出现在枯水期鄱阳湖湖面上,而最低值出现在丰水期赣江经过南矶山湿地水体中入湖处;整个水文周期下 BIX均值为 0.92,这表明鄱阳湖水体具有一定的微生物活性.枯水期时水体CDOM的BIX值变化范围为 0.96~1.25,均值为 1.06,表明枯水期水体中CDOM虽然以外源输入为主,但相比于其他水文条件下,也具有更高的微生物活性.腐殖化指数HIX可用于估算CDOM的腐殖化程度[12,14],HIX指数越高则腐殖化程度越高,芳香性越强. Zhang等[3]研究结果指出当HIX<1.5时,CDOM具有生物自生源特征,本研究由图6可以看出,整个水文周期内,HIX指数偏低,均小于 1.5,这表明整体而言,鄱阳湖水体腐殖化程度较弱,生物活性较强.此结论与生物源 BIX 指数结论一致.枯水期CDOM中的HIX值显著高于其他水文节律(P <0.001),表明枯水期相对于其他水文条件下,尽管枯水期类腐殖质荧光强度最低(图4),但由于储水量小,易受外源输入影响,从而导致 CDOM 腐殖化程度更高.

图6 不同水文节律下鄱阳湖水体的荧光指数值Fig.6 Values and distribution of fluorescence indices in Poyang Lake in different water-level periods
2.4 CDOM荧光组成和氮磷营养盐的相关性
由于 CDOM 的成分复杂性,因而不同水域的 CDOM 特征也有所不同.三维荧光光谱技术具有快速、高灵敏度、低检测限、无需样品提取和可以准确判别水体中CDOM组成的特点[3].目前有很多文献研究了特定水域 CDOM 中荧光组成与氮磷营养盐的显著相关性,以期建立基于 CDOM 荧光手段来快速监测特定水域的水质状况.如 Hur等[26]研究典型城市河流得出TN与微生物作用类腐殖质C1之间的相关性最好.Zhang等[3]通过研究38个云贵高原湖泊得出,类腐殖质物质与 TN、DTN、TP、DTP都呈现显著的正相关(P<0.01),而类蛋白物质(类酪氨酸和类色氨酸)则与氮磷营养盐无显著相关性.鄱阳湖作为典型通江湖泊,随着周边快速发展,富营养化加剧.为此本研究使用三维荧光技术结合平行因子分析法探讨 CDOM 与氮磷营养盐的关系,为日后实现快速、实时地进行水质监测和管理提供科技支撑.由表 3可看出,类腐殖质组分 C1、C2、C3、总类腐殖质荧光强度(C1+C2)以及总荧光强度值都与TN、DTN呈现极显著正相关(P<0.01).如前分析,鄱阳湖水体主要受氮污染特征较显著,该显著关系表明应用总荧光强度尤其是类腐殖质荧光强度可以很好地应用到鄱阳湖水质尤其是氮污染性水体表征中.此外,总荧光强度值和类酪氨酸组分与TP之间呈现显著正相关.由此可以看出,类酪氨酸还可以较好地反映TP状况.

表2 水质参数和CDOM组分荧光强度间的Pearson相关性Table 2 Pearson correlations between water quality and fluorescence intensities of CDOM components
3 结论
3.1 通过 PARAFAC 分析得出,鄱阳湖 CDOM以类腐殖质物质为主(占 71.6 %),主要由类微生物作用类腐殖质物质C1(245/391nm)、陆源性类腐殖质 C2(255(340)/453nm)和类酪氨酸物质 C3(275/304nm)构成.
3.2 类腐殖质和类酪氨酸在两个极端水文条件下表现出截然不同规律,即类腐殖质在枯水期荧光强度和贡献都为最低,在丰水期贡献率最大,而类酪氨酸在丰水期,荧光强度和贡献为最低,在枯水期贡献率最大.
3.3 CDOM各组分荧光强度因水文条件不同具有差异性.各组分在枯水期和退水期,其荧光强度变化幅度较小,较高值出现在入江湖口处.涨水期则表现为南高北低特征,且河口的荧光强度值显著大于湖体值,受河流输入扩散影响较大.丰水期荧光强度较高值出现在湿地附近和受人类活动影响大的水域.
3.4 荧光光谱参数结果表明,鄱阳湖 CDOM 呈现外源和内源的特征,其中枯水期以外源输入为主.CDOM各组成荧光强度、总荧光强度都与总氮、溶解性总氮呈现显著正相关.类酪氨酸组分除跟氮营养盐显著正相关外,还与 TP呈现显著正相关.
[1]Liu X, Zhang Y, Shi K, et al. Absorption and fluorescence properties of chromophoric dissolved organic matter: implications for the monitoring of water quality in a large subtropical reservoir[J]. Environmental Science and Pollution Research, 2014,21(24):14078.
[2]Wang X, Zhang F, Kung H T, et al. Evaluation and estimation of surface water quality in an arid region based on EEM-PARAFAC and 3D fluorescence spectral index: A case study of the Ebinur Lake Watershed, China [J]. Catena, 2017,155:62-74.
[3]Zhang Y, Zhang E, Yin Y, et al. Characteristics and sources of chromophoric dissolved organic matter in lakes of the Yungui Plateau, China, differing in trophic state and altitude[J].Limnology & Oceanography, 2010,55(6):2645—2659.
[4]Zhou Y, Shi K, Zhang Y, et al. Fluorescence peak integration ratio IC:IT as a new potential indicator tracing the compositional changes in chromophoric dissolved organic matter[J]. Science of the Total Environment, 2016,574:1588-1598.
[5]虞敏达,何小松,檀文炳,等.城市纳污河流有色溶解有机物时空演变特征 [J]. 中国环境科学, 2016,36(1):133-142.
[6]Zhou Y, Zhang Y, Shi K, et al. Dynamics of chromophoric dissolved organic matter influenced by hydrological conditions in a large, shallow, and eutrophic lake in China [J]. Environmental Science & Pollution Research, 2015,22(17):12992-13003.
[7]王书航,王雯雯,姜 霞,等.基于三维荧光光谱—平行因子分析技术的蠡湖 CDOM 分布特征 [J]. 中国环境科学, 2016,36(2):517-524.
[8]程庆霖,郑丙辉,王圣瑞,等.滇池水体有色溶解性有机质(CDOM)三维荧光光谱特征 [J]. 光谱学与光谱分析, 2014,34(3):698-703.
[9]周永强,张运林,牛 城,等.基于 EEMs及 PARAFAC 的洪湖,东湖与梁子湖 CDOM 组成特征分析 [J]. 光谱学与光谱分析,2013,33(12):3286-3292.
[10]Zhou Y, Zhang Y, Jeppesen E, et al. Inflow rate-driven changes in the composition and dynamics of chromophoric dissolved organic matter in a large drinking water lake [J]. Water Research, 2016,100:211-221.
[11]Mcknight D M, Boyer E W, Westerhoff P K, et al.Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity [J].Limnology & Oceanography, 2001,46(1):38-48.
[12]Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary [J]. Organic Geochemistry, 2009,40(6):706-719.
[13]金相灿,屠清瑛.湖泊富营养化调查规范(第二版) [M]. 北京:中国环境科学出版社, 1990.
[14]Zsolnay A, Baigar E, Jimenez M, et al. Differentiating with fluorescence spectroscopy the sources of dissolved organic matter in soils subjected to drying [J]. Chemosphere, 1999,38(1):45-50.
[15]祝 鹏,华祖林,李惠民.湖泊水体三维荧光光谱的PARAFAC法在污染源解析中的应用 [J]. 光谱学与光谱分析, 2012,32(12):3290-3294.
[16]胡春华,周文斌,王毛兰,等.鄱阳湖氮磷营养盐变化特征及潜在性富营养化评价 [J]. 湖泊科学, 2010,22(05):723-728.
[17]Redfield A C, The biological control of chemical factors in the environment [J]. Science Progress, 1960,11(11):150-170.
[18]Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy [J].Marine Chemistry, 1996,51(4):325-346.
[19]Xu H, Jiang H. UV-induced photochemical heterogeneity of dissolved and attached organic matter associated with cyanobacterial blooms in a eutrophic freshwater lake [J]. Water Research, 2013,47(17):6506-6515.
[20]Yao X, Wang S, Ni Z, et al. The response of water quality variation in Poyang Lake (Jiangxi, People's Republic of China) to hydrological changes using historical data and DOM fluorescence[J]. Environmental Science and Pollution Research, 2015,22(4):3032-3042.
[21]蔡文良,许晓毅,罗固源,等.长江重庆段溶解性有机物的荧光特性分析 [J]. 环境化学, 2012,31(7):1003-1008.
[22]祝 鹏,华祖林,李惠民.PARAFAC法解析太湖水体 DOM三维荧光光谱 [J]. 光谱学与光谱分析, 2013,33(6):1619-1625.
[23]Stedmon C A, Markager S. Resolving the variability in dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis [J]. Limnology &Oceanography, 2005,50(2):686-697.
[24]刘学利,姚 昕,董 杰,等.东平湖可溶性有机物的荧光特征及环境意义 [J]. 生态与农村环境学报, 2016,32(6):933-939.
[25]Liu L, Song C Y, Yan Z G, et al. Characterizing the release of different composition of dissolved organic matter in soil under acid rain leaching using three-dimensional excitation-emission matrix spectroscopy [J]. Chemosphere, 2009,77(1):15-21.
[26]Hur J, Cho J. Prediction of BOD, COD, and Total Nitrogen Concentrations in a Typical Urban River Using a Fluorescence Excitation-Emission Matrix with PARAFAC and UV Absorption Indices [J]. Sensors (Basel, Switzerland), 2012,12(1):972-986.
[27]金国花,谢冬明,邓红兵,等.鄱阳湖水文特征及湖泊纳污能力季节性变化分析 [J]. 江西农业大学学报, 2011,33(2):0388-0393.
[28]刘发根,李 梅,郭玉银.鄱阳湖水质时空变化及受水位影响的定量分析 [J]. 水文, 2014,34(4):37-43.
[29]李艳红,葛 刚,王茂林,等.垂向归纳模型下鄱阳湖丰、枯水期初级生产力特征及与环境因子相关性分析 [J]. 湖泊科学,2016,28(3):575-582.
[30]Helms J R, Aron S, Ritchie J D, et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter [J].Limnology & Oceanography, 2008,54(3):955-969.

