强化混凝和改性活性炭对二级出水DON的作用机制
刘 冰,郑煜铭,古 励,李清飞,余国忠,翟慧敏 (.信阳师范学院地理科学学院,河南 信阳 464000;.中国科学院城市环境研究所,福建 厦门 60;.重庆大学城市建设与环境工程学院,重庆 重庆 400044)
城市污水处理厂进水中NH4+-N、颗粒性有机氮、胶体性有机氮可以通过污水处理工艺加以去除,而溶解性有机氮(DON)却很难被去除[1].城市污水厂二级出水中DON可达到0.5~3.0mg/L.甚至可占到出水总氮 40%~85%[2].二级出水中DON还含有部分的可生物降解DON(BDON)或可生物利用 DON(ABDON),如:溶解游离氨基酸和尿素等,约占 DON 的 18%~61%[3-4].二级出水排入到河流或湖泊等自然水体中,ABDON、BDON可以成为潜在的营养物质,刺激水中生物生长以及消耗溶解氧,严重威胁到受纳水体生物安全性以及提高富营养化程度.另一方面,城市污水厂出水还可能作用中水回用或者排入河流直接/间接地作为下游水源水,水中 DON在氯化消毒过程中会形成含硝基(—NO2)、腈基(—C≡N)、酰胺基(—CO—NH2)和亚硝胺(—N—N=O)的含氮消毒副产物(N-DBPs)[5-7].N-DBPs致癌浓度较低,以亚硝胺类为例,其中二甲基亚硝胺(NDMA)和二乙基亚硝胺(NDEA)致癌浓度仅为0.7, 0.2ng/L[6].
水体中溶解性有机碳(DOC)可以通过混凝沉淀、活性炭吸附、离子交换、高级氧化和生物降解等不同的物理和化学方法来消除/转移.其中,混凝沉淀和活性炭吸附是最经济、最常用和效率高的工艺,较容易在生产中应用,经常被用于去除二级出水 DOC[8-10].但常规混凝对DOC去除能力较为有限,则可以通过优化絮凝条件、调节 pH值、氧化剂预氧化、加入高分子助凝剂剂等手段对混凝进行强化,达到对水中有机物最大限度去除的目的[11].对二级出水进行强化混凝时发现,强化混凝对水中有机物及消毒副产物前体物具有良好的去除效果[12].而活性炭主要用于去除二级出水中小/中分子量、生物降解性有机物,可获得约 65%~70%的去除率[13-14].活性炭对有机物的去除效果取决于其特征,例如:比表面积、孔隙度、表面极性、物理形状等,以及被吸附物质的特点(亲疏水性、电荷和分子结构等).其中,活性炭表面的化学性质(包括官能团、电位和酸碱性质等)对吸附容量有重要影响,而且酸或碱对活性炭进行改性来改变表面化学性质是最常用处理方法[15-16].
与DOC相比,DON主要包括NH类、氨基类、腈类、嘌呤、嘧啶、硝基化合物等,分子结构复杂,其中的胺类(—NH2)、酰胺(—CONH2或—CONH—R)、硝基(—NO2)和腈类(—CN)均为亲水性官能团,较易溶于水[17].氨基酸是 DON的重要组成部分,游离态的氨基酸具有分子量小、种类繁多、亲水性好、不易去除的特点[17].鉴于DON具有的典型官能团易与周围的水分子形成氢键,因而增强了 DON的亲水性.同时因其相对分子量较小,DON在常规水处理工艺中很难被去除.常规混凝和活性碳吸附对 DON去除作用都十分有限[18-20].
本文以城市污水处理厂二级出水为研究对象,以pH值、氧化剂、聚丙烯酰胺、粉末活性炭、改性活性炭作为重要变量因素,探讨强化混凝和改性活性炭对二级出水中 DON作用机制.分析分子量变化以及有机物的亲疏水性,并考察消毒副产物生成势变化特征,最后结合三维荧光光谱(3DEEM)分析,对强化混凝和活性炭吸附前后DON组成、化学结构特征进行研究,以期为城市污水处理厂二级出水中DON的控制研究提供依据和参考.
1 材料与方法
1.1 研究对象
本文研究对象为某城市污水处理厂二级出水(处理量为4×104m3/d,主要工艺包括格栅、初次沉池、卡鲁塞尔氧化沟、二次沉池),所取水样立即用 0.45μm 滤膜过滤后测定.DON、TDN、NH4+-N、NO3--N、NO2--N质量浓度分别为 1.95, 10.26,2.37,5.86,0.08mg/L,pH值为7.44,水温 22.3℃.
1.2 测定方法
pH:便携式溶解氧测定仪(pH/DO HQ40,HACH);NH4+-N:水杨酸-次氯酸盐光度法[21];NO2--N:N-(1-萘基)-乙二胺光度法[21];NO3--N:紫外分光光度法[21];TDN(总溶解性氮):过硫酸钾消解-紫外分光光度法[21];DON等于 TDN与NH4+-N、NO3--N、NO2--N 的差值;马尔文Zetasizer测定Zeta电位;活性炭表面各种官能团的含量:Boehm 滴定法测定[22];零电荷点 pHPZC:质量滴定法测定[23];比表面积:BET比表面积分析仪(美国Quantachrome 公司);活性炭表面形貌结构:扫描电子显微镜(SEM,S-3000N日立);活性炭热重量分析:热重分析仪(Netzsch TG209F3).所有数据取3次平均值.
DBPs标准品(EPA551B)购自Sigma-Aldrich公司,包括三氯乙腈(TCAN)、二氯乙腈(DCAN)、二氯丙酮(1,1-DCP)、三氯硝基甲烷(TCNM)、一氯一溴乙腈(BCAN)、三氯丙酮(1,1,1-TCP)、二溴乙腈(DBAN),以甲基叔丁基醚(MtBE)作为溶剂(购自 J.T.Baker),间溴氟苯作为内标物.测定方法采用修改后的 EPA551.1方法,进样口 200℃,检测器 290℃.升温程序为 35℃保持10min,然后以 10℃/min升温至 145℃,保持 2min,再以 20℃/min升温至260℃,保持5min.采用GC-ECD分析(岛 津-GC2010),毛 细 管 柱 为 Rtx-1(30m×0.25mm×0.25μm).
1.3 强化混凝实验
聚合氯化铝(28%Al2O3,PACl)作为混凝剂,O3、KMnO4、NaClO 作为氧化剂,粉末活性炭(PAC)和聚丙烯酰胺(阳离子型,PAM)作为助凝剂.取500mL水样调节pH值,投加一定量的混凝剂(0,10,20,40,60,80,100,120mg/L),180r/min搅拌2min,40r/min搅拌 15min,然后静止沉淀 30min,取上清液用 0.45μm 膜过滤,待测定.pH 值采用0.1mol/LHCl和KOH溶液调节.取500mL水样于加入不同浓度(0.5,1.0,1.5,2.0,2.5mg/L)的预氧化剂(O3、KMnO4、NaClO),200r/min搅拌 10min,然后加入 60mg/LPACl,180r/min搅拌 2min,40r/min搅拌 15min,然后静止沉淀 30min.取500mL水样加入不同浓度(4,8,12,16,20mg/L)的PAC搅拌 1min,然后加入 0或 60mg/L PACl,180r/min搅拌2min,40r/min搅拌15min,然后静止沉淀30min.取500mL水样加入不同浓度(0.4,0.8,1.2,1.6,2.0mg/L)的PAM搅拌1min,然后加入0或60mg/LPACl,180r/min搅拌 2min,40r/min搅拌15min,然后静止沉淀30min.
1.4 活性炭的酸碱改性及吸附实验
活性炭(煤质,国药集团化学试剂有限公司)用去离子水100℃蒸煮和清洗多次,然后在105℃环境下烘干4h,筛分20~40目之间的颗粒.颗粒活性炭研磨并过200目筛作为PAC.取20g颗粒活性炭分别放入 200mL5mol/LHNO3和 5mol/LNaOH溶液中,水浴保持恒温70℃,反应2h后取出,然后在振荡器上24h,保持温度35℃.再用去离子水反复洗涤至漂洗水pH值稳定为止,在105℃环境下烘干后备用,分为标记为 AC、AC-NaOH和 AC-HNO3,使用前保存在干燥器内.具体过程见参考文献[23].酸碱改性前后的活性炭表面物理参数见表1.
DON吸附动力学:取 200mL二级出水于250mL锥形瓶中,加入浓度0.5g/L活性炭放置于恒温振荡器中(250r/min和 20℃),吸附不同时间.为抑制微生物生长,加入数滴氯化汞溶液. DON吸附等温线:取200mL二级出水于250mL锥形瓶中,加入一定量浓度活性炭(0,0.05,0.1,0.2,0.3,0.4,0.5,0.8,1.0,2.0g/L),放置于恒温振荡器中(250r/min和20℃),震荡吸附24h.

表1 活性炭样品的物理性质Table 1 Physical characteristics of activated carbon
1.5 DON分子量和有机组分分布
取300mL水样,采样Millipore公司8400型超滤器,以氮气作为驱动力,磁力搅拌器的搅拌速度为 100r/min,分别依次通过截留不同相对分子量(20000、6000)的滤膜,测定滤液的 DON 质量浓度,再计算不同相对分子量DON占总DON的百分量.
采用AmberliteXAD-8与XAD-4树脂将水中DON进行亲疏水性分离.将200mL水样用盐酸酸化调节pH=2后,连续通过XAD-8和XAD-4树脂柱,流出亲水性有机物(HPI).用 0.1mol/L溶液洗提XAD-8树脂,出水为疏水性有机物(HPO).总有机物浓度与HPI和HPO浓度差值为过渡性有机物(TPI).以上的流速均控制在100mL/h.
1.6 氯化消毒副产物生成势测定
取500mL水样,加入磷酸盐缓冲溶液调节pH=7.0,然后加入一定量的次氯酸钠溶液(有效氯的投加量计算见文献[24]),放入生化培养箱,在 25℃避光反应 72h,反应完后加一定的抗坏血酸消除水中的余氯(抗坏血酸的量是水中余氯量的2~3倍,以摩尔浓度计).取20mL水样于50mL试管中,加入8g 无水硫酸钠,置于振荡器上振荡1min,使得无水硫酸钠充分溶解,再加入2mLMtBE并振荡 3min,静置 20min,用移液管吸取 1mL上层萃取液,置于 1.5mL进样瓶中,待测定.
1.7 3DEEM分析
3DEEM分析使用日立F-4600型荧光光谱分析仪,配 1cm 石英液池.光源选用 150W 氙弧灯,PMT 电压为 700V,信噪比>110,带通.激发波长 Ex=5nm,发射波长 Em=5nm,扫描速度为1200nm/min.扫描波长范围分别:Ex280~400nm,Em200~500nm,以 Milli-Q 水为空白,使用软件Origin7.5(OriginLab公司,美国)绘制三维荧光光谱图.使用荧光光谱区域体积积分法(FRI)对3DEEM光谱进行定量分析[25].
2 结果和讨论
2.1 强化混凝对DON去除效果
2.1.1 pH值强化混凝效果 从图1(a)可以知道,在pH值为6.2、7.4和8.5时,DON去除率随着PACl浓度增加而上升.在PACl浓度为120mg/L时,去除率分别为26.1%、18.2%、14.8%.其中,pH在 6.2时去除率最大(26.1%).pH值对混凝去除DON 的过程有显著影响.这主要是因为:在酸性条件下,水中DON表面带负电荷,PACl会形成带正电荷的聚合水解产物或 Al(OH)3凝胶沉淀物,则对水中 DON电中和、吸附和网捕卷扫作用;当 pH值大于 7时,Al(OH)3则带较弱的负电荷,pH 值大于 8.0时,转化为溶解性[Al(OH)4]-1,使得DON不易脱稳和去除率下降[26].pH值较低时还会影响有机物离解度改变其存在形态和提高有机物质子化程度,降低电荷密度和 DON溶解性及亲水性,使成为较易被吸附的形态[27].从图1(b)可知,pH值为6.2时,Zeta电位增加较快,而且明显高于pH值为7.4和8.5时的 Zeta 电位,说明pH值为6.2时电中和能力较强.对于PACl来讲,混凝效果与水中Al13浓度具有密切关系,在偏酸性条件下,Al13浓度相对较高,并提高混凝效率和DON去除率[26].据报道,二级出水中DON主要来源于生物处理过程中微生物产物(SMPs),SMPs中的蛋白和腐殖类物质在偏酸性(pH=6)时与金属离子(Al3+等)都有很强的络合作用[28],有利于二级出水中DON的去除.
2.1.2 预氧化强化混凝效果 从图 1(a)和 2(a)可以看出,pH值在7.4单独混凝时,DON去除率仅为 17.9%.而随着预氧化剂(O3、KMnO4和NaClO)浓度增加时,DON 去除率也随着提高.当O3、KMnO4和 NaClO 浓度达到 2.5mg/L,DON去除率分别为 36.8%、32.4%和 27.3%,其中 O3预氧化时 DON去除率最大.主要原因是:预氧化可使胶体颗粒表面的有机物分离和分子量下降,这样会使有机物脱稳和降低静电斥力,有利于混凝作用.预氧化同时还可以有效减少有机物负电荷的密度, 从而增加了颗粒碰撞和凝结的机会[29].预氧化作用可导致有机物,特别是芳香类和色氨酸类有机物的羧酸(—COOH)含量的增加,这样可以提高有机物和二级出水中 Al3+、Ca2+和Mg2+的络合作用[30-31].预氧化可使得DOM(包括 DON)通过桥连反应聚集,同时还可以造成金属离子复合物分离产生新的混凝剂,进一步提高混凝效果[29-30].从图 2(b)可知道,随着 O3、KMnO4和 NaClO浓度增加,Zeta电位也随之上升.其中,投加O3时增加的Zeta电位最大,也说明水体电中和能力较强.标准状态下,O3、KMnO4和 NaClO氧化还原电位分别是2.07V、1.77V和1.49V,O3的氧化性比KMnO4和NaClO氧化性强,可以更容易把稳态的颗粒附着的有机物分离氧化,改变有机物的稳定性.据报道,O3氧化过程中也可以降解部分DON[32].
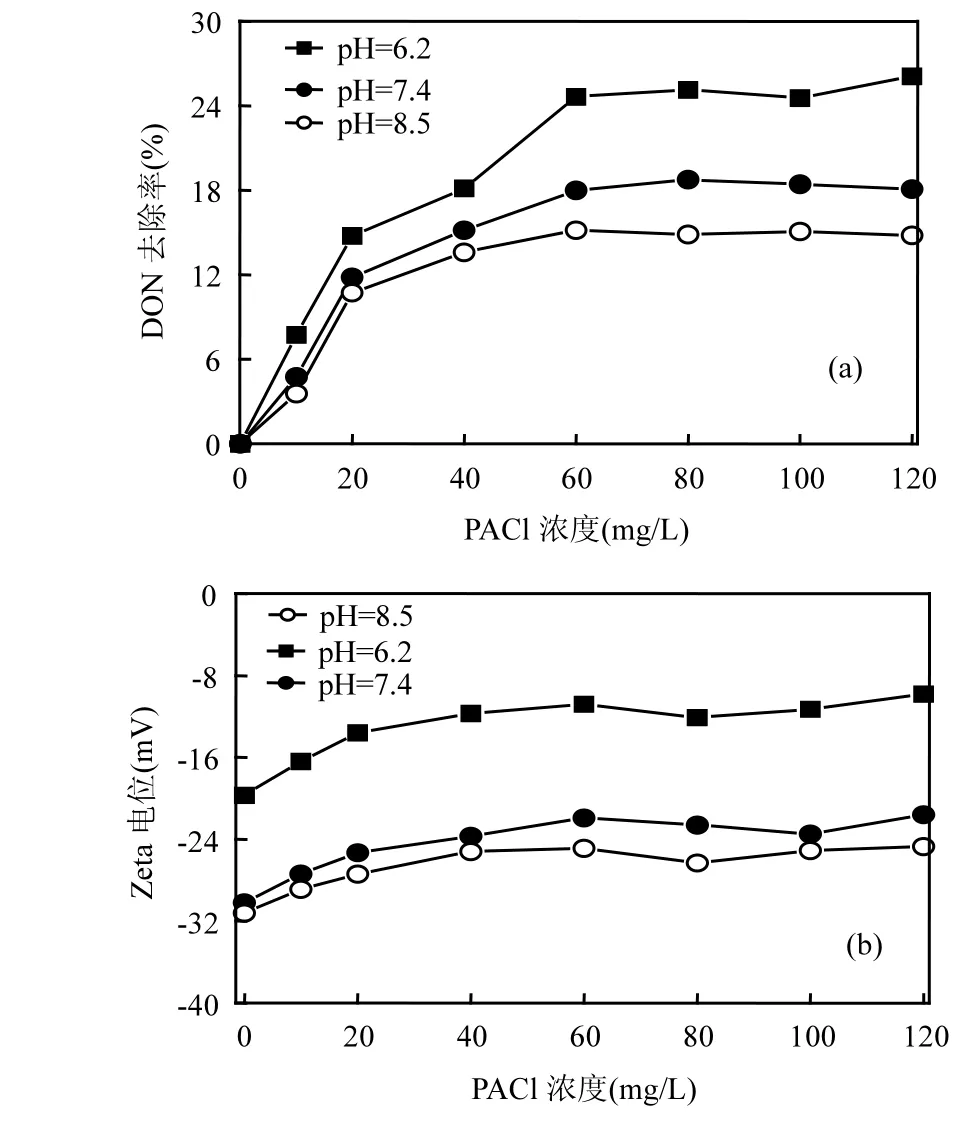
图1 pH值强化混凝对DON去除率Fig.1 DON removal rate by pH enhanced coagulation
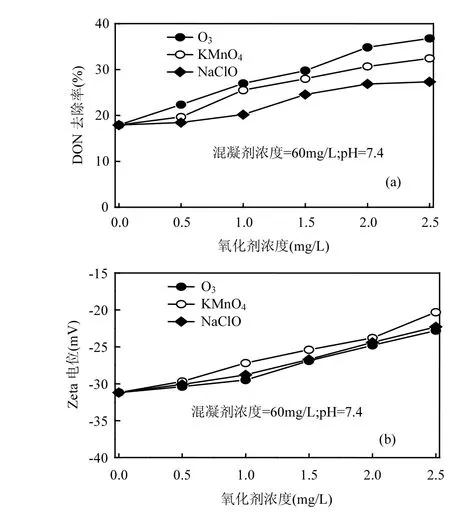
图2 预氧化强化混凝对DON去除率Fig.2 DON removal rate by pre-oxidation enhanced coagulation
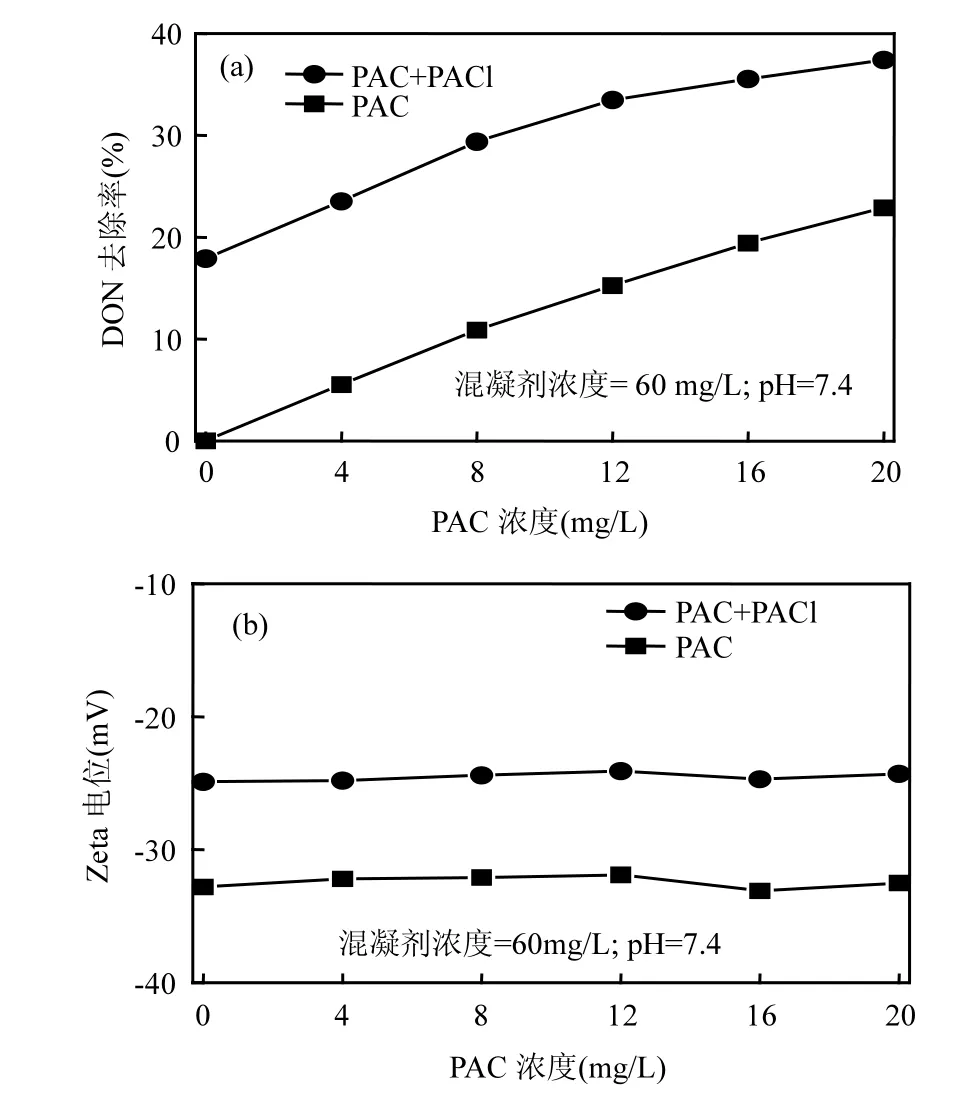
图3 PAC强化混凝对DON去除率Fig.3 DON removal rate by PAC enhanced coagulation
2.1.3 PAC强化混凝效果 从图3可以知道,随着PACl投加量的增加,DON去除率一直处于上升趋势.从图3(a)和图1(a)可以看出,PAC浓度在4~12mg/L,强化混凝 DON 去除率大于单独混凝DON去除率和单独PAC作用DON去除率之和;而在 16~20mg/L,DON去除小于单独混凝 DON去除率和单独PAC作用DON去除率之和.这主要是因为: PAC在水中去除DON主要靠吸附作用,特别是对芳香族化合物(二级出水 DON主要组成物质)直接可被 PAC吸收[33].虽然相对小分子量和亲水性 DON所占比例相对高,但是由于PAC吸附作用提高PAC表面附近DON浓度[34],从而增加DON混凝去除效果.当PAC浓度较低时(4~12mg/L),在水体中被混凝剂絮体包裹或网捕作用机率较小,可以充分与水中有机物接触而吸附 DON,使得 DON 去除率的增加较快;而当PAC 浓度较高时(16~20mg/L),混凝絮体有可能存在对活性炭的包裹或网捕作用,降低了活性炭对DON的吸附作用.随着PAC浓度增加,PAC吸附和混凝作用会出现对有机物竞争现象,这样也会降低了DON去除效率,造成DON去除率的增长率下降.随着PAC浓度增加,水体中Zeta电位基本没有变化[图 3(b)],这说明 PAC强化混凝主要靠吸附作用.
2.1.4 PAM 强化混凝效果 如图 4(a),随着PACl投加量增加,DON去除率一直处于上升趋势,最大去除率分别为 13.6%和 35.1%,说明单独加入 PAM 对 DON也有一定去除效果,但PAM 强化混凝 DON去除率大于单独混凝DON去除率和单独PAM作用DON去除率之和.主要原因是:在混凝过程中加入阳离子PAM 可以中和带负电荷、极性较强的 DON,然后通过其链状分子作为DON和氢氧化铝表面之间的桥梁.吸附架桥作用导致絮凝物的快速沉淀,使得PAM强化PACl混凝提高DON去除率[35-36].同时,二级出水中 DON 主要来源于生物处理过程中 SMPs,而阳性高分子聚合物PAM 可以与芳香族类蛋白物和 SMPs通过范德华力或极性基团之间相互作用结合,使得DON被去除[35].
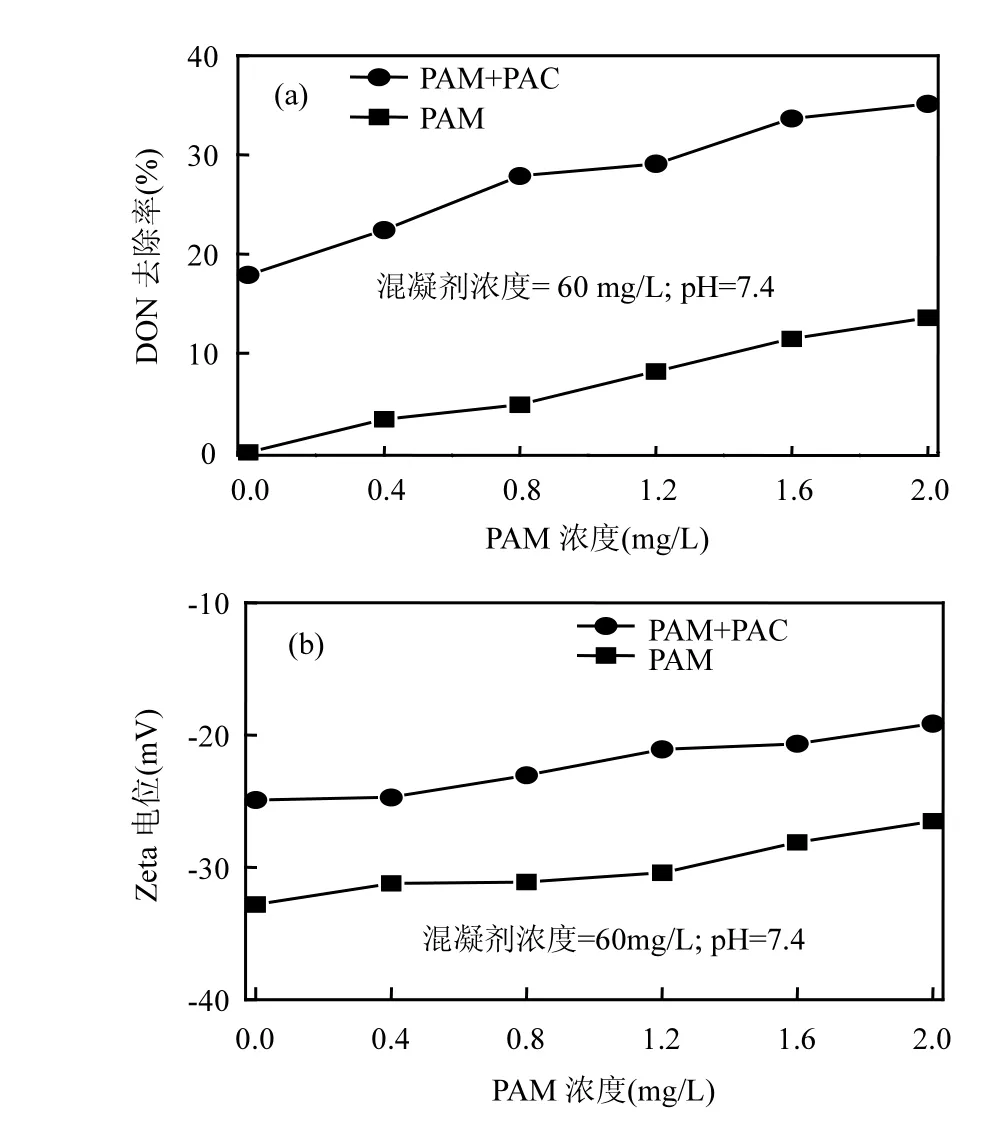
图4 PAM强化混凝对DON去除率Fig.4 DON removal rate by PAM enhanced coagulation
随着 PAM 浓度增加,Zeta电位有上升趋势[图 4(b)],说明 PAM 作为助凝剂来强化混凝时,DON去除效果主要是靠吸附架桥和中和电荷.但因为PAM化学结构中含有DON,当PAM浓度较高时(>2.0mg/L),PAM强化混凝过程中DON去除率反而会出现下降趋势[36].因此,在浓度较低时(0.4~2.0mg/L),PAM 强化混凝可以提高 DON去除率.
2.2 改性活性炭对DON去除效果
2.2.1 DON 吸附动力学 从图 5(a)、(b)和(c)可以看出,DON吸附率在前 60min快速地增加,达到平衡吸附容量的 60%,后来吸附率逐渐下降,180min达到吸附平衡.由表2吸附速率常数可以看出,准一级动力学的相关系数都大于0.96,表现出了一定相关性. AC对 DON的吸附容量为2.68mg/g, AC-HNO3吸附容量下降至2.63mg/g,AC-NaOH吸附容量增加到3.29mg/g.DON吸附过程更符合准二级动力学模型(R2>0.99),这表明在 DON吸附过程中,化学吸附是限制整个吸附效率主要的关键步骤,为活性炭表面改性提供研究方向.
Weber-Morris模型主要分析二级出水中DON在活性炭吸附过程中的扩散作用,主要包括表面扩散和孔隙扩散 2个阶段.从图 5(d)和表 2可看出,这 2个阶段数据拟合较好符合 Weber-Morris模型(R2>0.96),说明活性炭对DON吸附由2个过程阶段主导.相比于 AC,AC-HNO3和AC-NaOH中Kd1值和Kd2值分别下降和增加,说明 AC-NaOH表面扩散和孔隙扩散速率相对较大.在 DON 吸附过程中,孔隙扩散速率是限制吸附 DON作用效率的关键步骤.从吸附过程的时间看[图 5(d)],孔隙扩散阶段控制了吸附过程的平衡时间.因此,下一步提高活性炭孔隙扩散速率是增加活性炭DON吸附效果的关键.
2.2.2 DON吸附等温线 从图6和表3可以看出,活性炭对 DON吸附平衡等温线符合Freundlich isotherm 模型(R2>0.97)和 Langmuir isotherm 模型(R2>0.96).从 Freundlich isotherm 模型中可以知道,活性炭经HNO3改性后,1/n从0.79增加到 0.81;而经 NaOH改性后 1/n下降到0.77.1/n代表了活性炭的吸附性能[37],1/n越小吸附性能越好,说明HNO3和NaOH改性活性炭分别降低和提高活性炭吸附能力.从 Langmuir isotherm模型中[37],qmax为活性炭的最大吸附容量.通过模型拟合得到AC对DON的最大吸附容量为 19.86mg/g.经 HNO3改性的活性炭对 DON的最大吸附容量有了一定程度的降低,为17.70mg/g;而NaOH改性的活性炭对DON的最大吸附容量增加到 25.24mg/g,最大饱和吸附量增长27.1%.

表2 DON吸附动力学模型参数Table 2 Parameters of kinetic models
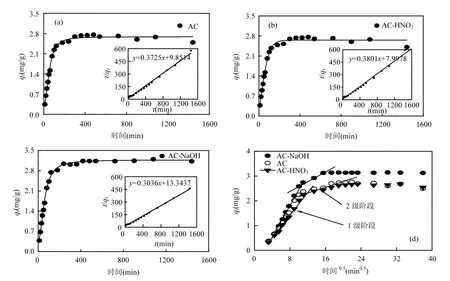
图5 活性炭对DON吸附动力学Fig.5 Adsorption kinetics of DON by AC, AC-HNO3and AC-NaOH
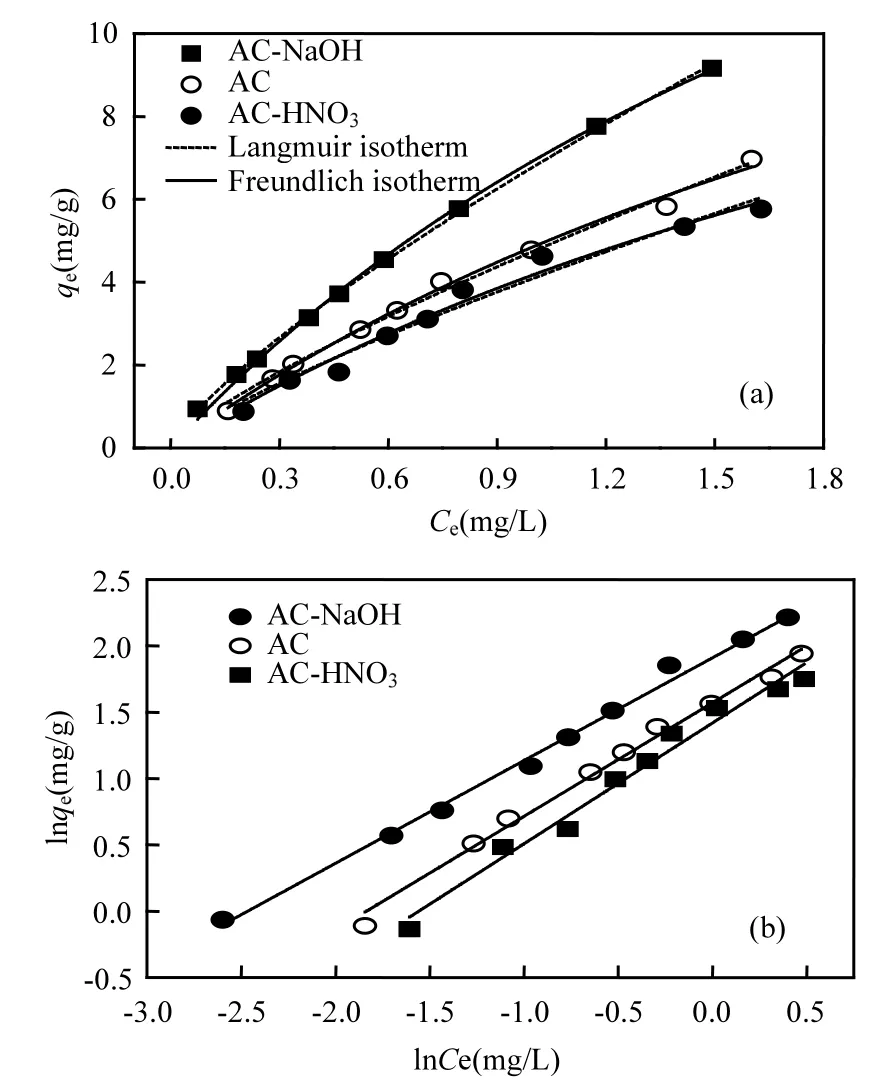
图6 活性炭对DON吸附等温线Fig.6 Adsorption isotherm of DON by AC, AC-HNO3 and AC-NaOH
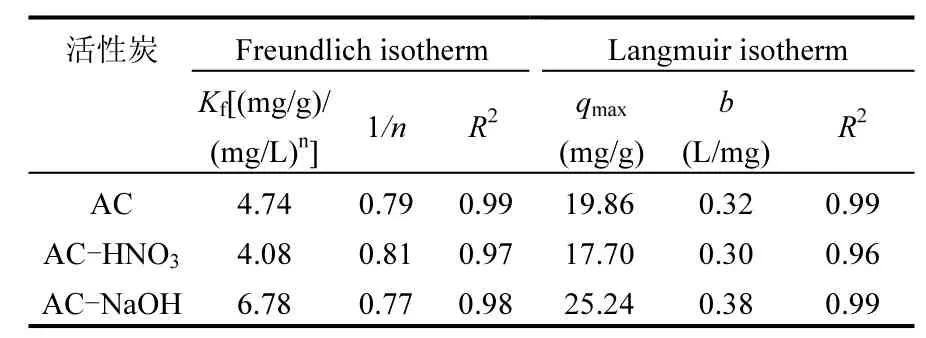
表3 DON吸附平衡等温线模型参数Table 3 Parameters of adsorption isotherm
2.2.3 改性活性炭对DON吸附机制 从图7中可以观察到,AC热重曲线在 20~100℃区间呈现轻微下滑趋势,在 100~620℃区间保持平稳,在620~900℃区间呈现较快下滑趋势,可能是由于AC表面挥发性物质的分解造成.AC-HNO3和AC-NaOH与 AC热重曲线变化趋势不同,在20~100℃和 620~900℃区间呈现明显的下降,主要是活性炭内部吸附水的蒸发脱除,表明 ACHNO3和AC-NaOH在保存中更易吸附空气中的水份,其亲水性增强.同时,AC-HNO3和 ACNaOH的热重曲线在620~900℃区间的下滑趋势更加明显,表明 AC-HNO3和 AC-NaOH表面的化学官能团变化较大,这与表4结果较为一致.
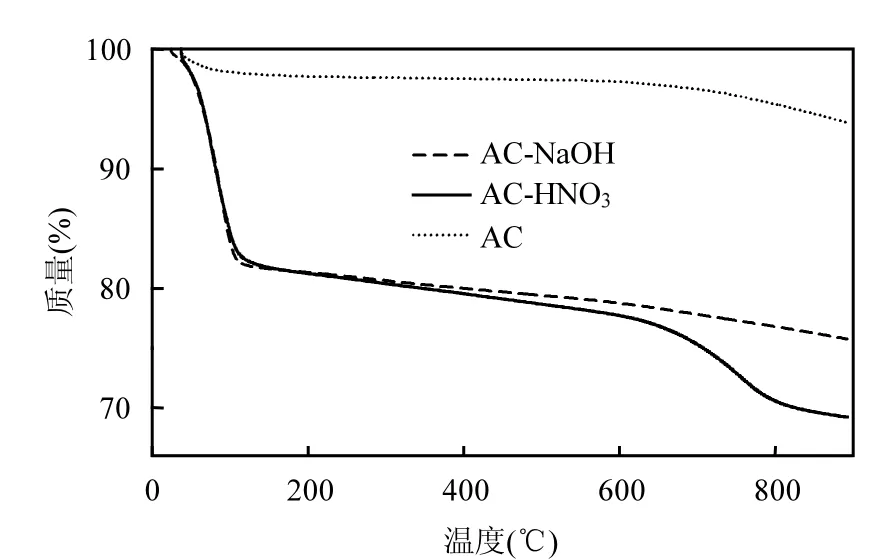
图7 活性炭热重分析Fig.7 TG curves of AC, AC-HNO3 and AC-NaOH
从表 4中可以看出,酸碱改性过程不但改变了活性炭的孔结构,也使得活性炭的表面化学性质发生了一系列的改变.AC为弱酸性的表面化学性质,其pHPZC为6.7,酸性基团和碱性基团的浓度分别为0.83, 0.71mmol/g.HNO3改性后,活性炭表面的酸性基团的总量急剧增加至1.52mmol/L,其中以羧酸基团的增加最大至 0.98mmol/g,这说明HNO3主要使得活性炭中的C—C键断裂而生成—COOH和 C—H键,再生成 C=O键.AC-HNO3表面呈酸性,pHPZC降低至 3.1.经NaOH改性后,AC-NaOH表面的酸性基团的含量下降,酸性基团的总量下降至0.75mmol/g.活性炭表面的C—O键在NaOH的作用下断裂形成新的—OH 键,表面的—OH 的含量上升.同时溶液中的 OH-也与表面羧酸基团反应,导致了羧酸基团含量的降低.AC-NaOH 表面呈碱性,其 pHPZC上升至7.4.

表4 活性炭样品的表面化学性质Table 4 Surface chemical properties of different AC samples
从图5、图6、表2和表3可以知道,AC-NaOH比AC和AC-HNO3对二级出水中DON具有更高吸附性能.这主要原因是:活性炭的吸附容量的大小与活性炭的表面积、孔结构和表面化学官能团分布密切相关,吸附过程通常需要吸附剂孔径结构与和吸附分子的相互匹配[38].因为二级出水中相对小分子量DON所占比例较高,经过HNO3改性后,活性炭的比表面积、微孔容积、总孔容和微孔/总孔比例下降.AC-HNO3的比表面积为489m2/g,相比较AC的652m2/g有一定降低,表明HNO3氧化可导致活性炭的结构塌陷,比表面积降低,孔结构受到一定程度的损伤,不利于 DON进入到活性炭内部孔道.经 NaOH作用后,AC-NaOH的比表面积、微孔容积、总孔容和微孔/总孔比例都比都比较高,容易吸附相对小分量有机物,更有利于 AC-NaOH对 DON吸附.根据π-π色散力作用机理[39],AC-HNO3表面含有酸性官能团较略多,亲水性增强,亲水性的含氧基团更易吸附水分子,水分子可以与活性炭表面的亲水官能团形成氢键而吸附在活性炭表面,会阻碍DON进入到活性炭内部孔道.水分子与DON分子之间的竞争吸附削弱了活性炭对DON的吸附,这样也可能使得AC-HNO3对 DON的吸附能力降低.二级出水中 DON主要是由色氨酸类蛋白质、芳香族类蛋白质和富里酸类物质等,如:色氨酸、富里酸.而 AC-NaOH的表面分布有较多的碱性基团,碱性基团更容易与色氨酸、富里酸类等酸性物质相结合,有利于 DON去除.根据给电子-受电子复合物形成机理[40],从表 4可以知道,AC-HNO3表面比AC-NaOH表面的酸性含氧官能团浓度高,含氧官能团吸收电子使得AC-HNO3的pHPZC也下降至3.1,表面带负电荷.而二级出水中有机物带负电荷,与 AC-HNO3表面产生电荷排斥作用,使得AC-HNO3对DON去除率下降.AC-NaOH的pHPZC上升至7.4,表面带正电荷,容易与DON形成给电子-受电子复合物,更有利于 DON去除.从以上面反应结果可以得到,DON吸附过程除物理作用,AC-HNO3表面主要是π-π色散力作用机理,而AC-NaOH表面主要是给电子-受电子复合物形成机制.
2.3 DON分子量和亲疏水组分分布
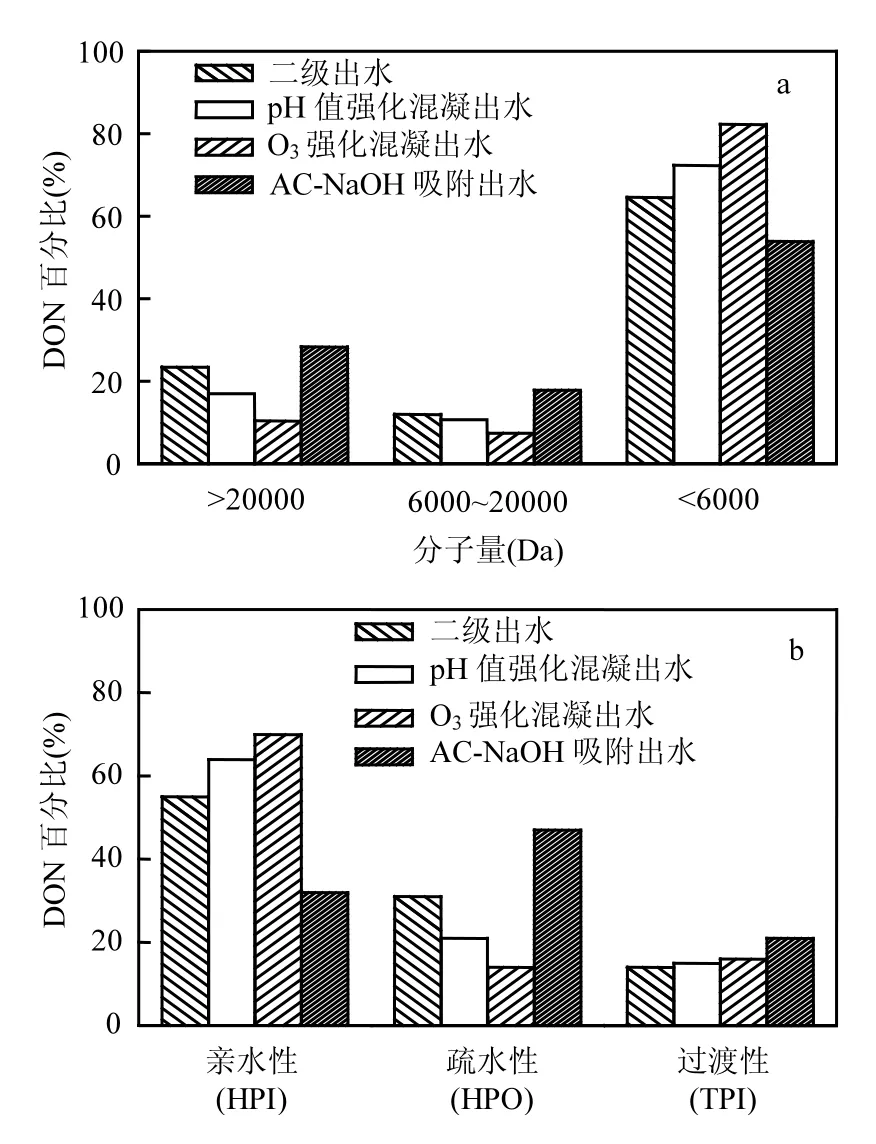
图8 DON分子量和亲疏水组分分布Fig.8 Distribution of molecular weight and hydrophobicity/hydrophilicity of DON
4个代表水样,二级出水、pH混凝出水(PACl浓度60mg/L,pH=6.2)、臭氧预氧化强化混凝出水(O3浓度2.5mg/L+PACl浓度60mg/L)、AC-NaOH出水(PAC浓度0.1g/L)中DON的分子量分布、亲疏水性变化如图8所示.从中可以知道,二级出水中相对小分子量(<6kDa)和亲水性 DON 分别约占 68%和 37%,相对于二级出水中 DOC,相对小分子量(<6kDa)和亲水性 DON所占比例较高,所以DON与DOC相比表现出不同性质特征.经过 pH和臭氧强化混凝处理后,相对大分子量(>20kDa)和疏水性 DON 所占比例显著下降,相对小分子量(<6kDa)和亲水性 DON 所占比例增加.主要原因是:大分子和疏水性组分更容易通过混凝被去除.臭氧会先与芳香类、强烈紫外吸收的疏水性有机物先反应,随后和亲水物质反应,造成相对大分子量有机物结构发生改变,提高有机物极性和酸性官能团的含量,从而改变 DON分子量分布和是 HPI组分增加的原因[41].经过AC-NaOH 吸附后,相对大分子量(>20kDa)和疏水性DON所占比例上升,主要是因为AC-NaOH对相对小分子量、亲水性DON去除率较高.可以看出,强化混凝和活性炭去除 DON组分和性质不同,如进一步提高 DON去除率,强化混凝和改性活性炭可以组合使用.
2.4 氯化消毒副产物生成势
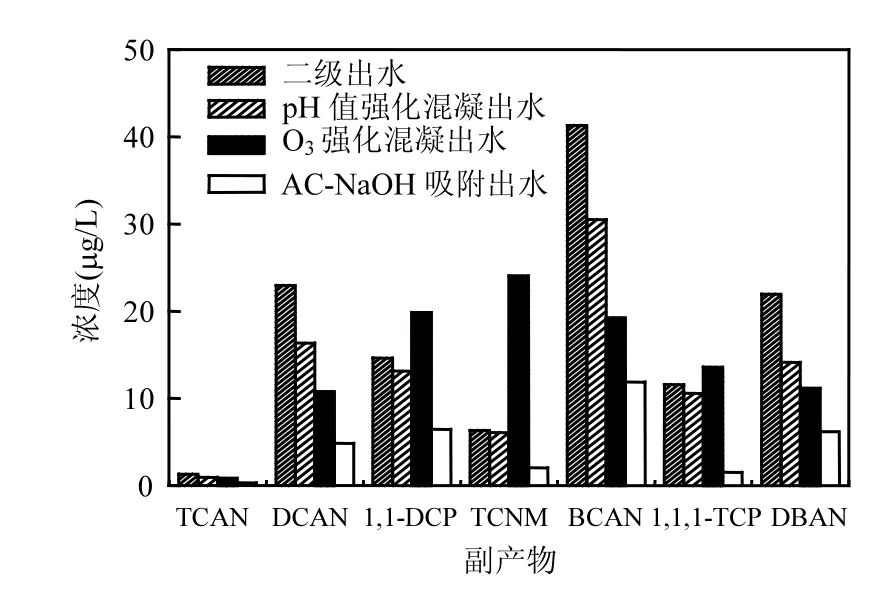
图9 氯化消毒副产物生成势Fig.9 Chlorinated disinfection by-products formation
4个代表水样,二级出水、pH混凝出水(PACl浓度 60mg/L,pH=6.2)、臭氧预氧化强化混凝出水(O3浓度2.5mg/L+PACl浓度60mg/L)、AC-NaOH出水(PAC浓度0.1g/L)氯化消毒副产物生成势如图9所示.从图1、图2和图6可以知道,pH混凝(PACl浓度 60mg/L,pH=6.2)对DON去除率为24.6%、臭氧预氧化强化混凝(O3浓度2.5mg/ L+PACl浓度60mg/L)对DON去除率为 36.8%、AC-NaOH(PAC浓度 0.1g/L)对DON去除率为 39.7%.从图 9可以看出,二级出水、pH混凝出水混、臭氧强化混凝出水和AC-NaOH吸附出水加氯反应72h后,二级出水7种消毒副产物中,生成势浓度最大是BCAN,生成势浓度最小是TCAN,它们都属于N-DBPs,氯化消毒副产物生成势都不同程度的下降.同时,臭氧预氧化强化混凝和AC-NaOH吸附对DON去除率相差3%(36.8%和39.7%).但是,臭氧预氧化强化混凝和AC-NaOH吸附出水氯化消毒副产物生成势浓度总和分别是99.4,33.2μg/L,活性炭吸附作用后氯化消毒副产物生成势大幅下降.说明活性炭吸附比强化混凝对氯化消毒副产物的前体物去除效果好,还进一步表明二级出水中相对小分子量和亲水性强 DON是 N-DBPs的主要前体物.
2.5 3DEEM分析
3DEEM 技术有较好的选择性和灵敏性,近年来广泛用于表征水体中DOM[42].水体中DON浓度与 3DEEM 图谱中荧光峰强度具有一定相关系[43].4个代表水样,二级出水、pH混凝出水(PACl浓度60mg/L,pH=6.2)、臭氧预氧化强化混凝出水(O3浓度 2.5mg/L+PACl浓度 60mg/L)、AC-NaOH出水(PAC浓度0.1g/L)的3DEEM图谱如图10所示.3DEEM图谱中荧光峰与腐殖质类、酪氨酸类、色氨酸类、芳香族类蛋白质和酚类有机化合物相关[42],区域Ⅰ和区域Ⅱ的位置分别是在Ex/Em=200~250nm/280~320nm、Ex/Em= 200~250nm/320~380nm,区域Ⅰ和区域Ⅱ主要代表了芳香性蛋白类物质;区域Ⅲ位置在Ex/Em=200~250nm /380~500nm,代表了富里酸类物质;区域Ⅳ位置在Ex/Em=250~280nm/280~380nm,代表了主要为溶解性微生物产物(SMPs),如:色氨酸和酪氨酸类蛋白质;区域Ⅴ的位置在Ex/Em= 250~400nm/380~500nm,代表了腐殖酸类物质.从图 10(a)可以看出,在区域Ⅰ、区域Ⅱ、区域Ⅲ、区域Ⅳ和区域Ⅴ都有荧光峰,但是区域Ⅱ和区域Ⅳ的荧光峰较为明显,这说明二级出水中有机污染物构成是以芳香性蛋白类、溶解性微生物代谢产物为主,富里酸类和腐殖酸类有机物的含量比较低.同时,图 10(a)中荧光指数[(λex370 /λem500)/ (λex370/λem450)]为 2.1,大于 1.9,可以判断二级出水中 DON主要来自污水生物处理工艺中的 SMPs.这也说明,荧光指数与区域荧光强度是相一致的.SMPs和芳香性蛋白类物质与ABDON具有正相关性(r>0.576,P<0.05)[44].同时,SMPs、芳香类蛋白质和腐殖质类物质都是氯消毒副产物的主要前体物[45],因此消减控制城市污水厂二级出水中 DON浓度水平,可以减少氯消毒副产物生成量,降低水体富营养化程度和人类健康风险.
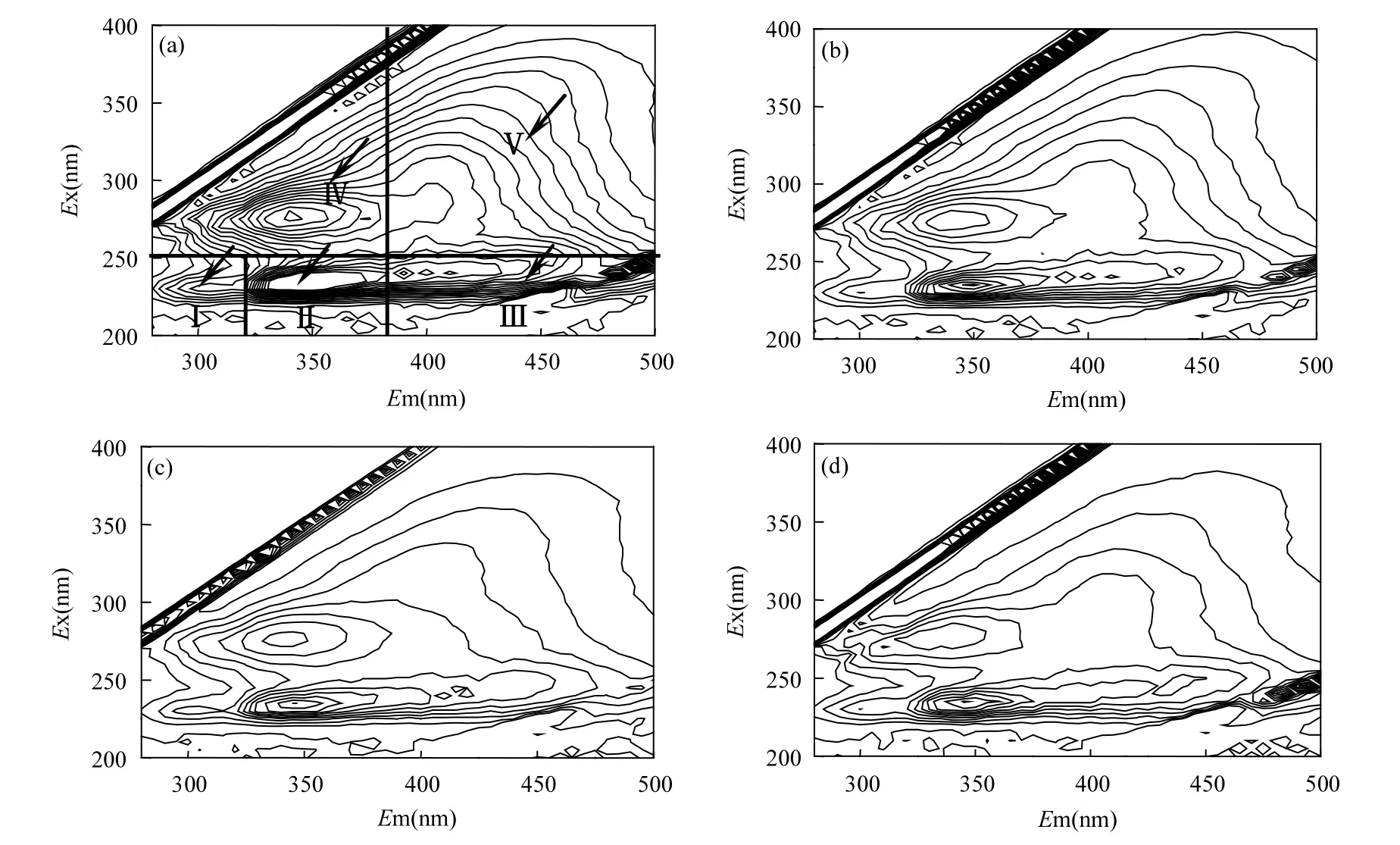
图10 不同样品3DEEM光谱Fig.10 3DEEM spectra of different water samples
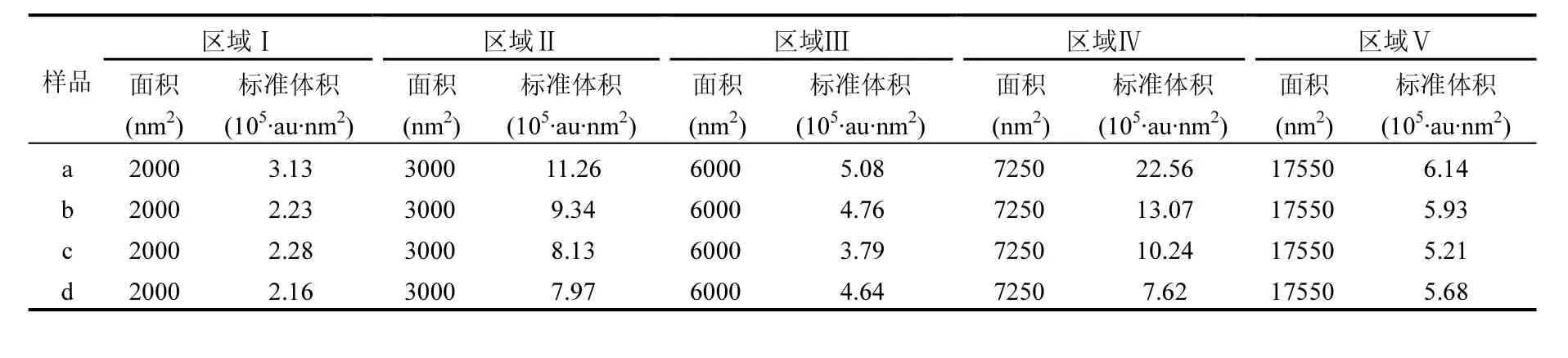
表5 不同样品的荧光光谱区域体积积分分析法参数Table 5 FRI parameters of different samples
采用荧光光谱区域体积积分分析法(FRI)对3DEEM 光谱进行定量分析,不同区域积分标准体积间接代表了区域内有机物的相对含量,结果见表5.从表5可以知道,二级出水中区域Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ的荧光区域标准体积分别为(3.13,11.26, 5.08, 22.56, 6.14)×105·au·nm2,总的荧光区域标准体积是 48.17×105·au·nm2.荧光区域Ⅱ和区域Ⅳ所代表的二级出水中芳香性蛋白类物质和SMPs占整个荧光区域有机物总量的23.38%和46.83%.经过pH值和臭氧预氧化强化混凝后,区域Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和总的荧光区域标准体积下降趋势,总的荧光区域标准体积分别为是(35.53, 29.65)×105·au·nm2.其中,荧光区域Ⅳ所代表的SMPs去除率较大,分别为42.06%和54.61%.因为SMPs主要成份有蛋白类(如:色氨酸和酪氨酸)、多糖类和核酸等物质,含有氨基、羧基、羟基、磺酸基、酚羟基等功能基团,这些基团容易与水中的金属离子(Cu2+、Al3+、Fe3+和 Pb2+等)发生络合反应生成有机物-金属化合物[28].当PACl作为混凝剂时,水体中 Al3+浓度相对较高,与 SMPs发生络合反应使得 SMPs去除率增大.荧光区域Ⅲ和Ⅴ所代表的富里酸类物质和腐殖酸类物质在 pH值强化混凝后去除率较低,仅有6.30%和 3.42%.而经过臭氧强化混凝后,去除率提高到 25.39%和 15.15%,主要是因为臭氧预氧化可有效去除二级出水中的富里酸类、腐殖酸类等难降解有机物和微生物代谢产物[41].经过活性炭吸附后,荧光区域Ⅳ的标准体积下降到 7.62×105·au·nm2,去除率为 66.22%,表明活性炭吸附是最有效去除二级出水中SMPs的方法.
3 结论
3.1 强化混凝可以提高 DON 去除率.其中,pH为6.2时DON去除率大于pH为7.4和8.5时,最大达到 26.1%,提高到 1.45倍.O3、KMnO4和NaClO强化混凝时,DON去除率分别为36.8%、32.4%和27.3%,其中O3强化混凝DON去除率最大提高到2.06倍.当PAC浓度为20mg/L,强化混凝对 DON去除率为 37.4%提高到 2.09倍.当PAM浓度为2mg/L.强化混凝对DON去除率为35.1%提高到1.96倍.
3.2 AC、AC-HNO3和AC-NaOH对DON吸附过程更符合准二级动力学模型.二级出水中DON在活性炭吸附过程中主要包括表面扩散和孔隙扩散 2个阶段.DON吸附平衡等温线符合Freundlich isotherm和Langmuir isotherm模型,其中 AC-NaOH对 DON的吸附容量最大达到25.24mg/g,AC、AC-HNO3和AC-NaOH除物理吸附作用,AC-HNO3表面主要是π-π色散力作用机理,而AC-NaOH表面主要是给电子-受电子复合物形成机制.
3.3 二级出水中相对小分子量(<6kDa)和亲水性DON分别约占68%和37%.经过pH和臭氧强化混凝处理后,相对大分子量(>20kDa)和疏水性DON 所占比例显著下降,相对小分子量(<6kDa)和亲水性DON所占比例增加.而经过AC-NaOH吸附后,相对大分子量(>20kDa)和疏水性 DON所占比例上升.
3.4 二级出水7种消毒副产物中,生成势浓度最大是BCAN,生成势浓度最小是TCAN.经过混凝沉淀和活性炭吸附后,氯化消毒副产物生成势都不同程度的下降,出水氯化消毒副产物生成势浓度总和分别是99.4, 33.2μg/L,活性炭吸附作用后氯化消毒副产物生成势大幅下降.
3.5 二级出水中区域Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ的荧光区域标准体积分别为(3.13, 11.26, 5.08, 22.56,6.14)×105·au·nm2,总 的 荧 光 区 域 标 准 体 积 是48.17×105·au·nm2,荧光区域Ⅱ和区域Ⅳ占整个荧光区域有机物总量的23.38%和46.83%.经过pH和臭氧预氧化强化混凝、以及活性炭吸附后,荧光区域Ⅳ去除率最大,分别为42.06%、54.61%和66.22%.
[1]kinia J M, Stensel H D, Czerwionka K, et al. Nitrogen transformations and mass balances in anaerobic/anoxic/aerobic batch experiments with full-scale biomasses from BNR activated sludge systems [J]. Water Science and Technology, 2009,60(9):2463-2470.
[2]Pagilla K R, Urgun-Demirtas M, Ramani R. Low effluent nutrient treatment technologies for wastewater treatment [J].Water Science and Technology, 2006,53(3):165-172.
[3]Sattayatewa C, Pagilla K, Pitt P, et al. Organic nitrogen transformations in a 4-stage Bardenpho nitrogen removal plant and bioavailability/biodegradability of effluent DON [J]. Water Research, 2009,43(18):4507-4516.
[4]Pehlivanoglu E, Sedlak D L. Bioavailability of wastewater derived organic nitrogen to the algaSelenastrum capricornutum[J]. Water Research, 2004,38(14/15):3189-3196.
[5]de Vera G A, Gernjak W, Weinberg H, et al. Kinetics and mechanisms of nitrate and ammonium formation during ozonation of dissolved organic nitrogen [J]. Water Research,2017,108:451-461.
[6]Hohner A K, Cawley K, Oropeza J, et al. Drinking water treatment response following a Colorado wildfire [J]. Water Research, 2016,105(15):187-198.
[7]Chu W H, Li D M, Deng Y, et al. Effects of UV/PS and UV/H2O2pre-oxidations on the formation of trihalomethanes and haloacetonitriles during chlorination and chloramination of free amino acids and short oligopeptides [J]. Chemical Engineering Journal, 2016,301(1):65-72.
[8]Shi X L, Xu C H, Hu H, et al. Characterization of dissolved organic matter in the secondary effluent of pulp and paper mill wastewater before and after coagulation treatment [J]. Water Science and Technology, 2016,74(6):1346-1353.
[9]Umar M, Ruddick F, Fan L. Comparison of coagulation efficiency of aluminum and ferric-based coagulants as pre-treatment for UVC/H2O2treatment of wastewater RO concentrate [J]. Chemical Engineering Journal, 2016,284:841-849.
[10]Pramanik B K, Roddick F A, Fan L H. A comparative study of biological activated carbon, granular activated carbon and coagulation feed pre-treatment for improving micro-filtration performance in wastewater reclamation [J]. Journal of Membrane Science, 2015,475:147-155.
[11]Xue S, Zhao Q L, Wei L, et al. Reduction of dissolved organic matter in secondary municipal effluents by enhanced coagulation[J]. Environmental Progress & Sustainable Energy, 2015,34(3):751-760.
[12]Liu Y C, Duan J M, Li W, et al. Effects of organic matter removal from a wastewater secondary effluent by aluminum sulfate coagulation on haloacetic acids formation [J]. Environmental Engineering Science, 2016,33(7):484-493.
[13]Altmann J, Rehfeld D, Träder K, et al. Combination of granular activated carbon adsorption and deep-bed filtration as a single advanced wastewater treatment step for organic micropollutant and phosphorus removal [J]. Water Research, 2016,92:131-139.
[14]Hatt J W, Germain E, Judd S J. Granular activated carbon for removal of organic matter and turbidity from secondary wastewater [J]. Water Science and Technology, 2013,67(4):846-853.
[15]丁春生,沈嘉辰,缪 佳,等.改性活性炭吸附饮用水中三氯硝基甲烷的研究 [J]. 中国环境科学, 2013,33(5):821-826.
[16]Khan M A, Ahn Y T, Kumar M, et al. Adsorption studies for the removal of nitrate using modified lignite granular activated carbon [J]. Separation Science and Technology, 2011,46(16):2575-2584.
[17]Hao Y Y, Boy D J, Hrudey S E, et al. Characterization of new nitrosamines in drinking water using liquid chromatography and mass spectrometry [J]. Environmental Science and Technology,2006,40(24):7636-7641.
[18]Marina A, Krishna P. Effluent dissolved organic nitrogen and dissolved phosphorus removal by enhanced coagulation and microfiltration [J]. Water Research, 2010,44(18):5306-5315.
[19]Chen B Y, Kim Y, Westerhoff P. Occurrence and treatment of wastewater-derived organic nitrogen [J]. Water Research, 2011,45(15):4641-4650.
[20]Hu H D, Ding L L, Geng J J, et al. Effect of coagulation on dissolved organic nitrogen (DON) bioavailability in municipal wastewater effluents [J]. Journal of Environmental Chemical Engineering, 2016,4(2):2536-2544.
[21]国家环保局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002.
[22]Contescu A, Contescu C, Schwarz J A, et al. Surface acidity of carbons characterized by their continuous and Boehm titration [J].Carbon, 1997,35(1):83-94.
[23]Baruon S S, Evans M J B, Halliop E, et al. Acidic and basic sites on the surface of porous carbon [J]. Carbon, 1997,35(9):1361-1366.
[24]Jia H, Hocheol S, Jesse W A, et al. Halonitromethane formation potentials in drinking waters [J]. Water Research, 2010,44(1):105-114.
[25]Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation -emission matrix regional integration to quantify spectra for dissolved organic matter. Environmental Science and Technology, 2003,37(24):5701-5710.
[26]初永宝,高宝玉,岳钦艳,等.聚合氯化铝中纳米Al13形态的混凝效应 [J]. 中国环境科学, 2005,25(4):504-507.
[27]杨 毅,杨霞霞,马新培,等.pH对城市污水二级出水中溶解性有机物的荷电、聚集与光谱特性的影响 [J]. 环境化学, 2015,34(10):1804-1808.
[28]Xu J, Luo H W, Wang Y K, et al. Fluorescence approach for investigating binding properties between metals and soluble microbial products from a biological wastewater treatment plant[J]. Process Biochemistry, 2015,50(4):636-642.
[29]Chiang P C, Chang E E , Chang P C, et al. Effects of preozonation on the removal of THM precursors by coagulation [J].Science of the Total Environment, 2009,407(21):5735-5742.
[30]Chandrakanth M S, Amy G L. Effects of ozone on colloidal stability and aggregation of particles coated with natural organic matter [J]. Environmental Science and Technology, 1996,30(2):431-443.
[31]Rodrguez F, Marcos L A. Effect of ozonation on molecular weight distribution of humic substances and coagulation process-A case study: the Uzquiza reservoir water [J]. Ozone-Science &Engineering, 2012,34(34):342-353.
[32]Liu B, Gu L, Yu G Z, et al. Profile of dissolved organic nitrogen(DON) in full-scale ozone and biological activated carbon filter[J]. Desalination and Water Treatment, 2015,55(8):2069-2078.
[33]Meinel F, Zietzschmann F, Ruhl A S, et al. The benefits of powdered activated carbon recirculation for micro-pollutant removal in advanced wastewater treatment [J]. Water Research,2016,91(2):97-103.
[34]Altmann J, Sperlich A, Jekel M. Integrating organic micropollutant removal into tertiary filtration: Combining PAC adsorption with advanced phosphorus removal [J]. Water Research, 2015,84(1):58-65.
[35]Zhang H N, Gu L, Liu B, et al. Pre-Oxidation Advances Dissolved Organic Nitrogen Removal in Downstream Coagulation [J]. Fresenius Environmental Bulletin, 2012,21(2A):460-467.
[36]Lee W, Westerhoff P. Dissolved organic nitrogen removal during water treatment by aluminum sulfate and cationic polymer coagulation [J]. Water Research, 2006,40(20):3767-3774.
[37]Ahmed M J. Adsorption of quinolone, tetracycline, and penicillin antibiotics from aqueous solution using activated carbons:Review [J]. Environmental Toxicology and Pharmacology,2017,50:1-10.
[38]Seyed A D, Tanju K, Cheng W. Tailoring activated carbons for enhanced removal of natural organic matter from natural waters[J]. Carbon, 2004,42(3):547-557.
[39]Muller E A, Hung F R, Gbbbins K E, et al. Adsorption of water vapor-methane mixtures on activated carbons [J]. Langmuir,2000,16(12):5418-5424.
[40]Moreno-Castilla C, Rivera-Utrilla J, Lopez-Ramon M V, et al.Adsorption of some substituted phenols on activated carbons from a bituminous coal [J]. Carbon, 1995,33(6):845-851.
[41]杨岸明,常 江,甘 一,等.臭氧氧化二级出水有机物可生化性研究 [J]. 环境科学, 2010,31(2):363-367.
[42]Henderson R K, Baker A, Murphy K R, et al. Fluorescence as a potential monitoring tool for recycled water systems: a review [J].Water Research, 2009,43(4):863-881.
[43]Liu B, Gu L, Yu X, et al. Dissolved organic nitrogen (DON)profile during backwashing cycle of drinking water bio-filtration[J]. Science of the Total Enviroment, 2012,414(28):508-514.
[44]Pehlivanoglu-Mantas E, Sedlak D L. Wastewater-derived dissolved organic nitrogen: analytical methods, characterization,and effect-a review [J]. Critical Reviews in Environmental Science and Technology, 2006,36(3):26-85.
[45]孙迎雪,吴乾元,田 杰,等.污水中溶解性有机物组分特性及其氯消毒副产物生成潜能 [J]. 环境科学, 2009,30(8):2282-2287.

