DO浓度对EBPR耦合SND处理低C/N污水的影响
赵 骥,王晓霞,李夕耀,彭永臻,贾淑媛 (北京工业大学,国家工程实验室,北京市水质科学与水环境科学重点实验室,北京 100124)
污水中氮磷的超标排放,是造成水体富营养化的主要原因[1].然而,传统生物脱氮除磷工艺在处理低碳氮比污水时,往往会由于碳源不足而造成脱氮除磷效果不能同时达到理想的效果.强化生物除磷(EBPR)系统是以厌氧/好氧交替的方式运行,在厌氧条件下,聚磷菌(PAOs)水解细胞内的多聚磷酸盐颗粒和糖原获得能量,吸收水体中的可挥发性脂肪酸,并将其转化为内碳源-聚羟基脂肪酸(PHA),同时释放正磷酸盐到细胞外;在好氧条件下, PAOs分解PHA产生能量,一部分用以自身生长及合成代谢,另一部分用于合成糖原并过量吸收水中的磷酸盐[2]. EBPR工艺通过富集PAOs,提高PAOs所占的比例,可以实现污水的高效稳定除磷.
目前,同步硝化反硝化(SND)现象已被证实存在于多种生物处理系统中,如流化床反应器[3]、生物转盘[4]、氧化沟[5]、序批式反应器(SBR)[6]和CAST[7]等.由于SND现象是发生在同一个反应器的同一处理条件下,其较传统脱氮工艺相比具有较为明显优势,如:工艺流程简单、节省曝气量和反应器容积、减少碱度投加量等.
将EBPR与SND耦合,可在保证系统稳定除磷的基础上实现污水的脱氮过程,且工艺流程简单.对于碳氮比(C/N)较低的城市污水,该耦合系统中 PAOs和聚糖菌(GAOs)可在厌氧段将外碳源储存为内碳源;在低氧段,硝化菌在进行硝化反应的同时,反硝化菌可利用剩余外碳源进行反硝化,而当外碳源不足时 PAOs和 GAOs可利用内碳源进行内源反硝化脱氮,有望实现低C/N污水的高效脱氮除磷[8-9].此外,该耦合系统好氧段需处于微曝气的状态,以保证SND的进行[9-12],与传统脱氮除磷工艺相比可节省 50%以上的曝气量.目前,有关将EBPR与SND耦合实现低碳比污水的脱氮除磷还鲜有报道[12-14],有关 DO浓度对EBPR与SND耦合系统启动及脱氮除磷特性的影响还未见报道.
本文以实际低C/N生活污水为处理对象,采用单一厌氧/好氧运行的SBR,先通过调控反应器进水C/N,实现了EBPR系统的启动和PAOs的富集培养,同时研究了EBPR系统的除磷特性;然后,通过调控反应器好氧段DO浓度,研究了不同DO浓度对反应器的好氧段SND率、总氮(TN)去除率、除磷性能和碳源转化特性的影响,以期为了解耦合系统实现低 C/N污水高效脱氮除磷的可行性及其实际应用提供依据.
1 材料和方法
1.1 试验装置与运行工序
试验用反应器为序批式反应器(SBR,图 1),采用有机玻璃制成,为敞口式反应器,容积为10L,有效容积为 8L.每天运行 4个周期,每周期进水3L.SBR在厌氧/好氧交替的条件下运行,运行工序为:厌氧150min(包括进水10min),好氧180min,排泥 2min,沉淀 20min,排水 5min,静置 3min.反应器内污泥浓度维持在(2500±300)mg/L,SRT为10.9d,好氧段 DO 浓度通过实时控制装置(PLC)进行调控(表1).
此外,SBR反应器中EBPR与SND耦合试验研究主要分为2个过程:在过程1,实现EBPR的启动及 PAOs的富集,以保证系统的除磷性能;在过程2,通过降低DO浓度以实现EBPR与SND的耦合,进而提高系统的脱氮性能.
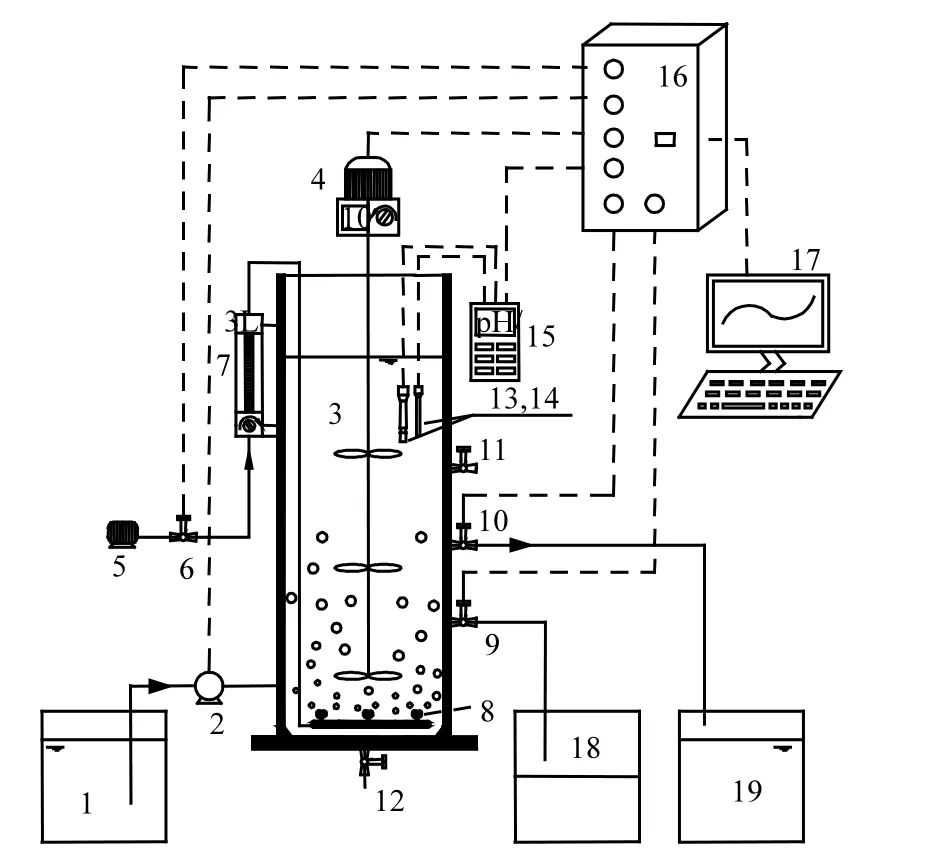
图1 SBR试验装置示意Fig.1 Experimental device of the SBR
1.2 试验用水和接种污泥
试验用水取自北京市某家属区化粪池生活污 水,具 体 水 质 为 :COD 浓 度 为 202.1~288.2mg/L,NH4+-N浓度为49.4~74.2mg/L, NO2--N浓度<1mg/L, NO3--N浓度<1mg/L, TN浓度为51.1~76.9mg/L, PO43--P 浓度为 3.9~7.5mg/L, pH值为7.1~7.6,C/N平均为3.8.此外,试验过程中通过向生活污水中投加固体乙酸钠的方式来提高进水COD浓度.试验过程中SBR进水条件和运行条件详细见表1.
试验用接种污泥取自某大学处理生活污水的好氧/缺氧(外加乙醇)短程硝化反硝化中试SBR,该污泥具有正常的脱氮除磷和短程硝化反硝化性能,其好氧段亚硝酸盐积累率约为 92.3%,系统NH4+-N和TN去除率分别平均达96.4%和92.3%,出水 PO43--P浓度约为 2.3mg/L.接种后SBR 内污泥浓度(MLSS)为 3.2g/L,污泥沉降比(SV%)为36%.
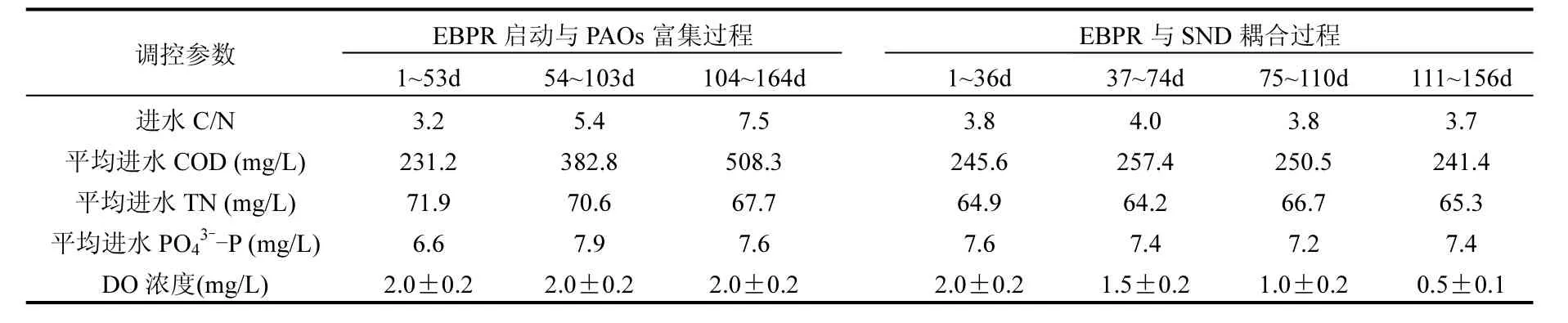
表1 SBR运行过程中进水水质和工艺运行参数Table 1 Influent and operation conditions of the SBR
1.3 检测分析方法
采用荧光原位杂交(FISH)技术[16]对活性污泥内部功能微生物进行定量分析. FISH分析过程所使用的PAOs探针为PAOmix,是由PAO462、PAO651和 PAO846混合而成.全菌探针为EUBmix,是由 EUB338、EUB338Ⅱ、EUB338Ⅲ组成.GAOs探针为 GAOmix,是由 GAO431和GAO989混合而成[17].相同目标探针均以相同比例混合为PAOmix、GAOmix和EUBmix.AOB探针由NSO1225和NSO190混合而成;NOB探针包括 NIT3和 Ntspa662[18].分析过程中.图片采用OLYMPUS DP72数字成像系统采集,每个泥样用荧光显微镜获得 60组以上的图片,然后采用Image plus软件计数,得到各目标菌占全菌的百分数.另外,分析过程中每个样品设立 3组平行,取均值,以表示目标菌的含量.
1.4 氮损失∆TIN和SND率的计算方法
∆TIN以表示系统好氧段的总无机氮损失量,单位为mg/L,其计算方法见公式(1):
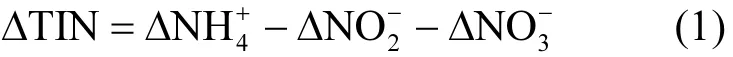
SND率用以表示通过同步硝化反硝化作用去除的 NH4+占进水 NH4+的百分比(%)[8-9],其计算方法见公式(2):
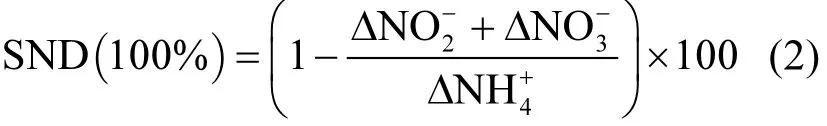
式中:ΔNH4+、ΔNO2-和 ΔNO3-分别为系统好氧段NH4+-N、NO2--N和NO3--N浓度的变化量,mg/L.
1.5 PAOs在厌氧段内碳源PHA储存中贡献比例的计算方法
在系统厌氧段,COD的去除主要是通过异养菌的反硝化过程和PAOs与GAOs的内碳源储存过程[10-11]. PAOs在内碳源PHA储存过程中的贡献比例(PPAO,An)的计算方法见公式(3)~式(4):
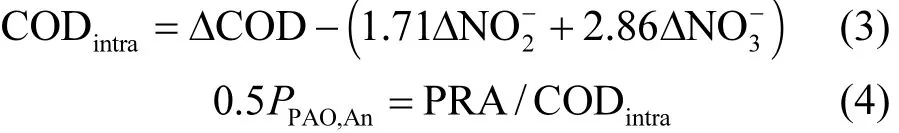
式中: CODintra为厌氧段被PAOs和GAOs储存为内碳源的COD量, mg/L;ΔCOD、和分别为系统厌氧段COD、-N和-N浓度的变化量, mg/L;1.71和2.86分别为单位质量浓度的-N和-N被异养菌反硝化时所消耗的COD浓度, mgN/mgCOD;PRA为厌氧段释磷量, mg/L;0.5为PAOs厌氧条件下每吸收单位质量的有机碳源所释放的磷量, molP/molC.
2 结果与讨论
2.1 EBPR系统的启动和PAOs的富集
本试验过程1中, SBR用于EBPR的启动及PAOs富集培养,共运行164d.根据进水C/N比和COD浓度变化情况,可以将整个运行过程划分为3 个阶段,即阶段 1 (1~53d)、阶段 2(54~103d)和阶段3(104~164d).其中,EBPR启动过程中COD、TN和PO43--P去除情况见图2和图3.
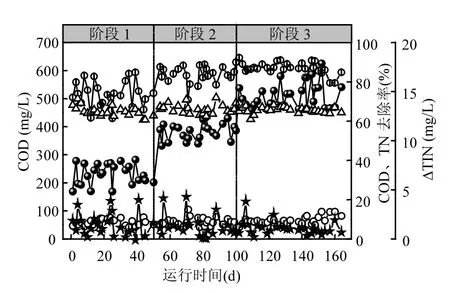
图2 EBPR启动过程中COD和TN浓度变化情况Fig.2 Variations of COD and TN concentrations during the start-up process of EBPR
由图 2、图 3可知,在阶段 1(1~53d),系统进水C/N和COD浓度平均为3.2和231.1mg/L.该阶段,系统出水COD浓度平均为59.2mg/L,COD去除率达73.7%;系统进、出水PO43--P浓度分别为6.6和3.9mg/L,且PRA和好氧段吸磷量(PUA)仅为3.3和4.3mg/L,PO43--P去除率为39.7%;系统好氧段∆TIN 为 1.5mg/L,但 TN 去除率高达65.1%.说明,系统具有较好的脱氮性能,且氮的去除主要是在厌氧段通过反硝化过程实现的.并且,由于反硝化菌对原水碳源的优先利用,使得PAOs释磷过程中碳源不足,导致系统除磷性能较差.
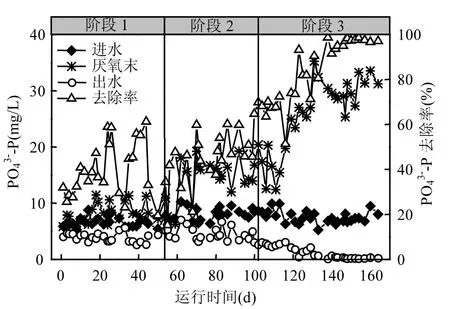
图3 EBPR启动过程中-P浓度变化情况Fig.3 Variations of -P concentration during the start-up process of the EBPR
为了保证系统厌氧段PAOs释磷过程的有效进行和系统除磷性能的进一步提高,在阶段2(54~103d)和阶段 3 (104~164d)将进水 C/N 分别提高到约5.4和7.5,进水COD浓度分别提高到400 和 500mg/L.在阶段 2(54~103d),系统出水COD浓度平均为56.9mg/L,COD去除率逐渐提高到 85%左右;系统 TN去除率保持在 66%左右,∆TIN保持在1.2mg/L,但出水-P浓度逐渐下降至2.4mg/L.PUA和PRA分别逐渐提高到12和14mg/L左右,-P去除率最高达65.7%.说明,进水COD浓度的提高,有利于PAOs释磷过程的进行,进而可提高系统的除磷性能.在阶段 3(104~164d),随着进水C/N和COD浓度的进一步提高,系统 COD和 TN去除性能得以稳定维持,其去除率分别保持在87%和66%左右,但系统除磷性能得以进一步提高.该阶段,系统 PUA 进一步增加到约30mg/L,出水-P浓度逐渐降低,并在第138~164d内稳定低于0.5mg/L.说明,当进水 C/N约为 8时, EBPR系统厌氧段反硝化、PAOs和其它异养菌均有充足的碳源进行厌(或缺)氧代谢.即该进水COD浓度条件有利于PAOs的富集和系统除磷性能的提高.碳源缺乏及异养菌对碳源的优先利用,是造成阶段 1系统除磷性能较差的主要原因[9].该试验结果与现有研究成果[19-21]相一致,即提高进水 C/N或 COD浓度可强化 PAOs的释磷/吸磷特性,进而可提高系统的除磷性能.
此外,EBPR系统启动前后的FISH分析结果显示:系统内PAOs占全菌的比例由第1d时的(4±2)%提高到第 164d 时的(38±3)%;同时,GAOs占全菌的比例由(3±1)%提高到(17±2)% (图4).AOB占全菌的比例稳定维持在(13±3)%,但 NOB占全菌的比例有所下降,由第1d时约6%降低至第164d时约3%.第164d时,氨氧化β Proteobacteria、Proteobacteria β类亚硝酸细菌、Nitrobacteria和Nitrospira分别占全菌的比例约为(12±3)%、2.9%、1.8%和 1%.说明通过逐步提高进水 COD浓度可以实现PAOs的富集,但 PAOs富集的同时也伴随着GAOs的富集.
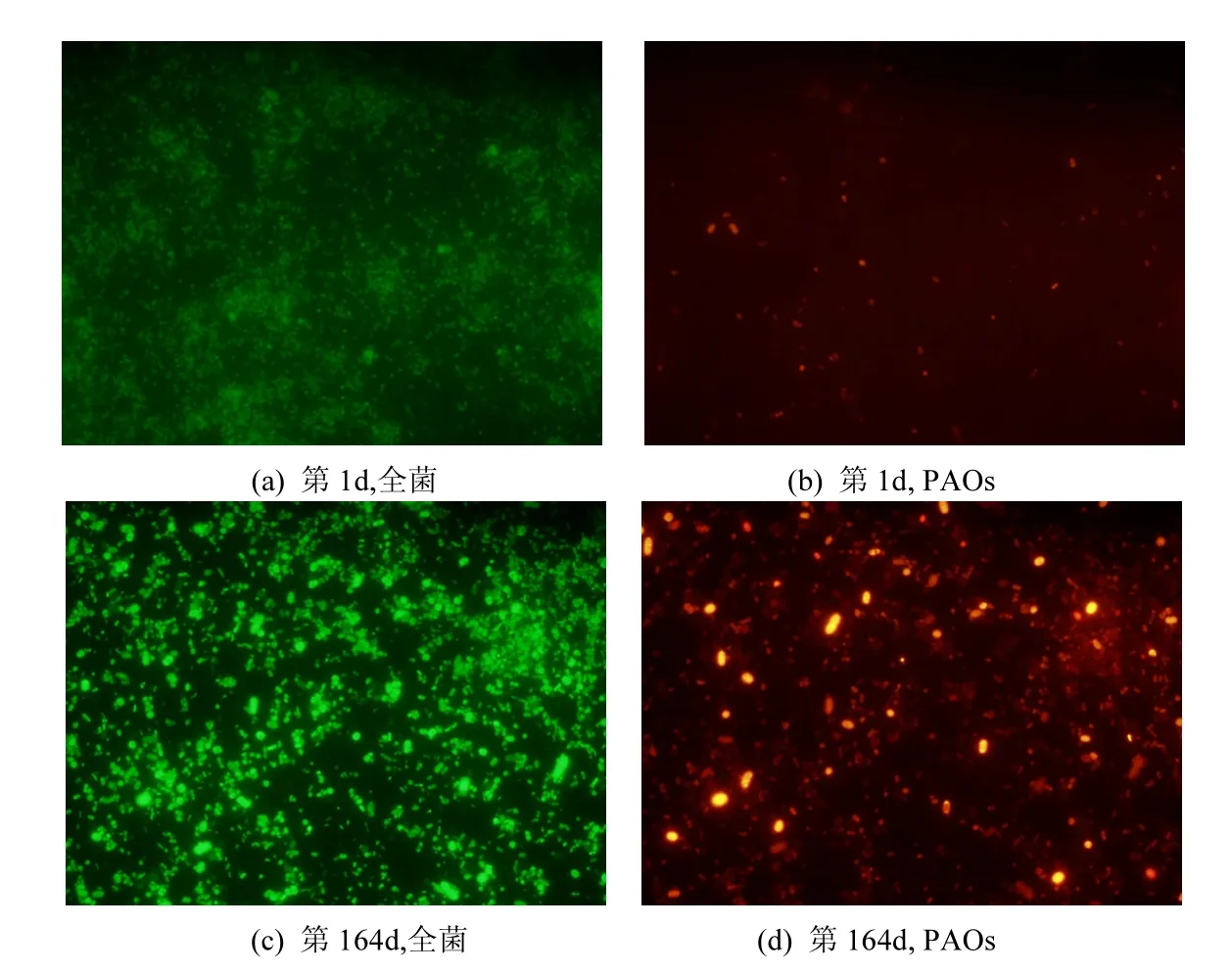
图4 EBPR启动过程中(第1和164d)全菌和PAOs的FISH图片Fig.4 FISH images of total bacteria and PAOs during the start-up process of the EBPR
2.2 DO浓度对 EBPR-SND耦合过程中∆TIN的影响
图5 为SBR运行过程2中NH4+-N、NO2--N和NO3--N浓度及好氧段氮损失的变化情况.由图 5可知,当 DO浓度分别约为 2.0,1.5,1.0mg/L时,系统出水 NH4+-N浓度均稳定维持在较低水平,平均为 0.9mg/L;但当 DO 浓度降低至约0.5mg/L后, DO浓度的减小导致硝化过程进行不完全,出水 NH4+-N 浓度略有升高,平均达2.2mg/L.说明,DO浓度为1.0~2.0mg/L时, DO浓度的降低几乎不影响系统的硝化性能;但当 DO浓度为0.5mg/L时,系统的硝化性能变差.

图5 不同DO浓度条件下EBPR耦合SND过程中氮去除情况Fig.5 Nitrogen removal performance of the SBR during the combination of EBPR with SND at various DO concentrations
从∆TIN 的变化情况来看,当 DO 浓度约为2.0mg/L时, ∆TIN稳定在2.6mg/L左右;当DO浓度降至约1.5和1.0mg/L后,∆TIN逐渐升高至9.4和 13.7mg/L;当 DO 浓度继续降至约 0.5mg/L后,∆TIN稳定在13.5mg/L.随着DO浓度的降低,好氧段氮损失越大.但当DO浓度低至约0.5mg/L时,由于系统硝化性能变差,氮损失量没有持续增加,而是维持在DO浓度为1.0mg/L后期(96~110d)的水平.此外,当DO浓度约为0.5mg/L时,系统出水亚硝酸盐积累较为明显,不排除在好氧段发生了短程硝化反硝化作用.
王晓霞等[10]在研究 SNDPR系统的脱氮特性时同样发现,低 DO浓度(0.5mg/L)会引起硝化细菌硝化速率的降低,从而降低系统的硝化性能(NH4+-N去除率由 96.8%降低至 92.0%);Zeng等[22]在研究DO浓度对SND脱氮过程的影响时发现,当DO浓度由2.5mg/L逐渐降低至0.5mg/L时,硝化速率由6.7mg/L逐渐降至4.3mg/L,但TIN由 3.4mg/L逐渐升高至 4.2mg/L;支霞辉等[23]在研究厌氧-好氧-缺氧短程硝化同步反硝化除磷工艺的启动时发现,较高的DO浓度(1.5~2.5mg/L)有利于氨氮的去除,低 DO浓度(0.5mg/L)会引起氨氧化菌(AOB)和亚硝酸盐氧化菌(NOB)硝化速率的同时受限,造成氨氮去除效果变差.上述试验结果均证实了本试验过程中,DO浓度对系统硝化特性的影响机制.
2.3 DO浓度对 EBPR-SND耦合过程中 SND率和TN去除率的影响
图6为不同DO浓度条件下SND率、TN去除率及TN浓度的变化情况.由图6可知,不同DO浓度条件下, SND率变化幅度较大.并且随着DO浓度的逐渐降低,SND率和TN去除率均逐渐升高.当DO浓度约为2.0mg/L时, SND率最低,仅为11.1%左右;系统TN去除率平均为65.8%,接近于EBPR系统启动阶段的水平(66%,见2.1).说明,该DO浓度条件下,系统内TN的去除主要是通过硝化反硝化过程实现的.

图6 不同DO浓度条件下EBPR耦合SND过程中SND率和TN去除率的变化情况Fig.6 Variations of SND efficiency and TN removal efficiency of the SBR during the combination of EBPR with SND at various DO concentrations
当DO浓度降至1.5,1.0mg/L后,SND率迅速增加到38%和57%左右,同时伴随着TN去除率和好氧段TN去除量的提高.TN去除率由第38d时的66.5%逐渐升高到第110d时的82.6% (图6).当DO浓度降至0.5mg/L后,SND率缓慢增加到65%左右,同时 TN 去除率提高到约 85%.因此,DO浓度的降低有利于 EBPR系统内同步硝化反硝化的进行,即有利于EBPR与SND的耦合过程,并可提高耦合系统的脱氮性能;但当DO浓度低于0.5mg/L时,系统硝化过程受阻,会引起出水 NH4+-N浓度升高,进而影响系统的脱氮性能的进一步提高.
Wang等[9]在DO浓度为1.0mg/L的条件下启动 EBPR时发现,系统好氧段存在较明显的SND 现象,SND 率为(30~40)%;而苗志加等[24]在DO浓度为2~4mg/L时启动EBPR时,并未发现较明显 SND 现象(∆TIN<2mg/L).其结合本试验研究结果均可说明,低 DO浓度有利于强化EBPR系统的SND脱氮过程,从而可提高系统的TN去除率.
2.4 DO浓度对EBPR-SND耦合过程中除磷性能的影响
图7为SBR运行过程2中不同DO浓度条件下 4 个典型周期内(32d: DO 2.0mg/L; 70d: DO 1.5mg/L; 107d: DO 1.0mg/L; 153d: DO 0.5mg/L)PO43--P去除情况.由图 7可知,当 DO浓度由约2.0mg/L逐渐降至约 0.5mg/L时,系统出水PO43--P浓度分别为 0.32,0.30,0.36,0.42mg/L,均低于0.5mg/L.不同DO浓度条件下,系统PO43--P去除率得以稳定维持,均在94%左右.说明DO浓度对系统除磷性能的影响不大.但不同 DO浓度条件下PRA和PUA均随着DO浓度的降低呈现缓慢下降趋势.当 DO浓度约为 2.0,1.5mg/L时,PRA和PUA分别保持在26,29mg/L左右;当DO浓度降至约1.0mg/L时,PRA和PUA均下降约3mg/L,其分别下降至22.1,24.6mg/L;但当DO浓度降至约0.5mg/L时,PRA和PUA均再次下降约4mg/L,分别为17.2,20.1mg/L.
说明当DO浓度为2.0~1.5mg/L时,DO浓度的降低几乎未对系统的除磷性能产生影响,系统释磷和吸磷性能均得以稳定维持;而当DO浓度为1.5~0.5mg/L时,系统释磷和吸磷性能均随着DO浓度的降低而逐渐降低,分析其原因可能在于低DO浓度条件下SND作用的增强(见2.3),使得厌氧段更多的 COD被 GAOs储存并用于好氧段SND脱氮,而 PAOs用于释磷过程的 COD减少,进而在好氧段用于吸磷过程的PHA分解量减少,表现为PRA和PUA值的同时降低[11].
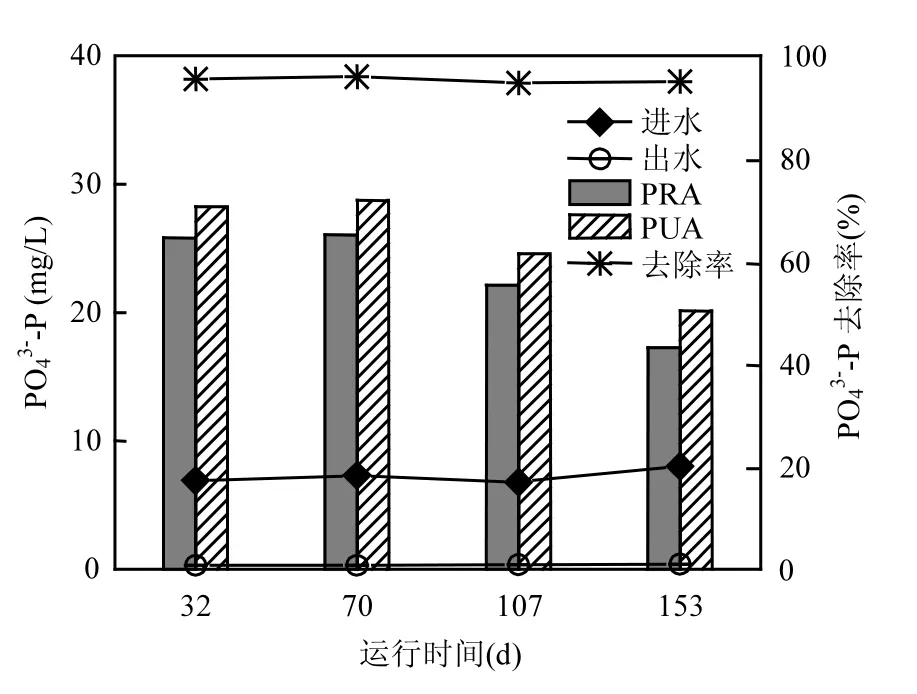
图7 不同DO浓度条件下典型周期内磷去除情况Fig.7 P removal characteristics in typical operation cycles at various DO concentrations
此外,本研究EBPR耦合SND过程中DO浓度约为0.5mg/L时,系统的释磷性能要高于低DO条件下(DO 浓度为 0.5~1.0mg/L)启动及优化的SNDPR 系统[10,19,25]的释磷性能(PRA: 17.2mg/L>14.7,8.3,15.7mg/L),说明本研究高浓度富集的PAOs有利于保证系统的释磷性能(PAOs占全菌的比例: (38±3)%> (29±3)%、14.7%和(34±3)%),进而保证系统出水 PO43--P浓度稳定低于0.5mg/L以下.
2.5 DO浓度对EBPR-SND耦合过程中碳源转化特性的影响
图8为SBR运行过程2中,不同DO浓度下4 个典型周期内(32d: DO 2.0mg/L; 70d: DO 1.5mg/L; 107d: DO 1.0mg/L; 153d: DO 0.5mg/L)COD去除情况、PHA储存情况及PPAO,An的变化情况.由图8可知,当DO浓度为2.0mg/L时,反应器厌氧末COD浓度最低,其消耗量最多,但PHA储存量较少.分析其原因在于好氧段硝化过程进行完全,使得进入下一反应周期厌氧段的硝酸盐和亚硝酸盐浓度较高,反硝化过程消耗了一部分COD.说明在厌氧段反硝化菌较 PAOs和 GAOs会优先利用外碳源.
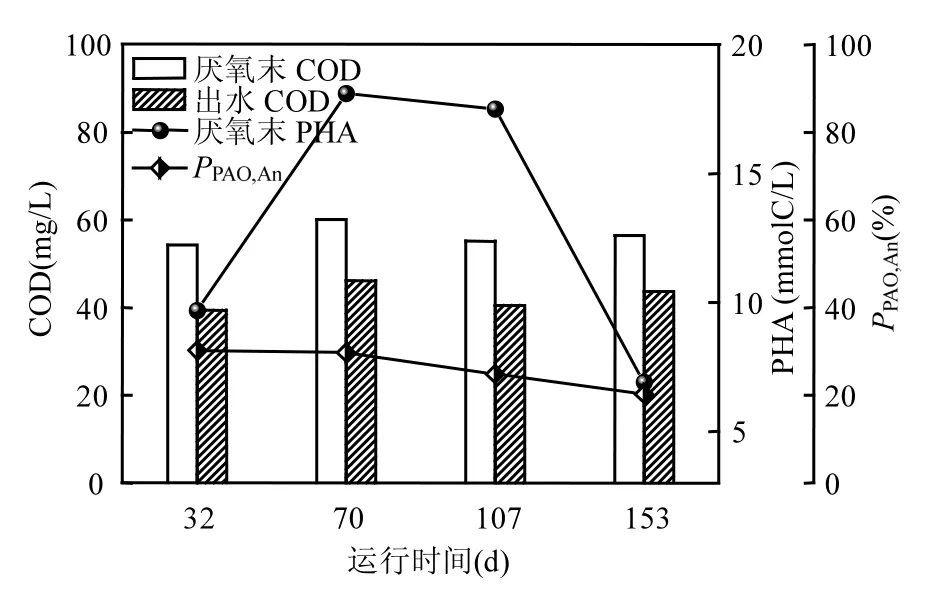
图8 不同DO浓度条件下典型周期内COD和PHA浓度与PPAO,An变化情况Fig.8 Variations of COD and PHA concentrations and PPAO,An in typical operation cycles at various DO concentrations
当DO浓度降至1.5和1.0mg/L时,厌氧末COD浓度维持在较低水平,但 PHA储存量大幅升高.说明系统厌氧段反硝化消耗 COD量减少,而PAOs和GAOs用于储存内碳源消耗的COD含量升高.当DO浓度为0.5mg/L时,厌氧末COD浓度最高,但 PHA 浓度依然维持在较高水平.因此, DO浓度为1.0~1.5mg/L有利于系统厌氧段内碳源PHA的合成.
此外,当 DO浓度由 2.0mg/L逐渐降至0.5mg/L时, PPAO,An由30.3%逐渐降至20.2%.说明低DO浓度条件下, GAOs较PAOs在厌氧内碳源储存中的贡献大,其也解释了 2.4中系统释磷和吸磷性能降低的原因.
3 结论
3.1 以实际低C/N(3.5)生活污水为处理对象,采用厌氧/好氧运行的SBR,通过调控进水C/N可以实现 EBPR的启动,通过进一步调控好氧段 DO浓度可以实现 EBPR 与 SND的耦合.耦合系统中TN和PO43--P去除率分别高达85%和94%.
3.2 DO浓度为1.0~1.5mg/L,SBR好氧段SND现象较为明显,过高或者过低的 DO浓度均不利于EBPR与SND的耦合,但低DO条件(0.5mg/L),亚硝酸盐积累较为明显,耦合系统中存在同步短程硝化反硝化现象.
3.3 DO浓度对SBR出水PO43--P浓度影响较小,但DO浓度降低(由2.0mg/L降至0.5mg/L)会引起厌氧释磷量和好氧吸磷量变小,且 PAOs较GAOs在厌氧内碳源储存中的贡献减弱, PPAO,An由30.3%降至20.2%.
3.4 DO浓度几乎不影响SBR的COD去除性能,不同DO浓度条件下,COD去除率稳定维持在85%左右.但DO浓度为1.0~1.5mg/L有利于厌氧内碳源(PHA)的合成.
[1]中华人民共和国环境保护部.2015年中国环境状况公报 [R].2015.
[2]Grocetti G R, Hugenholtz P, Bond P L, et al. Identification of polyphosphate accumulating organisms and design of 16SrRNA-directed probes for their detection and quantitation [J]. Applied and Enviromental Microbiology, 2000,66(3):1175—1182.
[3]Munch E, Lant P, Keller J. Simultaneous Nitrification and Denitrification in Bench-scale Sequencing Batch Reactors [J].Water Research, 1996,30(2):277—284.
[4]Masuda S, Watanabe Y, Ishiguro M. Biofilm Properties and Simultaneous Nitrification and Denitrification in Aerobic Rotating Biological Contactors [J]. Water Science and Technology,1991,23(7):1355—1363.
[5]Rittmann B, Langeland W. Simultaneous Denitrification with Nitrification in Single-channel Oxidation Ditches [J]. Journal Water Pollution Control Federation, 1985,57(4):300—308.
[6]赵 玲,张之源.复合 SBR系统中同步硝化/反硝化现象及其脱氮效果 [J]. 工业用水与废水, 2002,(2):4—6.
[7]Goronszy M, Demoulin G, Newland M. Aerated Denitrification in Full-scale Activated Sludge Facilities [J]. Water Science and Technology, 1997,35(10):103—110.
[8]何 理,高大文.基于反硝化聚磷菌的颗粒污泥的 [J]. 中国环境科学, 2014,34(2):383—389.
[9]Wang X X, Wang S Y, Xue T L, et al. Treating low carbon/nitrogen (C/N) wastewater in simultaneous nitrificationendogenous denitrification and phosphorous removal (SNDPR) systems by strengthening anaerobic intracellular carbon storage [J]. Water Research, 2015,77:191—200.
[10]王晓霞,王淑莹,赵 骥,等.厌氧/好氧运行的SNEDPR系统处理低C/N污水的优化运行 [J]. 中国环境科学, 2016,36(9):2672—2680.
[11]Wang X X, Wang S Y, Zhao J, et al. A novel stoichiometries methodology to quantify functional microorganisms in simultaneous nitrification- endogenous denitrification and phosphorous removal (SNEDPR) [J]. Water Research, 2015,95:319—329.
[12]方 茜,张朝阳,张立秋,等.同时硝化/反硝化除磷工艺稳定性控制研究 [J]. 中国给水排水, 2014,40(11):132—135.
[13]戴 娴,彭永臻,王晓霞,等.不同厌氧时间对富集聚磷菌的SNDPR 系统处理性能的影响 [J]. 中国环境科学, 2016,36(1):92—99.
[14]苗志加,彭永臻,薛桂松,等.强化生物除磷工艺富集聚磷菌及其微生物菌群分析 [J]. 北京工业大学学报, 2013,(5):742-748.
[15]国家环境保护总局.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002:252—354.
[16]Amann R I, Krumholz L, Stahl D A. Fluorescent-oligonucleotide probing of whole cells for determinative, phylogenetic, and environmental studies in microbiology [J]. Journal of Bacteriology, 1990,172(2):762—770.
[17]许松瑜.双泥折流板反硝化除磷工艺硝化菌的 FISH检测研究[D]. 苏州:苏州科技学院环境科学与工程学院, 2011.
[18]Grocetti G R, Hugenholtz P, Bond P L, et al. Identification of polyphosphate accumulating organisms and design of 16SrRNA-directed probes for their detection and quantitation [J]. Applied and Enviromental Microbiology, 2000,66(3):1175—1182.
[19]戴 娴,王晓霞,彭永臻,等.进水C/N对富集聚磷菌的SNDPR系统脱氮除磷的影响 [J]. 中国环境科学, 2015,35(9):2636—2643.
[20]王晓霞,王淑莹,彭永臻,等.EBPR的快速启动及其与同步硝化反硝化耦合实现污水的脱氮除磷 [J]. 中国环境科学,2014,44(6):1278—1284.
[21]苗志加.强化生物除磷系统聚磷菌的富集反硝化除磷特性 [D].北京:北京工业大学, 2013.
[22]Zeng R J, Lemaire R, Yuan Z G, et al. Simultaneous nitrification,denitrification, and phosphorus removal in a lab-scale sequencing batch reactor [J]. Biotechnology and Bioengineering, 2003,84(2):170—178.
[23]支霞辉,黄 霞,李 朋,等.厌氧-好氧-缺氧短程硝化同步反硝化除磷工艺研究 [J]. 环境科学学报, 2009,29(9):1806—1812.
[24]苗志加,薛桂松,翁冬晨,等.不同碳源对 EBPR 系统厌氧计量学参数的影响 [J]. 化工学报, 2012,63(12):4034—4041.
[25]Coma M, Verawaty M, Pijuan M, et al. Enhancing aerobic granulation for biological nutrient removal from domestic wastewater [J]. Bioresource Technology, 2012,103(1):101—108.

