高产红曲色素和Monacolin K红曲霉菌的诱变选育
常聪,张安,程述敏,张文学
(四川大学 轻纺与食品学院,成都 610065)
红曲是以大米为发酵基质,接种红曲霉菌,经发酵而得的一种色泽为紫红色的产物[1]。我国对红曲霉的应用历史悠久。红曲霉代谢产物繁多[2],而红曲色素和Monacolin K是2种重要的代谢产物[3]。红曲色素作为天然优质食用色素,具有抗突变、防腐等作用[4,5],在食品、医药等行业应用较广;Monacolin K能抑制人体胆固醇合成[6],被认为是最佳的血脂调节物。目前国内外以同时提高二者产量为目的的诱变育种研究较少,而我国工业化生产红曲色素和Monacolin K普遍存在成本高、产量低的问题,因此提高红曲霉菌株发酵产红曲色素和Monacolin K的能力具有重要的现实意义。诱变育种是利用合理有效的诱变剂及诱变剂量处理微生物的单细胞,提高突变频率,再通过适当的筛选方法获得优质菌株的育种方法[7]。因此,文章采用对红曲霉单孢子悬液进行紫外线-氯化锂的复合诱变方法,对平板菌落初筛,对红曲色素、Monacolin K含量检测进行复筛,并进行遗传稳定性实验,旨在筛选出同时高产红曲色素和Monacolin K及具备良好遗传稳定性的红曲霉突变菌株。
1 材料与方法
1.1 材料
1.1.1 实验菌种
从本实验室、中国工业微生物菌种保藏管理中心(CICC)、中国普通微生物菌种保藏管理中心(CGMCC)共购买收集5株红曲霉菌株(QH,JP2,5046,40225,40938)。
1.1.2 培养基
1.1.2.1 种子液培养基
马铃薯20%,无水葡萄糖2%,自然pH,121 ℃灭菌20 min。
1.1.2.2 大米培养基
大米经清洗,于水中浸泡1 h,沥干水分,进行蒸煮至大米颗粒分散、微粘状态。蒸煮后的大米分别取30 g分装于250 mL三角瓶中,121 ℃,0.1 MPa灭菌20 min。
1.1.3 主要试剂
色谱纯:甲醇、磷酸;分析纯:甲醇、无水葡萄糖、无水乙醇、无水氯化锂。
1.1.4 主要仪器设备
单人双面净化工作台、立式压力蒸汽灭菌锅、台式高速冷冻离心机、高效液相色谱仪、电热恒温真空干燥箱、恒温振荡培养箱、酶标仪、电子天平、磁力搅拌器、超声清洗机、可调万用电炉、电磁炉、蒸锅、40目筛等。
1.2 实验方法
1.2.1 红曲米制作方法
1.2.1.1 种子液
将红曲霉斜面孢子刮下置于三角瓶中,振荡充分,无菌脱脂棉过滤孢子液,将孢子稀释至浓度约为 106~107个/mL,即为孢子悬液,2%接种量接种于种子液培养基中,120 r/min摇床28 ℃培养48 h。
1.2.1.2 固态发酵红曲米
将种子液按照10%(V/V)接种量接种于装有30 g大米培养基的250 mL三角瓶中,并用无菌玻璃棒打散,于28 ℃培养14天。
1.2.2 红曲中Monacolin K的检测方法[8,9]
将红曲发酵产物于40 ℃下烘干研磨至40目,称取0.5 g于50 mL容量瓶中,加入适量无水甲醇,室温下超声1 h,中间间歇振荡3~4次最终定容到50 mL。以4000 r/min的转速离心10 min。取上清液经0.45 μm微孔滤膜过滤,滤液取20 μL经HPLC测定方法检测,并根据HPLC标准曲线计算内酯式及酸式Monacolin K含量,并计算Monacolin K总含量。HPLC检测方法参考QB/T 2847-2007。
1.2.3 红曲中红曲色素的检测方法[10]
红曲色素提取及检测方法参考GB 1886.19-2015。
称取0.2 g烘干研磨后的红曲发酵产物,用70%乙醇溶液溶解并将其转入100 mL容量瓶中,定容,置于(60±0.5) ℃水浴中,浸泡1 h,冷却至室温,补充70%乙醇溶液至刻度,混匀后过滤,吸取一定体积的滤液于50 mL容量瓶中,用70%乙醇溶液稀释定容至50 mL,摇匀,在505 nm的波长下测定处理后样品的吸光度A,并计算样品的色价。
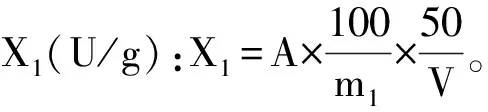
式中:A为样品吸光度;m1为样品质量(g);V为吸取乙醇浸泡液的体积(mL)。
1.2.4 红曲霉菌株产红曲色素和Monacolin K能力的测定
对5株红曲霉(QH,JP2,5046,40225,40938)的固态发酵产物进行Monacolin K和红曲色素的提取及检测。比较5株红曲霉固态发酵产红曲色素和Monacolin K能力,选择最优红曲霉菌株作为后续实验菌株。
1.2.5 诱变方法
1.2.5.1 紫外诱变
在避光的无菌操作台中,将装有5 mL制备好的单孢子悬浮液的无菌培养皿放置于磁力搅拌器上,将灭过菌的搅拌转子放置于培养皿中,开启搅拌器,使单孢子悬浮液一直保持搅拌状态,在紫外灯(25 W)下,保持垂直照射距离20 cm,将培养皿分别照射1,2,3,4,5 min。避光下将不同紫外诱变剂量的单孢子菌悬液分别稀释至10-3,取各诱变后的单孢子菌悬液及其稀释液0.1 mL涂平板,每个样品做3个平行。未经诱变的原菌液稀释同等梯度涂平板作为空白对照。平板静置20 min后于28 ℃恒温培养室中倒置培养3天左右,避光培养,以免发生光复活作用。待菌落生长出来观察并记数,计算致死率。一般来说,为了提高诱变成功率,应采取较高致死率的平板菌落继续进行后续实验,但过高致死率平板上的突变菌株容易发生回复突变的情况,性状不稳定。因此,选取致死率在70%~80%的平板的诱变剂量作为最佳诱变剂量。

式中:A为对照组菌落数;B为诱变组菌落数。
1.2.5.2 紫外-氯化锂复合诱变
将上述紫外诱变后的孢子悬浮液分别吸取0.1 mL涂布于氯化锂浓度分别为0.2‰,0.4‰,0.6‰,0.8‰,1.0‰的PDA平板上,每个梯度3个平行,并以不含氯化锂的PDA平板作为对照组。将以上PDA平板于28 ℃恒温培养室倒置培养3天。观察并记录菌落数,计算不同诱变剂量的致死率。
1.2.5.3 突变菌株筛选方法
初筛方法:以原始菌株菌落形态作为对照,选取最佳诱变剂量下的诱变菌落中,菌落直径、菌落颜色、菌丝疏密程度等与原始菌落有区别者,进行平板划线分离,获得突变单菌落。
复筛方法:初筛得到的单菌落接种于斜面PDA培养基中,28 ℃培养7天后转入种子液培养基中培养2天后,进行固态发酵培养14天,检测发酵产物中红曲色素和Monacolin K的含量,筛选出高产红曲色素和Monacolin K的突变菌株。
1.2.5.4 诱变菌株的遗传稳定性实验
将紫外-氯化锂复合诱变处理后,筛选得到的高产Monacolin K红曲霉突变菌株转接至斜面PDA培养基中,28 ℃恒温培养7天后作为第1代,第1代斜面菌落转接至新的斜面PDA培养基中,28 ℃恒温培养7天后为第2代,以此类推到第5代。每一代的红曲菌株都需进行固态发酵,发酵14天后检测红曲色素和Monacolin K的含量,筛选出遗传稳定性最高的菌株。
2 结果与分析
2.1 红曲霉菌株产Monacolin K能力的测定
对5株初始红曲霉菌株(QH,JP2,5046,40225,40938)红曲色素和Monacolin K产量进行测定,见表1。

表1 5株初始红曲霉红曲色素色价和Monacolin K含量Table 1 Levels of Monascus pigments and Monacolin K in 5 original Monascus strains
注:“—”为未检出。
其中红曲霉QH的红曲色素相对较高,色价达1330 U/g,Monacolin K产量最高,为0.36 mg/g。后续将选用该菌株作为原始菌株,进行复合诱变育种高产Monacolin K菌株。
2.2 最佳诱变条件的确定
通过平板菌落计数,计算不同诱变剂量下的红曲霉菌致死率,制作诱变剂量与致死率的相关曲线,从而确定紫外-氯化锂的最佳复合诱变条件。
2.2.1 紫外诱变剂量的选择

图1 紫外诱变时间对红曲霉菌QH致死率的影响Fig.1 Effect of ultraviolet mutation duration on the lethal rate of Monascus QH
由图1可知,紫外诱变剂量达到2 min时,红曲菌致死率达到75%,所以确定2 min为紫外诱变的最佳诱变剂量。
2.2.2 紫外-氯化锂复合诱变剂量的选择

图2 氯化锂浓度对红曲霉菌QH致死率的影响Fig.2 Effect of LiCl concentration on the lethal rate of Monascus QH
由图2可知,氯化锂浓度达到0.6‰时,红曲霉菌致死率达到78%,所以确定氯化锂浓度为0.6‰作为复合诱变处理剂量。
2.2.3 紫外-氯化锂复合诱变筛选结果
2.2.3.1 诱变菌株初筛
选取最佳诱变剂量——紫外诱变2 min、氯化锂浓度0.6‰的平板菌落作为诱变菌落,诱变前后的红曲霉菌菌落形态对比见图3。

图3 诱变前后红曲霉菌落形态对比Fig.3 Colonial morphology of Monascus before and after mutation
注:左表示未经诱变,右表示紫外-氯化锂复合诱变后。
由图3可知,紫外-氯化锂复合诱变后的菌落形态与原始菌落形态有一定差别:诱变后的菌落直径较大,且边缘白色菌丝所占面积较未经诱变的菌落小,而中心橙红色部分菌丝所占面积较未经诱变的菌落大。挑选与原始菌落差别较大的单菌落进行平板划线分离及PDA斜面保藏。
2.2.3.2 诱变菌株复筛
经菌落形态初筛,获得紫外-氯化锂复合诱变菌株50株,编号为QH1~QH50,分别对其进行固态发酵并测定发酵产物中红曲色素和Monacolin K的含量,检测其是否高于原始菌株QH的色素和Monacolin K产量,若高于原始菌株QH则为正突变。50株红曲霉诱变菌株的代谢能力不一,有的突变株产量提高,有的突变株产量降低。红曲色素和Monacolin K产量同时提高最多的突变菌株见表2。

表2 诱变菌株QH12,QH14,QH46 红曲色素和Monacolin K含量及提高值
由表2可知,突变株QH12,QH14,QH46的红曲色素及Monacolin K产量较原始菌株均有所提高,红曲色素色价分别达到2450,3190,1960 U/g,是原始菌株的1.84,2.40,1.47倍;Monacolin K分别达到1.68,1.28,1.99 mg/g,是原始菌株的4.67,3.56,5.53倍,可见紫外-氯化锂复合诱变红曲菌株的产红曲色素和Monacolin K能力好。
2.2.4 诱变菌株的遗传稳定性实验
诱变后的突变菌株性状不稳定,培养过程中会出现突变性状衰退甚至消失,从而不能应用于工业生产,故要对突变菌株进行传代稳定性试验。对3株红曲菌突变株QH12,QH14,QH46分别连续传代4次,进行固态发酵实验并检测其红曲色素和Monacolin K产量,每次3个平行,取平均值,结果见表3。
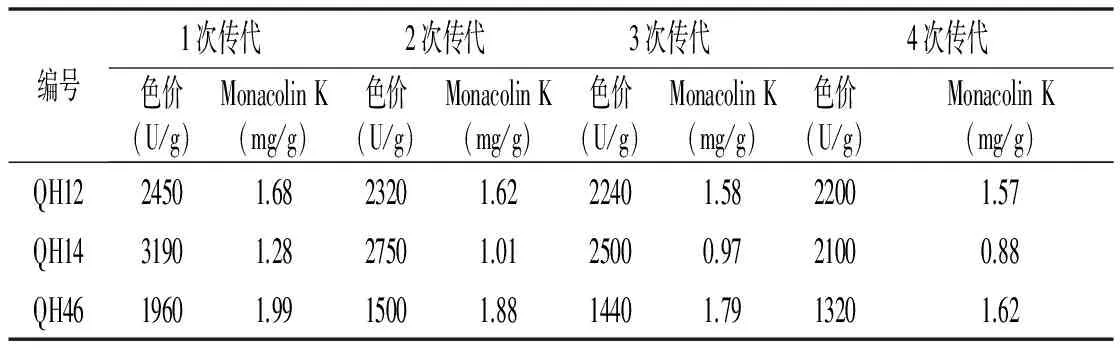
表3 红曲霉菌诱变菌株产红曲色素和Monacolin K的情况Table 3 Production of Monascus pigments and Monacolin K in mutant strains
由表3可知,突变株每次传代后的红曲色素和Monacolin K产量均低于第1代突变株,降低幅度不定。两种产物综合考虑,其中QH12突变株降幅均较小,遗传性能比较稳定,因此选择该菌株作为继续研究的菌株。
方春玉等[11]采用物理(紫外、超声波、微波)诱变和化学(氯化锂)诱变相结合的方式对红曲进行诱变,诱变菌株产红曲色素的能力提高了约3倍。孙嘉龙等[12]采用紫外线照射45 s、氯化锂1.0‰的诱变剂量对红曲菌株进行复合诱变,筛选出高产Monacolin K的红曲突变菌株,其Monacolin K产量是原始菌株Monacolin K含量的3.3倍,且连续传接4代Monacolin K产量稳定。罗定军等[13]将Monacolin K产生菌采用紫外线(UV)和氯化锂(LiCl)对其原生质体进行复合诱变,经原生质体再生,获得高产菌株BTL23,BTL56,Monacolin K的产量比原来提高23.3%,并将高产菌株BTL23成功用于红曲Monacolin K的实际生产。而本研究采用紫外诱变2 min、氯化锂浓度0.6‰对红曲霉菌株QH进行复合诱变,得到高产红曲色素和Monacolin K且遗传性能稳定的突变菌株QH14,与以上研究结论有异曲同工之处,故说明采用紫外-氯化锂对红曲霉菌株进行复合诱变是合理、有效、有依据的。
3 结论
本文对5株原始红曲霉菌产红曲色素和Monacolin K的能力进行测定,其中红曲霉QH的红曲色素较高,Monacolin K产量最高,对其进行紫外-氯化锂复合诱变筛选高产红曲色素和Monacolin K的突变菌株。得到最佳诱变条件:紫外诱变时长2 min,氯化锂浓度0.6‰。经过菌落形态初筛,红曲色素和Monacolin K含量检测复筛,以及遗传稳定性实验,得到了高产红曲色素和Monacolin K且遗传稳定性能好的突变菌株QH12,其红曲色素色价达到2450 U/g,是原始菌株的1.84倍;Monacolin K产量达到1.68 mg/g,是原始菌株QH的4.67倍,两种代谢产物较原始菌株均有所提高。本文为高产红曲色素和Monacolin K工程菌株提供了有效的菌种资源,对红曲中色素和Monacolin K的学术研究具有意义。
[1]李东,谢静,王敏,等.红曲起源新考[J].中药材,2007,30(4):484-487.
[2]童群义.红曲霉产生的生理活性物质研究进展[J].食品科学,2003,24(1):163-167.
[3]李雪梅,沈兴海,段震文,等.红曲霉代谢产物的研究进展[J].中草药,2011,42(5):1018-1025.
[4]翟鹏贵,赵珺彦,周大兴,等.中药红曲复方制剂降脂作用的实验研究[J].浙江中医药大学学报,2012,36(1):70-72.
[5]王玲,吴军林,吴清平.红曲降血脂功能的研究及应用概况[J].食品工业科技,2014,35(8):387-390.
[6]Endo A.Monacolin K,a new hypocholesterolemic agent that specifically inhibits 3-hydroxy-3-methylglu-larylcoenzyme A reductase[J].Antibitics,1980,33(3):334-336.
[7]曹军卫,马辉文.微生物工程[M].北京:科学出版社,2002.
[8]朱效刚.红曲功能性成分分析及发酵法生产的研究[D].无锡:江南大学,2005.
[9]胡文效,魏彦锋,蒋锡龙,等.高产Monacolin K红曲霉菌种的诱变选育及液态发酵工艺优化[J].食品工业科技,2013,34(24):296-301.
[10]GB 1886.19-2015,食品添加剂 红曲米[S].
[11]方春玉,周健,邓静,等.高产红曲色素的紫红红曲霉诱变育种技术研究[J].中国酿造,2008,27(23):19-21.
[12]孙嘉龙,邹晓,刘爱英,等.高产Monacolin K红曲菌株的复合诱变选育[J].菌物学报,2007,26(4):507-516.
[13]罗定军,周兴挺.洛伐他汀产生菌原体质体诱变育种及发酵配方优选的研究[J].中国抗生素杂志,2000,25(5):339-340.

