浅析药物晶型发明专利创造性评判标准的中美差异
郑希元 张 英
固体物质由于分子结构的构型、构象、分子排列、分子作用力、共晶物质等各种因素影响,致使分子晶格空间排列不同,形成两种或两种以上不同的晶体结构,这种现象被称为“多晶现象”(Polymorphism Phenomenon)或“同质异晶现象”。“多晶现象”在固体药物中广泛存在,同一药物的不同晶型之间理化性质可能存在差异,如外观、密度、硬度、熔点、溶解度、稳定性、溶出度、溶出速率、生物利用度等方面可能会有显著不同,此现象在口服固体制剂上表现得尤为明显。①王先恒,许巧珊,赵长阔. 基于专利分析的我国药物晶型进展研究[J]. 中国新药杂志, 2017, 26(8): 845-850.
开发新的药物晶型是延长药物基础专利保护期的重要手段,通常将产生额外的专利保护期限4~6年,②Kapczynski A, et al., Polymorphs and Prodrugs and Salts (Oh My!): An Empirical Analysis of “Secondary Pharmaceutical Patents”PLOS ONE, 2012; 7(12): e49470.国外大型制药企业往往通过多种晶型专利设置专利壁垒,稳固自己的市场地位,近年来因晶型引发的无效诉讼案件逐年增多。本文拟对中美两国药物晶型发明专利的创造性评判标准进行比较并对相关案例进行解析,以期为我国制药企业的药物晶型的专利布局和维护专利稳定性提供借鉴。
一、美国专利商标局(USPTO) 的评判标准
USPTO 在2015年版《专利审查程序手册》(MPEP)2143.I中指出有七种情况均可导致“显而易见”,其中第五种为“显易尝试(obvious to try)”,即“从确定的有限数目的、可以预料的解决方案中选择,并具有合理的可预期的成功”。因“显易尝试”导致发明“显而易见”的判断原则是:本领域普通技术人员在其掌握的技术范围内有足够的理由寻找到该公知的选择,如果导致可预见的成功,则其不是创新的结果,而是常规技术和公知常识的产物。
“显易尝试”起源于美国联邦最高法院2007年的KSR案,典型案例如美国辉瑞公司的专利降血压药苯磺酸氨氯地平(US4879303)。辉瑞公司发现苯磺酸盐氨氯地平相比于其他形式的盐具有更好的制药特性(如黏性降低、稳定性提高),并且在治疗效果上与已知氨氯地平一致。案件的核心问题是判断苯磺酸氨氯地平相对于已知的氨氯地平是否具有“非显而易见性”。地区法院认为:形成苯磺酸氨氯地平的结果具有不可预见性,因此是“非显而易见”的。然而,联邦巡回上诉法院(CAFC)驳回了将“不可预见性”等同于“非显而易见性”的观点,认为本领域普通技术人员在氨氯地平的可加工性方面遇到困难时,会寻求成盐,并且有能力将潜在的盐的范围缩小到制药上可接受的公知的53种阴离子(其中包括苯磺酸根阴离子)。这是形成“合理的成功预期”可接受的数量,是“显易尝试”。在该数量范围内进行试验,有望筛选获得涉案专利化合物。因此,上诉法院作出判决,认为苯磺酸氨氯地平专利基于“显而尝试”而无效。③张晓东,傅利英. 美国专利审查中的“显易尝试”标准及对我国的启示[J]. 中国医药工业杂志, 2013, 44(5): 533-537.
此外,美国《专利审查程序手册》2144.04.VII中指出:纯的物质与不怎么纯或不纯的物质相比是具备新颖性的,因为纯的物质和不纯的物质之间存在差异。因此,问题在于涉及纯的材料的权利要求相对于现有技术而言是否是非显而易见的。In re Bergstrom, 427 F.2d 1394, 166 USPQ 256 (CCPA 1970),更纯形式的已知产品可能是可授予专利权的,但是仅仅产品的纯度本身不会使产品非显而易见。在确定已有产品的纯化形式相对于现有技术是否是显而易见的时所要考虑的因素包括所要求保护的化合物或组合物是否具有与现有技术中密切相关的物质相同的用途,以及现有技术是否暗示所要求保护的物质的特定形式或结构或者获得该形式或结构的合适方法。In re Cofer, 354 F.2d 664, 148 USPQ 268 (CCPA 1966),涉及化合物的自由流动(free-flowing)晶型的权利要求相对于公开了黏稠液体形式的相同化合物的对比文件而言是非显而易见的,因为现有技术的记载没有暗示所要求保护的结晶形式的化合物或者如何获得这种晶体。④Manual of Patent Examining Procedure (MPEP), Ninth Edition, Revision 07.2015, Last Revised November 2015. The United States Patent and Trademark Office [EB/OL]. [2017-09-05]. https://www.uspto.gov/web/offices/pac/mpep/index.html.
二、USPTO的评判实例
(一)“阿莫达非尼”的专利申请及侵权诉讼
阿莫达非尼(Armodafinil)(CRL 40982;CEP 10952)⑤阿莫达非尼. MedChem Express [EB/OL]. [2017-09-05]. www.medchemexpress.cn/armodafinil.html?src=bd-product.的化学名称为(-)-2-[R-二苯甲基亚硫酰基]乙酰胺,是仅由外消旋药物莫达非尼的活性(-)-(R)-对映体构成的对映体药物,其也被称作为(-)-莫达非尼((-)-modafinil或 R-modafinil)。Cephalon公司就阿莫达非尼I型晶体(CRL 40982 FORM I)申请了美国专利,并于2006年11月7日获得授权(US7132570B2),2007年6月15日美国食品药物监督管理局(FDA)批准阿莫达非尼作为药物上市。Cephalon公司以商品名Nuvigil®销售阿莫达非尼片剂,用于改善伴有阻塞性睡眠呼吸暂停、发作性睡病、倒班睡眠障碍的嗜睡患者的觉醒状态,其中活性药物成分(API)使用I型阿莫达非尼多晶型。⑥阿莫达非尼. WIKIPEDIA, The Free Encyclopedia [EB/OL]. [2017-09-05]. https://en.wikipedia.org/wiki/ armodafinil.
授权专利US7132570 B2的权利要求书的中文译文如下所示:
1. 一种多晶型的莫达非尼的左旋对映异构体,其产生包括在以下晶面间距处的强度峰的粉末X射线衍射光谱:8.54、4.27、4.02、3.98(Å)。
2. 根据权利要求1所述的莫达非尼的左旋对映异构体,其中所述多晶型产生进一步包括在以下晶面间距处的强度峰的粉末X射线衍射光谱:13.40、6.34、5.01、4.68、4.62、4.44、4.20、4.15、3.90、3.80、3.43(Å)。
3. 一种多晶型的莫达非尼的的左旋对映异构体,其产生包括在15.4、31.1、33.1和33.4度2θ处的反射的粉末X-射线衍射光谱。
4. 根据权利要求3所述的莫达非尼的左旋对映异构体,其中所述多晶型产生进一步包 括 在 9.8、20.8、26.4、28.3、28.7、29.9、31.6、32、34.1、35.1和39度2θ处的反射的粉末X-射线衍射光谱。
5. 一种包含根据权利要求1至4任一项所述的莫达非尼的左旋对映异构体的药物组合物。
6. 一种基本上由根据权利要求1至4任一项所述的莫达非尼的左旋对映异构体构成的药物组合物。
7. 一种(-)-莫达非尼的I型多晶型物。
8. 一种包含根据权利要求7所述的(-)-莫达非尼的I型多晶型物的药物组合物。
9. 一种基本上由根据权利要求7所述的(-)-莫达非尼的I型多晶型物构成的药物组合物。
10. 一种用于制备(-)-莫达非尼的I型多晶型物的方法,包括以下步骤:
(a)提供溶解在热溶剂中的(-)-莫达非尼溶液;
(b)快速冷却来自步骤(a)的所述溶液以产生晶体;
(c)过滤所述晶体;
(d)干燥所述晶体;以及
(e)获得(-)-莫达非尼的所述I型多晶型物的所述晶体,其中步骤(a)的所述溶剂选自水、甲醇、无水乙醇、无水乙醇加3%水(v/v)、以及用甲苯加3%水变性的乙醇(v/v,基于乙醇和甲苯的总体积)。
(二)实质审查阶段
在实质审查阶段,审查员指出:权利要求1至9(修改后的权利要求78~86)相对于对比文件(US4927855)缺乏新颖性和创造性,具体地US4927855教导了(-)-莫达非尼(参见第1栏第61~62行)并且公开了由乙醇重结晶得到(-)-莫达非尼(总产率为32%)以及(-)-莫达非尼以白色晶体的形式存在(参见第3栏第50~52行),并且US4927855所描述的结晶方法与该申请的结晶方法相类似,因而可以合理预期I型(-)-莫达非尼的成功获得而缺乏相反的证据。
申请人并不同意该审查意见,在意见陈述中,申请人指出:为了确定所要求保护的发明的表见显而易见性(prima facie obviousness),现有技术必须教导或暗示权利要求的所有限定。MPEP§2143.03(引用In re Royka, 490 F. 2d 921 (CCPA 1974)),关于所要求保护的(-)-莫达非尼I型多晶型物,US4927855没有任何明确的或固有的教导或暗示。尽管该对比文件指出(-)-莫达非尼的结晶形式是从制备I中获得的,但它并不表示产物是否是多晶型或是其他的某些结晶形式。US4927855完全没有提及任何可用于鉴定(-)-莫达非尼特定多晶型的X射线衍射数据。事实上,US4927855甚至没有暗示(-)-莫达非尼可以以不同的多晶型物存在,更不用说描述作为该申请的权利要求的主题的(-)-莫达非尼的特定的I型多晶型物。因此申请人指出,US4927855没有教导或暗示该申请的权利要求提出的所有限定,并不能使所要求保护的主题是表见显而易见的。
该案的情况类似于In re Cofer, 354 F.2d 664(CCPA 1966)案件中所呈现的情况。在该案件中,审查员和上诉委员会(the Board)均宣称:“仅仅改变已有产品的形式、纯度或其他特性,但仍然保持与已有产品相同的效用,无法使所要求保护的产品具有可专利性。”然而,海关和专利上诉法院(CCPA)驳回了上述意见,因为上诉委员会“未能处理在确定主题作为一个整体是否是显而易见的时必须给予重视的其他因素,即现有技术是否暗示化合物或组合物的特定结构或形式以及获得该结构或形式的适当方法”。法院还指出:“该记载无法支持以下观点:本领域技术人员应该知道[该化合物]会以结晶形式存在或者会知道如何获得这种晶体。”
对于该申请的审查意见中提出的反对意见,申请人也有与In re Cofer中法院相同的看法。US4927855甚至没有教导(-)-莫达非尼可以以多晶型存在,更不用说该申请权利要求中列举的特定形式,或者也没有为本领域技术人员提供如何获得这样的多晶型物的任何指导。
此外,在In re Cofer中法院的观点并不孤立,并且在之后的案件中也得以遵循并得出了类似的结果。例如,在In re Irani, 427 F. 2d 806 (CCPA 1970)的案件中,所讨论的专利的权利要求涉及更纯形式的现有技术产品。CCPA发现:与现有技术的产品相比,所要求保护的(新)形式没有表现出任何预料不到的不同特性,也没有在性能或效用方面表现出任何可授予专利权的显著变化。尽管如此,法院依照In re Cofer,认定所要求保护的晶型是非显而易见的,因为“法院无法确信对比文件的记载会导致本领域普通技术人员预期[化合物]会以结晶形式存在,或以无水形式存在,或者相信(assum[e])以下预期:对比文件会使能够产生这种[化合物]的方法显而易见。”
同样,联邦巡回上诉法院在一个未公布的意见中,依赖于In re Cofer认定:涉及结晶一水合物形式的头孢羟氨苄一水合物的权利要求是非显而易见的。参见Bristol-Myers Co. v. ITC, 15 U.S.P.Q.2d 1258 (Fed.Cir.1989)。如法院所述,“现有技术示出的一些(但不是全部)化学家能够修改的方法对于生产[所要求保护的]晶型是不充分的。在现有技术中必须存在暗示或教导:无论是通过操作还是通过[引用的现有技术]的方法,或者通过任何其他方法,能够或应当制造出[所要求保护]的晶体结构”。由于该记载未能示出“现有技术存在制造新的一水合物会是显而易见的肯定的暗示或教导”,而不仅仅是对于这样做不存在任何障碍,因此法院认定所要求保护的一水合物是可授予专利权的。
US4927855未能教导或暗示(-)-莫达非尼可以以在审的权利要求提出的晶型存在,也未能教导或暗示所要求保护的晶型能够或应当被制造,也未能教导或暗示任何这样做的方法。因此,该申请的事实与上述的In re Cofer、In re Irani和Bristol-Myers v. ITC的事实相似。在上述每一个案件中,法院都认定:由于缺乏与权利要求所限定的发明相似的启示或暗示,因此所要求保护的主题是非显而易见的。申请人尊敬地表示,对于该申请的事实,得出同样的结论是适当的。因此,权利要求1~9(修改后的权利要求78~86)相对于对比文件(US4927855)具备创造性。
最终,USPTO的审查员接受了申请人的上述答复意见,权利要求1~10(修改后的权利要求78~87)获得授权。
(三)侵权诉讼阶段
2009~2010 年,Watson、Sandoz、Lupin 和Apotex四家公司分别向FDA提交了简略新药申请(Abbreviated New Drug Application,ANDA), 拟在US7132570专利期限届满前生产、使用、许诺销售、销售仿制的阿莫达非尼产品。在提交的ANDA中,上述公司声称US7132570无效,不具有执行力,因此所提交的ANDA不侵权,且上述公司已将其ANDA告知了Cephalon公司。Cephalon公司分别对上述公司的行为提起侵权诉讼,侵权行为涉及US7132570的权利要求6和9,美国特拉华州地区法院对四起诉讼集中处理。⑦赵菁,劳芳. 晶型转变引发的专利诉讼[J]. 中国发明与专利, 2016, 9, 123-126.现将法院的部分判决内容摘录如下。⑧In re Armodafinil Patent Litigation Inc. (‘722 Patent Litigation), 939 F.Supp.2d456 (D. Del. 2013). LEAGLE [EB/OL]. [2017-09-05]. http://www.leagle.com/decision/In%20FDCO%2020130403990/IN%20RE%20ARMODAFINIL%20PATENT%20 LITIGATION%20INC.
1.关于制备I型阿莫达非尼是否属于“显易尝试”
被告基于通过“显易尝试”实验以制备阿莫达非尼的最稳定形式的抗辩不足以证明I型会是显而易见的。“显易尝试”并不是在任何情况下都等同于显而易见,特别是在该案中,现有技术仅仅提供了最普通的动机以在明显不可预知的领域进行试验和错误实验。更确切地说,审理KSR案(“显易尝试”起源于KSR案)的法院并没有建立以下假设:已经存在于有用知识背景领域中的所有实验都是‘显易尝试’的,而无须考虑科学或技术的本质。在某种程度上,艺术(art)是不可预知的,而化学艺术(chemical art)经常也是如此,KSR案的焦点在于:对于专利挑战者来说,确定的可预测的解决方案是否可以代表困难的障碍(difficult hurdle),因为潜在的解决方案不太可能是真正可预测的。在实验是不可预测的情况下,如此发明会是非显而易见的,而并非如被告所声称的“(其属于)常规药物开发的结果,而不是发明”。
具体来说,美国联邦巡回上诉法院已经澄清:当技术人员不得不进行以下行为时,“显易尝试”也是非显而易见的:(1)“改变所有参数或尝试各种可能的选择直到达到一种可能成功的结果为止,其中现有技术并没有给出哪些参数是关键的任何指示,或者也没有给出多种可能的选择中哪一个可能是成功的任何指示”;或(2)“探索一种新技术或者似乎是有希望的实验领域的一般方法,其中现有技术仅仅对所要求保护的发明的具体形式或如何实现它给出了一般性指导。”参见In re O'Farrell, 853 F.2d 894, 903 (Fed.Cir.1988)和In re Kubin, 561 F.3d at 1359-60。
被告争辩:US4927855公开了乙醇作为制备和分离阿莫达非尼的重结晶溶剂,使得本领域技术人员不必在多种溶剂之间进行选择以获得I型。然而,法庭认定:这一争辩是基于不允许的后知之明的分析,因为在2002年本领域普通技术人员并不会知道是否存在I型,而且也不能知晓利用任何溶剂生产I型的方法。本领域技术人员仅在US7132570之后才会知晓该方法,该专利确认了I型阿莫达非尼并详细描述了在缓慢冷却条件下从乙醇中重结晶I型的方法。被告也不能通过非现有技术的实验来确立显而易见性的事实,而必须证明所要求保护的发明“在发明完成时会是显而易见的”。在审判过程中提呈的证据表明结晶和多态性测试的结果是不可预测的,这需要采用大量可变条件的结晶实验。因此,即使采用结晶实验的一般构思是显易尝试的,但是这种不可预测的试验和错误实验无法使I型成为显而易见的,因为所需的测试不仅仅是简单的例行程序。
2.关于US4927855是否隐含地公开I型阿莫达非尼
尽管制备I被描述为“从乙醇中重结晶”的“白色晶体形式”,但是对于该晶体是否可以是或可以不是溶剂化物、水合物、多种物质的混合物或不同形式的阿莫达非尼,US4927855并没有作出任何说明。另外,除了描述“从乙醇中重结晶”之外,US4927855并没有具体涉及可用的大量结晶条件中的任何一种。关于可能产生I型的热条件,US4927855也没有提供任何指示。
此外,US4927855所记载的制备I物质的熔点没有表明阿莫达非尼是否可以是多晶型的以及是否与溶剂化物的物质是一致的。有证据表明,溶剂化物的存在并不是假设的,因为后来发现可以形成阿莫达非尼的乙醇溶剂化物。因此,US4927855公开的由乙醇制备的“白色晶体”不会提示本领域技术人员阿莫达非尼是多晶型的。不如说,“白色晶体”并没有公开超出描述物质之外的任何信息。
3.审判决定
审判长Gregory M. Sleet认定,被告没有清楚并令人信服地表明:(专利)所要求保护的阿莫达非尼晶型是实践现有技术专利“必要的并且不可避免的结果”。法院进一步认定,US7132570所要求保护的阿莫达非尼的多晶型对于本领域普通技术人员来说是非显而易见的。
审判长Sleet禁止被告制造、使用、许诺销售或销售它们仿制的阿莫达非尼ANDA产品,此外还在覆盖Nuvigil®的Cephalon公司专利期限届满之前禁止FDA批准被告的ANDA。
三、国家知识产权局(SIPO)的评判标准
《专利法》第22条第3款指出:创造性,是指与现有技术相比,该发明具有突出的实质性特点和显著的进步。
《专利审查指南》(2010版)第二部分第十章6.1节指出:(1)结构上与已知化合物不接近的、有新颖性的化合物,并有一定用途或者效果,审查员可以认为它有创造性而不必要求其具有预料不到的用途或者效果;(2)结构上与已知化合物接近的化合物,必须要有预料不到的用途或者效果。此预料不到的用途或者效果可以是与该已知化合物的已知用途不同的用途;或者是对已知化合物的某一已知效果有实质性的改进或提高;或者是在公知常识中没有明确的或不能由常识推论得到的用途或效果。⑨中华人民共和国国家知识产权局.专利审查指南2010[M]. 北京: 知识产权出版社, 2010:284-285.
四、SIPO的评判实例
【实例1】 无锡药兴医药科技有限公司与北京天衡药物研究院关于四苄基伏格列波糖专利权无效的行政纠纷案
授权专利1“四苄基伏格列波糖的结晶及制备方法”(专利权人:无锡药兴医药科技有限公司,专利号:ZL200610061713.4,授权公告号:CN100393694C)的权利要求1为:
1.一种结晶形式的四苄基伏格列波糖,其化学名为(1S)-(1(羟基),2,4,5/1,3)-2,3,4-三 -氧 -苄基 -5-[(2-羟基 -1-(羟甲基)乙基)氨基]-1-碳-苄氧基甲基-1,2,3,4-环己烷四醇,结构式如下所示:
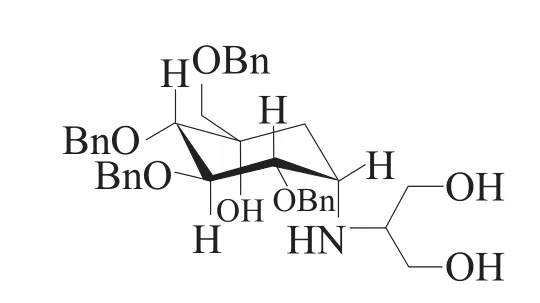
其特征为:
具有图5所示的四苄基伏格列波糖结晶粉末的X-射线衍射图;
具有图6所示的差示扫描量热分析图;
具有图7 所示的红外光谱图特征。
无效请求人北京天衡药物研究院提交的证据1:US4824943的实施例6公开了中间体四苄基伏格列波糖的制备方法,并公开了经硅胶柱层析用乙酸乙酯洗脱,制备得到白色粉末状的四苄基伏格列波糖的纯化方法;实施例7公开了目标产物伏格列波糖的制备方法,该目标产物经乙醇处理析出无色结晶。
授权专利1的权利要求1与证据1的区别在于,权利要求1保护的是具有某种具体结晶形式的四苄基伏格列波糖,而证据1没有公开其白色粉末状四苄基伏格列波糖的堆积形态。该专利中并未提及现有技术存在固体形态的四苄基伏格列波糖。因此,该案的焦点在于:现有技术中是否存在制备结晶形式的四苄基伏格列波糖的技术启示。
关于此案,国家知识产权局专利复审委员会以及一审、二审法院均认为:某种化合物是否存在晶体形式、存在多少种晶体形式以及存在何种晶体形式是客观的,且晶体一般是对已知化合物采用常规结晶方法后得到的必然产物,因此,只要某种化合物确实存在采用常规结晶方法就能够获得的晶体,本领域的技术人员如果想要获得该化合物的晶体,并不需要创造性的劳动就可以获得。对于本领域的技术人员来说,存在制备晶体形式化合物的普遍动机,若发明方式采用的制备方式是本领域的常规技术手段,则由已知化合物制备获得该化合物的晶体是显而易见的,除非所述晶体具备预料不到的技术效果,否则晶体产品不具备创造性。⑩劳芳,赵菁等. 从专利无效、行政诉讼的案例看药物晶型的创造性[J]. 中国发明与专利, 2016(2): 110-115.
最终专利复审委员会作出授权专利1的包括权利要求1在内的所有权利要求全部无效的审查决定,一审、二审法院维持了国家知识产权局专利复审委员会所作的无效宣告请求审查决定。
【实例2】无效宣告请求审查决定(第31365号)
授权专利2“合成伊伐布雷定及其与药学上可接受的酸的加成盐的新方法”(专利权人:法国施维雅药厂,专利号:ZL200510051779.0,授权公告号:CN1305856C)的权利要求15为:
15.α晶型的式(Ia)伊伐布雷定盐酸盐:
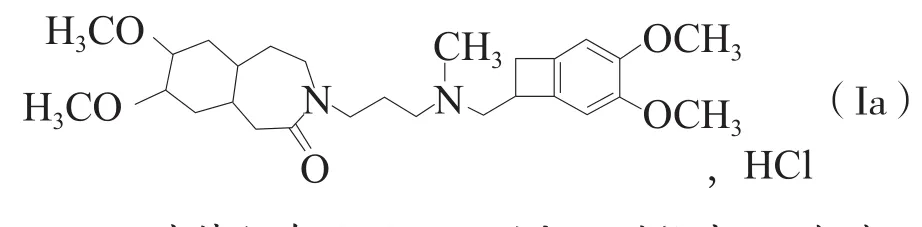
其特征在于用……测定下列粉末X-射线衍射图谱,以射线位置(Bragg’s角度2θ,用度表示)、射线高度(以计数表示)、射线面积(以计数×度表示)、半高射线宽度(“FWHM”,以度数表示)和晶面距离d(以Å表示)来表示:
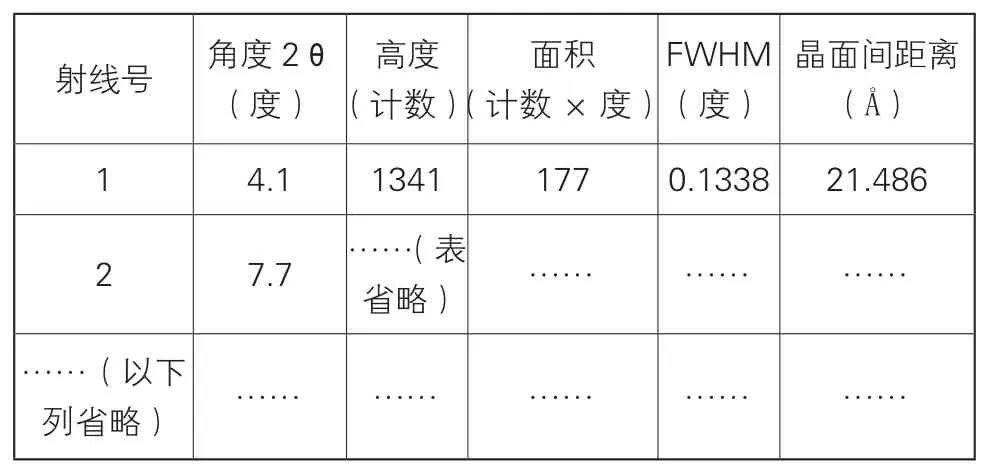
无效请求人江苏恒瑞医药股份有限公司提交的证据1:US5296482A的实施例2公开了一种伊伐布雷定盐酸盐的化合物的制备方法,并且具体公开了:(+)-7,8-二甲氧基-3-{3-{N-[(4,5-二甲氧基苯并环丁烷-1-基)甲基]-N-(甲基)氨基}丙基}-1,3,4,5-四氢-2H-3-苯并氮杂-2-酮单盐酸盐,具体公开了将14.9 mL 0.1N HCl加入到0.7 g( +)-7,8-二甲氧基-3-{3-{N-[(4,5-二甲氧基苯并环丁烷-1-基)甲基]-N-(甲基)氨基}丙基}-1,3,4,5-四氢-2H-3-苯并氮杂-2-酮中,全体搅拌,过滤,浓缩,并从5 mL乙腈中进行重结晶,得到0.5 g对应的单盐酸盐(产率55%),熔点(瞬时)135~140℃。
授权专利2的权利要求15与证据1的区别在于,权利要求15限定了伊伐布雷定盐酸盐的具体的晶型以及XRD数据,而证据1实施例2没有公开其具体的晶型,也没有相应的粉末衍射图谱。
关于此案,国家知识产权局专利复审委员会认为:除了授权专利2的说明书第4页第4段描述了“按照本发明的方法生成的伊伐布雷定盐酸盐的晶体为α-形 —— 其轮廓分明,可完美再现,并且就过滤、干燥、稳定性和方便配制而言,这是特别有价值的特性”之外,授权专利2的说明书中没有记载晶型α是否具有其他与效果相关的性能,尤其是没有记载在制备药物组合物时晶型α性能有何不同。因此,授权专利2的权利要求15相对于证据1并未取得更好的效果,其实际解决的技术问题仅仅是提供一种具有不同晶型的伊伐布雷定盐酸盐晶体。对于本领域技术人员而言,已知许多有药用价值的化合物呈现出多晶型现象,对药物化合物进行晶体学研究,是药物设计研究的重要内容。多晶型现象在本领域中是一种普遍存在的现象。对于多晶型药物的研究,本领域中采用重结晶法制备多晶型药物的技术也已相对成熟。因此,本领域技术人员出于寻找制备过程更为方便快捷或提高药物化合物稳定性的目的,有动机结合其他现有技术和公知常识进行其他晶型的实践尝试,选择性质更优的晶型,继而对所获晶体的具体技术参数(例如X射线衍射图谱)进行测定,从而形成授权专利2的权利要求15的技术方案,其效果差异也是可以预见的。
最终专利复审委员会作出授权专利2的包括权利要求15在内的权利要求15~20无效的审查决定。
五、中美之间的差异及启示
在美国,联邦巡回上诉法院已经注意到:就结果是预料不到的而言,药物是一种“不可预测的艺术”,但是它也认识到:根据KSR案,“有限数量的已确定的可预测的解决方案或替代方案”的证据可以支持显而易见的推论(参见Eisai Co. Ltd. v. Dr. Reddy's Labs. Ltd., 533 F.3d 1353, 1359 (Fed.Cir.2008))。因此,评判晶型药物的创造性时,美国审查员和法官似乎并不关注于预料不到的技术效果,而主要关注于从药物本身的结构出发,综合现有技术中关于该药物是否存在其他已知晶型以及是否存在结晶方法、条件的教导,考量制得某种特定晶型的成功预期高低,进而得出结论。
然而,在中国,审查员和法官一般认为:药物多晶型现象在本领域中是普遍存在的现象。对于本领域的技术人员来说,存在制备晶体形式化合物的普遍动机。当所要求保护的发明相对于现有技术的贡献仅是提供了一种新的晶型,但该晶型并不具有预料不到的技术效果时,则该晶型通常不能被认为是非显而易见的。因此,评判药物晶型的创造性时,中国审查员和法官主要关注于新晶型是否具有预料不到的技术效果。
笔者通过比较中美两国药物晶型专利的创造性评判标准并对相关案例进行解析,以期为我国制药企业对于晶型药物的专利布局和维护专利稳定性提供借鉴。
由于中美两国关于药物晶型的创造性评判标准存在差异,我国制药企业若要在本国获得有关晶型的专利授权并维持权利要求的稳定,在专利申请文件中不仅需要记载化合物新的晶型的确认数据,还需要记载能够证明新的晶型所具有的效果的各种具体的实验数据,例如:稳定性、水中的溶解度、生物利用度、生物活性、可加工性、溶出度、溶出速率等,以满足创造性评判中对于“新的晶型需具有预料不到的技术效果”的要求。
而当我国制药企业针对晶型药物拟向美国提交专利申请时,则应当对新晶型的各种技术效果进行充分和深入的研究,并将实验数据结果详尽地记载于原始申请文件中以呈现新晶型的有益甚至预料不到的技术效果,并对与该申请相关的药物化合物的晶型研究情况进行深入的调查和研究;当面对关于药物晶型的创造性的审查意见时,应结合药物化合物本身的结构特点,从不同的角度对创造性进行争辩,例如现有技术是否教导了该药物化合物存在多晶型现象、通过常规实验和技术能否获得该新晶型以及结晶实验中是否使用了大量可变条件、对于找到新晶型是否有合理的成功预期等,从而使药物晶型专利获得授权。

