牡蛎内脏多糖抗氧化活性及对四氯化碳所致小鼠急性肝损伤的影响作用
,,,
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
多糖广泛存在于动物、植物及微生物中,是构成生命体的基本物质。目前国内外已从多种海洋动物体中提取到多糖成分,海洋动物多糖具有广泛的生物活性。相比来源于陆生植物多糖及化学合成的多糖,海洋动物多糖具有毒副作用小、药物效果较好的优点[1]。朱森君[2]从单环刺螠内脏中提取到一种具有抗氧化活性的多糖。黄璐[3]从鲍鱼性腺中分离得到一种具有调控BMP-2活性的多糖。Shi等[4]从牡蛎中分离得到一种保肝多糖。曲敏等[5]从大鲵体中得到一种具有保肝效果的低聚糖肽。
牡蛎是全球最大养殖贝类,也是我国重要的经济养殖贝类之一。牡蛎的功效作用主要体现在增强免疫力、降血糖、抗氧化等方面,临床上使用牡蛎治疗慢性中耳炎、子宫肌瘤、失眠等症状具有较好的疗效[6]。牡蛎中含有大量的多糖,牡蛎多糖在抗肿瘤、抗凝血、抗疲劳和增强免疫力等方面都具有较好的生物活性。王俊[7]提取牡蛎多糖具有增强小鼠免疫和抗肿瘤能力。马卫卫[8]发现牡蛎多糖能增强小鼠胃肠组织的消化能力。胡婷[9]提取了一种具有降血脂、抗凝血的牡蛎多糖。而牡蛎内脏约占整个牡蛎的40%,其含有丰富的蛋白质、脂肪及碳水化合物,但大部分被丢弃,造成了极大的资源浪费[10]。目前对牡蛎内脏的研究报道较少,本文利用废弃的牡蛎内脏制备得到牡蛎内脏多糖(CGOP),以DPPH自由基、ABTS自由基、羟基自由基和FRAP还原能力作为抗氧化模型,评价其抗氧化活性,并研究了CGOP对四氯化碳致小鼠急性肝损伤的保护作用,以期为牡蛎内脏的开发利用提供科学依据。
1 材料和方法
1.1 材料与仪器
牡蛎 大连长兴水产市场,取其内脏备用;SPF级雄性昆明小鼠(体重18~22 g) 大连医科大学实验动物中心[SCXK(辽)2008-0002];联苯双脂滴丸(批号160701) 北京协和药厂;谷丙转氨酶(ALT)测定试剂盒、谷草转氨酶(AST)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒、丙二醛(MDA)测定试剂盒、考马斯亮蓝蛋白质测定试剂盒 南京建成生物工程公司;DPPH、ABTS 美国Sigma公司;胰蛋白酶(potency ≥2500 units/mg) 上海麦克林公司;其他试剂 为分析纯。
660-IR红外光谱仪 美国Agilent公司;MuLTiSJAN MK3酶标仪、Microcl 17R离心机 美国Thermo公司;DMLLLED型倒置显微镜 德国Leica公司;UV-754紫外分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 牡蛎内脏多糖(CGOP)的制备 牡蛎内脏多糖参考文献[11]方法提取。牡蛎内脏加蒸馏水匀浆,匀浆液用5%冰醋酸调整pH至8.0,加入1%胰蛋白酶粉末在45 ℃水浴中酶解4 h,酶解结束后100 ℃水浴灭酶10 min,酶解液离心(9000 r/min 10 min)得上清液,上清液加入3倍体积的95%乙醇过夜,离心(9000 r/min,10 min)得沉淀,真空冷冻干燥得到牡蛎内脏多糖。
1.2.2 总糖含量的测定及红外光谱(IR)分析 CGOP总糖含量的测定方法采用苯酚硫酸法[12]。取配制合适浓度的CGOP溶液,加入0.5 mL 6%苯酚溶液,混匀后加入2.5 mL 浓硫酸,振荡后静置30 min,以葡萄糖为标准品,蒸馏水为空白对照,490 nm波长处测定吸光值,根据标准曲线(y=0.0085x+0.0583,R2=0.9994),得到CGOP总糖含量,公式如下:
式中,C为标准曲线所得的糖浓度(μg/mL);V为样品溶液总体积(mL);M为CGOP的质量(g)。
红外光谱分析:将CGOP与KBr混合研磨,压片后在4000~400 cm-1范围内扫描检测,以KBr为扫描背景。
1.2.3 体外抗氧化实验
1.2.3.1 DPPH自由基清除 清除DPPH自由基的能力采用文献[13]报道的方法稍加改动进行计算。取不同浓度的样品溶液2 mL分别加入DPPH·乙醇溶液2 mL于试管中,混合摇匀,于室温黑暗的环境中静置30 min,在波长517 nm处测定吸光值,以无水乙醇溶液做空白,调零。DPPH清除率的计算公式如下:
DPPH·清除率(%)=1-(Ai-Aj)/Ac×100
式中,Ac:未加入样品时DPPH的吸光值;Aj:未加入DPPH时样品的吸光值;Ai:样品和DPPH混合反应后的吸光值。
1.2.3.2 羟基自由基清除 清除羟基自由基的能力参照文献[14]报道的方法。取不同浓度的样品溶液2 mL,分别加入9 mmol/L的FeSO41 mL,9 mmol/L的水杨酸-乙醇1 mL,加入8.8 mmol/L的双氧水1 mL启动反应,37 ℃下反应30 min,以蒸馏水为空白,在510 nm下测吸光值,考虑到样品本身的吸光值,取9 mmol/L的FeSO41 mL,9 mmol/L的水杨酸-乙醇1 mL,以及不同浓度的样品溶液2 mL作为本底吸收。OH清除率的计算公式如下:
·OH清除率(%)=1-(Ax-Axo)/Ao×100
式中,Ao:空白对照吸光值;Ax:加入样品溶液吸光值;Axo:未加双氧水的样品溶液吸光值。
1.2.3.3 ABTS自由基清除 清除ABTS+·测定采用文献[15]报道的方法。加入7.4 mmol/L的ABTS储液,与2.6 mmol/L的K2S2O8于黑暗室温反应12 h,再用PBS pH7.4稀释到波长734 nm处吸光值为0.70±0.02,在反应体系中,于试管中加入0.2 mL不同浓度的样品或参比溶液(pH7.4 PBS),再加入0.8 mL的ABTS反应溶液,振荡摇匀,室温下静置6 min,在波长734 nm下测吸光值。ABTS自由基清除率公式如下:
ABTS自由基清除率(%)=(1-A1/A0)×100
式中,A1:加入样品溶液吸光值;A0:对照溶液吸光值。
1.2.3.4 FRAP还原能力 还原能力的测定采用文献[16]报道的方法。吸取1 mL不同浓度的样品在试管中,分别加入2.5 mL 0.2 mol/L磷酸盐缓冲液(pH6.6),混合均匀,50 ℃水浴20 min,冷却后加入5 mL 10%三氯乙酸溶液,充分反应后离心(3000 r/min 10 min)取上清液2.5 mL,加入0.5 mL 0.1%三氯化铁溶液,10 min后在波长700 nm下测吸光值。还原能力的计算公式如下:
还原能力=A1-A2
式中,A1:加入样品溶液吸光值;A2:蒸馏水代替0.1%三氯化铁溶液的吸光值。
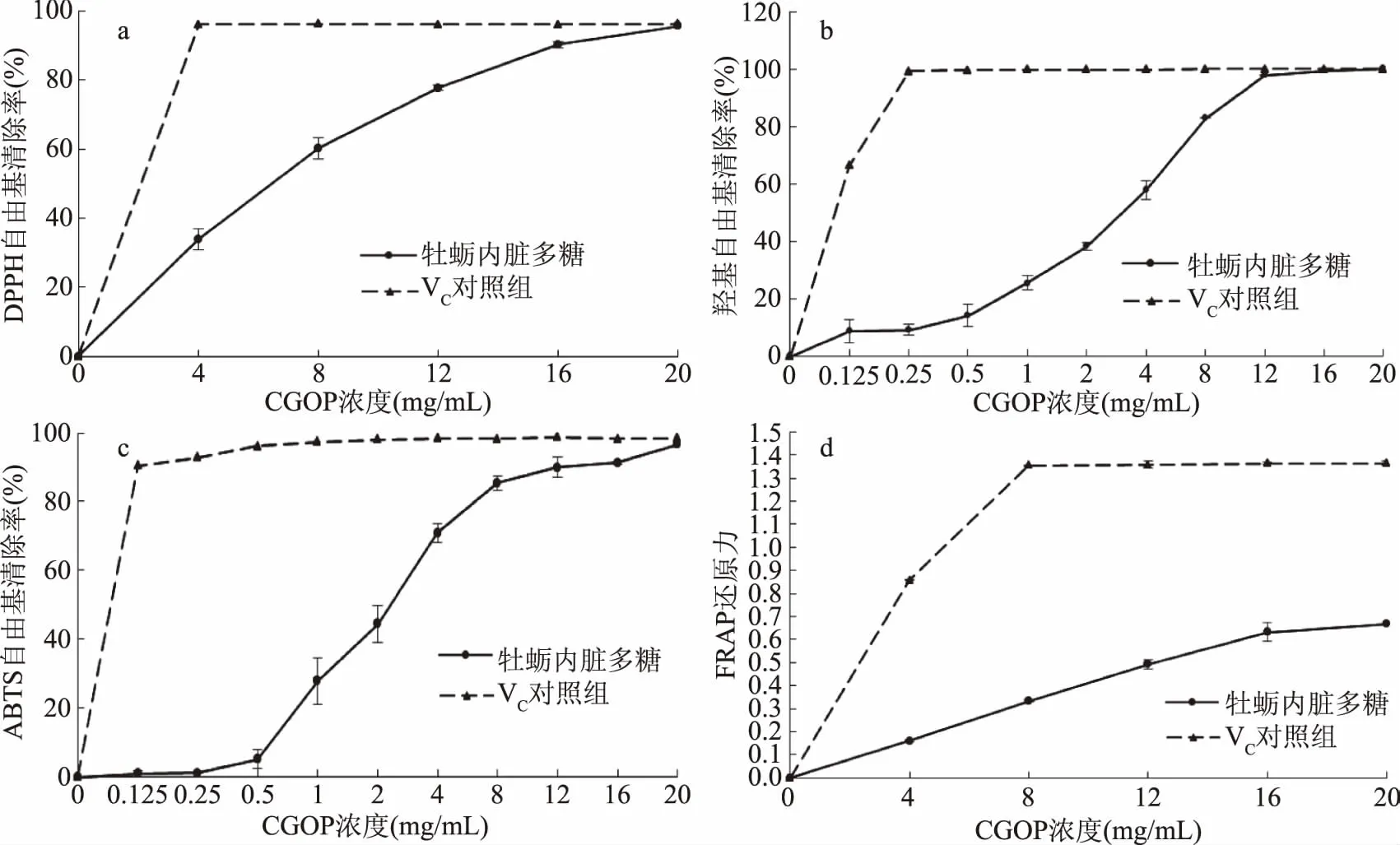
图2 CGOP抗氧化能力的测定Fig.2 Determination of antioxidant activities of CGOP注:a. DPPH自由基清除能力;b. 羟基自由基清除能力;c. ABTS自由基清除能力;d. FRAP还原能力。
1.2.4 四氯化碳致小鼠急性肝损伤模型的建立 将60只SPF级雄性昆明小鼠随机分成正常组、模型组、联苯双脂(200 mg/(kg·d))阳性对照组、牡蛎内脏多糖低浓度(200 mg/(kg·d))、中浓度(400 mg/(kg·d))、高浓度(800 mg/(kg·d))剂量组,每组10只,各组每天灌胃一次(0.2 mL),正常组和阳性对照组给予同体积的生理盐水,连续灌胃两周,于末次给药2 h后,正常组按10 μL/g腹腔注射植物油,其余各组均腹腔注射10 μL/g含0.2% CCl4植物油溶液,禁食不禁水,20 h后摘眼球取血,离心(4 ℃ 3000 r/min 10 min)得上层血清备用。处死小鼠取肝脏,肝左叶组织称取0.3 g,用生理盐水制成10%匀浆液,离心(4 ℃ 4500 r/min 10 min)得上清液备用。肝右叶组织称取0.3 g,用10%中性福尔马林溶液进行固定,石蜡包埋切片。苏木精-伊红(HE)染色,在显微镜下观察肝组织形态[17]。
1.2.5 生化指标检测 试剂盒测定小鼠血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)活性,测定小鼠肝组织匀浆液中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。
2 结果与分析
2.1 CGOP总糖含量及其红外光谱(IR)

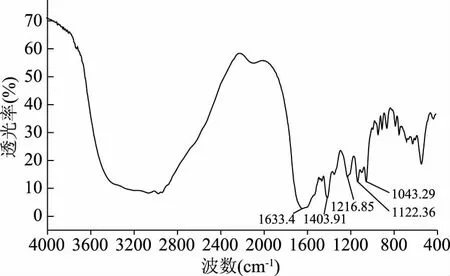
图1 牡蛎内脏多糖CGOP红外光谱Fig.1 IR spectra of CGOP
2.2 CGOP抗氧化实验
由图2a可知,CGOP对DPPH自由基具有较好的清除效果,呈现明显的剂量依赖性。在浓度为20 mg/mL时,CGOP对DPPH自由基清除率能达到95.65%。由图2b可知,CGOP在低浓度时,对羟基自由基没有明显的清除作用。当CGOP浓度达到1 mg/mL时,随着浓度的增加,羟基自由基清除率逐渐提高,在浓度为16 mg/mL时,清除率为99.41%。由图2c可知,CGOP在低浓度时对ABTS自由基基本没有清除作用,但随着浓度上升,清除率也逐渐上升,当CGOP浓度达到20 mg/mL时,清除率为96.65%。由图2d可知,随着CGOP浓度的增加,FRAP还原能力逐渐上升,呈现明显的剂量依赖性。
由上可知,CGOP具有一定程度的抗氧化效果。研究发现,多糖的抗氧化活性与其分子量大小、硫酸根含量及其连接位置等多方面有关[20]。CGOP清除4种自由基效果较好,推测可能是由于氨基己糖含量较高,因为酰胺基和酚羟基可以提升多糖的抗氧化性[21]。
2.3 CGOP对CCl4致小鼠急性肝损伤生化指标

表1 CGOP对CCl4致肝损伤小鼠的影响Table 1 Effects of CGOP on induced liver damage in mice
注:*p<0.01;#p<0.05与模型组相比。(n=10)。
CGOP对CCl4致小鼠急性肝损伤生化指标结果如表1所示,模型组各项指标均显著区别于正常组(p<0.05),表明建模成功。与模型组相比,灌胃CGOP高剂量组(800 mg/(kg·d))的小鼠血清ALT和AST指标都显著降低(p<0.05),说明高剂量组的CGOP可显著抑制由CCl4导致的血清ALT、AST活性的升高。模型组小鼠的MDA含量比正常组显著上升(p<0.05),而CGOP高剂量组MDA含量显著低于模型组(p<0. 05),说明灌胃CGOP可以降低小鼠肝组织中MDA含量。CGOP中、高剂量组SOD活性与模型组相比显著上升(p<0.01),说明灌胃CGOP也可提高肝损伤小鼠肝组织中SOD活性。
CCl4致小鼠肝损伤原理是CCl4进入肝组织细胞代谢,产生大量的自由基,从而破坏肝组织细胞。ALT和AST是肝功能的主要指标,当肝组织受损时,ALT、AST都会进入血液中,导致血清中ALT、AST活性升高[22]。同时肝损伤也会增加肝组织中SOD的消耗,导致其含量下降,并伴随着MDA的产生,MDA含量上升[23]。实验结果说明适当剂量的CGOP对CCl4致小鼠急性肝损伤有明显的保护作用。
2.4 CGOP对CCl4致小鼠急性肝损伤肝组织学
正常组小鼠肝组织细胞排列规则,细胞正常。CCl4模型组肝细胞排列紊乱,有明显的炎症、变性及坏死,细胞核不同程度的萎缩。CGOP低、中、高剂量组的肝细胞较模型组明显恢复正常,排列整齐,说明小鼠接触CCl4时,CGOP能改善小鼠肝组织细胞状态,减轻CCl4对肝组织的损伤。

图3 CGOP对CCl4诱导小鼠急性肝损伤的组织病理影响(HE×400)Fig.3 Effects of CGOP on histopathological changes of hepatic injury by CCl4 in mice(HE×400)注:a.正常组;b.CCl4模型组;c.药物组; d.CGOP低剂量组;e.CGOP中剂量组;f.CGOP高剂量组。
多糖护肝原理主要为其能有效清除自由基,减少CCl4在肝组织中产生的自由基,防止肝组织病变,例如大鲵低聚糖肽[4]、壳聚糖[24]、牛筋草[25]等。其次是多糖能改善肝损伤小鼠的生化指标,降低小鼠ALT、AST活性和MDA含量,提高SOD活性,达到减轻肝损伤的作用。还有是多糖能促进免疫细胞DNA的合成,使脾细胞和T细胞大量增殖,提高机体免疫能力。
牡蛎内脏多糖在体内外均表现出较好的抗氧化效果,推测牡蛎内脏多糖的抗氧化性可能是通过清除自由基和提高体内抗氧化酶活性途径等方面,来降低或抵御自由基对肝细胞的损伤,从而发挥抗氧化作用[26-27]。随着蛋白质组学、代谢组学、分子生物学的发展,在以后的研究中,对其抗氧化及保肝机制进行深入研究,为牡蛎的开发利用提供参考。
3 结论
本文用牡蛎内脏提取得到CGOP,并研究了其抗氧化能力,对4种氧化模型均表现出一定的抗氧化作用。20 mg/mL CGOP对DPPH自由基、ABTS自由基、羟基自由基清除率分别为95.7%、96.7%、99.4%,并且具有较好的FRAP还原能力。在CCl4导致小鼠急性肝损伤模型实验中,CGOP高剂量组(800 mg/kg·d)可显著降低血清中ALT、AST活性,明显降低肝组织中MDA含量,并提高肝组织中SOD活性。肝组织形态学观察,CGOP剂量组能减轻肝细胞肝损伤状况。本研究表明,CGOP具有较好的抗氧化能力,并且能有效保护受损的肝组织。研究结果为更充分利用牡蛎资源提供了基础数据。
[1]马慧慧. 牡蛎多糖的制备及其生物活性研究[D]. 大连:大连海洋大学,2015.
[2]牛森君,陈米娜,牛庆凤,等. 单环刺螠内脏多糖结构的分析及其对脂质过氧化物的清除作用[J]. 食品科学,2015,36(5):67-71.
[3]黄璐,王洪旭,殷廷,等. PMP-HPLC-MS分析扇贝内脏多糖的组成[J]. 食品工业科技,2015,36(7):113-117.
[4]Shi X,Ma H H,Tong C Q,et al. Hepatoprotective effect of a polysaccharide fromCrassostreagigason acute and chronic models of liver injury[J]. International Journal of Biological Macromolecules,2015,78:142.
[5]曲敏,田丽冉,佟长青,等. 大鲵低聚糖肽对四氯化碳致小鼠急性肝损伤的保护作用[J]. 食品工业科技,2013,34(14):350-352.
[6]冯丽,赵文静,常惟智. 牡蛎的药理作用及临床应用研究进展[J]. 中医药信息,2011,28(1):114-116.
[7]王俊,姚滢,张建鹏,等. 牡蛎多糖的制备及其开发利用[J]. 医学研究生学报,2006,19(3):217-220.
[8]马卫卫,黄志坚. 牡蛎多糖对热应激小鼠胃肠道抗氧化能力及酶活力的影响[C]. 第三届中国兽医临床大会,2012:392.
[9]胡婷,陈琼华. 牡蛎多糖防治心血管病及其它生物活性[J]. 中国生化药物杂志,1993,18(1):53-56.
[10]徐静. 牡蛎提取物的降血糖活性研究[D]. 济南:山东大学,2005.
[11]崔青曼,陈菁菁,袁春营,等. 四角蛤蜊糖胺聚糖的化学组成与生物学功能研究[J]. 食品工业,2013,35(4):776-785.
[12]Dubois M,Gilles KA,Hamilton IK,et al. Colorimetric method for determination of sugars and related substances[J]. Analyticcal Chemistry,1956,28(3):350-356.
[13]Yamaguchi T,Takamura H,Matoba J,et al. HPLC method for evaluation of the free radical-scavenging activity of foods by using 1,1-diphenyl-2-picrylhydrazyl[J]. Bioscience Biotechnology and Biochemistry,1998,62(6):1201-1204.
[14]Beeley J G. Glycoprotein and proteoglycan techniques,as laboratory techniques in biochemistry and molecular biology[M]. New York:Elsevier Amsterdam,1985.
[15]陈卫云,张名位,魏振承,等. 不同方法提取荔枝多糖抗氧化活性的比较[J]. 食品工业科技,2012,33(4):192-194.
[16]Qiao D L,Ke C L,Hu B,et al. Antioxidant activities of polysaccharides fromHyriopsiscumingii[J]. Carbohydrate Polymers,2009,78(2):199-204.
[17]郭国丽,陈悦,佟长青,等. 水溶性黑木耳根多糖对四氯化碳所致小鼠肝损伤的保护作用[J]. 食品工业科技,2015,36(24):341-344.
[18]Lloyd AG,Dodgson KS,Price RG,et al. Infrared studies on sulphate esters. I. Polysaccharide sulphates[J]. Biochimica Et Biophysica Acta,1961,46(1):108-115.
[19]Barker SA,Bourne EJ,Stacey M,et al. Infrared spectra of carbohydrates. Part I. Some derivatives of D-glucopyranose[J]. Journal of the Chemical Society,1954,1:171-176.
[20]Tang Y Z,Liu Z Q,Wu D. Lidocaine:An inhibitor in the free-radical induced hemolysis of erythrocytes[J]. Journal of Biochemical and Molecular Toxicology,2009,23(2):81-86.
[21]Mclaughlin J L. Paw paw and cancer:annonaceous acetogenins from discovery to commercial products[J]. Journal of Natural Products,2008,71(7):1311-1321.
[22]Comporti M. Biology of disease:lipid peroxidation and cellular damage in toxic liver injury[J]. Lab Invest,1985,53(6):599-620.
[23]姚秀芬,程栋,王承明. 花生粗多糖对四氯化碳及酒精所致小鼠急性肝损伤的保护作用[J]. 食品科学,2011,32(9):261-265.
[24]许青松,宫德正,谭成玉,等. 壳聚糖对四氯化碳致肝损伤小鼠的保护作用[J]. 中国海洋药物,2006,25(5):31-33.
[25]Iqbal M,Gnanaraj C. Eleusine indica L. possesses antioxidant activity and precludes carbon tetrachloride(CCl4)-mediated oxidative hepatic damage in rats[J]. Environmental Health and Preventive Medicine,2012,17(4):307-315.
[26]陈骞. 牡蛎糖原的提取与抗疲劳活性研究[D]. 无锡:江南大学,2005.
[27]李志. 牡蛎多糖的分离纯化及生物活性研究[D]. 福州:福建农林大学,2009.

