卡拉胶酶固体酶制剂的喷雾干燥制备工艺优化
,,,,,,,,,,*
(1.集美大学食品与生物工程学院,福建厦门 361021; 2.绿新(福建)食品有限公司,福建漳州 363100; 3.福建省海洋功能食品工程技术研究中心,福建厦门 361021; 4.厦门市海洋功能食品重点实验室,福建厦门 361021)
卡拉胶是以1,3-β-D半乳糖和1,4-α-D半乳糖作为基本骨架连接而成的线性硫酸多糖。卡拉胶因其优良的理化性质及多种生物活性,在食品、医药、饲料和化工等领域具有重要的应用价值。相对卡拉胶而言,卡拉胶寡糖分子量较小、溶解性较好、稳定性和安全性都有所改善。研究发现,卡拉胶降解得到的小分子寡糖具有免疫[1-2]、抗肿瘤[3-4]、抗氧化[5]和抗病毒[6-7]活性等。
通过物理法、化学法和酶解法降解卡拉胶可以制备卡拉胶寡糖[8-10]。相对于化学法和物理法降解,酶法降解反应条件温和,易于控制,可以最大程度地保护反应底物的活性基团不会在降解过程中受到破坏,产物活性较高。除此之外,卡拉胶酶可特异性地断裂卡拉胶的β-1,4-糖苷键,生成卡拉胶寡糖,降解产物均一。酶解过程中酸碱用量少,对环境污染少,表现出了较好的应用前景。目前,卡拉胶酶的研究主要集中在产酶菌种筛选[11-12]、发酵特性[13-14]和酶学性质[15-16]研究等方面。
为了实现卡拉胶酶的推广应用,需要将卡拉胶酶制备成固体酶制剂,从而便于卡拉胶酶的贮藏和运输。目前,固体酶制剂的制备方法主要有冷冻干燥[17-18]、喷雾干燥[19-20]和真空干燥[21]等。其中,喷雾干燥法具有操作简单、干燥速度快、干燥产品状态均一、参数可控性强等优点,从而在工业生产中被广泛用于各种液态物料,如糖类、脂类、氨基酸、维生素、色素、酶蛋白等的干燥。
喷雾干燥法已经在单宁酶[19]、柚苷酶[20]、溶菌酶[22]等固体酶制剂的制备过程中得到应用,而卡拉胶酶固体酶制剂的制备工艺尚未见报道。本研究通过单因素实验建立了喷雾干燥工艺参数,并在单因素实验基础上,采用响应面分析法,对影响卡拉胶酶酶制剂喷雾干燥的显著因子——麦芽糊精含量、进料速度和进风温度进行考察,建立卡拉胶酶固体酶制剂的喷雾干燥工艺的二次多项数学模型,进而确定喷雾干燥制备卡拉胶固体酶制剂的最佳工艺。
1 材料与方法
1.1 材料与仪器
乳糖 上海国药集团;牛肉浸膏 上海中科新生命生物科技有限公司;胰蛋白胨 北京奥博星生物技术有限责任公司;卡拉胶 绿新(福建)食品有限公司;麦芽糊精 食品级,北京索莱宝科技有限公司;脱脂奶粉 伊利集团有限公司;菌种PseudoalteromonascarrageenovoraASY5 分离自厦门红树林土壤腐叶样品,保藏于中国工业微生物保藏管理中心(CICC),保藏编号为23819。NaCl 西陇化工股份有限公司;KCl 西陇化工股份有限公司;CaCl2西陇化工股份有限公司;MgCl2·6H2O 国药集团化学实剂有限公司;NaHCO3西陇化工股份有限公司;MgSO4·7H2O 国药集团化学实剂有限公司;FeSO4·7H2O 国药集团化学实剂有限公司;NaH2PO4·2H2O 西陇化工股份有限公司;Na2HPO4·12H2O 西陇科学股份有限公司;蔗糖 国药集团化学实剂有限公司;以上试剂均为分析纯。
Unic7200型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;FE20/EL20 pH计 梅特勒-托利多仪器(上海)有限公司;BS233S电子天平 德国赛多利科学仪器(北京)有限公司;WB-10L1精密恒温水浴锅 厦门精艺兴业科技有限公司;Thermo scientific层析柜 Thermo Fisher Scientific Inc;GZX-DH电热恒温干燥箱 上海跃进医疗器械厂;YC-1000实验室喷雾制粒包衣机 上海雅程仪器设备有限公司。
1.2 培养基
种子培养基:牛肉浸膏10 g、胰蛋白胨10 g、蒸馏水250 mL、人工海水(人工海水:NaCl 37.51 g、KCl 1.03 g、CaCl21.61 g、MgCl2·6H2O 6.4 g、NaHCO30.15 g、MgSO4·7H2O 4.67 g、蒸馏水1000 mL)750 mL。牛肉浸膏和胰蛋白胨溶解后调pH至7.8,加热煮沸10 min,冷却后调pH至7.3,然后和人工海水混合,121 ℃灭菌20 min。
发酵培养基:卡拉胶2.5 g、NaCl 30 g、KCl 0.1 g、CaCl20.2 g、MgSO4·6H2O 3.0 g、胰蛋白胨3.0 g、FeSO4·7H2O 0.036 g、NaH2PO4·2H2O 1.3 g、Na2HPO4·12H2O 3.8 g、蒸馏水1000 mL,121 ℃、灭菌20 min。
1.3 卡拉胶酶粗酶液的制备
将保存在-20 ℃的菌种解冻后,接入制备好的种子培养基,在摇床温度20 ℃、转速180 r/min条件下培养24 h,即为活化的菌种。将活化好的种子液以2%的接种量接入制备好的发酵培养基,在摇床温度20 ℃、转速180 r/min条件下发酵培养32 h,发酵液在5000 r/min离心20 min,收集上清液,即为粗酶液,保存于4 ℃备用。
1.4 卡拉胶酶固体酶制剂制备流程
粗酶液依次经过0.8、0.45、0.22 μm水相膜抽滤,向50 mL酶液中加入麦芽糊精,至终浓度为20%,溶解后,喷雾干燥制备卡拉胶酶固体制剂。喷雾干燥初始条件为:进风温度130 ℃,热风流量4 m3/min,进料速度400 mL/h,喷雾压力0.15 MPa。
1.5 助干剂和保护剂的选择
先选取麦芽糊精、脱脂奶粉、蔗糖为助干剂,其添加量为20%(质量与体积比),考察其对卡拉胶酶酶活回收率的影响;接着考察最优助干剂的添加量对卡拉胶酶酶活回收率的影响。
选取甘油、吐温80、NaCl、海藻糖作为保护剂,其添加量均为0.5%(体积或质量与体积比),考察其对卡拉胶酶酶活回收率的影响,对照组不添加保护剂。
1.6 单因素实验设计
通过单因素实验对影响卡拉胶酶活回收率的喷雾干燥条件进行优化,包括进风温度(110、120、130、140、150 ℃)、热风流量(3.0、3.5、4.0、4.5、5.0 m3/min)、进料速度(300、400、500、600、700 mL/h)、喷雾压力(0.10、0.15、0.20、0.25、0.30 MPa)。喷雾干燥初始条件为:进风温度130 ℃,热风流量4 m3/min,进料速度400 mL/h,喷雾压力0.15 MPa。按照上述顺序逐一进行优化,并且在后续实验中使用上一个最佳条件,进行三次平行实验。
1.7 响应面实验设计
在单因素实验基础上,以卡拉胶酶酶活回收率为响应指标,使用Box-Behnken中心组合实验设计,采用3因素3水平进行响应面设计,对喷雾干燥条件进行优化,实验因素与水平设计见表1。
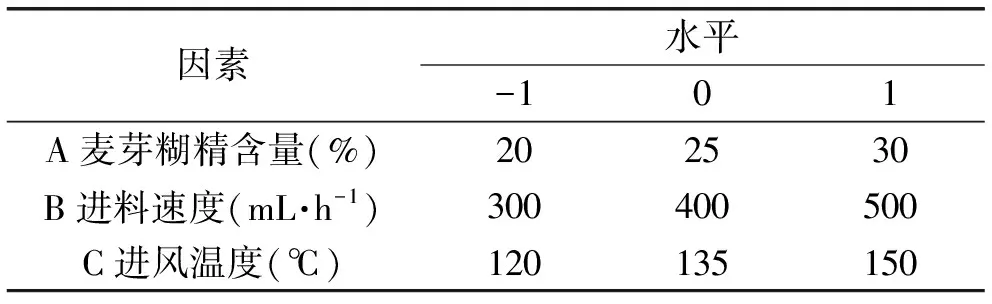
表1 Box-Bohnkon实验设计因子及水平表Table 1 Factors and levels of response surface Box-Bohnkon design
1.8 卡拉胶酶活力测定
[23],称取0.1 g酶制剂,用缓冲液(50 mmol/L NaH2PO4-Na2HPO4,pH7.0)充分溶解后定容至10 mL。采用3,5-二硝基水杨酸法[24]测定酶解产物还原糖的含量。在pH7.0,60 ℃条件下每分钟产生1 μmol还原糖所需的酶量定义为一个酶活单位(U/g)。
酶制剂的酶活回收率(%)=(酶制剂活力/加入酶液的活力)×100
酶制剂的相对活力(%)=(酶制剂活力值/该组中最高活力值)×100
1.9 数据处理
采用Excel 2016制图,SPSS 17.0对单因素实验数据进行Duncan多重比较分析,Design Expert 8.0.6.1进行响应面实验设计及数据分析。
2 结果与分析
2.1 喷雾干燥中助干剂和保护剂的选择
2.1.1 助干剂及用量的选择 粗酶液中固形物含量较少,喷雾干燥后几乎收集不到酶粉,因此在喷雾干燥中需添加助干剂以便得到酶粉。本实验选取不同助干剂,考察其对酶活回收率的影响,结果如图1所示。
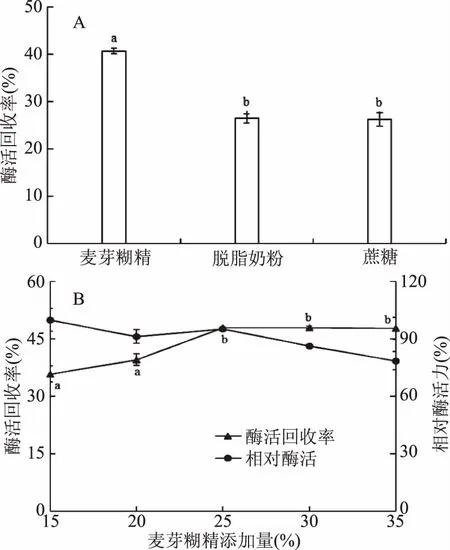
图1 助干剂对酶活回收率的影响Fig.1 Effects of drying aids on carrageenase activity recovery注:A:助干剂对酶活回收率的影响;B:麦芽糊精添加量对酶活回收率的影响;图中不同字母表示差异显著,p<0.05。
图1A可以看出,以麦芽糊精为助干剂时,酶活回收率较高,达到40.8%,这是因为麦芽糊精的水溶性好,喷雾干燥过程中形成的雾滴均匀,能起到较好的包埋效果。除此之外,麦芽糊精的玻璃化转变温度(Tg)较大,能显著提高干燥物料的Tg,使喷雾干燥的颗粒温度低于其Tg,防止物料进入黏流态[25],使其在干燥过程中较少出现黏壁现象,干燥成粉效果好。而以脱脂奶粉和蔗糖为助干剂时,酶活回收率相对较低。实验中发现,在以脱脂奶粉为助干剂时,喷雾干燥过程中会堵塞喷雾头,导致收集到的酶粉较少,从而降低了酶活回收率,而以蔗糖为助干剂时,同样会收集到较少的酶粉,并且得到的酶制剂有结块现象。因此最适的助干剂为麦芽糊精。
图1B为麦芽糊精的添加量对酶制剂酶活回收率的影响。随着麦芽糊精浓度的增加,酶活力有降低的趋势,而酶活回收率则先增加然后基本保持不变,这是因为随着麦芽糊精添加量的增加,增大了料液形成雾滴的表面积,使得水分更容易逸出,从而减少了喷雾干燥时的挂壁现象,使得更容易收集到酶粉。但添加量过大,又会引起输送和雾化困难,造成雾化器喷嘴堵塞,不利于成粉,降低单位质量的酶粉的活力。在麦芽糊精的添加量为25%时,酶活力和酶活回收率都较高,回收率达到47.9%,因此选择添加25%麦芽糊精。
2.1.2 保护剂的选择 在喷雾干燥过程中,有时会添加保护剂用于保护酶在高温下不会变性失活。多羟基类化合物是喷雾干燥中常用的保护剂,它能代替水分子与蛋白质形成氢键,在水分子缺失的情况下保持蛋白的结构稳定[26]。
由图2结果可知,添加甘油、吐温80和NaCl三种保护剂,酶活回收率与不添加保护剂相比没有显著差异,而添加海藻糖后,酶活回收率有显著下降,因此,选择不添加保护剂进行卡拉胶酶酶制剂的喷雾干燥制备。
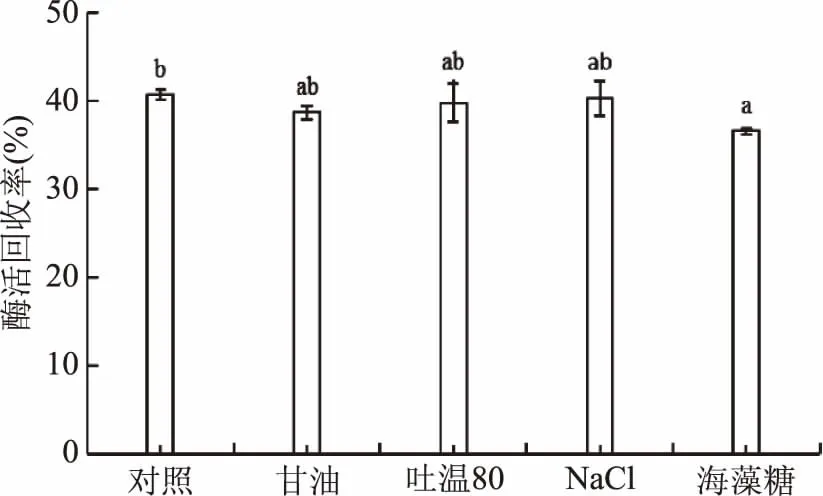
图2 保护剂对酶活回收率的影响Fig.2 Effect of protective agent on carrageenase activity recovery注:图中不同字母表示差异显著,p<0.05。
2.2 单因素实验结果与分析
2.2.1 进风温度对酶活回收率的影响 进风温度是影响酶活回收率和酶活力的一个重要因素。进风温度过低,热量供给较弱,脱水速率较慢,导致产品在干燥容器内部流动时由于颗粒表面水分含量高而黏性大,容易黏壁,随着温度升高,此现象减弱,但温度过高又会导致产品热熔黏壁[27]。因此本实验考察进风温度对卡拉胶酶酶制剂制备的影响,选择最佳进风温度,有利于减少酶活力的损失,同时节约能源。
如图3所示,随着进风温度的升高,酶活力呈现降低的趋势,这是因为进风温度越高出风温度也越高[28],致使蛋白长时间接触高温,活性变低。在110~130 ℃之间,酶活力下降,而酶活回收率基本保持不变,因为温度的升高,有利于形成更多的酶粉,导致酶粉的收集率变大,从而酶活回收率基本维持不变。在130~150 ℃之间时,酶活回收率则呈现降低的趋势,其中在130 ℃处,酶活回收率有峰值,为43.1%。因此进风温度选择130 ℃。
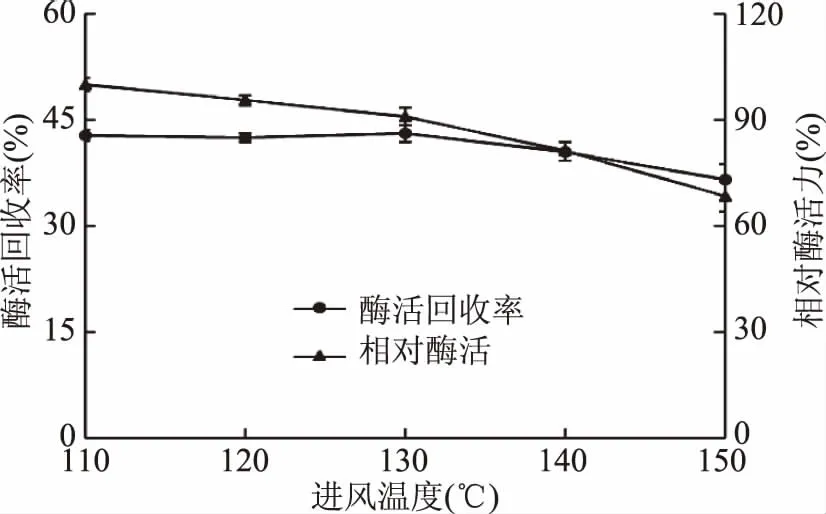
图3 进风温度对酶活回收率和相对酶活力的影响Fig.3 Effect of inlet air temperature on carrageenase activity recovery
2.2.2 热风流量对酶活回收率的影响 热风流量的高低能影响物料水分蒸发的快慢,同时会改变酶液和热空气的接触时间及出风温度。以热风流量为研究对象,结果见图4。
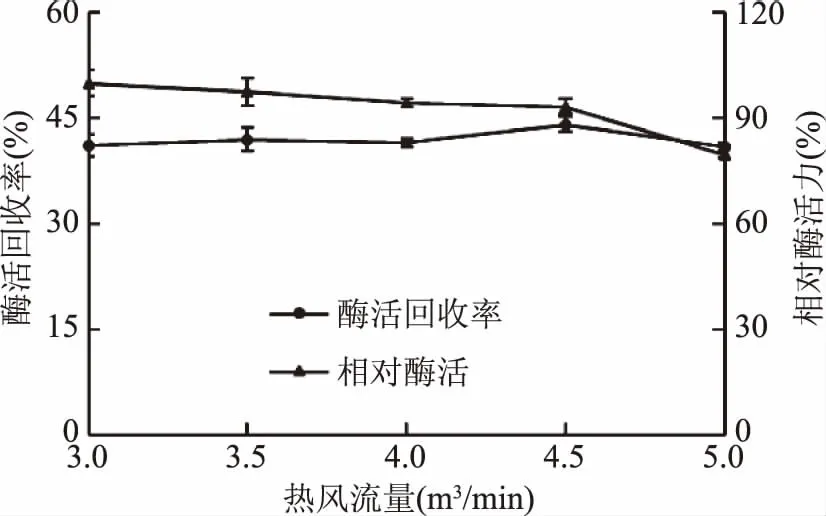
图4 热风流量对酶活回收率和相对酶活力的影响Fig.4 Effect of hot air flow rate on carrageenase activity recovery
随着热风流量的增加,酶活力呈现降低的趋势,这是因为在喷雾干燥过程中,湿粉在旋风分离器中沉降,接受至少10 min出口温度下的干燥处理[29],此过程中长时间的高温作用可能导致蛋白质变性,溶解性降低,从而影响酶活力。酶活回收率则呈现先升高后降低的趋势,因为在一定范围内,随着热风流量的增加,促使干燥塔的温度提高,从而形成更多的酶粉,但温度过高则使酶失活。当热风流量为4.5 m3/min时,酶活回收率最大。
2.2.3 进料速度对酶活回收率的影响 图5为进料速度对酶活回收率和相对酶活力的影响。随着进料速度的增加,酶活力呈现增加的趋势,而酶活回收率则呈现先增加后降低的趋势,因为加快进料速度虽可以提高喷雾干燥的效率,但是速度过快,雾滴变大,超过雾化室的干燥能力,会导致水分蒸发不彻底,造成严重的挂壁现象[30],基本无法出粉,导致收集到的酶粉减少,故酶活回收率降低。在进料速度为300 mL/h,酶活力最低,这是因为过低的进料速度使干燥容器内部干燥产品颗粒浓度较低,惯性力不足,导致黏壁;除此之外,进料速度的过低致使酶液和热风接触时间过长,导致部分酶失活。进料速度为400 mL/h时,酶活回收率较优。

图5 进料速度对酶活回收率和相对酶活力的影响Fig.5 Effect of feeding speeds on carrageenase activity recovery
2.2.4 喷雾压力对酶活回收率的影响 如图6所示,随着喷雾压力升高,酶活力和酶活回收率均呈现先增大后减小的趋势,因为喷雾压力过低,酶液不能充分分散开,形成的液滴过大,不能被完全干燥或者部分沉降到干燥塔的壁上,同时增加了酶粉的水分含量,随着喷雾压力增高,物料分散均匀,利于干燥成粉,但是喷雾压力过高又会有部分酶液粘到壁上。在喷雾压力为0.2~0.25 MPa时,酶活回收率相对稳定,其中在喷雾压力为0.2 MPa时出现峰值,为50.5%。

图6 喷雾压力对酶活回收率和相对酶活力的影响Fig.6 Effect of spray pressure on carrageenase activity recovery
2.3 响应面实验结果与分析
使用SPSS Statistics 17.0对影响卡拉胶酶酶活回收率的因素(麦芽糊精含量,进料速度,热风流量,进风温度及喷雾压力)优化结果进行方差分析。其中麦芽糊精含量(p=0.03),进料速度(p=0.03),进风温度(p=0.021)对结果影响显著。故本实验在热风流量为4.5 m3/h和喷雾压力为0.2 MPa条件下,选取麦芽糊精含量、进料速度和进风温度为实验因素,以卡拉胶酶酶活回收率为响应指标进行响应面设计,实验方案及实验结果见表2。
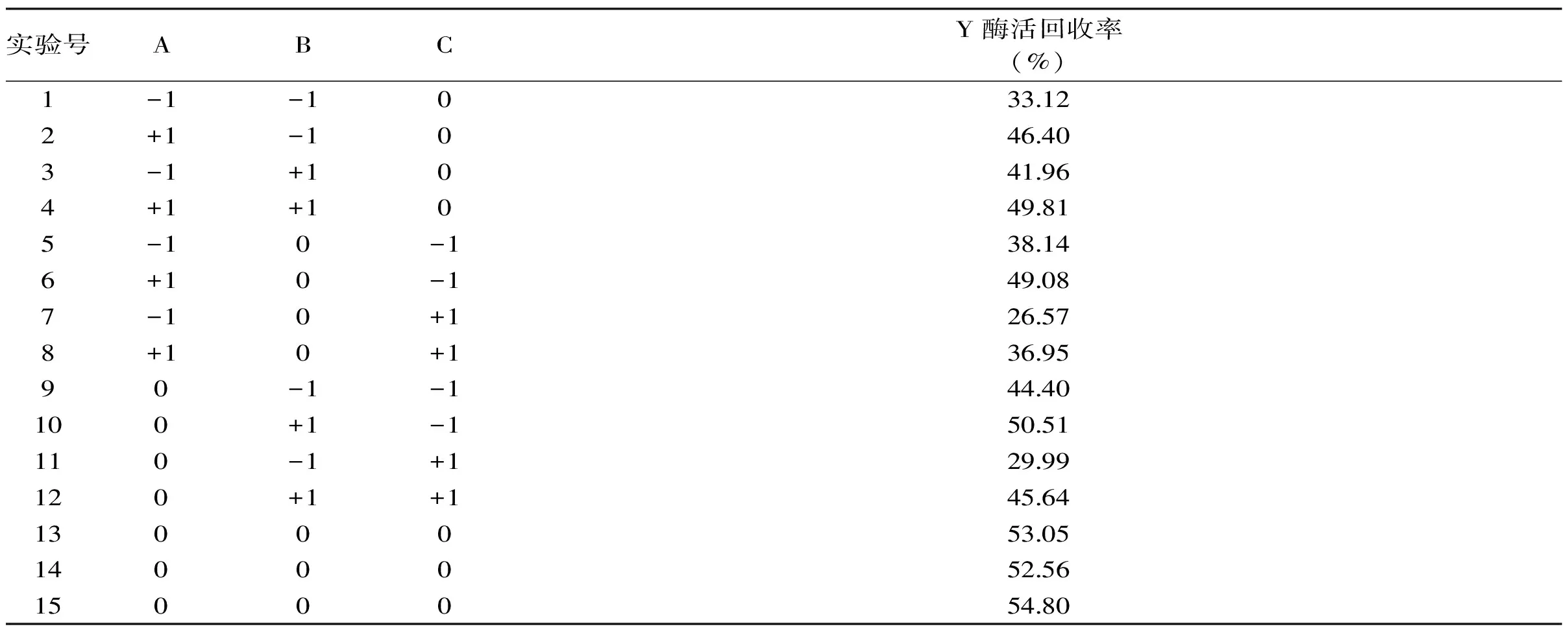
表2 Box-Bohnkon实验设计表及结果Table 2 Designs and results of Box-Bohnkon experiment
2.3.1 回归模型的建立及显著性检验 以实验所得卡拉胶酶酶活回收率为响应值(Y),采用Design-Expert 8.0.6.1程序进行回归拟合后,得到卡拉胶酶酶活回收率对麦芽糊精含量(A)、进料速度(B)、进风温度(C)编码值的二次多项回归方程为:
Y=53.47+5.31A+4.25B-5.37C-1.36AB-0.14AC+2.38BC-7.80A2-2.85B2-7.99C2
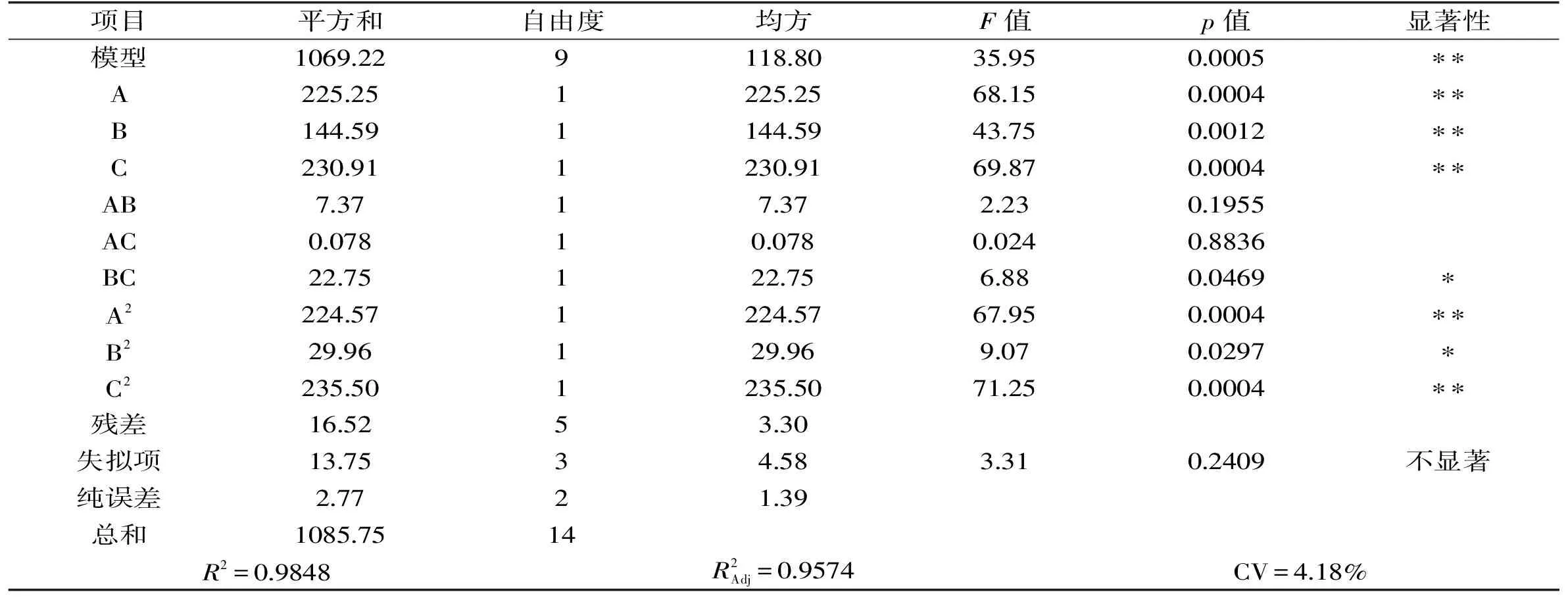
表3 回归模型方差分析Table 3 ANOVA for response surface quadratic model
注:*,差异显著,p<0.05;**,差异极显著,p<0.01。
对该模型进行方差分析,模型p<0.01,表明回归模型极显著。失拟项p=0.2402>0.05,模型失拟度不显著,回归模型拟合度较好。相关系数R2=98.48%,说明98.48%的实验数据可由此方程解释,实验误差小。模型一次项A、B、C(p<0.01)影响极显著;二次项A2、C2(p<0.01)影响极显著,B2(p<0.05)影响显著;交互项BC(p<0.05)影响显著,AB、AC(p>0.05)影响不显著。由一次项系数绝对值的大小可以判断出各因素对响应值Y影响的大小顺序为:C>A>B,即进风温度>麦芽糊精含量>进料速度。
2.3.2 卡拉胶酶喷雾干燥的响应面分析及优化 图7为进风温度位于中心水平即135 ℃时,麦芽糊精含量、进料速度及其交互作用对卡拉胶酶活回收率影响的响应面和等高线图。图7中等高线图接近圆形表明两者交互作用不显著,卡拉胶酶的回收率在麦芽糊精含量25%~27.5%和进料速度450~500 mL/h范围内有最大值。从响应面图可以看出,卡拉胶酶回收率随麦芽糊精含量的改变而呈现出的变化趋势远大于进料速度,因此麦芽糊精含量对卡拉胶酶回收率的影响大于进料速度。
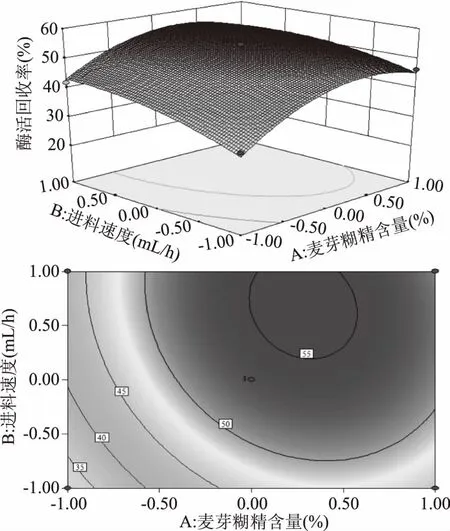
图7 麦芽糊精含量、进料速度及其交互作用对卡拉胶酶酶活回收率影响的响应面和等高图Fig.7 Response surface and contour plots for the effect of maltodextrin content and feeding speeds on carrageenase activity recovery
从图8可以看出,麦芽糊精含量和进风温度交互作用不显著。从响应面图中可以看出,麦芽糊精含量对卡拉胶酶活回收率的影响大于进风温度。由图8等高线图可知,卡拉胶酶的回收率在麦芽糊精含量25%~27.5%和进风温度在127.5~135 ℃范围内有最大值。
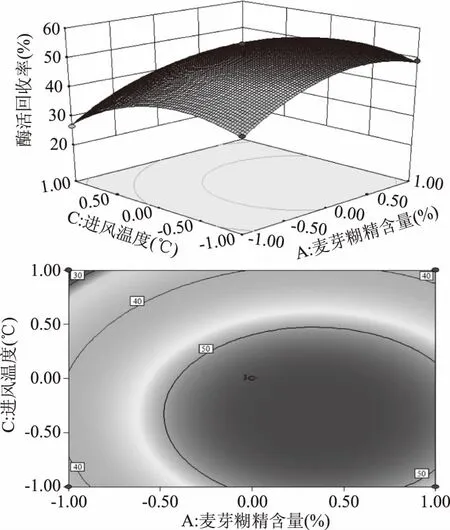
图8 麦芽糊精含量、进风温度及其交互作用对卡拉胶酶酶活回收率影响的响应面和等高图Fig.8 Response surface and contour plots for the effect of maltodextrin content and cross-interation inlet air temperature on carrageenase activity recovery
从图9响应面图中可以看出,当固定进料速度为某一值时,进风温度在120~135 ℃范围内,酶活回收率随进风温度增大而增大,当进风温度超过135 ℃后,卡拉胶酶的酶活回收率随进风温度的增加而降低;当固定进风温度为某一值时,酶活回收率随着进料速度的变化也是先增加后降低,这与单因素优化结果是相符的。由图9中的等高线图可知,卡拉胶酶的酶活回收率在进料速度450~500 mL/h和进风温度127.5~135 ℃范围内有最大值。
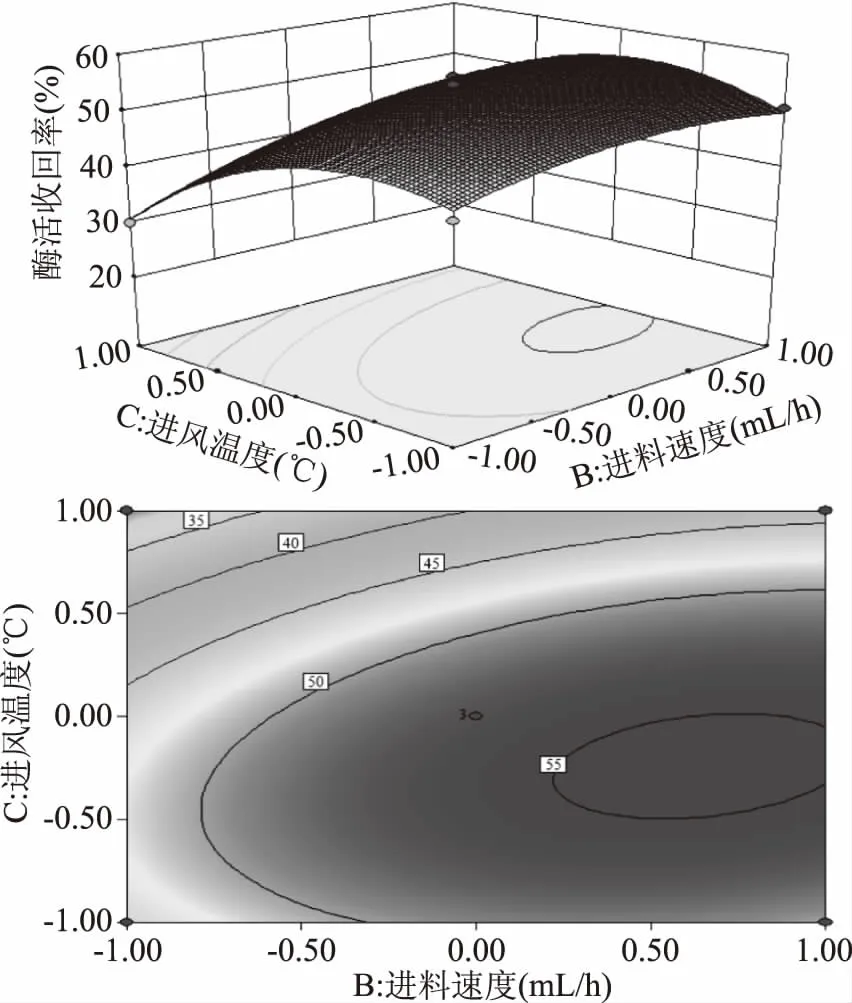
图9 进料速度、进风温度及其交互作用对卡拉胶酶酶活回收率影响的响应面和等高图Fig.9 Response surface and contour plots for the effect of feeding speeds and cross-interation inlet air temperature on carrageenase activity recovery
2.3.3 验证实验 利用软件Design-Expert 8.0对方程模型进行分析,得到制备卡拉胶酶酶制剂的最佳参数条件为麦芽糊精含量为26.5%,进料速度为456.9 mL/h,进风温度为131.2 ℃,在此条件下,预测卡拉胶酶酶制剂的酶活回收率达到56.1%。修正后选择麦芽糊精含量为27%,进料速度为456 mL/h,进风温度为131 ℃。在此条件下进行3次重复实验,得到卡拉胶酶酶制剂的酶活回收率为56.9%±2.1%,与理论值的误差为1.3%,表明所得模型能反映出各因素对卡拉胶酶酶制剂的酶活回收率的影响。
3 结论
为优化卡拉胶固体酶制剂喷雾干燥制备工艺,本实验通过单因素和Box-Behnken对工艺条件进行优化。在单因素实验基础上,采用Box-Behnken设计,以卡拉胶酶酶活回收率为评价指标对喷雾干燥法制备卡拉胶酶固体酶制剂的工艺进行优化,最终得到喷雾干燥最佳参数条件为:麦芽糊精浓度27%,进风温度131 ℃,热风流量4.5 m3/min,进料速度456 mL/h,喷雾压力0.2 MPa。在此条件下,酶活回收率达到56.9%±2.1%。
参考文献
[1]王秀武,杜昱光,白雪芳,等. 卡拉胶寡糖对肉仔鸡肠道菌群、小肠微绒毛及免疫功能和生产性能的影响[J]. 中国兽医学报,2004(5):498-500.
[2]刘雪冰.卡拉胶十一糖对小鼠单核/巨噬细胞的免疫调节效应研究[D]. 海口:海南大学,2016.
[3]吴海歌,王艳预,姚子昂. 卡拉胶寡糖的制备及其生物活性的研究[J]. 化学与生物工程,2010(6):37-40.
[4]张胜霞,吴海歌,姚子昂,等. 两种海洋寡糖对S180荷瘤小鼠抗肿瘤及免疫调节作用的研究[J]. 现代免疫学,2012(1):5-8.
[5]朱楠楠,吴海歌,姚子昂,等. κ-卡拉胶寡糖抗氧化活性的研究[C]//International Conference on Cellular,2010
[6]栾晖,牟海津,罗兵,等. κ-卡拉胶寡糖硫酸基含量与其抗疱疹病毒活性的关系[J]. 渔业科学进展,2010(1):110-116.
[7]马悦欣,董双林,牟海津,等. κ-卡拉胶寡糖的酶解制备及其体外抗病毒活性[J]. 中山大学学报:自然科学版,2009(6):105-108.
[8]Rochas C,Heyraud A. Acid and enzymic hydrolysis of Kappa carrageenan[J]. Polymer Bulletin,1981,5(2):81-86.
[9]Knutsen S H,Grasdalen H. Analysis of carrageenans by enzymic degradation,gel filtration and1H NMR spectroscopy[J]. Carbohydrate Polymers,1992,19(3):199-210.
[10]李桂村,张志焜,耿美玉. κ-卡拉胶的氧化降解[J]. 青岛科技大学学报:自然科学版,2002,23(4):48-51.
[11]Sun F X,Ma Y X,Wang Y,et al. Purification and characterization of novel κ-carrageenase from marineTamlanasp. HC4[J]. Chinese Journal of Oceanology and Limnology,2010,28(6):1139-1145.
[12]Liu G L,Li Y,Chi Z,et al. Purification and characterization of κ-carrageenase from the marine bacterium Pseudoalteromonas porphyrae for hydrolysis of κ-carrageenan[J]. Process Biochemistry,2011,46(1):265-271.
[13]Jiang L,Hu Q,Seswita-Zilda D. Purification and characterization of a thermostable λ-carrageenase from a hot spring bacterium,Bacillussp.[J]. Biotechnology Letters,2014,36(8):1669-1674.
[14]Xiaoyan,Shangyong,YANG,et al. Cloning and Characterization of a New κ-Carrageenase Gene from Marine BacteriumPseudoalteromonassp. QY203[J]. Journal of Ocean University of China,2015,14(6):1082-1086.
[15]刘苹,张珠,张聪芝,等. 响应面法优化黄杆菌YK-5产卡拉胶酶的发酵条件[J]. 烟台大学学报自然科学与工程版,2012,25(3):194-198.
[16]苏平安,王莹,李尚勇,等. κ-卡拉胶酶CgkX高效重组表达菌株的构建和发酵优化[J]. 中国海洋药物,2015(4):1-6.
[17]薛枫,欧仕益,傅亮,等. 冷冻干燥法制备阿魏酸酯酶和阿拉伯木聚糖酶固体混合酶制剂[J]. 食品工业科技,2006(5):152-154.
[18]周艳明,刘丹,胡睿. 冷冻干燥法制备植物酯酶[J]. 食品工业科技,2007(12):140-142.
[19]肖安风,王芳,倪辉,等. 单宁酶固体酶制剂的喷雾干燥制备工艺优化[J]. 中国食品学报,2013(7):144-151.
[20]肖安风,丁涛,倪辉,等. 喷雾干燥法制备柚苷酶固体酶制剂的工艺优化[J]. 中国食品学报,2013(3):92-100.
[21]胡宜亮,李锋,周伏忠,等. 纳豆激酶高产菌株产酶特点及其干燥工艺的研究[J]. 河南科学,2013(3):285-288.
[22]朱照静,邱宗荫. 喷雾干燥对溶菌酶一级结构的影响[J].中国生化药物杂志,2003,24(6):279-280.
[23]许彩云,朱艳冰,倪辉,等. 一株产卡拉胶酶细菌的分离鉴定及其酶学性质[J]. 微生物学报,2015(2):140-148.
[24]朱海霞,石瑛,张庆娜,等. 3,5-二硝基水杨酸(DNS)比色法测定马铃薯还原糖含量的研究[J]. 中国马铃薯,2005,19(5):266-269.
[25]Truong V,Bhandari B R,Howes T. Optimization of cocurrent spray drying process for sugar-rich foods. Part II—Optimization of spray drying process based on glass transition concept[J]. Journal of Food Engineering,2005,71(1):66-72.
[26]Abadias M,Benabarre A,Teixidó N,et al. Effect of freeze drying and protectants on viability of the biocontrol yeast Candida sake[J]. International Journal of Food Microbiology,2001,65(65):173-182.
[27]苏东晓,张名位,侯方丽,等. 速溶龙眼粉加工的酶解提取与喷雾干燥工艺优化[J]. 农业工程学报,2009,25(8):268-274.
[28]于华宁,阿地里江,龙薇运,等. 实验型喷雾干燥机低温干燥牛初乳粉的赶干燥性能[J]. 农业工程学报,2010,26(10):361-366.
[29]王春维,胡奇伟. 喷雾干燥血浆蛋白粉生产工艺研究进展[J]. 中国粮油学报,2006(3):396-399.
[30]刘贺,王雪,李君,等. 扁杏仁水解蛋白的喷雾干燥及其抗氧化活性[J]. 食品科学,2012(16):18-23.

