脐血干细胞移植对失代偿期肝硬化患者TNF-α浓度和CD45RO+粒细胞表达的影响
董媛 师贞宗
失代偿期肝硬化又叫肝硬化失代偿期,是肝硬化的终末发展阶段[1]。早期肝硬化肝功能尚具有代偿性,但病情发展到一定的程度便会超出肝功能的代偿能力,因此称之为失代偿期肝硬化,该阶段表现为以门静脉高压、肝功能减退为主的临床表现[2]。新鲜脐血具有充足的间充质干细胞,同时具有较弱的免疫原性,脐血干细胞更为原始,具有较强的扩增能力,因此脐血间充质干细胞在临床疾病中的应用越来越普遍,各器官疾病的细胞移植均可采用这种新的替代细胞来源,运用于终末期肝硬化具有十分重要的临床意义[3]。本文探究对失代偿期肝硬化患者进行脐血干细胞移植的临床疗效,并检测患者肿瘤坏死因子(tumor necrosis factor,TNF-α)浓度和CD45RO+粒细胞表达的影响,为失代偿期肝硬化的诊治提供理论依据,报道如下。
资料与方法
一、一般资料
本组观察对象为2015年7月至2016年7月于湖北医药学院附属人民医院消化内科治疗的80例失代偿期肝硬化患者,进行病历资料回顾性分析,将40例在常规对症、支持治疗的基础加用通过肝动脉灌注性脐血干细胞移植治疗的患者设为观察组,40例常规治疗的患者设为对照组。观察组中男27例,女13例;年龄最大83岁,最小45岁,中位年龄(59.54±6.76)岁;病程最短2年,最长6年,平均(3.03±0.39)年;3例丙型肝炎所致肝硬化、22例乙型肝炎所致肝硬化、8例酒精所致肝硬化、4例血吸虫型肝硬化,3例自身免疫疾病所致肝硬化;Child-Pugh分级:28例B级、12例C级;对照组中男26例,女14例;年龄最大82岁,最小45岁,中位年龄(60.21±6.32)岁;病程最短2年,最长7年,平均(3.11±0.41)年;2例丙型肝炎所致肝硬化、23例乙型肝炎所致肝硬化、7例酒精所致肝硬化、5例血吸虫型肝硬化,3例自身免疫疾病所致肝硬化;Child-Pugh分级:26例B级、14例C级;本研究方案均获得卫计委以及我院伦理委员会批准。
纳入标准:原发性肝病符合《内科学》[4]诊断标准;所有患者均符合美国肝病学会《成人肝硬化腹水诊疗指南(2009年版)》[5]关于肝硬化失代偿期诊断标准;Child-Pugh分级为B级、C级;患者或家属同意治疗方案;排除标准:病情严重生命垂危者;患者肝部癌变或其他组织恶性肿瘤者;合并严重感染者;两组年龄、性别、疾病类型等一般资料比较差异无统计学意义(P> 0.05)。
二、方法
1.基础治疗:患者入院后均进行常规对症、支持治疗,包括降酶、保肝、利尿、退黄、输白蛋白治疗,在常规治疗上进行脐血干细胞移植治疗。脐血干细胞采集与移植:选取身体健康的足月产妇,分娩前做好各项病毒学以及酶学排查。胎儿娩出后马上进行断脐,并进行严格的包扎处理,通过采血袋针刺入胎盘侧脐静脉,采集150 ~ 200 ml脐血。通过脐带血细胞处理试剂盒(湖州赛托森生物科技发展有限公司)进行相应操作,包括纯化、分离,同时进行干细胞计数,操作说明书进行详细操作,参照《全国临床检验操作规范》第三版[6],测出样本核细胞总数A以及收集的有核细胞总数B,回收率=B/A×100%计算。细胞活性:取2滴细胞悬液加1滴2%锥虫蓝染液,5 ~ 10 min后取样作湿片,高倍镜检,死细胞被染成蓝色,活细胞不着色,原则上活性细胞数大于1×107个。脐带血细胞放置于5 ml细胞转移管内,治疗前2 h置于恒温冰桶。
2.肝动脉灌注性脐血干细胞移植方法:采用2%盐酸利多卡因进行局部麻醉,穿刺右侧股动脉参照Seldinger技术,通过数字减影血管造影的透视下完成5 FYashiro导管的引入,导丝输送路线为肝总动脉-肝固有动脉-肝动脉远端定,通过导丝的支撑将导管送至肝固有动脉,进行导管固定后拔出导丝。注入非离子型造影剂于导管,明确导管头端处于超过胃十二指肠动脉的位置后停止数字减影血管造影透视。患者保持平静的呼吸,导管位置固定好后采用生理盐水对导管内残留造影剂进行冲洗,将脐血干细胞悬液从冰桶中取出待达到室温后经由导管匀速缓慢注入肝内,干细胞纯化分离的回收率为90%,每次干细胞数量(1 ~ 3)×108个,每周1次,共4 ~ 6次。并用生理盐水严格冲洗导管残留液。结束后拔管,采用动脉压迫器加压对伤口进行8 h的加压包扎,伸直右下肢平卧8 h。
3.指标判定标准:采集患者空腹外周静脉血,检查治疗前与治疗后肝功能,包括总胆红素(total bilirubin,TBIL)、谷丙转氨酶(cereal third transaminase,ALT)、血清白蛋白(albumin,ALB)、谷草转氨酶(aspartate transaminase,AST)等。肝纤维化指标,包括层粘连蛋白(laminin,LN)、透明质酸酶(hyaluronidase,HA)、IV型胶原(type IV collagen,IVCol)、III型前胶原(procollagen type III,IIINP)。采用美国R&D公司快速ELISA试剂盒检测治疗前与治疗后肿瘤坏死因子(tumor necrosis factor,TNF-α)、白细胞介素6(interleukin,IL-6)等细胞因子水平。采用Attune NxT 流式细胞仪检测治疗前、治疗6个月后CD45RO+淋巴细胞以及粒细胞表达水平。
三、统计学分析方法
采用SPSS 16.00统计软件,肝功能、肝纤维化指标、TNF-α、IL-6、CD45RO+淋巴细胞以及粒细胞表达水平以±s表示,组间比较采用独立t检验,治疗前后比较采用配对t检验,以P< 0.05为差异有统计学意义。
结 果
一、治疗前后肝功能比较
两组治疗后TBIL、ALT、AST水平显著低于治疗前,ALB高于治疗后,治疗后组间比较差异具有统计学意义(P< 0.05,表1,表2)。
二、治疗前后肝纤维化指标比较
两组治疗后LN、HA、IVCol、IIINP低于治疗前,且治疗后组间比较差异具有统计学意义(P< 0.05,表3,表4)。
三、治疗前后TNF-α、IL-6比较
两组治疗后TNF-α、IL-6均逐渐降低,且治疗后组间比较差异有统计学意义(P< 0.05,表3)。
四、治疗前后CD45RO+淋巴细胞以及粒细胞表达水平比较
治疗后CD45RO+淋巴细胞以及粒细胞表达水平均低于治疗前,且组间比较差异有统计学意义(P< 0.05,表4)。
表1 治疗前后TBIL、ALT水平比较(±s)
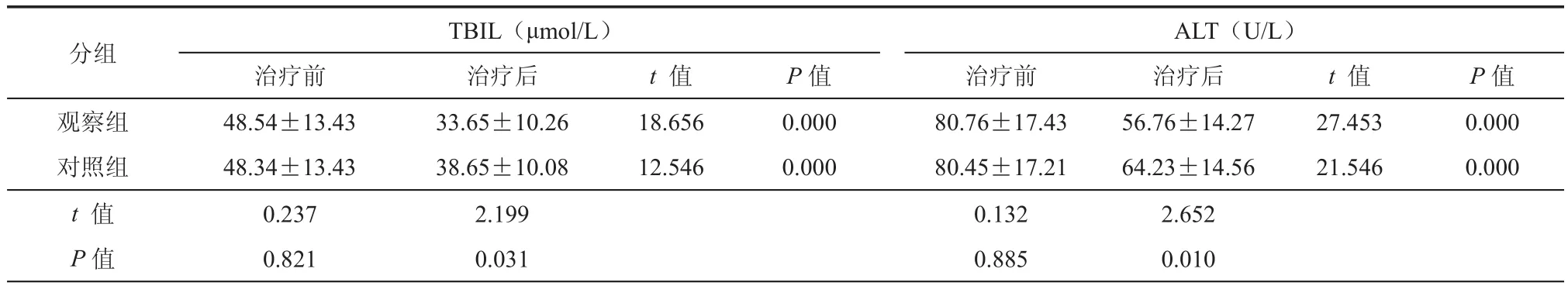
表1 治疗前后TBIL、ALT水平比较(±s)
ALT(U/L)治疗前治疗后t 值P值治疗前治疗后t 值P值观察组48.54±13.4333.65±10.2618.6560.00080.76±17.4356.76±14.2727.4530.000对照组48.34±13.4338.65±10.0812.5460.00080.45±17.2164.23±14.5621.5460.000 t 值 0.2372.1990.1322.652 P值0.8210.0310.8850.010分组TBIL(μmol/L)
表2 治疗前后AST、ALB水平比较(±s)

表2 治疗前后AST、ALB水平比较(±s)
ALB(g/L)治疗前治疗后t 值P值治疗前治疗后t 值P值观察组75.65±20.3348.54±17.0432.5460.00030.65±7.4336.65±8.320.1240.862对照组75.62±20.1758.21±17.0226.7580.00030.54±7.2732.56±8.125.3430.000 t 值 0.1282.1990.2132.225 P值0.8240.0320.8450.029分组AST(U/L)
表3 治疗前后肝纤维化指标LN、HA比较(μg/L,±s)
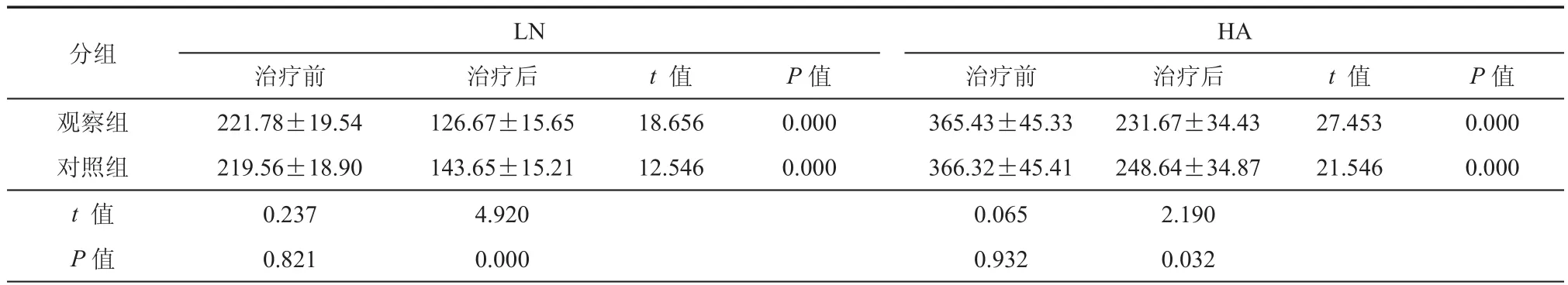
表3 治疗前后肝纤维化指标LN、HA比较(μg/L,±s)
HA治疗前治疗后t 值P值治疗前治疗后t 值P值观察组221.78±19.54126.67±15.6518.6560.000365.43±45.33231.67±34.4327.4530.000对照组219.56±18.90143.65±15.2112.5460.000366.32±45.41248.64±34.8721.5460.000 t 值 0.2374.9200.0652.190 P值0.8210.0000.9320.032分组LN
表4 治疗前后肝纤维化指标IVCol、IIINP比较(μg/L,±s)
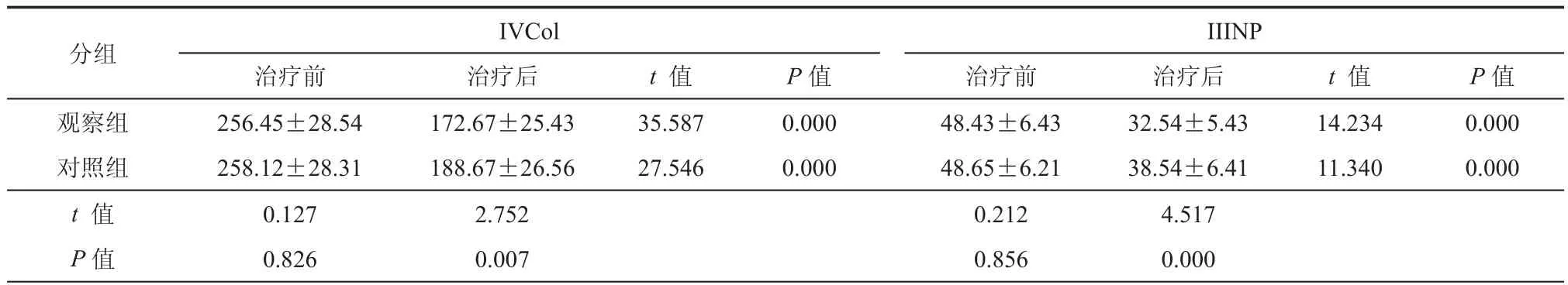
表4 治疗前后肝纤维化指标IVCol、IIINP比较(μg/L,±s)
IIINP治疗前治疗后t 值P值治疗前治疗后t 值P值观察组256.45±28.54172.67±25.4335.5870.00048.43±6.4332.54±5.4314.2340.000对照组258.12±28.31188.67±26.5627.5460.00048.65±6.2138.54±6.4111.3400.000 t 值 0.1272.7520.2124.517 P值0.8260.0070.8560.000分组IVCol
表5 治疗前后TNF-α、IL-6比较(pg/ml,±s)
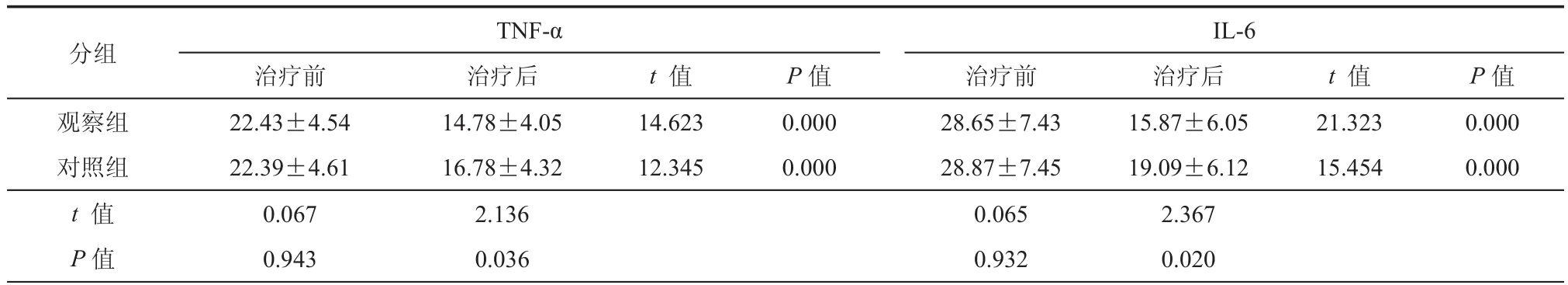
表5 治疗前后TNF-α、IL-6比较(pg/ml,±s)
IL-6治疗前治疗后t 值P值治疗前治疗后t 值P值观察组22.43±4.5414.78±4.0514.6230.00028.65±7.4315.87±6.0521.3230.000对照组22.39±4.6116.78±4.3212.3450.00028.87±7.4519.09±6.1215.4540.000 t 值 0.0672.1360.0652.367 P值0.9430.0360.9320.020分组TNF-α
表6 治疗前后CD45RO+淋巴细胞以及粒细胞表达水平比较(%,±s)
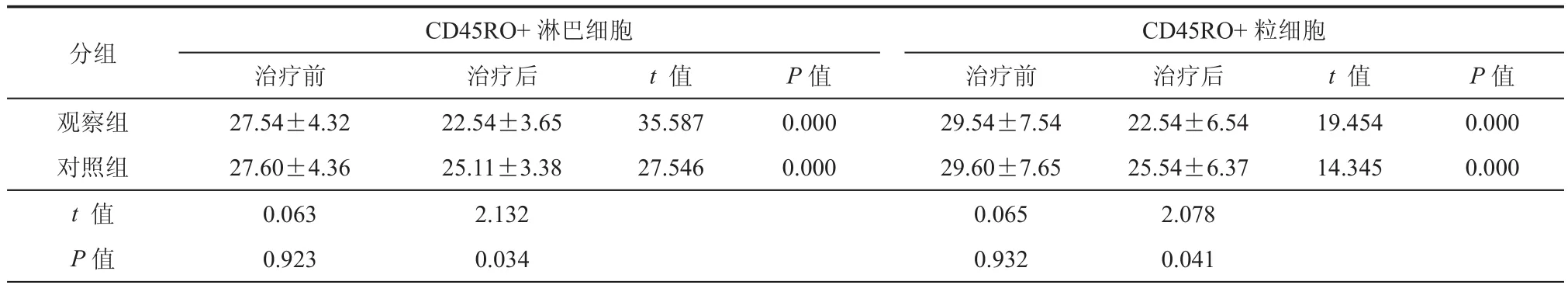
表6 治疗前后CD45RO+淋巴细胞以及粒细胞表达水平比较(%,±s)
CD45RO+粒细胞治疗前治疗后t 值P值治疗前治疗后t 值P值观察组27.54±4.3222.54±3.6535.5870.00029.54±7.5422.54±6.5419.4540.000对照组27.60±4.3625.11±3.3827.5460.00029.60±7.6525.54±6.3714.3450.000 t 值 0.0632.1320.0652.078 P值0.9230.0340.9320.041分组CD45RO+淋巴细胞
讨 论
肝硬化主要指肝脏弥漫性损害,该病由单种或多种致病因素反复、长期刺激所引起,主要病理特征为肝细胞坏死变性、弥漫性结缔组织慢性增生、形成假小叶以及损害肝小叶结构。失代偿期肝硬化是肝硬化的终末期,临床上无特效治疗方法,主要采用对症以及支持治疗,如何改善失代偿期肝硬化肝功能、缓解肝纤维化是该症研究热点及难点[7]。近年来随着再生医学及干细胞技术的研究深入,通过干细胞移植为基础的细胞治疗成为失代偿期肝硬化的新方案。干细胞具有多向分化潜能以及自我更新的特点,在条件适宜的情况下能够向多种功能细胞分化[8]。有研究证明,肝硬化患者肝细胞再生及肝损伤过程中,干细胞的作用较为明显,干细胞经体外分离纯化后移植于肝硬化患者肝内,其分化特性有助于定植于肝脏中,恢复和重构损伤的肝功能[9]。本研究中,患者经脐血干细胞移植后各项肝功能指标均改善,提示患者肝功能的提升。同时各项肝纤维化指标的降低使肝硬化患者肝纤维化进程受到抑制,研究结果与上述观点吻合[10]。
失代偿期肝硬化的血循环、腹水中的内毒素水平较高,肝组织受到内毒素、病毒的不断刺激,TNF-α是一种重要的炎症始发细胞因子,主要作用对象是免疫炎性细胞与血管内皮系统,能够触发机体炎症级联反应[11]。大多数单核细胞、淋巴细胞受到内毒素、TNF-α、IL-1因素的刺激后会产生IL-6,IL-6在细胞因子网络中表现出多种生物学功能[12]。有研究发现,IL-6能够作为肝细胞刺激因素,可在对肝细胞的直接刺激下促进其分泌胶原及增生,同时对储能细胞刺激后其增生并合成LN、胶原以及蛋白多糖,同时对免疫球蛋白、细胞因子的表达具有促进作用,通过对胶原酶活性的抑制,缓解胶原蛋白的降解过程,最终导致肝脏胶原沉积,形成肝纤维化[13]。本研究治疗后TNF-α、IL-6水平降低,其原因在于脐血干细胞能够分泌IL-10等细胞因子,改变肝脏的微环境,减轻炎性反应,达到降低TNF-α、IL-6的目的[14]。CD45RO+能够反应机体炎症反应的严重程度,本研究证明脐血干细胞植入后降低炎症反应,相应的,CD45RO+淋巴细胞及粒细胞表达水平均降低[15]。各指标进行组间比较后发现,加用脐血干细胞移植的观察组患者各项数据均优于常规治疗,这得益于两者在提升肝功能,降低炎症反应的协同作用。
综上所述,失代偿期肝硬化通过脐血干细胞移植治疗能够改善肝功能,降低相关肝纤维化指标,降低TNF-α、IL-6等细胞因子的水平以及CD45RO+淋巴细胞以及粒细胞表达水平,可作为新型治疗失代偿期肝硬化有效方案。
1 张江春, 江必武, 胡乃毅, 等. 脐血干细胞移植治疗失代偿期肝硬化的术后观察及护理[J]. 重庆医学, 2016, 45(6):790-792.
2 董惠芳, 章晓鹰, 周飞, 等. 肝硬化患者血清TNF-α和CD45RO+粒细胞检测的意义[J]. 上海医学检验杂志, 2001, 16(4):233-234.
3 周诗君, 叶英, 李家斌. 脐血干细胞移植治疗失代偿期肝硬化的疗效及安全性评价[J]. 安徽医科大学学报, 2016, 51(7):1035-1038.
4 贺立山, 翁孝刚. 内科学.第6版[M]. 西安:第四军医大学出版社,2005.
5 丁晓东, 范建高. 美国肝病学会成人肝硬化腹水诊疗指南(2009年版) [J]. 肝脏, 2009, 14(3):245-246.
6 尚红, 王毓三, 申子瑜. 全国临床检验操作规程[M]. 人民卫生出版社, 2015.
7 江必武, 贾学平, 吴玉芳,等. 脐血干细胞移植治疗对失代偿期肝硬化患者细胞因子水平的影响及其临床意义[J]. 华中科技大学学报(医学版), 2015, 44(3):294-297.
8 朱彦红, 韩大正. 脐血干细胞移植治疗失代偿期肝硬化的早期临床疗效探讨[J]. 中国医师进修杂志, 2014, 37(22):15-17.
9 Guo XL, Liu Y, Zhou LM, et al. Umbilical cord blood stem cell transplantation for treatment of decompensated cirrhosis[J]. Chinese Journal of Tissue Engineering Research, 2016.
10 公建庄, 杜晨旭, 陈雅宁, 等. 脐血间充质干细胞移植治疗失代偿期肝硬化的临床疗效观察[J]. 中国全科医学, 2014 (20):2392-2395.
11 Abbasi P, Shamsasenjan K, Movassaghpour Akbari AA, et al. The effect of baicalin as a PPAR activator on erythroid differentiation of CD133(+)hematopoietic stem cells in umbilical cord blood [J]. Cell J,2015, 17(1):15-26.
12 江必武, 时昭红, 袁泉, 等. 彩色多普勒超声评价脐血干细胞移植治疗失代偿期肝硬化效果的价值[J]. 广东医学, 2015, 36(18):2858-2861.
13 张岁, 佟立新, 闫宝勇, 等. 人脐血干细胞经外周静脉移植治疗失代偿期肝硬化的临床研究 [J]. 天津医药, 2016, 44(1):83-87.
14 郭宪立, 刘跃, 周丽敏, 等. 脐血干细胞移植修复失代偿期肝硬化[J].中国组织工程研究, 2016, 20(14):2080-2085.
15 Delaney M, Ballen KK. Umbilical cord blood transplantation: review of factors affecting the hospitalized patient[J]. J Intensive Care Med,2015, 30(1):13-22.

