发芽糙米多糖微波辅助提取工艺及其抗氧化活性研究
潘姝璇PAN Shu-xuan 王嘉怡 - 陈 建 n 夏 陈 邓俊琳 - 蒲 彪
(1. 四川省农业科学院农产品加工研究所,四川 成都 610066;2. 四川农业大学食品学院,四川 雅安 625014;3. 四川大学华西公共卫生学院,四川 成都 610041)
发芽糙米(germinated brown rice,GBR)是糙米在一定的湿度和温度下发芽至一定芽长(一般为0.5~1.0 mm),所得到的由幼芽和带糠层的胚乳组成的糙米制品[1]。人们在养身的过程中发现糙米能产生较强的饱腹感,且对身体健康有很多益处[2]。但糙米口感粗糙。通过发芽处理后的糙米经历了种子萌发阶段激活了大量的内源酶,酶解作用导致糙米中多糖等活性物质的含量、结构、种类及其生物活性都有所改变或增强,不仅口感得到了一定程度的改善,而且富含许多生物活性物质,如γ-氨基丁酸、菲汀、谷维素、神经酰胺、阿魏酸、多糖等。因此发芽糙米营养物质丰富,具有特殊的营养功效[3]。
很多报道[4-7]表明植物中的多糖对自由基有一定的抗氧化活性,可以作为新的潜在抗氧化剂进行研究。氧化是许多生物能量生产的基本过程,但是过量的自由基在体内会产生一些氧化反应过程不仅与脂质过氧化作用密切相关,还会引起疾病。因此,对高效的抗氧化剂的开发并用于保护机体免受自由基的破坏是十分必要的[8]。热水浸提法为传统且最为常用的水溶性多糖制备方法,但耗时长、效率低[9]。微波辅助提取法是利用微波对物质进行萃取的一种新兴技术,具有耗时短、效率高、节省溶剂、最终产生的物质产量高而不改变其性质等优势[10-12]。作为一种替代传统方法的潜在方法,该方法受到越来越多的关注[13-14]。
目前,在发芽糙米中的功能成分的研究报道中对多糖的研究甚少,刘晓飞等[15]曾采用超声波辅助双水相法萃取对发芽糙米多糖的工艺优化及其抗氧化活性进行过研究。本试验拟采用微波辅助法对发芽糙米多糖(germinated brown rice polysaccharides, GBRP)进行提取,用响应面试验对其工艺进行优化,并研究GBRP的抗氧化活性,旨在为发芽糙米的增值利用和新型多糖的制备提供依据。
1 材料与方法
1.1 材料与仪器
发芽糙米:由东北产糙米经某谷物公司生产车间1 000 kg 级大生产制备;
石油醚(35~60 ℃)、浓硫酸、硫酸亚铁、水杨酸、过氧化氢:分析纯,成都市科龙化工试剂厂;
葡萄糖:分析纯,国药集团化学试剂有限公司;
苯酚:分析纯,成都市苌征化玻有限公司;
1,1-二苯基-2-三硝基苯肼(DPPH·) :梯希爱化成工业发展有限公司;
中药粉碎机:FY-250型,永康市久品工贸有限公司;
微波科学实验炉:ORW08S-3H型,南京奥润微波科技有限公司;
扫描型紫外可见分光光度计:UV-6100型,上海美普达仪器有限公司;
高速冷冻离心机:Gentrifuge 5180R型,德国Eppendorf公司;
电子天平:FA2104型,上海舜宇恒平科学仪器有限公司。
1.2 发芽糙米的前处理
将50 kg发芽糙米用碾米机去除胚乳(即分离除去大量淀粉)得到5.5 kg发芽糙米米糠(含有约10%碎米)。取该米糠1.0 kg浸泡于5 L 石油醚中并搅拌4 h脱脂处理后,过滤,置于通风橱风干,粉碎,过60目筛,密封保存,备用。
1.3 多糖含量的测定
采用苯酚-硫酸法[16]。
1.4 微波辅助提取GBRP
1.4.1 提取工艺 称取1.0 g前处理的发芽糙米米糠,在40 ℃ 下用去离子水按一定的液料比混合后,置于微波科学实验炉,设定微波功率,采用不同的液料比、微波提取时间、微波功率、提取次数(具体数据设计见1.4.1)4个因素进行微波辅助提取。提取完后将混合物离心(8 000 r/min,10 min),取5 mL上清液加25 mL乙醇沉淀。醇沉之后再离心(8 000 r/min,10 min),去上清液,将沉淀冷冻干燥后,复溶于5 mL去离子水中,采用苯酚-硫酸法测定多糖含量。
1.4.2 单因素试验 参考文献[17~18]的条件,以去离子水为提取剂,分别就微波功率、微波时间、液料比和微波次数做单因素试验。
(1) 微波功率:固定微波温度40 ℃,微波时间4 min,液料比20∶1 (mL/g),提取次数2次,采用以上选出的结果,考察不同微波功率200,300,400,500,600,700 W对GBRP提取率的影响。
(2) 微波时间:固定微波温度40 ℃,液料比20∶1(mL/g),提取次数2次,采用以上选出的结果,考察不同微波时间2,3,4,5,6,7 min对GBRP提取率的影响。
(3) 液料比:固定微波温度40 ℃,提取次数2次,采用以上选出的结果,考察不同液料比10∶1,15∶1,20∶1,25∶1,30∶1,35∶1 (mL/g)对GBRP提取率的影响。
(4) 提取次数:其他条件采用以上选出的结果,考察不同提取次数1,2,3,4,5次对GBRP提取率的影响。
1.5 GBRP的抗氧化活性试验
1.5.1 GBRP溶液的配制 称取50 g发芽糙米米糠,按照试验得到的最优提取条件提取GBRP,醇沉后冷冻干燥得GBRP固体,将其配制为不同浓度的多糖溶液,测定其抗氧化活性。
1.5.2 还原力测定 根据文献[19]的方法,取不同浓度的样品溶液5.0 mL,依次加入pH值6.6的1.0 mL 0.2 mo1/L的磷酸盐缓冲溶液(PBS)、1.0 mL 1%铁氰化钾溶液,充分混合,于50 ℃水浴20 min,冷却后加入10%三氯乙酸1.0 mL,并以5 000 r/min离心15 min,取上清液1 mL,再加1 mL蒸馏水和0.1 mL 0.1%三氯化铁,静置10 min后在波长700 nm 处测吸光值。以超纯水作为阴性对照,以VC溶液为阳性对照,重复测3次,还原力Y1以吸光值为指标。
1.5.3 清除·OH能力的测定 根据文献[20]的方法修改如下,取不同浓度的样液5.0 mL,加入9 mmol/L 硫酸铁溶液1.0 mL后,加8.8 mmol/L 双氧水溶液0.1 mL,摇匀,静置10 min,加入9 mmol/L的水杨酸溶液300 μL,37 ℃水浴30 min后,于波长510 nm处测吸光度;以超纯水代替双氧水为样品本底组;以超纯水代替样品溶液为空白对照组;以VC作为阳性对照,重复测3次。·OH清除率按式(1)计算:
(1)
式中:
Y2——·OH清除率,%;
AX——样品组吸光值;
AXo——样品本底组吸光值;
A——空白对照组吸光值。
(2)
式中:

AX——样品组吸光值;
A——空白对照组吸光值。
1.5.5 清除DPPH·能力的测定 根据文献[22]的方法,取不同浓度的样液5.0 mL,加入1.0 mL(0.2 mmol/L)DPPH· 乙醇溶液,避光反应30 min,于517 nm波长处测定吸光度Ax。超纯水为空白组;将相同量无水乙醇置换DPPH·溶液为本底组,以同浓度的VC溶液作为阳性对照,重复测3次。DPPH·清除率按式(3)计算:
(3)
式中:
Y4——DPPH·清除率,%;
AX——样品组吸光值;
AXo——样品本底组吸光值;
A——空白对照组吸光值。
1.5.6 抑制脂质过氧化能力的测定 根据文献[23]的方法,分别加入脂质体磷酸盐缓冲分散系(LLS)1.0 mL、400 μmol/L三氯化铁溶液1.0 mL、不同浓度的样品5.0 mL,避光于37 ℃ 水浴1 h,加入三氯乙酸-硫代巴比妥酸-盐酸 2.0 mL,沸水浴15 min,以6 000 r/min离心15 min,取上清液于波长535 nm处测吸光度。空白管以蒸馏水代替样品测得吸光度,重复测3次。脂质过氧化抑制率按式(4)计算:
(4)
式中:
Y5——脂质过氧化抑制率,%;
AX——样品组吸光值;
A——空白对照组吸光值。
2 结果与分析
2.1 标准曲线的绘制
标准曲线方程为y=0.015 4x+0.002 8,R2=0.999 5,表明标准溶液的吸光度与不同浓度之间有很好的线性关系。
2.2 单因素试验结果
2.2.1 微波功率对GBRP提取率的影响 由图1可知, GBRP提取率在微波功率600 W以下时逐渐增加;微波功率在600 W时,提取率达到最大值(2.30%);而功率继续增加时,GBRP提取率随着功率的增加而缓慢降低,可能是在微波功率较小时,促进发芽糙米米糠中多糖的溶出;当微波功率达到一定值后,过高的功率对溶出的多糖结构产生了影响,多糖的提取率降低。因此微波功率在600 W时为最佳条件。
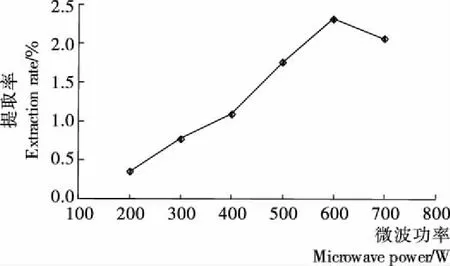
图1 微波功率对GBRP提取率的影响
Figure 1 Effect of microwave power on the extraction efficiency of polysaccharides from germinated brown rice
2.2.2 微波时间对GBRP提取率的影响 由图2可知,GBRP提取率在 4 min内随着时间的延长而增加;在4 min时达到最大提取率(2.01%);提取时间继续延长后多糖的提取率却明显降低,可能是长时间的微波辐照会破坏多糖的结构,也可能是长时间的微波处理使提取环境中局部温度升高而导致多糖的损失,进而影响了多糖的提取率。因此微波时间在4 min时为最佳条件。
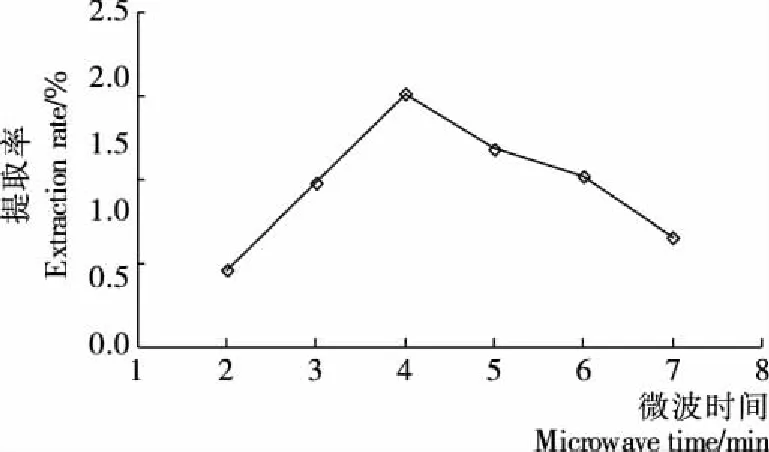
图2 微波时间对GBRP提取率的影响
Figure 2 Effect of extraction time on the extraction efficiency of polysaccharides from germinated brown rice
2.2.3 液料比对GBRP提取率的影响 由图3可知,多糖的提取率随液料比的增加先增加后减少,当液料比为25∶1(mL/g)时提取率最大(2.68%)。这可能是,液料比较少时随着溶剂量的增加,物料与溶剂间的浓度差增加,有利于多糖的传递速度且增加了多糖的溶出量;液料比较大时微波对物料辐照能力减弱,或使非多糖物质的溶出量增加,从而导致了多糖含量的降低。因此液料比在25∶1 (mL/g)时为最佳条件。
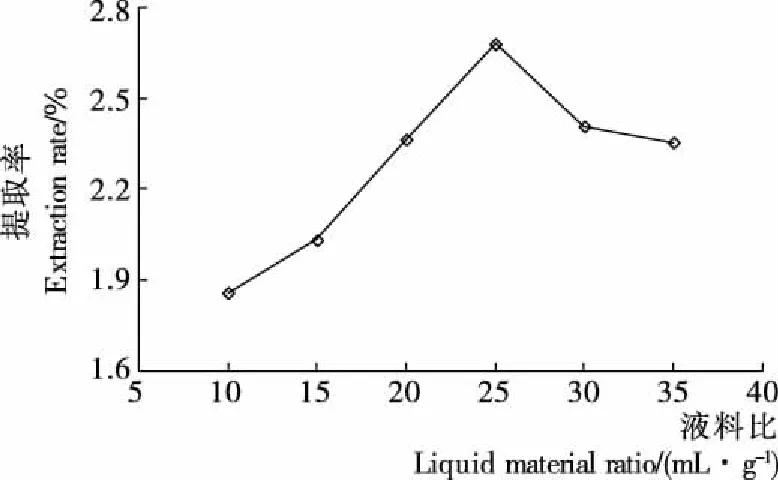
图3 液料比对GBRP提取率的影响
Figure 3 Effect of liquid-solid ratio on the extraction efficiency of polysaccharides from germinated brown rice
2.2.4 提取次数对GBRP提取率的影响 由图4可知,提取1次的效果不佳,提取2次的多糖提取率(2.56%)相较于提取1次的(1.46%)增加了约1倍;提取次数超过2次后,提取率却不再显著增大。从效率和成本等多方面考虑,提取2次为宜。
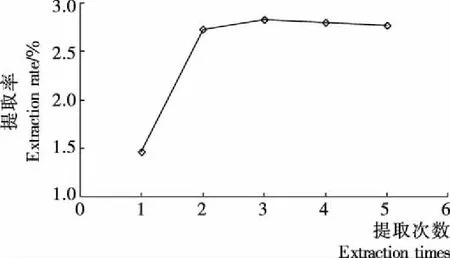
图4 提取次数对GBRP提取率的影响
Figure 4 Effect of number of extractions on the extraction efficiency of polysaccharides from germinated brown rice
2.3 响应面法优化超声波辅助提取GBRP条件
2.3.1 响应面优化试验设计 根据各单因素试验结果,采用响应面Box-Behnken模型,选择自变量为微波功率、液料比、微波时间,以GBRP提取率(Y)为响应值,设计三因素三水平试验。试验因素及水平见表1。
2.3.2 响应面试验设计及结果 根据表2试验结果,运用Design-Expert 8.0数据统计软件进行多元回归拟合,得到GBRP提取率对自变量微波功率、微波时间和液料比的二次多项回归方程:
Y=2.8+0.076A-0.26B-0.28C-0.085AB-0.072AC-0.37BC-1.1A2-0.59B2-0.48C2。
(5)
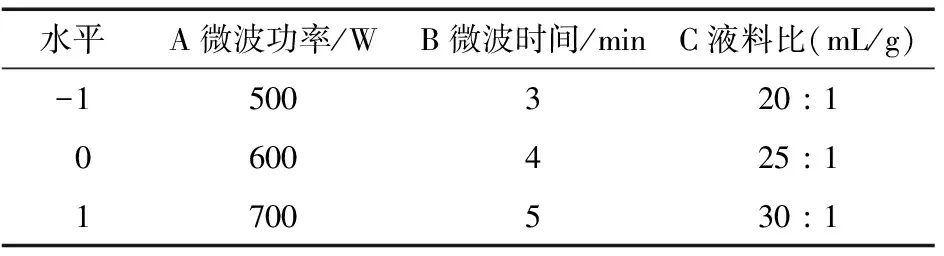
表1 GBRP响应面分析因素及水平表
表2 GBRP响应面试验设计及结果
Table 2 Experimental design and result of response surface of germinated brown rice prolysaccharides
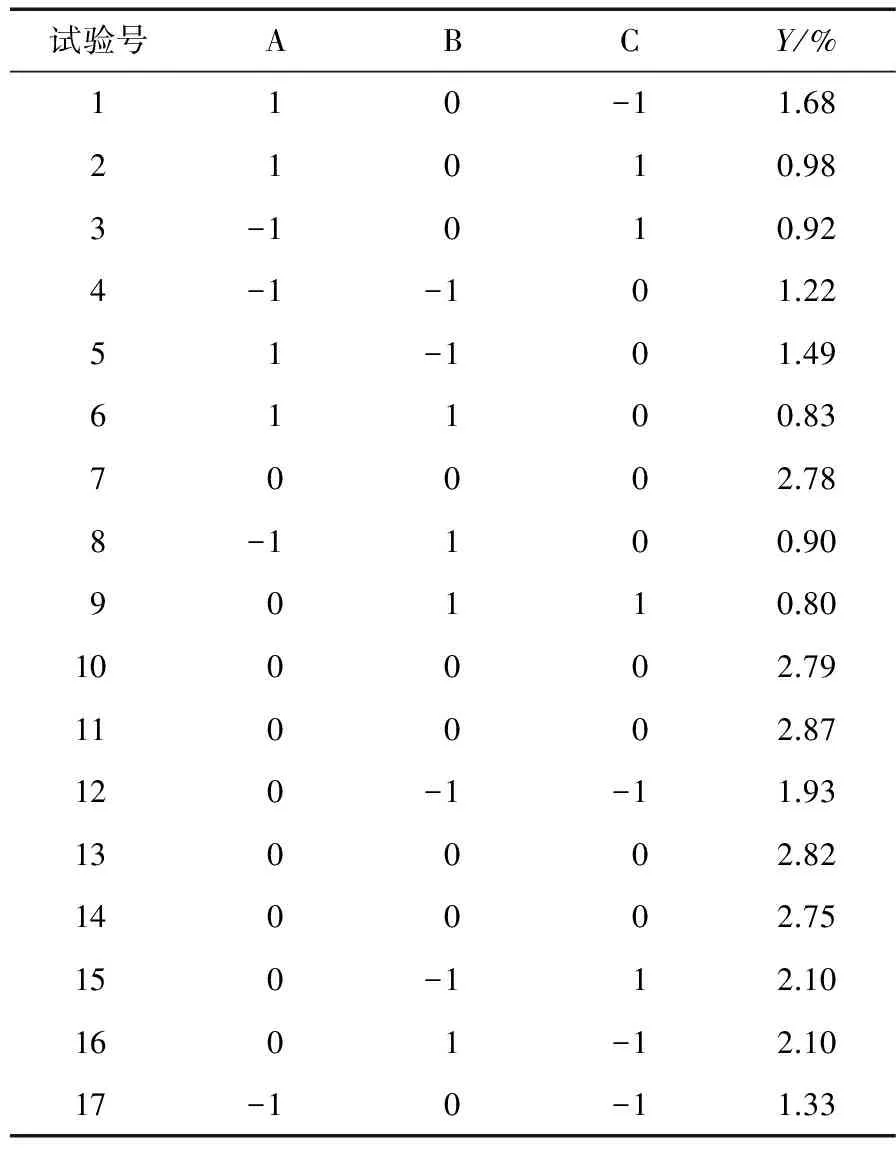
试验号ABCY/%110-11.6821010.983-1010.924-1-101.2251-101.4961100.8370002.788-1100.9090110.80100002.79110002.87120-1-11.93130002.82140002.75150-112.101601-12.1017-10-11.33
表3 GBRP响应面回归方程的方差分析表†
Table 3 Variance analysis table of response surface regression equation of germinated brown rice prolysaccharides
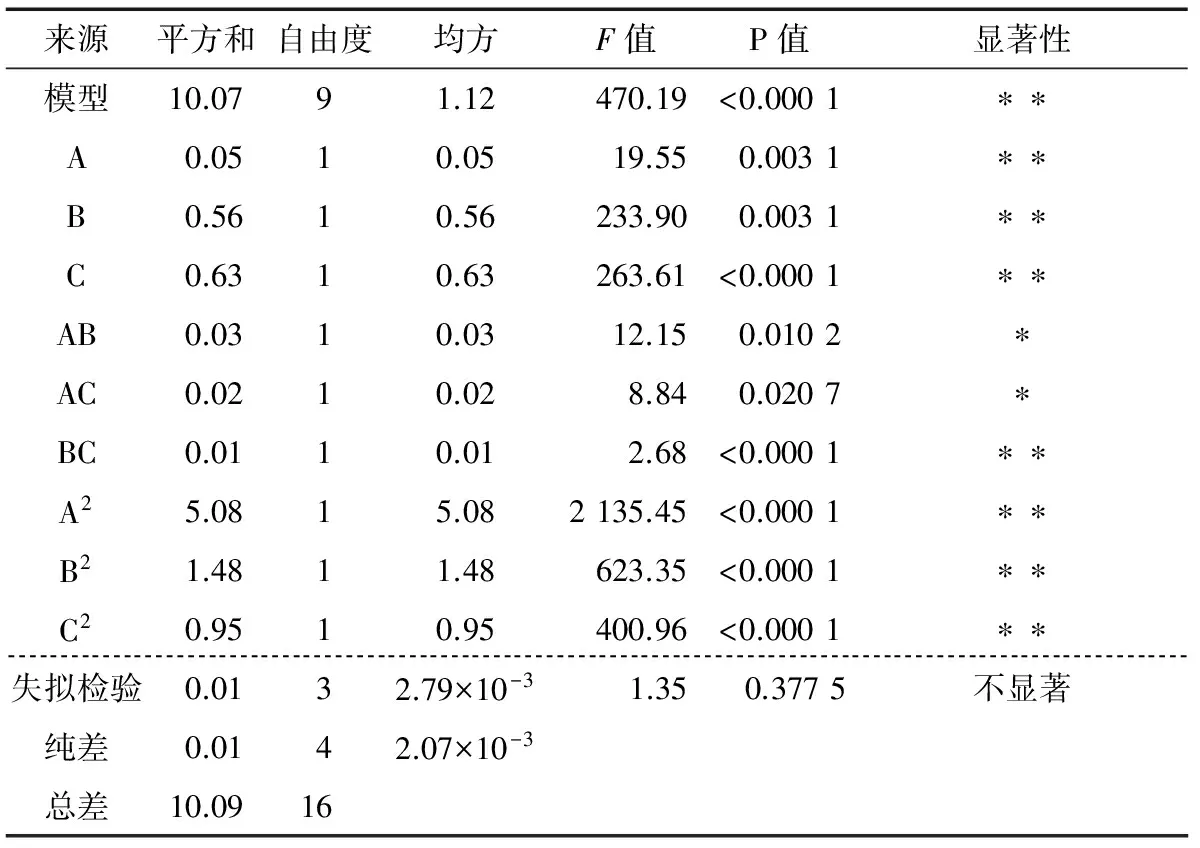
来源平方和自由度均方F值P值显著性模型10.0791.12 470.19<0.0001∗∗A0.0510.0519.550.0031∗∗B0.5610.56233.900.0031∗∗C0.6310.63263.61<0.0001∗∗AB0.0310.0312.150.0102∗AC0.0210.028.840.0207∗BC0.0110.012.68<0.0001∗∗A25.0815.082135.45<0.0001∗∗B21.4811.48623.35<0.0001∗∗C20.9510.95400.96<0.0001∗∗失拟检验0.0132.79×10-3 1.35 0.3775不显著 纯差0.0142.07×10-3总差10.0916
由表3可知,模型显著(P模型<0.000 1),失拟检验不显著(P失拟>0.05),可用于提取GBRP试验的预测;各因素对GBRP提取率的影响程度大小为微波时间>液料比>微波功率;A、B、C、BC、A2、B2、C2影响极显著,AB、AC影响显著,说明各因素对GBRP提取率的影响均为非线性关系。
2.3.3 响应面的优化与验证 在回归方程优化所得最佳条件下,即微波功率604.89 W,液料比23.81∶1 (mL/g),微波时间3.85 min,GBRP提取率的预测值为2.85%;在改进后所得条件下,即在微波功率604 W,液料比24∶1(mL/g),微波时间3.83 min,验证实验所得提取率平均值为2.82%,误差值为1.05%,说明回归方程能有效地反映各因素对GBRP提取率的影响,证明应用响应面法优化微波辅助法提取GBRP的回归模型可靠。
2.4 GBRP的抗氧化活性
2.4.1 GBRP还原力的测定 由图5可知,微波辅助法提取的GBRP还原力逐渐增加,当浓度达到0.4 mg/mL时,吸光度达到0.196,之后趋于平稳;而VC在该浓度时吸光度达1.073,GBRP的还原力约为VC的1/5。

图5 GBRP的还原力
2.4.2 GBRP对·OH的清除作用 由图6可知,微波辅助法提取的GBRP对·OH清除能力也是随着浓度的增大而增加,达到一定浓度值后趋于相对平稳。当GBRP浓度达到0.5 mg/mL时,对·OH的清除率达到最大值(88.41%)。但VC在此浓度对·OH清除率仅为64.46%。由拟合曲线Y=183.57X+112.04 (R2=0.909)计算得到GBRP的半最大效应浓度(EC50)值为0.211 mg/mL。说明GBRP溶液对·OH 有很强的清除能力,不仅高于文献[24]报道的普通糙米米糠多糖对·OH的最高清除率(63.8%),也明显高于VC的清除能力。提示糙米在发芽时启动并激活了各种酶,经酶促作用改变了多糖的活性,提高了多糖的抗氧化能力。
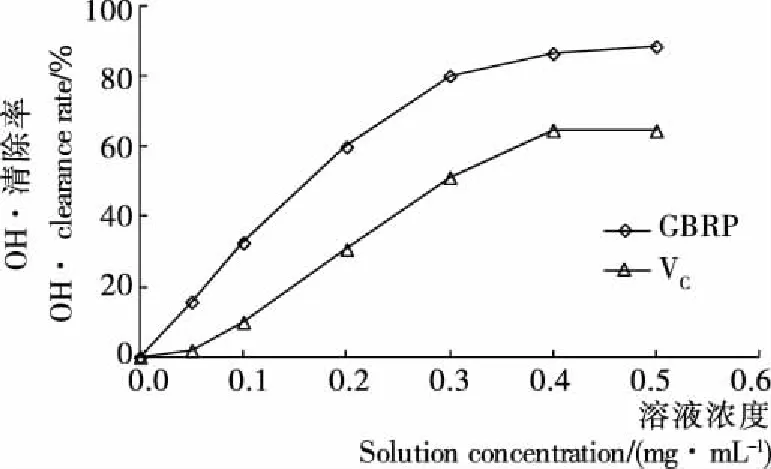
图6 GBRP对·OH的清除作用
Figure 6 Scavenging effect on hydroxyl radical of prolysaccharides from germinated brown rice
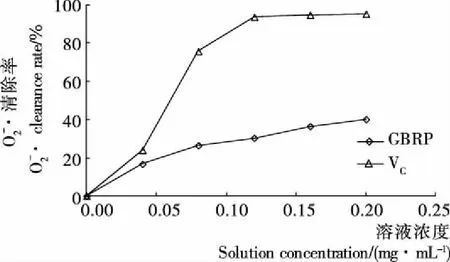
图7 GBRP对的清除作用
Figure 7 Scavenging effect on Super oxide anion radical of polysaccharide from germinated brown rice
2.4.4 GBRP对DPPH·的清除作用 由图8可知,超声波辅助提取的GBRP溶液对DPPH·清除能力随着浓度的增大而增加,清除率达到最大值后趋于平稳。当GBRP浓度达到0.4 mg/mL时,对DPPH·清除率达到最大值(52.71%),但VC在此浓度对DPPH·清除率达90.49%。由拟合曲线Y=24.728X+41.712 (R2=0.875)计算得GBRP的EC50值为0.34 mg/mL。结果表明,GBRP溶液对DPPH· 的清除能力低于VC的,而与文献[24]和[25]报道的同浓度的普通糙米米糠多糖溶液对DPPH·的清除能力(51.8%)相近。
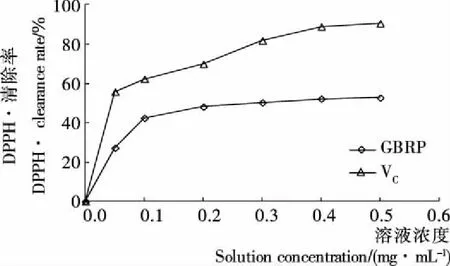
图8 GBRP对DPPH·的清除作用
Figure 8 Scavenging effect on DPPH radical of polysaccharide from germinated brown rice bran
2.4.5 GBRP对脂质过氧化的抗氧化作用 脂质过氧化过程将产生多种小分子产物,如丙二醛,会引起多种细胞功能的衰退,并且会导致多种疾病的发生[26]。由图9可知,微波辅助法提取的GBRP溶液对抑制脂质过氧化能力随GBRP浓度的增大而逐渐增加,当GBRP浓度为0.5 mg/mL时,对抑制脂质过氧化能力趋于平稳(60.86%),而VC浓度在0.5 mg/mL 时仅为39.97%。由拟合曲线Y=568.12X+6.473 4 (R2=0.865 2)计算得到GBRP的EC50值为0.077 mg/mL。GBRP溶液的抑制脂质过氧化能力不仅高于文献[27]报道的普通糙米米糠多糖的(49.30%),还高于VC的。提示糙米经发芽过程改变了多糖的活性,提高了多糖的抗氧化能力,特别是对脂质过氧化的抗氧化能力明显增强。
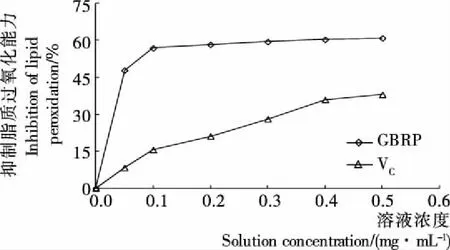
图9 GBRP抑制脂质过氧化能力
3 结论
本试验对微波辅助提取GBRP的工艺条件及其抗氧化活性进行研究。结果表明,其最佳提取工艺条件为提取温度40 ℃、微波功率604 W、液料比24∶1 (mL/g)、微波时间3.83 min、提取次数2次,该条件下GBRP提取率为2.82%;同未发芽的糙米多糖的抗氧化活性进行对比后证明微波辅助有利于GBRP的提取,并且通过多指标结果表明糙米经发芽活化,改变了其多糖活性,GBRP的抗氧化性高于普通糙米多糖的。
GBRP对·OH的清除率和抑制脂质过氧化能力不仅高于普通糙米多糖,甚至高于同浓度VC的,表明发芽糙米可作为高抗氧化性多糖进行研究开发,并可作为功能食品、化妆品等增值产品的一个新的原料。但该试验仅对发芽糙米的粗提多糖进行了研究,后期将从成分和结构角度对GBRP进一步深入分析。
[1] 汪阿虎. 高含量GABA发芽糙米的制备工艺优化和GABA的提取纯化初探[D]. 长沙: 中南林业科技大学, 2012: 1-2.
[2] 张守文. 糙米的营养保健功能[J]. 粮食与饲料工业, 2003(12): 39-42.
[3] 高丽红, 吴盛文, 何旭孔, 等. 糙米及其制品营养成分含量的比较[J]. 粮食与饲料工业, 2016(5): 4-5.
[4] CAPEK P, MACHOVA E, TURJAN J, et al. Scavenging and antioxidant activities of mmunomodulating polysaccharides isolated from Salvia officinal is L[J]. International Journal of Biological Macromolecules, 2009, 44(1): 75-80.
[5] LUO Ao-xue, HE Xing-jin, ZHOU Song-dong, et al. Purification, composition analysis and antioxidant activity of the polysaccharides from Dendrobium nobile Lindl[J]. Carbohydrate Polymers, 2010, 79(4): 1 014-1 019.
[6] GAN Chee-yuen, LATIFF A A. Extraction of antioxidant pectic-polysaccharide from mangosteen (Garcinia mangostana) rind: optimization using response surface methodology[J]. Carbohydrate Polymers, 2011, 83(2): 600-607.
[7] HAN Jiang-wei, JIANG Xing-ming, ZHANG Li-da. Optimisa-tion of extraction conditions for polysaccharides from the roots ofIsatistinctoriaL. by response surface methodology and their in vitro free radicals scavenging activities and effects on IL-4 and IFN-mRNA expression in chicken lymphocytes[J]. Carbohydr-ate Polymers, 2011, 86(3): 1 320-1 326.
[8] CHEN Jing-jing, ZHANG Tao, JIANG Bo, et al. Characterization and antioxidant activity of Ginkgo biloba exocarp polysaccharides[J]. Carbohydrate Polymers, 2012, 87(1): 40-45.
[9] LEI Jin-wei, DING Shao-dong, DING Xiao-lin,et al. Optimiz-ation of the ultrasonically assisted extraction of polysaccharides from Zizyphus jujuba cv. jinsixiaozao[J]. Journal of Food Engineering, 2007, 80(1): 176-183.
[10] BALAVIGNESWARAN C K, SUJIN J K T, MOSES P R,et al. Anti-oxidant activity of polysaccharides extracted from Isocrysis galbana using RSM optimized conditions[J]. International Journal of Biological Macromolecules, 2013, 60(6): 100-108.
[11] BAGHERIAN H, ASHTIANI F Z, FOULADITAJAR A. Comparisons between conventional, microwave-and ultrasound-assisted methods for extraction of pectin from grapefruit[J]. Chemical Engineering & Processing Process Intensification, 2011, 50(11/12): 1 237-1 243.
[12] SENTHIL KC, SIVAKUMAR M. Microwave-assisted extraction of polysaccharides from Cyphomandra betacea and its biological activities[J]. International Journal of Biological Macromolecules, 2016, 92: 682-693.
[13] HOSSEINI S S, KHODAIYAN F, YARMAND M S. Optimization of microwave assisted extraction of pectin from sour orange peel and its physicochemical properties[J]. Carbohydrate Polymers, 2016, 140: 59.
[14] WANG Yong-gang, LENG Fei-fan, LIU Xiao-feng, et al. Optimization of microwave-assisted extraction of water-soluble polysaccharides from piteguo fruit by response surface methodology[J]. Food Science & Technology Research, 2014, 20(4): 755-764.
[15] 刘晓飞, 王鑫, 孟庆红, 等. 发芽糙米多糖双水相萃取工艺优化及其抗氧化活性[J]. 食品与机械, 2017, 33(7): 149-154.
[16] 董群, 郑丽伊. 改良的苯酚—硫酸法测定多糖和寡糖含量的研究[J]. 中国药学杂志, 1996, 31(9): 550-553.
[17] 冯自立, 党娅. 响应面法优化微波提取枳椇子多糖及其清除羟自由基活性研究[J]. 食品科学, 2013, 34 (12): 56-60.
[18] KIT Leong Cheong, WANG Lan-ying, WU Ding-tao, et al. Microwave-assisted extraction, chemical structures, and chain conformation of polysaccharides from a novel cordyceps sinensis fungus UM01[J]. Journal of Food Science, 2016, 81(9): C2 167.
[19] 何传波, 魏好程, 熊何健, 等. 酶与微波处理对海带多糖提取及抗氧化活性的影响[J]. 食品科学, 2013(18): 51-55.
[20] 刘水英, 李新生, 党娅, 等. 响应面法优化紫山药花青苷提取工艺及其抗氧化活性[J]. 食品科学, 2014, 35(22): 84-91.
[21] 程知庆, 沈和定, 姚理想, 等. 干燥方法对瘤背石磺多糖抗氧化性和还原力的影响[J]. 食品与机械, 2015, 31(6): 169-172.
[22] 周中流, 石任兵, 等. 卷丹乙醇提取物及其不同极性部位抗氧化活性的比较研究[J]. 食品科学, 2011(9): 55-58.
[23] 董秀芳, 李楠, 韩冬, 等. 裙带菜孢子叶多糖的超声辅助提取工艺优化及其抗氧化活性研究[J]. 食品与机械, 2015, 31(4): 162-166.
[24] ZHA Xue-qiang, WANG Jun-hui, YANG Xue-fei, et al. Antioxidant properties of polysaccharide fractions with different molecular mass extracted with hot-water from rice bran[J]. Carbohydrate Polymers, 2009, 78(3): 570-575.
[25] YUAN Jiang-feng, ZHANG Zhi-qi, FAN Zhi-chao, et al. Antioxidant effects and cytotoxicity of three purified polysacchar-ides from Ligusticum chuanxiong Hort[J]. Carbohydrate Polymers, 2008, 74(4): 822-827.
[26] HALLIWELL B. Vitamin C and genomic stability[J]. Mutation Research/fundamental & Molecular Mechanisms of Mutagenesis, 2001, 475 (1/2): 29-35.
[27] HEFNAWY H T M, ELSHOURBAGY G A. Chemical analysis and antioxidant activity of Polysaccharide extracted from rice bran[J]. World Journal of Dairy & Food Sciences, 2014, 9(2): 95-104.

