银杏叶色素超声辅助提取工艺优化及其稳定性研究
李 玲LI Ling 闫旭宇 -
(1. 湖南科技学院化学与生物工程学院,湖南 永州 425199;2. 湖南省银杏工程技术研究中心,湖南 永州 425199;3. 延安大学生命科学学院,陕西 延安 716000)
银杏(GinkgobilobaL.)为银杏科银杏属植物,现代化学及药理研究表明,银杏叶的活性成分主要是黄酮类化合物和萜内酯类化合物[1],具有抗氧化、抑制血小板聚集、扩张动脉血管、降血糖、调血脂等药理作用,在临床上用来治疗血栓、炎症和心血管疾病[2]。目前,国内外学者先后对银杏化学成分[3]、药理作用[4]及临床应用[5]做了大量研究,主要集中在黄酮、内酯及多糖的分离纯化,以及相关制剂的制备生产方面,但关于银杏叶色素提取及其稳定性方面的研究报道比较少。刘咏等[6]曾采用洗滤法对银杏色素进行提取并研究其稳定性;文赤夫等[7]曾采用石油醚浸提法对银杏色素进行提取并研究其稳定性;赵磊等[8]曾采用微波法、水浴法、超声波提取法对银杏黄色素进行提取并研究其染色性能。目前,还未见利用超声辅助乙醇提取银杏色素稳定性方面的报道。
由于不同方法提取的银杏色素稳定性有一定的差异。同时,考虑到银杏叶色素作为天然食品着色剂的用途,本研究拟采用超声辅助乙醇提取银杏叶色素,利用正交试验优化银杏叶色素的提取工艺,并研究了酸、碱、热、金属离子和光照等因素对银杏叶色素稳定性的影响,以期为进一步开发银杏资源提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
银杏叶:采自湖南永州桐子坳;
无水乙醇、磷酸氢二钠、磷酸二氢钠、氯化钠、氯化镁、氯化钙、氯化铜、氯化铁:分析纯,天津市福晨化学试剂厂。
1.1.2 仪器与设备
电热鼓风干燥箱:WG-71型,天津市泰斯特仪器有限公司;
中草药粉碎机:FW177型,天津市泰斯特仪器有限公司;
电子分析天平:JA3003型,上海舜宇恒平科技仪器有限公司;
可见分光光度计:721型,浙江赛德仪器设备有限公司;
电热恒温水浴锅:DK-98-ⅡA型,上海百典仪器设备有限公司;
旋转蒸发仪:YRE-2010-Ⅱ型,郑州长城科工贸有限公司;
超声波清洗仪:BL3-120型,上海比朗仪器制造有限公司。
1.2 试验方法
1.2.1 银杏叶色素的提取 新鲜银杏叶于60 ℃干燥至恒重,粉碎过80目筛,放入50 mL锥形瓶中,加入乙醇,摇匀,在一定温度下超声(300 W)辅助浸提,离心过滤取上清液,即为银杏叶色素提取液。
1.2.2 银杏叶色素吸光度的确定 取10.0 mL色素提取液,蒸馏水稀释并定容至100 mL,用可见分光光度计在420~450 nm波长范围内测定吸收光谱,确定其最佳吸收波长。
1.2.3 单因素试验
(1) 乙醇浓度的选择:固定溶液pH值6.0、料液比1∶20 (g/mL)、提取温度60 ℃、提取时间90 min,乙醇浓度分别设置为80%,85%,90%,95%,100%,平行试验3次,研究乙醇浓度对银杏叶色素吸光度的影响。
(2) 料液比的选择:固定溶液pH值6.0、乙醇浓度95%、提取温度60 ℃、提取时间90 min,料液比分别设置为1∶10,1∶15,1∶20,1∶25,1∶30 (g/mL),平行试验3次,研究料液比对银杏叶色素吸光度的影响。
(3) pH值的选择:固定乙醇浓度95%、料液比1∶20 (g/mL)、提取温度60 ℃、提取时间90 min,pH值分别设置为4,5,6,7,8,平行试验3次,研究pH值对银杏叶色素吸光度的影响。
(4) 提取温度的选择:固定溶液pH值6.0、乙醇浓度95%、料液比1∶20 (g/mL)、提取时间90 min,提取温度分别设置为40,50,60,70,80 ℃,平行试验3次,研究提取温度对银杏叶色素吸光度的影响。
(5) 提取时间的选择:固定溶液pH值6.0、乙醇浓度95%、料液比1∶20 (g/mL)、提取温度60 ℃时,提取时间分别设置为0.5,1.0,1.5,2.0,2.5 h,平行试验3次,研究提取时间对银杏叶色素吸光度的影响。
1.2.4 正交试验 在单因素试验的基础上,选择4个影响较大的因素作为正交试验因素,采用L9(34)正交设计对其进行优化,得出超声辅助乙醇提取银杏叶色素的最佳工艺条件。
1.2.5 稳定性试验
(1) 酸碱对银杏叶色素稳定性影响:准确吸取1 mL银杏叶色素提取液,定容至10 mL,用磷酸缓冲液调节pH值分别为2,3,4,5,6,7,8,9,10,11,12,静置1 h,在最佳波长处测定其吸光度。
(2) 温度对银杏叶色素稳定性影响:准确吸取1 mL银杏叶色素提取液,定容至10 mL,分别在20,30,40,50,60,70,80,90 ℃水浴30 min,在最佳波长处测其吸光度值。
(3) 金属离子对银杏叶色素稳定性影响:准确吸取5 mL银杏叶色素提取液,分别置于5支试管中,与0.1 mol/L的Na+、Mg2+、Cu2+、Fe3+、Ca2+溶液以1∶1的体积比振荡混合,室温静置6 h,在最佳波长处测定其吸光度。
(4) 光照对银杏叶色素稳定性影响:准确吸取2 mL银杏叶色素提取液,定容至20 mL,静置,分别在日光、室内光和避光条件下保存2,4,6,8,10 h,在最佳波长处测定其吸光度。
2 结果与分析
2.1 银杏叶色素最佳吸收波长的确定
如图1所示,银杏叶色素特征吸收峰为435~450 nm,本试验确定银杏叶色素的最佳吸收波长为445 nm。
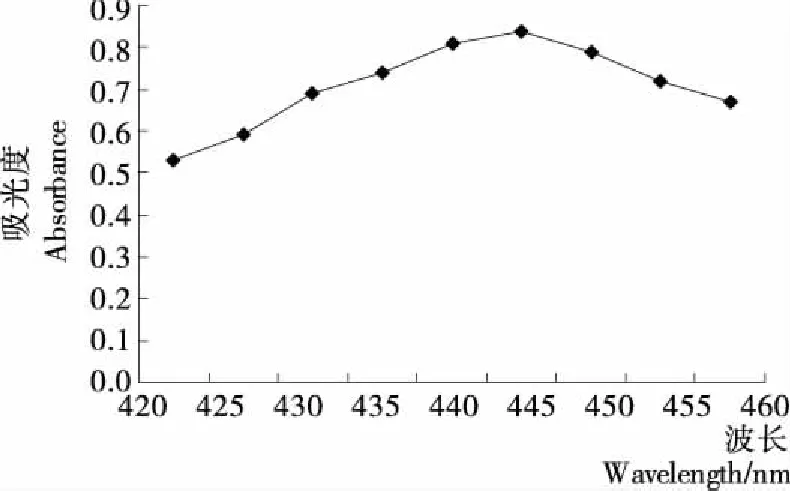
图1 银杏叶色素的吸收波长
2.2 单因素试验结果
2.2.1 乙醇浓度的确定 由图2可知,随乙醇浓度的增加,银杏叶色素的吸光度值呈上升趋势,在乙醇浓度为95%时达到最高。可能是由于该色素易溶于乙醇,在浸提液中的溶解率随着乙醇浓度的增加而逐渐升高。然而,当采用无水乙醇浸提,即乙醇浓度达到100%时,色素提取液的吸光值略有降低。可见,用有一定含水量的乙醇来提取银杏叶色素效果更好,但水分过多会导致溶解度下降。因此,初步确定乙醇浓度为95%。
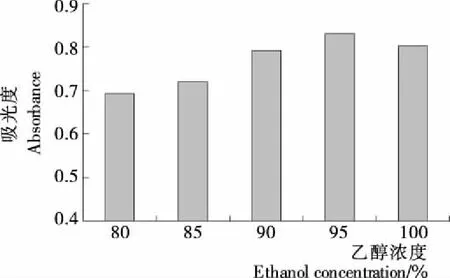
图2 不同乙醇浓度下色素的吸光度值
2.2.2 料液比的确定 由图3可知,随着溶剂的增加,银杏叶色素的吸光度值先上升后下降。料液比为1∶20(g/mL)时,吸光度值最高,表明银杏叶色素在料液比1∶20(g/mL)的条件下已基本溶出。料液比太大,银杏叶粉末与浸提液接触不充分,不利于色素全部溶出;料液比太小,则浸提液过多,虽然色素的溶出更加充分,但不利于后期浓缩[9],并且还会引起其它物质溶出,使银杏叶色素有效浓度降低,导致吸光度下降[10]。因此,料液比以1∶20 (g/mL)为宜。
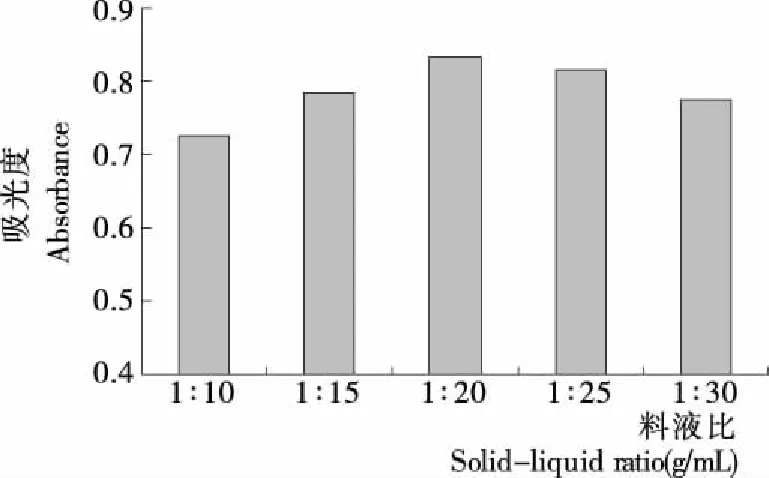
图3 不同料液比下色素的吸光度值
2.2.3 pH值的确定 由图4可知,随着pH值的增加,银杏叶色素的吸光度值先上升后下降,在pH值为6时,吸光度值最高。说明银杏叶色素在弱酸偏中性条件下溶解度达到最大,pH值为4和8时,吸光度值下降,可能是在偏酸或偏碱条件下,色素的发色基团不稳定,会发生某些化学反应引起吸光度值下降[9]。因此,pH值为6时提取效果最好。
2.2.4 提取温度的确定 由图5可知,随着温度的升高,银杏叶色素的吸光度值逐渐上升,当浸提温度达到60 ℃时,浸提效果最好,之后当浸提温度高于60 ℃时,吸光度值逐渐下降。说明在较低的温度下,随着温度升高,分子运动加剧,细胞膜的通透性和溶剂的渗透能力逐渐增强[11-13],利于银杏叶色素的溶出。但如果温度高于60 ℃,银杏叶色素对热不稳定,温度升高易使色素分解,导致提取效果降低[14]。因此,最佳浸提温度为60 ℃。
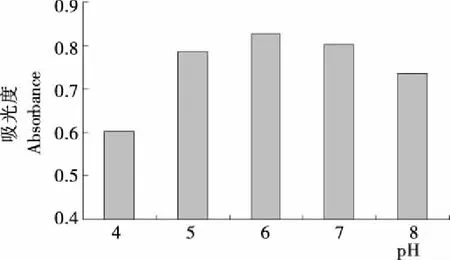
图4 不同pH值下色素的吸光度值
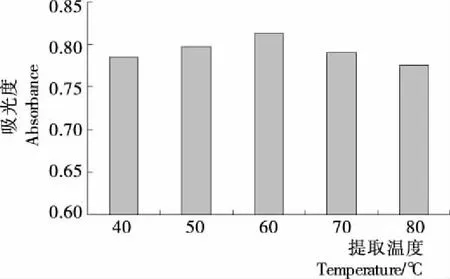
图5 不同提取温度下色素的吸光度值
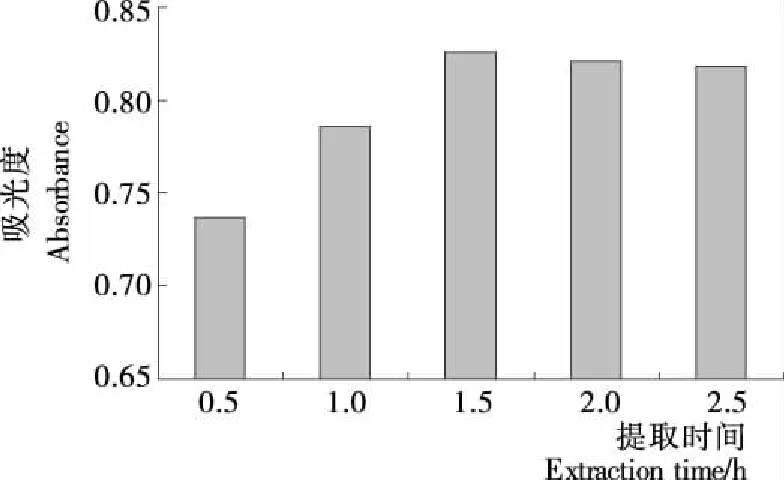
图6 不同提取时间下色素的吸光度值
2.2.5 提取时间的确定 由图6可知,随着浸提时间的延长,银杏叶色素的吸光度值迅速上升,在1.5 h时达到最高值,之后如继续提取,吸光度略有下降,但浸提效果变化不明显。可能是在1.5 h时色素已完全溶出,如果继续延长提取时间,则会导致溶出色素发生分解或其它醇溶性物质溶出,使银杏叶色素的有效浓度下降,影响吸光度值的准确性[15-16]。因此,最佳浸提时间为1.5 h。
2.3 银杏叶色素提取条件的优化
基于单因素试验结果,选取乙醇浓度、pH值、提取温度和提取时间为正交试验因素,以银杏叶色素吸光度为指标,按照表1的因素水平进行正交优化试验。
由表2可知,影响银杏叶色素吸光度的主次因素依次为乙醇浓度>pH值>提取温度>提取时间,乙醇浓度对提取率的影响相对较大。超声辅助乙醇提取银杏叶色素的最佳组合为A2B2C2D2,即乙醇浓度95%,pH值6.0,提取温度60 ℃,提取时间2.0 h。在最佳组合条件下设置3次平行实验进行验证,最终得到银杏叶色素的吸光度值为0.831。
2.4 稳定性试验结果
表1银杏叶色素提取的正交试验因素与水平
Table 1 The orthogonal test variables and levels of pigment extraction from the leaves ofGinkgobiloba

水平A乙醇浓度/%BpH值C提取温度/℃D提取时间/h1905.0501.52956.0602.031007.0702.5
表2银杏叶色素提取的正交试验结果
Table 2 The orthogonal experiment results of pigment extraction from the leaves ofGinkgobiloba

序号ABCD吸光度111110.783212220.819313330.806421230.821522310.828623120.815731320.796832130.801933210.804k10.8030.8000.8000.805 k20.8210.8160.8150.810k30.8000.8080.8100.809R0.0210.0160.0150.005
2.4.1 酸碱对银杏叶色素稳定性的影响 由表3可知,银杏叶色素在pH 5~8时比较稳定,在pH 2~4和pH 10~12时,色素溶液吸光度明显上升。由此推断,在弱酸和弱碱性条件下银杏叶色素的稳定性较好,可作为偏中性饮料等食品的着色剂[17]。在偏酸及偏碱条件下不稳定,其原因是酸性或碱性条件改变了色素中发色基团的结构,导致吸光值的明显变化[9]。因此在银杏叶色素的开发使用过程中,要注意酸碱性的影响。
2.4.2 温度对银杏叶色素稳定性的影响 由表4可知,银杏叶色素具有一定的耐热性,在温度为20~70 ℃时,吸光度变化不大,80~90 ℃时,吸光度明显下降。可能是银杏叶色素对热不稳定,在80~90 ℃时易发生氧化反应,导致共价键断裂引起色素分解,最终引起吸光值下降[18]。因此在制备和储存银杏叶色素时应尽量避免长时间处于70 ℃以上的高温。

表3 不同pH值条件下银杏叶色素的吸光度值

表4 不同温度条件下银杏叶色素的吸光度值

表5 不同金属离子条件下色素的吸光度值
2.4.3 金属离子对银杏叶色素稳定性的影响 由表5可知,Na+和Ca2+对银杏叶色素基本无影响,Mg2+和Cu2+溶液使银杏叶色素吸光度值明显增大,Fe3+使银杏叶色素吸光度值增大最明显。说明银杏叶色素或某些色素基团可能与Mg2+、Cu2+和Fe3+发生了络合反应,导致吸光度值增加[19]。因此,在银杏叶色素加工贮存和应用过程中应尽量避免与Mg2+、Cu2+和Fe3+接触,这与金属离子对乌饭叶、紫色甘薯茎叶和山竹壳色素的稳定性研究是一致的[20-22]。
2.4.4 光照对银杏叶色素稳定性的影响 由图7可知,避光保存的银杏叶色素吸光度值明显高于日光照射和室内自然光条件的吸光度值。日光照射对银杏叶色素的影响较大,随着放置时间的延长色素的吸光度值逐渐下降。室内自然光照射对银杏叶色素的影响没有日光照射明显,吸光度值随着照射时间的延长呈现缓慢下降。避光保存时,银杏叶色素的稳定性非常好,保存时间在0~10 h时其吸光度值没有明显变化。因此,贮存并运输银杏叶色素时应尽可能避光或者添加一定的色素稳定剂[18]。
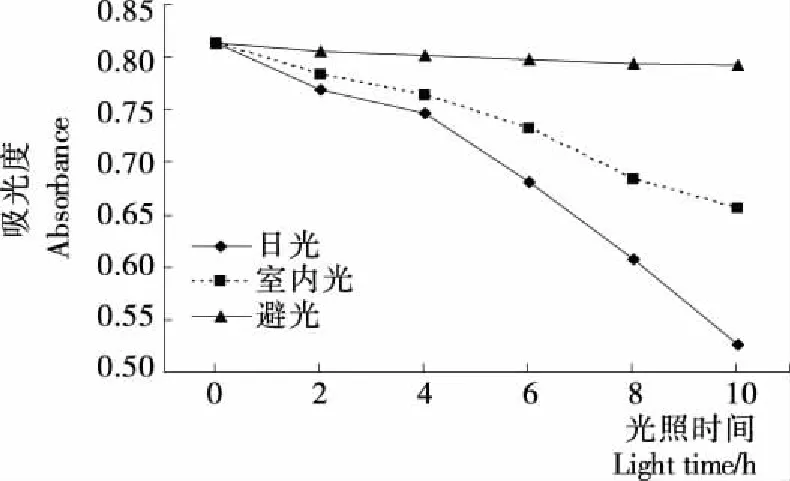
图7 不同光照条件下银杏叶色素的吸光度值
3 结论
本试验采用超声辅助乙醇浸提法提取银杏叶色素,通过单因素试验和正交试验对影响银杏叶色素提取效果的因素进行了研究。结果表明,银杏叶色素最佳提取工艺条件为:乙醇浓度95%、pH值6.0、提取温度60 ℃、提取时间2 h,此条件下银杏叶色素的吸光度为0.831。超声辅助醇提法简单易行,乙醇作为提取溶剂安全环保。
银杏叶色素在弱酸和弱碱性条件下稳定性较好,在偏酸及偏碱条件下不稳定;对金属离子Na+、Ca2+比较稳定,对 Fe3+、Cu2+、Mg2+不稳定,在银杏叶色素生产和应用过程中应尽量避免与Mg2+、Cu2+和Fe3+接触;70 ℃以上温度会促进银杏叶色素分解,在制备和贮存银杏叶色素时应尽量避免长时间处于70 ℃以上的高温;银杏叶色素对日光和室内光均不稳定,宜避光保存。银杏叶色素可以作为一种良好的天然食用色素进行开发利用。
[1] STROMGAARD K, NAKANISHIK. Chemistry and biology of terpene trilactones fromGinkgobiloba[J]. Angewandte Chemie International Edition, 2004, 43(13): 1 640-1 658.
[2] LIN Xiao-han, ZHANG Jin, LI Ying, et al. Functional genomics of a living fossil tree, Ginkgo, based on next-generation sequencing technology[J]. Physiologia Plantarum, 2011, 143(3): 207-218.
[3] 池静端, 徐礼, 马辰. 银杏叶的化学成分研究[J]. 中国中药杂志, 1997, 22(2): 105-107.
[4] 杨静峰, 张旭, 梁忠岩. 银杏叶水溶性多糖的分离、纯化、初步鉴定及活性研究[J]. 特产研究, 2006, 28(4): 51-53.
[5] BEEK T A V, SCHEEREN H A, MELGERW C, et al. Determination of ginkgolides and bilobalide inGinkgobilobaleaves and phytopharmaceuticals[J]. Journal of Chromatography A, 1991, 543: 375-387.
[6] 刘咏, 陈莉. 银杏叶中绿色素的组成及稳定性研究[J]. 食品科技, 2007, 33(6): 174-176.
[7] 文赤夫, 向小奇, 刘旋, 等. 银杏叶黄色素提取及稳定性研究[J]. 食品科学, 2010, 31(8): 43-45.
[8] 赵磊, 张玲珑, 裴付宇, 等. 银杏叶黄色素对大麻/桑皮/羊毛混纺纱的染色性能[J]. 毛纺科技, 2015, 43(3): 33-36.
[9] 许海棠, 廖艳娟, 欧小辉, 等. 密蒙花黄色素的提取及其稳定性研究[J]. 食品与发酵工业, 2015, 41(6): 218-222.
[10] 崔荣健, 岳鹍. 辣椒红素超声波辅助提取工艺的研究与优化[J]. 食品研究与开发, 2010, 31(12): 48-50.
[11] 王芳, 张庆庆, 乔璐, 等. 响应面法优化乌饭叶色素提取工艺[J]. 山西农业科学, 2014, 42(8): 917-920.
[12] 黄昕蕾, 李晓东, 孙国峰, 等. 萱草花色素的超声波辅助提取及其稳定性研究[J]. 山西农业科学, 2013, 41(5): 440-445.
[13] 罗璇, 何景. 超声辅助提取花生红衣色素工艺的优化[J]. 食品与机械, 2016, 32(9): 172-176.
[14] 张瑞, 邢军, 毛居代·亚尔买买提, 等. 红苋菜天然红色素的提取及其稳定性[J]. 食品与发酵工业, 2013, 39(1): 208-214.
[15] 杨萍, 牛春艳. 响应面法优化紫色甘薯茎、叶色素提取工艺[J]. 食品科学, 2010, 31(12): 148-152.
[16] 杨钰钦, 吴赞敏, 任崇玲, 等. 辣椒红色素的提取、乳化及对牛奶蛋白复合纤维的染色[J]. 毛纺科技, 2010, 38(6): 24-29.
[17] 张娜, 魏龙, 蒋彩飞, 等. 莴笋叶色素稳定性研究[J]. 中国食品添加剂, 2016(12): 94-98.
[18] PATRAS A, BRUNTON N P, O'DONNELL C, et al. Effect of thermal processing on anthocyanin stability in foods, mechanisms and kinetics of degradation[J]. Trends in Food Science & Technology, 2010, 21(1): 3-11.
[19] 崔福顺, 金清, 李铉军, 等. 兴安杜鹃花色素提取及理化性质研究[J]. 食品与机械, 2011, 27(4): 61-64.
[20] 王芳, 张庆庆, 赵森妙, 等. 乌饭叶色素的稳定性研究[J]. 湖南农业科学, 2014(15): 56-59.
[21] 杨萍. 紫色甘薯茎叶色素理化性质研究[J]. 东北农业大学学报, 2010, 41(7): 113-117.
[22] 章斌, 侯小桢, 郭丽莎. 山竹壳色素稳定性研究[J]. 食品与机械, 2011, 27(3): 35-37.

