嗜水气单胞菌脂多糖提取及毒性研究
蒋栋磊JIANG Dong-lei 刘 延 葛攀玮 - 吴满刚 - 葛庆丰 - 方维明 -
(扬州大学食品科学与工程学院,江苏 扬州 225127)
中国淡水养殖业发达,淡水鱼主要依靠微冻保鲜技术保存[1],但部分耐冷菌株增殖导致鱼类腐败变质,造成严重经济损失[2]。其中嗜水气单胞菌(Aeromonashydrophila)是主要腐败菌之一[3]。大量研究表明嗜水气单胞菌腐败能力与其毒力因子密切相关[4-5],其中脂多糖(LPS)由多糖链与类脂组成,具有高毒性和免疫学活性[6]。
细胞是构成生物体的基本组成和功能单元[7]。细胞模型利用细胞的高敏感性,迅速识别外界环境变化,具有主动、真实、准确等优势[8]。根据细胞生理变化和细胞力学的特殊性质,可将细胞用于对危害物的检测和评价[9-10]。本试验选用的巨噬细胞Ana-1对外源物应激反应较强,具有充足的研究基础, Wang Hui等[11]和WANG Xue-mei等[12]分别利用巨噬细胞Ana-1细胞模型研究了弓形虫诱导HMGB1释放作用,以及LPS对细胞的毒性及损伤作用。
本试验提取了嗜水气单胞菌菌体表面的脂多糖(LPS),并创新地利用巨噬细胞Ana-1模型对其毒性进行评价。菌体表面LPS进行提取纯化采用改良的热酚水法[13-14]、酶解法[15]与醇沉法[16],并测算LPS产率,检测所得纯化LPS样品中蛋白质与核酸含量,利用SDS-PAGE电泳分析纯度。建立巨噬细胞Ana-1模型,通过细胞活力、胞内Ca2+水平变化以及电镜观察,比较纯化LPS样品与LPS标准品对巨噬细胞Ana-1的损伤情况,判定纯化LPS样品的毒性和生物活性,为后续提取与检测方法的开发提供技术支持。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
嗜水气单胞菌菌株(Aeromonashydrophilasubsp.hydrophilaATCC 7966 chromosome): 由扬州某市场的草鱼样品分离得到;
巨噬细胞Ana-1:中科院上海细胞库;
LPS标准品、DNase I、RNase A、蛋白酶K:美国Sigma公司;
胰酶消化液、Fluo-4 AM (5 mmol/L)钙离子荧光探针、CCK-8试剂盒:碧云天生物技术有限公司。
1.1.2 主要仪器设备
单人双面净化工作台:SW-CJ-1F型,苏州净化设备有限公司;
高压蒸气灭菌锅:SX-500型,日本TOMMY公司;
台式高速冷冻离心机:Sorvall ST 16R型,美国Thermo Fisher公司;
冷冻干燥机:Alpha 1-2LD PoLus型,德国Martin Christ公司;
CO2恒温培养箱:3111型,美国Thermo Fisher公司;
荧光显微镜:IX51型,日本Olympus公司;
酶标仪:Infinite 200 PRO型,瑞士Tecan公司;
核酸蛋白测定仪:BioPhotometer plus型,德国Eppendorf公司;
场发射扫描电镜:S-4800型,日本日立公司。
1.2 试验方法
1.2.1 菌体培养 参照文献[17]。将冻存的嗜水气单胞菌菌株置室温下解冻,划线于AHM琼脂培养基,28 ℃培养24 h,挑取单菌落接入LB培养基,28 ℃摇床培养12 h后,8 000 r/min 离心10 min,收集菌体,沉淀依次用生理盐水与无菌蒸馏水洗涤1次后,收集沉淀称重,用3倍质量无菌蒸馏水重悬(即1 g菌体加入3 mL蒸馏水),得到菌悬液。
1.2.2 LPS粗提取 参照文献[13]。菌悬液反复冻融5次后,与等体积90%苯酚混合,68 ℃恒温水浴振荡1 h,冰浴至4 ℃,4 000 r/min冷冻离心20 min。收集上清,下层酚相加等体积无菌蒸馏水重复洗涤1次,合并2次上清于透析袋中,蒸馏水透析至FeCl3检测无酚试剂反应出现。透析所得溶液经真空冷冻干燥处理24 h,即制得 LPS粗样。
1.2.3 LPS的纯化 参照文献[14~16]的方法,并加以改良。10 mL Tris-HCl (100 mmol/L,pH 8.0)溶解LPS粗样,加终浓度20 mg/mL DNase I与10 mg/mL RNase A,37 ℃酶解2 h后,加终浓度20 mg/mL蛋白酶K,57 ℃处理1 h,趁热加入5 mL水饱和苯酚,混匀,4 000 r/min离心30 min,吸取上清于透析袋中,蒸馏水透析48 h后,溶液真空冷冻干燥24 h。冻干产物置于氯仿/甲醇(体积比2∶1)混合液中充分混匀,12 000 r/min离心20 min,弃上清并晾干沉淀。10 mL 蒸馏水溶解沉淀后真空冷冻干燥24 h,即得到纯化LPS样品,于-20 ℃保存备用。
1.2.4 LPS中物质的测定
(1) 蛋白质含量测定:5 mL蒸馏水溶解纯化LPS样品,用核酸蛋白测定仪检测样品中蛋白质含量,检测波长280 nm,读数稳定后读取结果,重复3次。
(2) 核酸含量测定:5 mL蒸馏水溶解纯化LPS样品,用核酸蛋白测定仪检测样品中核酸含量,检测波长260 nm,读数稳定后读取结果,重复3次。
1.2.5 LPS纯度分析 采用 SDS-PAGE 法,浓缩胶 3%,分离胶 10%,上样电泳后银染色,进行纯度分析。
1.2.6 LPS样品对Ana-1细胞影响检测
(1) CCK-8检测细胞活力:于1 000 r/min离心4 min,收集对数生长期细胞,用无血清培养液重悬后转移至96孔板中(约5 000个/孔)于37 ℃培养12 h。分别加入终浓度为5 μmol/L的LPS标准品与纯化LPS样品,并设置不含LPS的空白对照组,每组3个重复。37 ℃处理3 h后每孔加入培养液总体积10%(10 μL)的CCK-8,37 ℃孵育1 h,测定其在450 nm处吸光度,根据式(1)计算细胞活力。
(1)
式中:
C—— 细胞活力,%;
A1——加药组450 nm处吸光度;
A2——空白对照组450 nm处吸光度。
(2) 细胞内Ca2+水平的检测:收集对数生长期细胞,无血清培养液重悬后转移至24孔板中,37 ℃培养12 h后,用0.1 mol/L PBS洗涤细胞3次,每孔加入终浓度3 μmol/L的Fluo-4 AM探针,37 ℃培养1 h后,用0.1 mol/L PBS洗涤细胞3次,再孵育30 min以确保细胞内Fluo-4 AM转变为Fluo-4。随后分别加入终浓度为5 μg/mL的LPS标准品与纯化LPS样品,37 ℃处理3 h,每组3个平行,空白对照组不添加LPS。使用IX51荧光显微镜观察拍照,酶标仪检测荧光,检测激发波长为455 nm,发射波长为515 nm[18]。
(3) Ana-1细胞损伤的电镜观察:将Ana-1细胞经终浓度为5 μg/mL的LPS处理3 h后,收集细胞,琼脂包裹切片加入2.5%的戊二醛中固定4 h,保存于4 ℃冰箱中。然后用0.1 mol/L的PBS清洗3次,每次15 min。按照50%,70%,80%,90%,95%,100%的乙醇梯度脱水,每次15 min,然后用含无水硫酸钠的100%乙醇再脱水15 min。将样品放入CO2临界点干燥45 min,取出黏贴在样板上准备镀膜,利用S-4800型场发射扫描电镜进行观察。
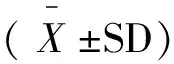
2 结果与分析
2.1 LPS提取与纯化结果
1.2 L的LB培养基培养24 h,收集菌体湿重为6.22 g,提取纯化后得到LPS共76.1 mg, LPS平均产率为1.22%。测得的蛋白浓度为232.87 mg/L,核酸浓度为120.51 mg/L,计算得出纯化后LPS中蛋白质占1.53%,核酸占0.79%,提取纯度较高,为下一步LPS毒性及生物活性检测减少干扰。
2.2 LPS纯度

1. LPS标准品 2. 纯化LPS样品
由图1可知,纯化LPS样品的主要条带清晰,大部分条带位置与标准品条带位置相同,均可以判定是LPS条带,说明纯化LPS结构完整,纯度较高。然而,泳道2顶端存在杂带,说明纯化LPS样品中仍有大分子杂质残留,结合2.1结果分析,杂带可能是残留蛋白质。
2.3 LPS对Ana-1细胞活力的影响
由图2可知,当终浓度为5 μg/mL时,LPS标准品与纯化LPS样品均能够显著抑制Ana-1细胞的活力。与空白组相比,LPS标准品组细胞活力降低了24.83%,纯化LPS样品组细胞活力降低了21.20%。与纯化LPS样品比较,LPS标准品对Ana-1细胞的活力抑制效果更强,但两组间无显著性差异(P>0.05)。
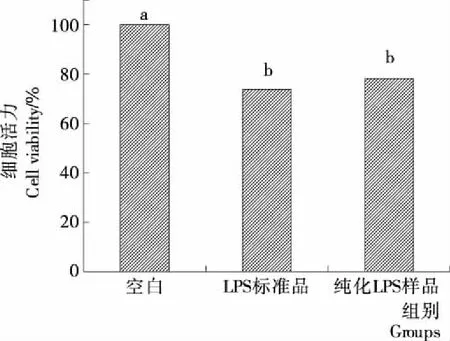
不同字母表示组间具有统计学差异(P<0.05)
2.4 LPS对细胞内Ca2+水平的影响
试验所使用的Fluo-4 AM是一种可以穿透细胞膜的荧光染料,Fluo-4 AM进入细胞后被酶剪切形成Fluo-4,与胞内Ca2+结合,产生荧光[19]。
图3显示装载了Fluo-4荧光探针后,Ana-1在荧光显微镜下的图像。图3(a)为只装载探针的空白对照组,荧光强度弱;图3(b)与3(c)分别为加入LPS标准品和纯化LPS样品处理的Ana-1细胞,从图中可以看到较明显的荧光。结合数据分析,与空白对照组比较,LPS标准品组相对荧光强度为1.92±0.12,纯化LPS样品组为1.67±0.19。结果表明,经LPS处理后,Ana-1细胞胞内Ca2+水平升高,且LPS标准品的作用强于纯化LPS样品的,但不存在显著性差异(P>0.05)。
2.5 LPS对Ana-1细胞损伤的电镜观察

图3 LPS(5 μg/mL)对巨噬细胞Ana-1胞内Ca2+水平的影响
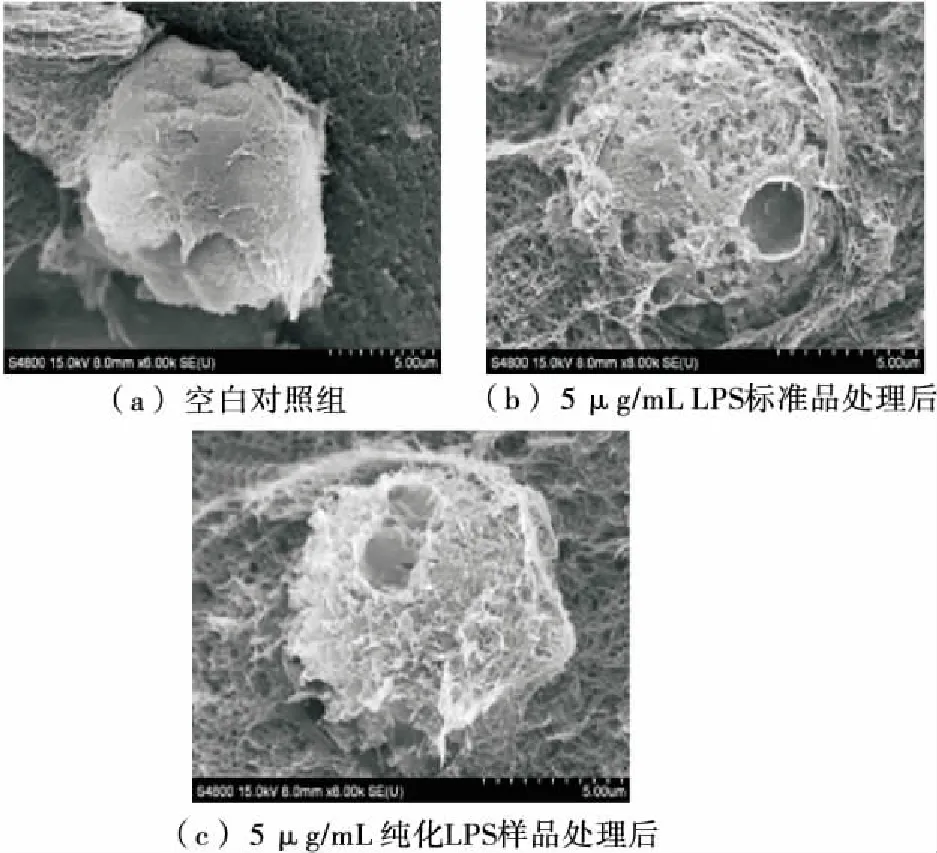
图4 LPS对Ana-1细胞形态的影响
由图4(a)可知,放大6 000倍观察正常Ana-1细胞形态饱满,表面光滑有细微绒毛状结构。图4(b)经5 μg/mL LPS标准品处理3 h后8 000倍观察,Ana-1细胞膜变得粗糙并脱落,细胞表面出现空洞,内部结构露出,形态已不完整,证明了细胞发生了较严重的破损。图4(c)为扫描电镜放大8 000 倍观察到的经5 μg/mL纯化LPS样品处理3 h后的Ana-1细胞,细胞同样表现为破损,表面有明显的空洞,细胞膜变得粗糙。说明LPS可以导致小鼠巨噬细胞Ana-1的损伤;纯化LPS样品与LPS标准品造成的损伤类似,但纯化LPS样品的毒性与生物活性相对较高。
3 结论
本试验成功制得了纯化LPS样品,杂质含量少,与LPS标准品相比,对Ana-1细胞造成损伤无显著性差异(P>0.05)。说明改良后的热酚水法及酶解法、氯仿/甲醇沉淀法能够较完好地提取、纯化菌体表面LPS,同时表明巨噬细胞Ana-1模型用于评价LPS的毒性与生物活性具有可行性,为LPS提取、检测方法的后续开发提供思路与技术支持。
与宋宏新等[15]、刘红亮等[16]的结果相比,本试验LPS产率更高,蛋白质含量更低,但纯化LPS样品中仍有0.79%的核酸残留,与宋宏新等[15]的研究结果相似。LPS能够显著抑制Ana-1细胞活力并提高胞内Ca2+浓度,同时经扫描电镜观察LPS对Ana-1细胞形态造成了一定程度的损伤,证实了Wang Xue-mei等[14]的相关研究报道结果。
为了进一步优化LPS提取、纯化方法,能否通过增加DNase I与RNase A酶浓度,延长消化时间来减少核酸残留有待深入研究。而巨噬细胞Ana-1模型的细胞活力,胞内Ca2+浓度以及细胞形态变化只能说明LPS对细胞造成损伤,具体损伤机制尚不明确,仍需进一步研究LPS对细胞脱颗粒、白介素的分泌等影响,探明损伤机制。
[1] 黎柳, 谢晶. 水产品冰鲜技术的研究进展[J]. 食品与机械, 2014, 30(1): 259-262, 266.
[2] 蔡青文, 谢晶. 微冻保鲜技术研究进展[J]. 食品与机械, 2013, 29(6): 248-252.
[3] JANDA J M, ABBOTT S L. The genus Aeromonas: taxonomy, pathogenicity, and infection[J]. Clinical Microbiology Reviews, 2010, 23(1): 35-73.
[4] LINDBENG A A, KAMELL A. The lipopolysaccharide of Shigella bacteriaas a virulence factor[J]. Rev Infect Dis, 1991, 13(4): 279.
[5] 朱大玲, 李爱华, 钱冬, 等. 嗜水气单胞菌毒力基因的研究进展[J]. 水生生物学报, 2004, 28(1): 80-84.
[6] 郭闯, 王永坤. 嗜水气单胞菌研究进展[J]. 水产科学, 2003, 22(6): 48-51.
[7] BANERJEE P, FRANZ B, BHUNIA AK. Mammalian cell-based sensor system[M]. Berlin: Springer, 2010: 21-55.
[8] JIANG Dong-lei, FENG Dong-dong, JIANG Hui, et al. Preliminary study on An innovative, simple mast cell-based electrochemical method for detecting foodborne pathogenic bacterial quorum signaling molecules (N-Acyl-Homoserine-Lactones)[J]. Biosensors & Bioelectronics, 2017, 90: 436-442.
[9] STRUSS A, PASINI P, ENSOR C M, et al. Paper strip whole cell biosensors: a portable test for the semiquantitative detection of bacterial quorum signaling molecules[J]. Analytical Chemistry, 2010, 82(11): 4 457.
[10] GU Wen-shu, ZHU Pei, JIANG Dong-lei, et al. A novel and simple cell-based electrochemical impedance biosensor for evaluating the combined toxicity of DON and ZEN[J]. Biosensors & Bioelectronics, 2015, 70: 447-454.
[11] WANG Hui, LI Mu-zi, LIU Jing, et al. Toxoplasma gondii infection induces high mobility group box 1 released from mouse macrophages[J]. Frontiers in Microbiology, 2017, 8: 658.
[12] WANG Xue-mei, ZHU Pei, PI Fu-wei, et al. A Sensitive and simple macrophage-based electrochemical biosensor for evaluating lipopolysaccharide cytotoxicity of pathogenic bacteria[J]. Biosensors & Bioelectronics, 2016, 81: 349-357.
[13] 宋宏新, 刘晓阳, 李宏. 改良热酚水法制备大肠杆菌O157∶H7脂多糖抗原的研究[J]. 食品科学, 2006, 27(10): 273-275.
[14] 刘红亮, 陈学忠, 李克生, 等. 肠出血性大肠杆菌O157∶H7脂多糖抗原的提取鉴定及间接ELISA法的建立[J]. 中国人兽共患病学报, 2011, 27(7): 637-640.
[15] TIRSOAGA A, NOVIKOV A, ADIB-CONQUY M, et al. Simple method for repurification of endotoxins for biological use[J]. Appl Environ Microbiol, 2007, 73(6): 1 803-1 808.
[16] JR D M, GOLDBERG J B. Purification and visualization of lipopolysaccharide from Gram-negative bacteria by hot aqueous-phenol extraction[J]. Journal of Visualized Experiments Jove, 2012, 63: e3 916.
[17] 谢军, 罗惠波, 边名鸿, 等. 酒曲中产香微生物的筛选及其生长特性研究[J]. 食品与机械, 2016, 32(1): 22-25, 86.
[18] LU Jie, YUE Bao-hong, WANG Chun-mei, et al. Efficacy of RNAi-induced down-regulation of wild-type FLT3 on NF-κB pathway in THP-1 cell line[J]. Life Science Journal, 2008, 5(2): 15-20.
[19] SHEN Zhi-hua, JIANG Xiao-fan, ZENG Chao, et al. High expression of ubiquitin-conjugating enzyme 2C (UBE2C) correla-tes with nasopharyngeal carcinoma progression[J]. Bmc Cancer, 2013, 13(1): 1-10.

