紫外线吸收剂和稳定剂污染及检测方法研究进展
黄翠莉HUANG Cui-li 周 佺 唐穗平 - 李锦清 - 吴炜亮 - 綦 艳
(1. 国家食品质量监督检验中心﹝广东﹞,广东 佛山 528300;2. 广东产品质量监督检验研究院,广东 佛山 528300;3. 华南农业大学食品学院,广东 广州 510642;4. 广东省疾病预防控制中心营养与食品安全所,广东 广州 511430)
塑料等高分子材料暴露于日光或强荧光时,易因吸收紫外线而引发自身降解的光老化作用,最终导致外观和物理机械性能劣变。若添加光稳定剂,则可有效防止老化并延长其使用寿命。紫外线吸收剂为其中一类光稳定剂,能选择性地吸收光源中的紫外线,使之转变为无害能量或阻止光氧化分解,达到保护材料的目的[1-3]。为了保证塑料食品接触材料在保存食品期间不因吸收紫外线而导致其失去保护食品的功能,中国GB 9865—2016《食品安全国家标准 食品接触材料及其制品用添加剂使用标准》允许部分紫外线稳定剂和吸收剂(ultra violet stabilizers and absorbers,UVSAs)在食品接触材料及其制品中添加使用,但规定了使用范围和使用量。根据分子结构式的不同,被允许使用的UVSAs主要分为苯并三唑类、二苯甲酮类和苯并噻唑类三类[4-5]。然而,若超范围或超限量添加于塑料食品接触材料中,则可能在与食品的接触过程中迁移至食品而引起安全隐患。有研究[6-7]表明,UVSAs除具有蓄积作用外,还具有一定的内分泌干扰作用。
自从“白酒塑化剂”事件爆发以来,目前公众关注的焦点主要集中于塑料食品接触材料中塑化剂的迁移,而UVSAs的迁移及可能涉及的安全性问题则未引起足够重视,为保证塑料食品接触材料的安全性,有必要对其中的UVSAs向食品中的迁移进行风险监测及分析,确保UVSAs既可在食品接触材料中发挥重要作用,又不会对食品安全带来潜在威胁。本文主要对UVSAs目前的污染水平、可能的危害、国内外使用情况及检测方法进行综述,旨在为有效监管和检测提供参考。
1 紫外线稳定剂和吸收剂的污染水平及毒性作用
1.1 紫外线稳定剂和吸收剂的污染水平
具有广泛商业用途的新型人工合成化学物在环境中的浓度水平、归趋和毒性作用近年来受到的关注逐渐增多,因此,美国环境保护署成立了高产量化学物(High Production Volume,HPV)计划,以应对这些化学物在评估和管理方面的挑战。
在HPV中,UVSAs在环境中的浓度水平引起了研究者的重点关注[8-10]。例如,苯并三唑类化合物的年平均使用量高达9 000 t,因其易溶解及对普通污水处理手段具有一定稳定性,使得其在初级污水、地表水以及饮用水等多种水体样本中均有检出[11]。然而,苯并三唑的2-羟基苯基衍生物则具有与其相反的极性,呈现中等至极高的疏水性,因此可累积于环境介质中,甚至通过食物链而累积放大[12]。此外,如苯甲酮衍生物和氧苯酮类UVSAs在自然水体[8, 11-12]、土壤[8],以及沉积物和污泥[8, 13-14]等环境介质中均可检出,浓度水平在10-9~10-3g/L时,甚至在生物体内,如鱼肉组织[13-18]、人体血液[19]和尿液样本[20]中,均可检出多种UVSAs,见表1。由此可知,UVSAs在环境介质中蓄积的浓度水平越高,越可能影响环境体系,还可能通过食物链蓄积至食品中。同样地,UVSAs也会用于食品接触材料中,尤其是各种塑料成型品[21]。在接触过程中,此类化合物可能从材料迁移至食品中而造成食品污染[22-25]。因此,对UVSAs进行定量的特定迁移水平检测,对保证食品质量安全具有重要意义。此外,当UVSAs在环境介质和食品中的浓度水平达到一定程度时,其引起的健康副作用也成为关注的焦点。
1.2 紫外线稳定剂和吸收剂的毒性作用
目前,已有越来越多的皮肤毒性试验、急性毒性试验或长期重复给药毒性试验的结果证明,部分UVSAs对生物或人体具有一定的毒性作用,如苯甲酮类、莰酮、氰双苯丙烯酸辛酯、甲氧基肉桂酸酯等UVSAs均被认为具有一定的雌激素作用[1,6,8,13]。
皮肤毒性试验方面,有报道[26-27]指出,直接与2-(2H-苯并三氮唑-2-基)对甲苯酚(UV-P)接触,可能会引起皮炎和皮肤刺激作用。对于UVSAs的急性毒性试验主要使用啮齿类动物和水生生物。其中,使用淡水甲壳纲动物评价常用的苯甲酮类UVSAs的急性毒性时,试验结果提示此类化合物的半数致死量LC50均>10 mg/L[28]。苯并三唑类UVSAs UV326、UV327和UV328急性毒性试验结果表明,它们对动物均具有一定的毒性作用,半数致死量LD50分别为5 000,2 000,5 000 mg/kg·大鼠体重(Bw)[19,29-30],使用大型蚤进行的急性毒性试验结果则显示,UV329的24 h半数最大效应浓度EC50为15 mg/L[31]。根据急性毒性剂量分级表,苯甲酮类和苯并三唑类UVSAs属于低毒性化合物。
然而,若长期暴露于某些UVSAs中,均可能会对多个器官产生潜在的毒性作用。苯甲酮类UVSAs UV-9的体外和体内毒性试验均表明其具有弱雌激素作用,UV-24被认为同样具有弱雌激素作用,因其在大鼠和小猪体内均可代谢为UV-9[32-33]。苯并三唑类UVSAs UV326、UV327和UV328在动物试验中,可影响新生大鼠的性激素,且具有明显的性别差异。UV320的大鼠长期重复给药毒性试验提示,其可导致大鼠血液和肝脏、肾脏、脾脏、甲状腺的病变,且具有显著的性别差异,可能与肝脏的过氧化物酶的增殖活性具有性别差异有关[34-35]。相类似的动物试验[34]得出UV328的无可见不良作用剂量水平<15 mg/kg·Bw,肝脏为最敏感的靶器官。
UVSAs中低毒性化合物被允许使用于塑料食品接触材料中,以防止塑料老化,但是化合物的雌激素作用及具有性别差异的毒性作用,则使相关标准限定了其在食品接触材料中的使用量及特定迁移量。
2 紫外线稳定剂和吸收剂在食品接触材料中的限量规定
2.1 国外限量规定
面对食品接触材料存在的安全隐患,欧盟相继颁布了30多项相关的法令或法规,其中的2007/19/EC专项指令规定了用于生产塑料食品接触材料的单体、原料、添加剂名单及其迁移限量和最大残留量,如塑料食品接触材料中的成分迁移到食品中的量不得超过10 mg/dm2,当塑料食品接触材料为容器且其容量为0.5~1.0 L,或与食品接触表面积不易估算时,其总迁移量不能超过60 mg/kg。85/572/EEC指令则规定了塑料食品接触材料的成分向食品迁移的测试条件,包括食品及模拟物种类、模拟物选择、迁移条件选择[21, 23]。
对于UVSAs,许多国家已规定了其在塑料食品接触材料中的最大使用量、最大残留量或迁移量。其中,美国、日本、法国等国家允许常见的UVSAs的最大使用量为0.5%[1-3],而意大利则规定最大使用量为0.2%[4-6]。此外,欧盟还规定了9种常用的UVSAs的特定迁移量或最大残留量,见表2。

表1 环境介质和生物样品中紫外线稳定剂和吸收剂的浓度水平
续表1

样品种类样品国家/地区紫外线稳定剂和吸收剂浓度水平参考文献污泥和沉积物污泥西班牙8种苯并三唑类UVSAs生物污泥TinuvinP:n.d.(<400ng/kg)~3.0×104ng/kg·干基;2⁃(2H⁃苯并三唑⁃2)⁃4,6⁃二(1⁃甲基⁃1⁃苯基乙基)苯酚(Tinuvin234):3.70×104~1.26×105ng/kg·干基;Tinu⁃vin320:n.d.(<1400ng/kg)~4.1×104ng/kg·干基;Tinuvin326:7.5×104~1.7×105ng/kg·干基;Tinuvin327:n.d.(<1200ng/kg)~3.3×104ng/kg·干基;Tinuvin328:2.8×104~1.5×105ng/kg·干基;2⁃(2'⁃羟基⁃5'⁃叔辛基苯基)苯并三唑(Tinuvin329):n.d.(<1000ng/kg)~2.3×104ng/kg·干基;2⁃(2'⁃羟基⁃3'⁃异丁基⁃5'⁃叔丁基苯基)苯并三唑(Tinuvin350):n.d.(<1200ng/kg)初级污泥TinuvinP:n.d.(<400ng/kg)~2.1×104ng/kg·干基;Tinuvin234:4.1×104~6.3×104ng/kg·干基;Tinuvin320:n.d.(<1400ng/kg);Tinuvin326:4.4×104~8.0×104ng/kg·干基;Tinuvin327:n.d.(<1200ng/kg);Tinuvin328:5.9×104~7.4×104ng/kg·干基;Tinuvin329:n.d.(<1000ng/kg);Tinuvin350:n.d.(<1200ng/kg)稳定化污泥TinuvinP:n.d.(<400ng/kg)~3.0×104ng/kg·干基;Tinuvin234:3.7×104~1.3×105ng/kg·干基;Tinuvin320:n.d.(<1400ng/kg)~4.1×104ng/kg·干基;Tinuvin326:7.5×104~1.7×105ng/kg·干基;Tinuvin327:n.d.(<1200ng/kg)~3.3×104ng/kg·干基;Tinuvin328:2.8×104~1.5×105ng/kg·干基;Tinuvin329:n.d.(<1000ng/kg)~2.3×104ng/kg·干基;Tinuvin350:n.d.(<1200ng/kg)[13]沉积物日本有明海4种苯并三唑类UVSAsTinuvin320:3.0×102~1.4×104ng/kg·干基;Tinuvin326:1800~2.0×105ng/kg·干基;Tinuvin327:1.6×103~1.9×105ng/kg·干基;Tinuvin328:2.6×103~3.2×105ng/kg·干基[14]潮滩和浅海生物日本有明海4种苯并三唑类UVSAsTinuvin320:n.d.(50ng/kg·湿基)~4.1×104ng/kg·湿基;Tinuvin326:n.d.(100ng/kg·湿基)~5600ng/kg·湿基;Tinuvin327:n.d.(120ng/kg·湿基)~1.3×104ng/kg·湿基;Tinuvin328:n.d.(150ng/kg·湿基)~5.5×104ng/kg·湿基[14]鱼菲律宾马尼拉湾8种苯并三唑类UVSAsTinuvinP:n.d.~2.22×105ng/kg·脂肪;Tinuvin9:n.d.~1.6×104ng/kg·脂肪;Tinu⁃vin234:n.d.~1.3×105ng/kg·脂肪;Tinuvin320:n.d.~2.9×104ng/kg·脂肪;Tinu⁃vin326:n.d.~7.1×104ng/kg·脂肪基;Tinuvin327:n.d.~2.2×105ng/kg·脂肪;Tinuvin328:n.d.~5.6×105ng/kg·脂肪;Tinuvin329:n.d.~9.7×104ng/kg·脂肪8种UVSAs的检出限为0.2~9.0ng/kg[15]生物样品鱼9种苯并三唑类UVSAsTinuvin234:n.d.(200ng/kg·干基)~320ng/kg·干基;Tinuvin320:n.d.(500ng/kg·干基)~4.1×104ng/kg·干基;Tinuvin326:n.d.(7000ng/kg·干基);Tinuvin327:5.3×103~6.8×104ng/kg·干基;Tinuvin328:6.0×102~3.1×104ng/kg·干基;Tinuvin329:n.d.(1500ng/kg·干基);Tinuvin350:n.d.(200ng/kg·干基)~8000ng/kg·干基;2,2'⁃亚甲基双(4⁃叔辛基⁃6⁃苯并三唑苯酚)(Tinuvin360):n.d.(1000ng/kg·干基);2⁃(2H⁃苯并三唑⁃2⁃基)⁃6⁃(1⁃甲基⁃1⁃苯乙基)⁃4⁃(1,1,3,3⁃四甲基丁基)苯酚(Tinuvin928):n.d.(500ng/kg·干基)[16]鱼瑞士2种UVSAs苄基樟脑:5.0×104~1.8×106ng/kg·脂肪;OCL:4.0×104~2.4×106ng/kg·脂肪[17]鱼瑞士4种UVSAs2⁃乙基⁃己基⁃4⁃三甲氧基肉桂酸酯(EHMC):n.d.~7.0×105ng/kg·脂肪;3⁃4(甲基)苯亚甲基⁃樟脑(4⁃MBC):n.d.;Tinuvin9:n.d.;BP⁃4:n.d.4种UVSAs的检出限为6×103~5×104ng/kg[18]血液—3种UVSAs2⁃羟基⁃4⁃甲氧基二苯甲酮:女200ng/mL,男300ng/mL;甲氧基肉桂酸辛酯:女10ng/mL,男20ng/mL;4⁃MBC:女20ng/mL,男20ng/mL[19]尿液—3种UVSAs2,4⁃二羟基二苯甲酮:1.0~14.6ng/mL;三氯生:n.d.(0.5ng/mL)~95.3ng/mL;三氯二苯脲:n.d.(0.5ng/mL)~13.8ng/mL[20]
2.2 中国限量规定
目前,中国GB 9685—2016明确规定了食品容器、食品接触材料用添加剂的使用原则、使用范围、允许使用的添加剂名称、最大使用量、最大残留量或特定迁移量,其中塑料接触材料用添加剂占58%。塑料制品中添加的UVSAs则是其中一大类,标准中规定了常用的9种UVSAs的最大允许使用量及特定迁移量,见表2。
虽然国家标准规定了可在食品接触材料中使用的多种UVSAs,并设定了其中部分的特定迁移量,但由于缺乏相应的检测方法支持,当超限量或超范围使用时,未能对其进行有效监管,从而可能使UVSAs在食品接触材料储存食品时过量迁移至食品中而影响食品安全[1-2]。
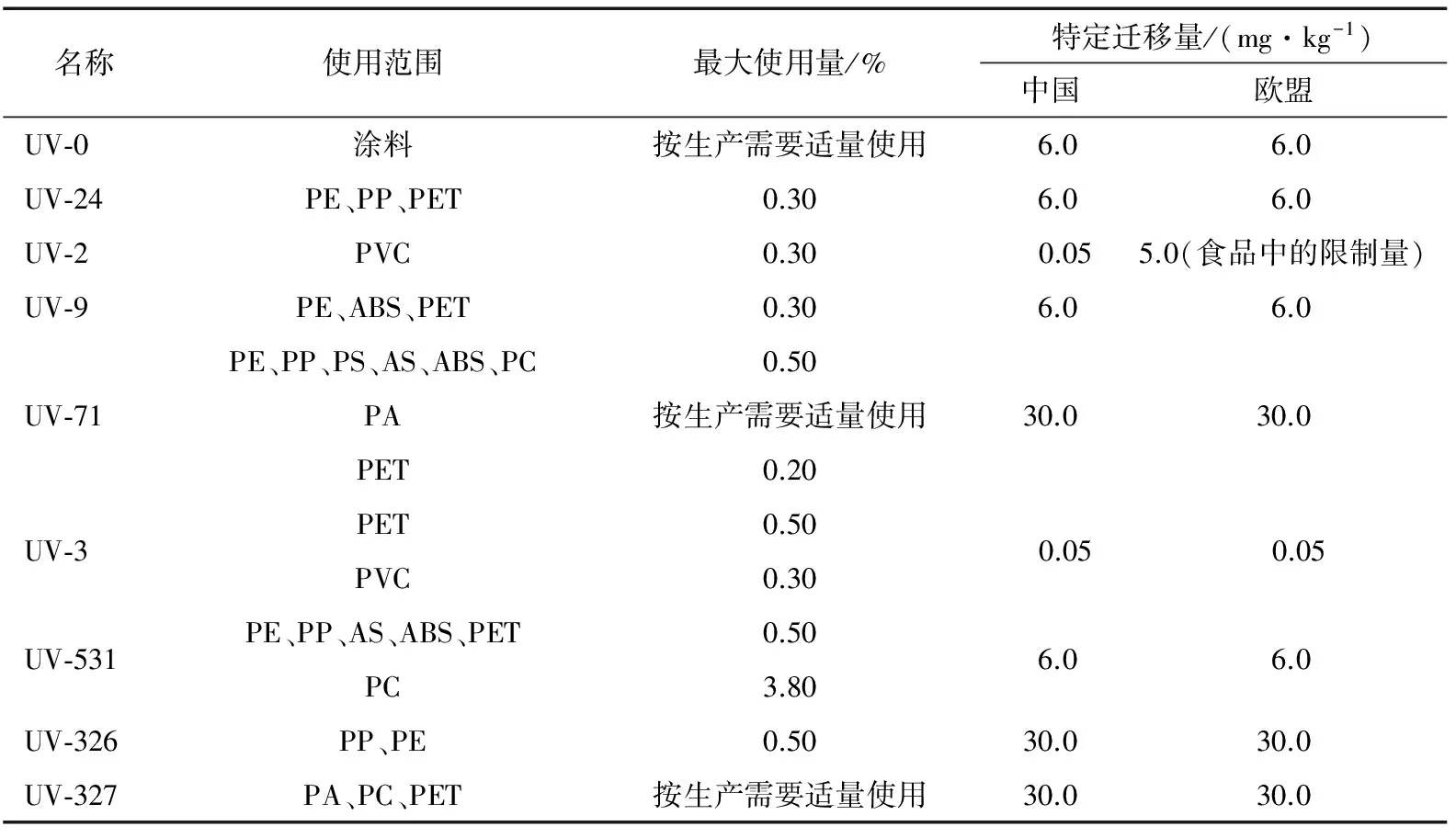
表2 紫外线稳定剂和吸收剂的最大使用量和特定迁移量
3 紫外线稳定剂和吸收剂的检测方法
一般地,UVSAs使用液相色谱或气相色谱进行检测,但针对不同样品种类,可选择更有针对性的前处理手段,从而有效地净化样品,去除杂质对检测的干扰,并对目标物进行富集。当高通量地检测样品中一类结构及性质相近的UVSAs时,则需串联质谱产生特征性离子碎片用于鉴别色谱中可能无法分离的2种或多种UVSAs。
3.1 食品接触材料
在中国,普遍采用高效液相色谱法检测塑料食品接触材料中的UVSAs。李静等[5]采用超声辅助提取和固相萃取技术进行前处理,使用高效液相色谱法(HPLC)对复合食品包装袋中的2种苯并三唑类(UV326和UV327)UVSAs含量进行测定,而李丽怡等[3]则采用相同的检测方法对聚对苯二甲酸乙二醇酯(PET)瓶中UV-P和UV-234 2种UVSAs的迁移进行研究。然而没有同时运用这2种方法测定多种UVSAs的研究。艾连峰等[2]进一步开发获得可同时测定食品接触材料与食品模拟物中6种UVSAs的超高效液相色谱法(UPLC)。近年来,可同时测定9种UVSAs的HPLC及气相色谱-串联质谱法(GC-MS)也已分别应用于食品塑料包装材料及运动饮料的检测[1, 6]。此外,可同时测定抗氧化剂和UVSAs的HPLC方法也已应用于检测食品模拟物中相关化合物的浓度水平,以研究其迁移至食品的浓度及迁移行为[22-23]。在上述研究中,普遍选用固相萃取对样品进行净化处理,但过程耗时较长且不能同时处理大量样品,因此Chang等[25]将新型前处理技术溶剂浮选应用于塑料饮料包装材料中抗氧化剂和UVSAs的检测,并研究了溶剂、氮气流速、浮选时间等参数对浮选效率的影响,该项前处理技术具有高分离效率、低有机溶剂消耗和操作简单等特点。各研究开发的检测方法参数归纳于表3。
国外所研发的检测方法更倾向于使用色谱-质谱串联技术,如Choi等[24]使用液相色谱-常压化学电离质谱检测聚丙烯塑料食品接触材料中的UVSAs;Bodai等[21]则使用HPLC-MS/MS检测牛奶中来源于塑料材料的潜在迁移物(抗氧化剂和UVSAs),并开发了更有针对性的液液萃取和低温净化前处理方法;Rani等[36]使用HPLC-MS检测塑料海洋废弃物中抗氧化剂和UVSAs的浓度水平,并与其相应的新产品进行比较。除HPLC-MS技术外,气相色谱-质谱串联技术(GC-MS)也可用于UVSAs的检测,但在测定前需要对化合物进行衍生化反应,如Chung等[37]将新型的分散固相微萃取结合甲基硅烷化及热解吸前处理技术应用于水性样品的苯甲酮类UVSAs的快速测定。相关检测方法的参数见表3。
3.2 环境介质及生物样品
相较于塑料食品接触材料,环境介质及生物样品的基质更为复杂,因此需高选择性和净化效率的前处理方法,以及准确的定性和定量检测方法。相关方法在污泥及沉积物、水和水生生物等样品中的UVSAs检测过程中得到应用。
对于污泥及沉积物中UVSAs的检测,Zhang等[38]使用HPLC-MS/MS和GC-MS调查中国东北地区河流中污泥和沉积物的苯甲酮类和苯并三唑类UVSAs的浓度水平;Ruan等[8]则使用HPLC-MS/MS检测中国60个市政污水处理厂的污泥样品中12种苯并三唑类UVSAs的浓度水平,以监测其对环境的污染情况及归趋。在国外的研究中,Casado等[13]在测定污泥样品中9种苯并三唑类UVSAs的研究中,使用了基质固相分散-气相色谱-四极杆飞行时间质谱法分析样品。在沉积物中UVSAs浓度水平的调查中,Nakata等[14]使用GC-MS检测日本有明海中污泥的4种苯并三唑类UVSAs的浓度水平(范围为7.9~720.0 ng/g·干基);Wick等[39]使用HPLC-MS/MS测定河流沉积物中9种苯并三唑类UVSAs的浓度水平及其时间趋势。
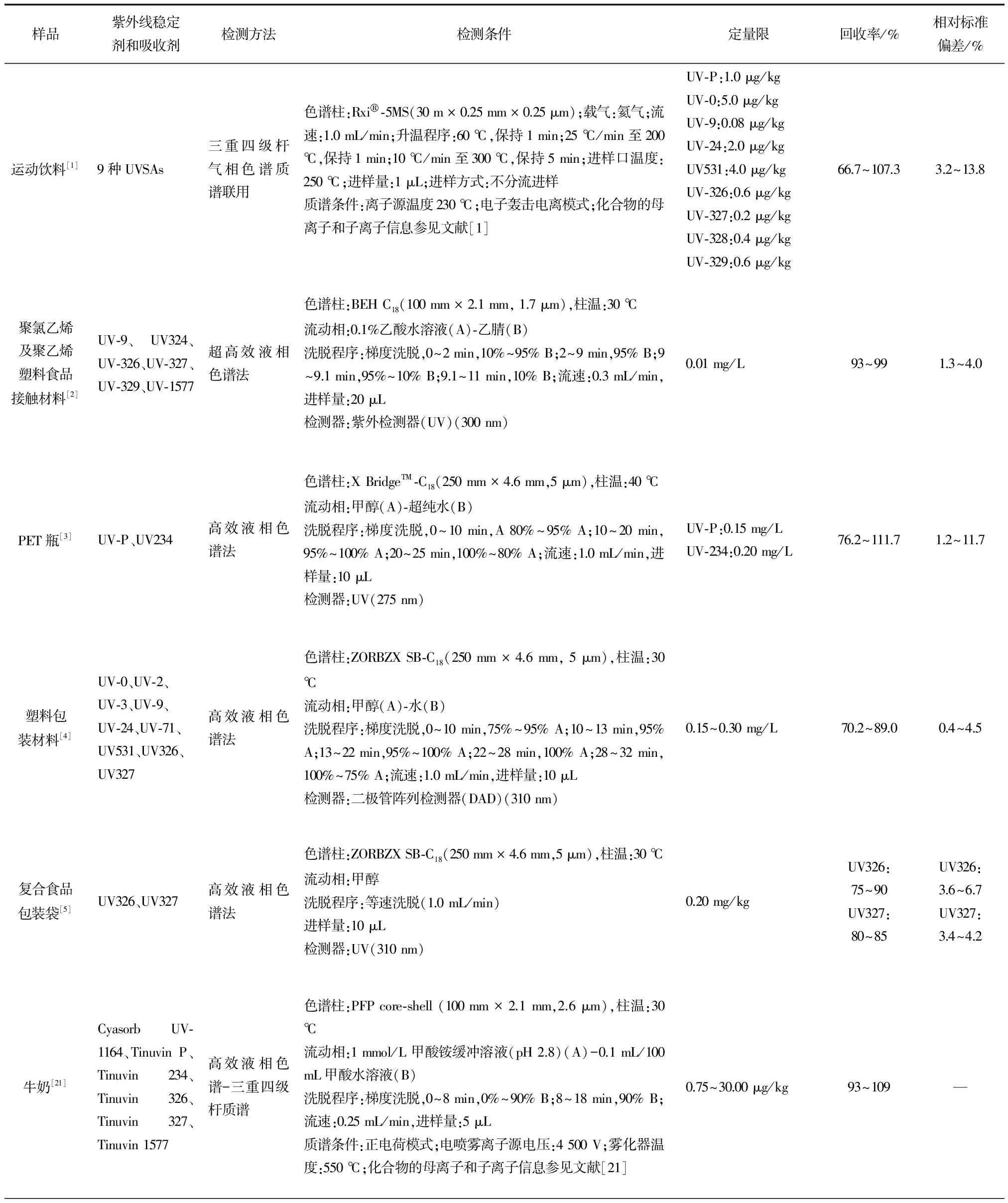
表3 紫外线稳定剂和吸收剂检测方法参数的比较
续表3
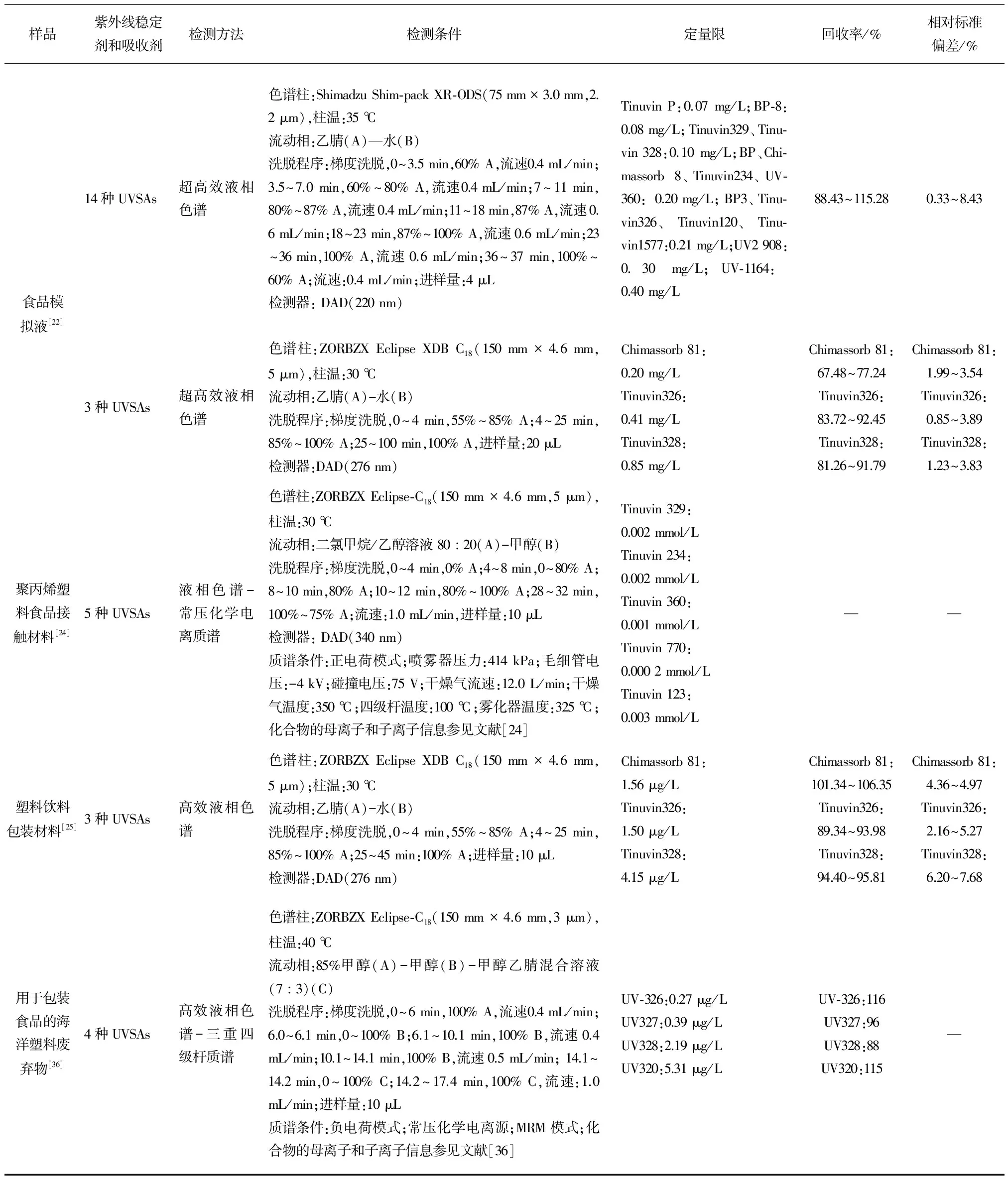
样品紫外线稳定剂和吸收剂检测方法检测条件定量限回收率/%相对标准偏差/%食品模拟液[22]14种UVSAs超高效液相色谱色谱柱:ShimadzuShim⁃packXR⁃ODS(75mm×3.0mm,2.2μm),柱温:35℃流动相:乙腈(A)—水(B)洗脱程序:梯度洗脱,0~3.5min,60%A,流速0.4mL/min;3.5~7.0min,60%~80%A,流速0.4mL/min;7~11min,80%~87%A,流速0.4mL/min;11~18min,87%A,流速0.6mL/min;18~23min,87%~100%A,流速0.6mL/min;23~36min,100%A,流速0.6mL/min;36~37min,100%~60%A;流速:0.4mL/min;进样量:4μL检测器:DAD(220nm)TinuvinP:0.07mg/L;BP⁃8:0.08mg/L;Tinuvin329、Tinu⁃vin328:0.10mg/L;BP、Chi⁃massorb8、Tinuvin234、UV⁃360:0.20mg/L;BP3、Tinu⁃vin326、Tinuvin120、Tinu⁃vin1577:0.21mg/L;UV2908:0.30mg/L;UV⁃1164:0.40mg/L88.43~115.280.33~8.433种UVSAs超高效液相色谱色谱柱:ZORBZXEclipseXDBC18(150mm×4.6mm,5μm),柱温:30℃流动相:乙腈(A)-水(B)洗脱程序:梯度洗脱,0~4min,55%~85%A;4~25min,85%~100%A;25~100min,100%A,进样量:20μL检测器:DAD(276nm)Chimassorb81:0.20mg/LTinuvin326:0.41mg/LTinuvin328:0.85mg/LChimassorb81:67.48~77.24Tinuvin326:83.72~92.45Tinuvin328:81.26~91.79Chimassorb81:1.99~3.54Tinuvin326:0.85~3.89Tinuvin328:1.23~3.83聚丙烯塑料食品接触材料[24]5种UVSAs液相色谱-常压化学电离质谱色谱柱:ZORBZXEclipse⁃C18(150mm×4.6mm,5μm),柱温:30℃流动相:二氯甲烷/乙醇溶液80︰20(A)-甲醇(B)洗脱程序:梯度洗脱,0~4min,0%A;4~8min,0~80%A;8~10min,80%A;10~12min,80%~100%A;28~32min,100%~75%A;流速:1.0mL/min,进样量:10μL检测器:DAD(340nm)质谱条件:正电荷模式;喷雾器压力:414kPa;毛细管电压:-4kV;碰撞电压:75V;干燥气流速:12.0L/min;干燥气温度:350℃;四级杆温度:100℃;雾化器温度:325℃;化合物的母离子和子离子信息参见文献[24]Tinuvin329:0.002mmol/LTinuvin234:0.002mmol/LTinuvin360:0.001mmol/LTinuvin770:0.0002mmol/LTinuvin123:0.003mmol/L——塑料饮料包装材料[25]3种UVSAs高效液相色谱色谱柱:ZORBZXEclipseXDBC18(150mm×4.6mm,5μm);柱温:30℃流动相:乙腈(A)-水(B)洗脱程序:梯度洗脱,0~4min,55%~85%A;4~25min,85%~100%A;25~45min:100%A;进样量:10μL检测器:DAD(276nm)Chimassorb81:1.56μg/LTinuvin326:1.50μg/LTinuvin328:4.15μg/LChimassorb81:101.34~106.35Tinuvin326:89.34~93.98Tinuvin328:94.40~95.81Chimassorb81:4.36~4.97Tinuvin326:2.16~5.27Tinuvin328:6.20~7.68用于包装食品的海洋塑料废弃物[36]4种UVSAs高效液相色谱-三重四级杆质谱色谱柱:ZORBZXEclipse⁃C18(150mm×4.6mm,3μm),柱温:40℃流动相:85%甲醇(A)-甲醇(B)-甲醇乙腈混合溶液(7︰3)(C)洗脱程序:梯度洗脱,0~6min,100%A,流速0.4mL/min;6.0~6.1min,0~100%B;6.1~10.1min,100%B,流速0.4mL/min;10.1~14.1min,100%B,流速0.5mL/min;14.1~14.2min,0~100%C;14.2~17.4min,100%C,流速:1.0mL/min;进样量:10μL质谱条件:负电荷模式;常压化学电离源;MRM模式;化合物的母离子和子离子信息参见文献[36]UV⁃326:0.27μg/LUV327:0.39μg/LUV328:2.19μg/LUV320:5.31μg/LUV⁃326:116UV327:96UV328:88UV320:115—
与污泥和沉积物相似,生物样品基质也比较复杂。因此,在相关监测工作中也常使用色谱串联质谱技术对样品进行检测。Nakata等[14]使用GC-MS检测日本有明海域海鸟和双髻鲨中4种苯并三唑类UVSAs的浓度水平,分别为74,190 ng/g·脂肪;Kim等[15]使用UPLC-MS/MS调查菲律宾马尼拉湾22种鱼类体内8种苯并三唑类UVSAs的污染状况和生物积累水平;Lu等[40]使用UPLC-MS/MS研究二苯胺基抗氧化剂和UPLC-MS/MS在小环境体系(水生生物、沉积物、地表水)中的分布、分配及生物累积情况;Wick等[39]则使用HPLC-MS/MS技术对样品进行测定,有针对性地回答了苯并三唑类紫外线吸收剂在河流沉积物、悬浮颗粒物及鱼类体内的水平、时间趋势及持久性等问题。
水体是环境体系中的重要一环,其中的污染物可通过水体流动污染所经过的流域,因此监测水体中相关污染物的浓度水平可有助于了解环境污染的整体状况。Loi等[11]将开发的固相萃取-液相色谱串联质谱检测方法应用于废水和处理水中苯并三唑和苯并噻唑两类UVSAs的检测;Carpinteiro等[12]则使用顶空固相微萃取-气相色谱串联质谱法检测水体样品中的苯并三唑类UVSAs。
4 结论
综上所述,通过各种现代检测技术发现,UVSAs的广泛使用不仅对环境介质造成了严重的负担,而且还通过食物链的传递累积于动物源性食品中而对食品安全造成潜在影响。然而,目前的研究仍集中于厘清环境介质以及水生生物中的UVSAs本底的浓度水平,未对消费者通过膳食途径摄入UVSAs及其风险进行研究,为了保障食品安全有必要对此进行深入的调查研究。
除此之外,UVSAs在塑料食品包装材料中的使用普遍性及风险等级并不亚于塑化剂,但塑料食品接触材料中UVSAs 的检测方法尚未制定国家标准,导致对其超量超范围使用的监管或进行风险监测缺乏相应的技术支撑。因此,为了加大塑料食品接触材料中UVSAs的监管力度,排除其因不正确使用而导致塑料食品接触材料发生突发安全事件,有必要为食品接触材料中UVSAs的监管建立有效的检测技术手段,以规范UVSAs的使用及对其迁移特性进行风险监测,并建立有效的筛查方法用于快速定性阳性样品。
[1] 刘伟, 张楠, 范赛, 等. 固相萃取-气相色谱-串联质谱法测定运动饮料中的9种紫外线稳定剂[J]. 分析化学, 2014, 42(5): 706-710.
[2] 艾连峰, 郭春海, 葛世辉, 等. 超高效液相色谱法同时测定食品接触材料与食品模拟物中6种紫外吸收剂[J]. 分析测试学报, 2011, 30(1): 13-17.
[3] 李丽怡, 梁锡镇, 林勤保, 等. PET瓶中UV-P和UV-234两种光稳定剂的迁移研究[J]. 包装与食品机械, 2015, 33(4): 1-5.
[4] 朱蕾, 樊永祥, 徐海滨, 等. 欧美和日本等国食品包装材料膳食暴露评估方法的比较分析[J]. 中国食品卫生杂志, 2012, 24(5): 479-484.
[5] 隋海霞, 刘兆平, 李凤琴. 不同国家和国际组织食品接触材料的风险评估[J]. 中国食品卫生杂志, 2011, 23(1): 36-40.
[6] 张居舟, 李静, 邵栋梁, 等. 固相萃取-高效液相色谱法同时测定食品塑料包装材料中9种光稳定剂[J]. 色谱, 2012, 30(2): 190-195.
[7] 李静, 张居舟, 邵栋梁, 等. 高效液相色谱法对复合食品包装袋中三唑类光稳定剂含量的测定[J]. 分析测试学报, 2011, 30(4): 435-438.
[8] RUAN Ting, LIU Run-zeng, FU Qiang, et al. Concentrations and composition profiles of benzotriazole UV stabilizers in municipal sewage sludge in China[J]. Environmental Science and Technology, 2012, 46(4): 2 071-2 079.
[9] HOWARD P H, MUIR D C G. Identifying new persistent and bioaccumulative organics among chemicals in commerce[J]. Environmental Science and Technology, 2010, 44(7): 2 277-2 285.
[10] RICHARDSON S D, TERNES T A. Water analysis: Emerging contaminants and current issues[J]. Analytical Chemistry, 2011, 83(12): 4 614-4 648.
[11] LOI C H, BUSETTI F, LINGE K L, et al. Development of a solid-phase extraction liquid chromatography tandem mass spectrometry method for bezotriazoles and benzothiazoles in wastewater and recycled water[J]. Journal of Chromatography A, 2013, 1 299(13): 48-57.
[12] CARPINTEIRO I, ABUN B, RODRGUEZ I, et al. Headspace solid-phase microextraction followed by gas chromatography tandem mass spectrometry for the sensitive determination of benzotriazole UV stabilizers in water samples[J]. Analytical and Bioanalytical Chemistry, 2010, 397(2): 829-839.
[13] CASADO J, RODRGUEZ I, CARPINTEIRO I, et al. Gas chromatography quadrupole time-of-flight mass spectrometry determination of benzotriazole ultraviolet stabilizers in sludge samples[J]. Journal of Chromatography A, 2013, 1 293(9): 126-132.
[14] NAKATA H, MURATA S, FILATREAU J. Occurrence and concentrations of benzotriazole UV stabilizers in marine organisms and sediments from the Ariake Sea, Japan[J]. Environmental Science and Technology, 2009(20): 6 920-6 926.
[15] KIM J W, ISOBE T, RAMASWAMY B R, et al. Contamination and bioaccumulation of benzotriazole ultraviolet stabilizers in fish from Manila Bay, the Philippines using an ultra-fast liquid chromatography-tandem mass spectrometry[J]. Chemosphere, 2011, 85(5): 751-758.
[16] NAGTEGAAL H, TERNES T A, BAUMANN W, et al. UV-Filtersubstanzen in wasser und fischen[J]. UWSF-Z. Umweltchemie Okotoxikologie, 1997, 9: 79-86.
[17] BUSER H R, BALMER M E, SCHMID P, et al. Occurrence of UV filters 4-methylbenzylidene camphor and octocrylene in fish from various Swiss rivers with inputs from wastewater treatment plants[J]. Environmental Science and Technology, 2006, 40(5): 1 427-1 431.
[18] FENT K, ZENKER A, RAPP M. Widespread occurrence of estrogenic UV-filters in aquatic ecosystems in Switzerland[J]. Environment Pollution, 2010, 158(5): 1 817-1 824.
[19] JANJUA N R, MOGENSEN B, ANDERSSON A M, et al. Systemic absorption of the sunscreens benzophenone-3, octyl-methoxycinnamate, and 3-(4-methyl-benzylidene) camphor after whole-body topical application and reproductive hormone levels in humans[J]. Journal of Investigative Dermatology, 2004, 123(1): 57-61.
[21] BODAI Z, SZABB S, NOVK M, et al. Analysis of potential migrants from plastic materials in milk by liquid chromatography-mass spectrometry with liquid-liquid extraction and low-temperature purification[J]. Journal of Agriculture and Food Chemistry, 2014, 62(41): 10 028-10 037.
[22] LI Chang-fa, LI Ying, CHEN Zhi-nan, et al. Simultaneous determination of antioxidants and ultraviolet absorbers by ultra-performance liquid chromatography in food simulants[J]. Food Analytical Methods, 2014, 7(9): 1 755-1 762.
[23] GAO Ya-li, GU Yan-xiang, WEI Yun. Determination of polymer additives-Antioxidants and ultraviolet (UV) absorbers by high-performance liquid chromatography coupled with UV photodiode array detection in food simulants[J]. Journal of Agriculture and Food Chemistry, 2011, 59(24): 12 982-12 989.
[24] CHOI S S, JANG J H. Analysis of UV absorbers and stabilizers in polypropylene by liquid chromatography/atmospheric pressure chemical ionization-mass spectrometry[J]. Polymer Testing, 2011, 30(6): 673-677.
[25] CHANG Lin, BI Peng-yu, LIU Ya-nan, et al. Simultaneous analysis of trace polymer additives in plastic beverage packaging by solvent sublation followed by high-performance liquid chromatography[J]. Journal of Agriculture and Food Chemistry, 2013, 61(29): 7 165-7 171.
[26] YAMANO T, SHIMIZU M, NODA T. Relative elicitation potencies of seven chemical allergens in the guinea pig maximization test[J]. Journal of Health Science, 2001, 47(2): 123-128.
[27] OKEREKE C S, ABDEL-RAHMAN M S, FRIEDMAN M A. Disposition of benzophenone-3 after dermal administration in male rats[J]. Toxicological Letters, 1994, 73(2): 113-122.
[28] KIM J, CHANG K, ISOBE T, et al. Acute toxicity of benzotriazole ultraviolet tabilizers on freshwater crustacean (Daphnia pulex)[J]. Journal of Toxicological Science, 2011, 36(2): 247-251.
[29] SCHLUMPF M, COTTON B, CONSCIENCE M, et al. In vitro and vivo estrogenicity of UV screens[J]. Environmental Health Perspectives, 2001, 109(3): 329-244.
[30] NAKAGAWA Y, SUZUKI T. Metabolism of 2-hydroxy-4-methoxybenzophenone in isolated rat hepatocytes and xenoestrogenic effects of its metabolites on MCF-7 human breast cancer cells[J]. Chemico-Biological Interactions, 2002, 139(2): 115-118.
[31] SUZUKI T, KITAMURA S, KHOTA R, et al. Estrogenic and antiandrogenic activities of 17 benzophenone derivatives used as UV stabilizers and sunscreens[J]. Toxicology and Applied Pharmacology, 2005, 203(1): 9-17.
[32] JEON H, SARMA S N, KIM Y, et al. Toxicokinetics and metabolism of benzophenone-type UV filters in rats[J]. Toxicology, 2008(2/3): 89-95.
[33] KASICHAYANULA S, HOUSE J D, WANG Tao, et al. Simultaneous analysis of insect repellent DEET, sunscreen oxybenzone and five relevant metabolites by reversed-phase HPLC with UV detection: Application to an in vivo study in piglet model[J]. Journal of Chromatography B, 2005, 822(1/2): 271-277.
[34] HIRATA-KOIZUMI M, MATSUYAMA T, IMAI T, et al. Gender-related difference in the toxicity of ultraviolet absorber 2-(3,5-ditert-butyl-2-hydroxyphenyl)-5-chlorobenzotrazole in rats[J]. Drug and Chemical Toxicology, 2008, 31(3): 383-398.
[35] WATANABE Y, KOJIMA H, TAKEUCHI S, et al. Metabolism of UV-filter benzophenone-3 by rat and human liver microsomes and its effect on endocrine-disrupting activity[J]. Toxicology and Applied Pharmacology, 2015, 282(2): 119-128.
[36] RANI M, SHIM W J, HAN G M, et al. Benzotriazole-type ultraviolet stabilizers and antioxidants in plastic marine debris and their new products[J]. Science of the Total Environment, 2017, 579: 745-754.
[37] CHUNG W H, TZING S H, DING W H. Optimization of dispersive micro solid-phase extraction for the rapid determination of benzophenone-type ultraviolet absorbers in aqueous samples[J]. Journal of Chromatography A, 2015, 1 411(1): 17-22.
[38] ZHANG Zi-feng, REN Nan-qi, LI Yi-fen, et al. Determination of benzotriazole and benzophenone UV filters in sediment and sewage sludge[J]. Environmental Science and Technology, 2011, 45(9): 3 909-3 916.
[39] WICK A, JACOBS B, KUNKEL U, et al. Benzotriazole UV stabilizers in sediments, suspended particulate matter and fish of German rivers: New insights into occurrence, time trends and persistency[J]. Environmental Pollution, 2016, 212: 401-412.
[40] LU Zhe, DE SILVA A O, PEART T E, et al. Distribution, partitioning and bioaccumulation of substituted diphenylamine antioxidants and benzotriazole UV stabilizers in an urban creek in Canada[J]. Environmental Science and Technology, 2016, 50(17): 9 089-9 097.

