欧前胡素通过上调细胞表面死亡受体5的数量增强TRAIL对乳腺癌细胞的杀伤活性*
徐正阳, 任瑞平, 万 鹏, 袁祖国
(宁波市鄞州人民医院放化疗科, 浙江 宁波 315040)
乳腺癌是在女性群体中发病率最高的恶性肿瘤,早期容易发生肿瘤转移,预后很差,严重危害女性健康[1]。在乳腺癌的治疗中,手术治疗是目前最有效的治疗手段,然而对于中晚期不能进行手术的病人或在术后的巩固治疗中,化疗或免疫治疗是不可缺少的治疗手段[2]。肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)属于肿瘤坏死因子(tumor necrosis factor,TNF)超家族成员。研究表明, TRAIL能选择性激活肿瘤细胞的凋亡通路而对正常细胞的无明显影响,因此, TRAIL是一种副作用很小的非常有临床应用前景的肿瘤免疫治疗药物[3-4]。然而, 某些类型的肿瘤细胞(如乳腺癌细胞)对TRAIL治疗的敏感性较低[5],因此为了提高乳腺癌细胞对TRAIL治疗的敏感性,采取一些辅助治疗(如辅以中药活性成分)协同TRAIL杀伤肿瘤细胞具有十分重要的意义。本研究的目的在于探讨中药活性成分欧前胡素(imperation,IMP)对TRAIL的抗乳腺癌协同效应及分子机制。
材 料 和 方 法
1 细胞培养
人乳腺癌细胞系T-47D和MCF-7购于美国模式培养物保存中心(American Type Culture Collection,ATCC)。细胞培养于含10%胎牛血清的DMEM培养基中,置于37 °C恒温培养箱中培养并通入5% CO2。细胞每2~3 d传代1次,传代时,用胰酶消化液悬浮细胞, 并用DMEM培养基洗涤2次,将细胞悬液按1∶3稀释后传代。
2 实验试剂
欧前胡素、重组人TRAIL、MTT试剂、二氢乙啶(dihydroe-thidium, DHE)、N-乙酰半胱氨酸(N-acetylcysteine, NAC)和凋亡检测试剂盒购于Sigma-Aldrich;DMEM培养基购于Gibco;抗死亡受体5(death receptor 5,DR5)、cleaved caspase-8、cleaved caspase-3和GAPDH抗体购于Cell Signaling;ECL试剂盒购于Pierce;DR5-PE流式细胞抗体购于R&D system;JC-1线粒体膜电位探针染料购于江苏碧云天生物技术有限公司;DR5 siRNA购于上海吉玛制药技术有限公司;Lipofectamine 2000购于Invitrogen。
3 方法
3.1DR5基因沉默 将DR5 siRNA(终浓度为50 nmol/L)用Lipofectamine 2000按试剂操作说明书步骤进行包裹后,加入到无血清培养基进行混合。将贴壁的T-47D细胞置于该无血清培养基孵育6 h,之后弃去无血清培养基加入新鲜的含10%胎牛血清的DMEM培养基中培养24 h。
3.2相对细胞活力测定 将T-47D和MCF-7细胞用IMP (10 μmol/L)和不同浓度TRAIL (0~20 μmol/L)处理。实验分为对照组、欧前胡素组、TRAIL组、欧前胡素+TRAIL组及欧前胡素+TRAIL+DR5 siRNA组。对照组为细胞不加药物处理48 h;欧前胡素组为细胞加入10 μmol/L欧前胡素处理48 h;TRAIL组为细胞加入2 μg/L TRAIL培养48 h;欧前胡素+TRAIL组为细胞用2 μg/L TRAIL联合10 μmol/L欧前胡素处理48 h;欧前胡素+TRAIL+DR5 siRNA组为DR5 siRNA转染的T-47D细胞用2 μg/L TRAIL联合10 μmol/L欧前胡素处理48 h。各组细胞经药物处理完毕后加入20 μL 浓度为5 g/L的MTT试剂,并在37 °C恒温培养箱中孵育4 h, 之后小心弃去细胞上清液并加入150 μL DMSO,振荡使紫色絮状物完全溶解,在570 nm波长下用酶标仪检测吸光度(A)。相对细胞活力=A药物处理组/A对照组。
3.3Western blot实验 将T-47D细胞按上述进行分组。药物处理完毕后用蛋白提取液提取各组细胞中的总蛋白质。将等量的总蛋白质用12.5% SDS-PAGE进行分离,分离完毕后通过电转方法将蛋白质转到PVDF膜上,用抗DR5、cleaved caspase-8、cleaved caspase-3和GAPDH抗体孵育过夜,之后再用带辣根过氧化物酶的 II 抗孵育2 h,蛋白条带用ECL试剂盒显色发光。蛋白灰度值分析用ImageJ软件处理。目标蛋白的相对表达水平用它们的蛋白灰度值与内参照GAPDH灰度值的比值表示。
3.4T-47D细胞表面DR5表达水平的检测 将T-47D细胞分为对照组、欧前胡素组和欧前胡素+DR5 siRNA组处理。收集细胞并用带PE荧光标记的DR5抗体孵育细胞,后用流式细胞术检测3组细胞表面DR5的表达情况。
3.5线粒体膜电位的测定 将T-47D细胞按方法 3.2所述进行分组。药物处理完毕后按试剂操作说明书步骤将细胞用JC-1染料进行孵育,孵育完毕后用流式细胞仪检测JC-1发出的红色荧光,红色荧光强度越强,线粒体膜电位越高[6]。
3.6活性氧簇(reactive oxygen species, ROS)水平的检测 将T-47D细胞用药物处理完毕后按试剂操作说明书步骤将细胞用DHE染料进行孵育,孵育完毕后用流式细胞仪检测DHE发出的红色荧光,红色荧光强度越强,ROS水平越高[7]。
3.7流式细胞术检测细胞凋亡 将各组细胞经药物处理完毕后按照凋亡试剂盒说明书步骤将碘化丙啶和Annexin V加入细胞中孵育20 min,采用流式细胞术检测肿瘤细胞的凋亡,Annexin V阳性细胞为凋亡细胞。
4 统计学处理
用SPSS 14.0统计分析软件进行数据处理和统计分析。所有实验重复3次,实验数据用均数±标准差(mean±SD)表示。2组间均数的比较采用 Student’st检验,多组间均数的比较采用单因素方差分析(one-way ANOVA)后行Bonferroni校正的t检验进行组间两两比较,以P<0.05为差异有统计学意义。
结 果
1 欧前胡素对TRAIL存在协同抗乳腺癌效应
MTT实验结果显示,虽然欧前胡素(10 μmol/L)单独处理对细胞活力的抑制作用轻微,但其能显著提高各浓度TRAIL对T-47D细胞和MCF-7的杀伤活性(P<0.05)。表明欧前胡素对TRAIL存在协同抗乳腺癌效应,能显著增强TRAIL对乳腺癌细胞的杀伤活性和凋亡诱导活性,见图1。
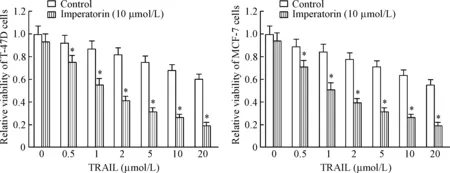
Figure 1. Imperatorin enhanced the cytotoxicity of TRAIL to breast cancer cells. Mean±SD.n=3.*P<0.05vscontrol group.
图1欧前胡素增强TRAIL对乳腺癌细胞的杀伤活性
2 欧前胡素通过ROS途径上调乳腺癌细胞表面DR5的数量
Western blot实验结果显示, 欧前胡素能显著提高T-47D细胞 TRAIL特异性受体DR5的蛋白表达水平,见图2A; 流式细胞术实验结果显示, 欧前胡素处理能明显上调T-47D细胞表面DR5的数量,然而转染DR5 siRNA沉默DR5基因表达后,欧前胡素处理不能再增加T-47D细胞表面DR5的数量,见图2B。另外,欧前胡素处理能明显诱导T-47D细胞ROS的产生,见图2C;用ROS清除剂NAC[7]对T-47D细胞进行处理后,欧前胡素对DR5的上调作用受到明显抑制,见图2D,提示欧前胡素能通过诱导ROS的产生增加T-47D细胞表面DR5的数量。这可能是欧前胡素发挥对TRAIL协同作用的机制。
3 欧前胡素通过上调T-47D细胞 DR5的表达促进TRAIL诱导的线粒体途径凋亡
MTT实验结果显示,在T-47D细胞中转染DR5 siRNA后,TRAIL联合欧前胡素对T-47D细胞的杀伤活性受到明显抑制,见图3A; 流式细胞术实验结果显示, 欧前胡素联合处理能显著提高TRAIL对T-47D细胞线粒体膜电位的损伤,而转染DR5 siRNA能显著抑制两者联合对T-47D细胞线粒体膜电位的损伤,见图3B; Western blot实验结果显示, 欧前胡素联合处理能显著提高TRAIL对T-47D细胞caspase-8和caspase-3的活化,而转染DR5 siRNA能显著抑制两者联合对T-47D细胞caspase-8和caspase-3的活化,见图3C; 同时,欧前胡素联合处理能显著提高TRAIL对T-47D细胞凋亡的诱导,而转染DR5 siRNA能显著抑制两者联合诱导的T-47D细胞凋亡的发生,见图3D。这些实验结果表明欧前胡素通过上调T-47D细胞中DR5的表达促进TRAIL诱导的线粒体途径凋亡。
讨 论
欧前胡素是从白芷根中提取的香豆素类天然活性物质。研究表明, 欧前胡素对一些肿瘤细胞有一定的抑制作用,如欧前胡素能抑制结肠癌细胞中低氧诱导因子1α 的表达,从而抑制结肠癌的增殖和血管生成;又如欧前胡素能通过抑制神经胶质瘤细胞中一些热休克蛋白的表达,诱导其发生程序性死亡。另外,欧前胡素还被报道能作为一种增敏剂,在宫颈癌的辅助治疗中,欧前胡素能下调肿瘤细胞中Mcl-1 的表达,提高其对凋亡信号的敏感性,从而增强化疗药物的抗肿瘤活性[8-10]。然而,欧前胡素对免疫治疗是否有协同增效作用,至今仍报道较少。在本研究中,作者发现欧前胡素能显著增强TRAIL对乳腺癌细胞系T-47D和MCF-7的杀伤活性,表明欧前胡素与TRAIL存在协同效应,能提高TRAIL的抗乳腺癌活性。
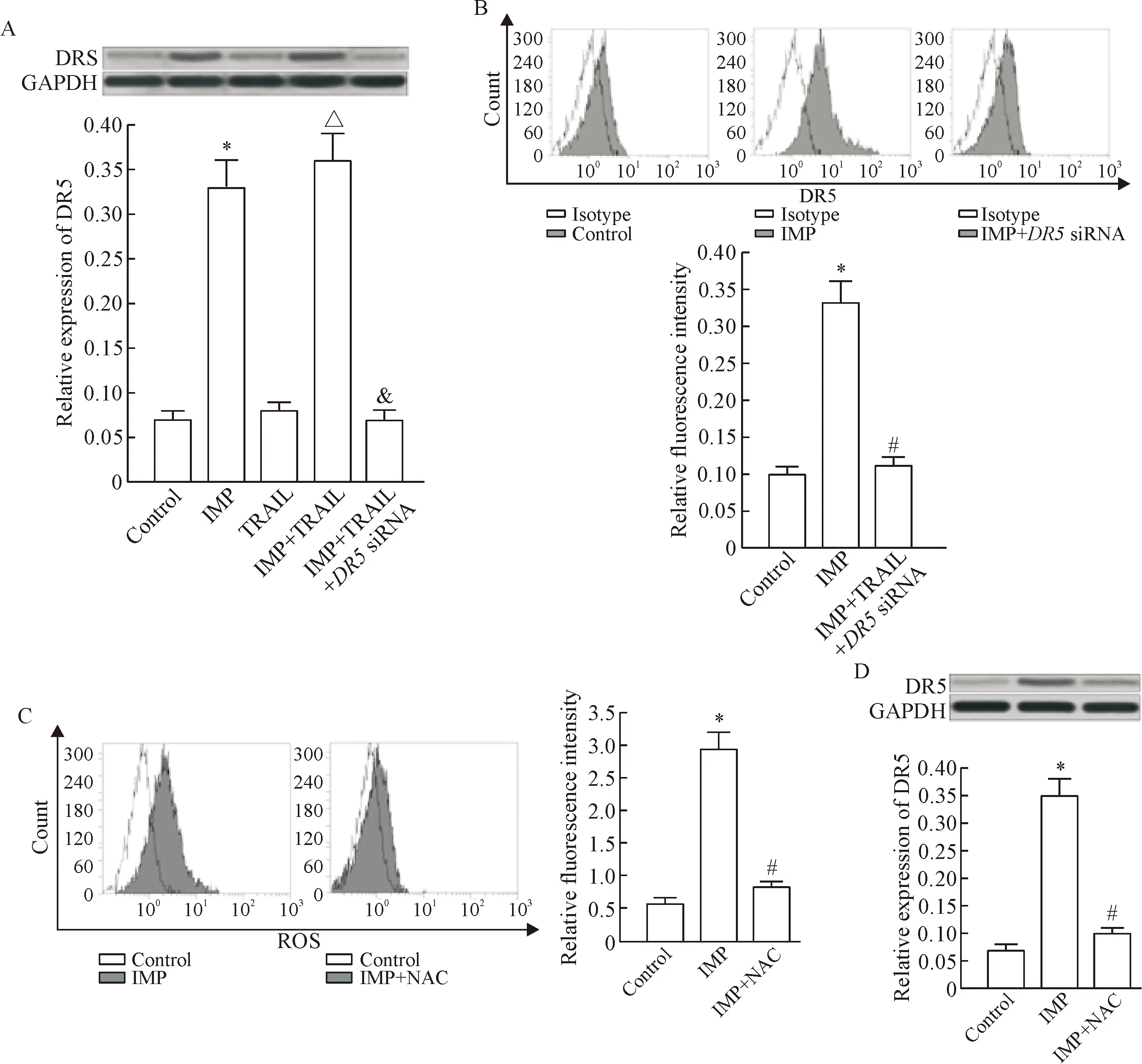
Figure 2. Imperatorin (IMP) upregulated the level of DR5 on the surface of T-47D cells through the ROS pathway. A: IMP upregulated the expression of DR5 in T-47D cells; B: treatment with IMP increased the levels of DR5 on the surface of T-47D cells; C: IMP increased the production of ROS in T-47D cells; D: NAC abolished the effect of IMP on increasing the DR5 expression level in T-47D cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsIMP group;△P<0.05vsTRAIL group;&P<0.05vsIMP+TRAIL group.
图2欧前胡素通过ROS途径上调T-47D细胞表面DR5的表达水平
在TRAIL依赖的凋亡信号通路中,TRAIL首先与细胞表面的DR4或DR5结合形成死亡受体复合物,该复合物能募集细胞中的caspase-8并使之发生活化;活化的caspase-8通过BID途径使肿瘤细胞的线粒体发生失能,导致线粒体膜电位下降从而诱导细胞发生线粒体途径的凋亡[11-13]。DR5的表达受细胞中多种刺激因子的调控,肿瘤细胞中ROS的聚集能诱导细胞DR5的显著表达[14-15]。在本研究中,作者发现欧前胡素能显著诱导乳腺癌细胞中ROS的产生并上调TRAIL的特异性受体DR5的表达水平,提示欧前胡素能通过ROS途径上调乳腺癌细胞表面DR5的数量,从而对TRAIL发挥协同效应。当用siRNA下调乳腺癌细胞中DR5的表达后,欧前胡素对TRAIL的协同效应受到明显抑制,证明欧前胡素是通过增加乳腺癌细胞中DR5的表达水平增强TRAIL依赖的凋亡信号,促使乳腺癌细胞发生caspase-8的活化,导致细胞发生线粒体途径的凋亡。
综上所述,本研究证明了欧前胡素对TRAIL有协同抗乳腺癌效应,其机制可能在于欧前胡素能上调乳腺癌细胞中DR5的表达水平。这些研究结果为更有效地将TRAIL应用于临床提供了新的策略和思路。
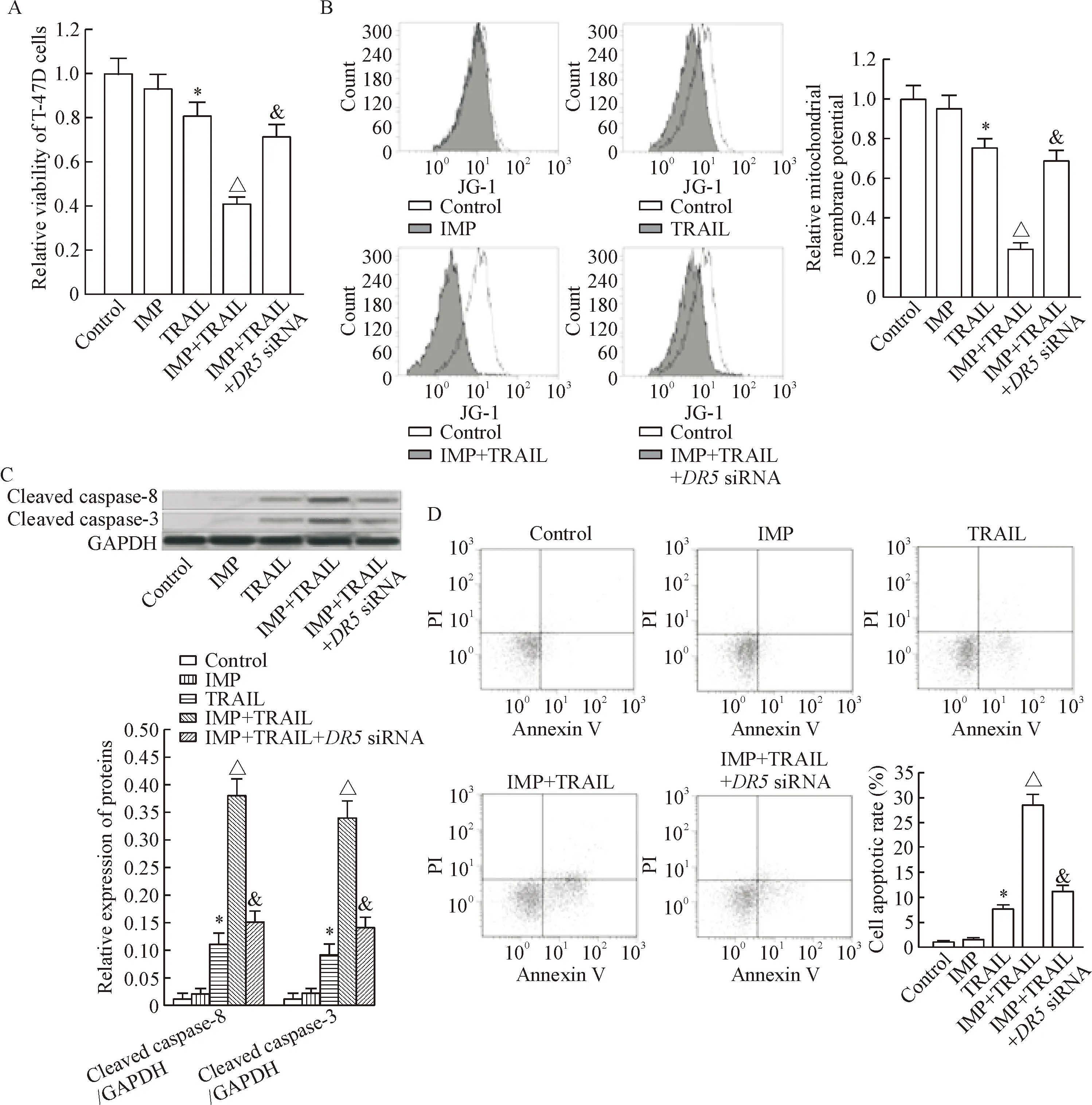
Figure 3. Imperatorin (IMP) enhanced the mitochondrial apoptosis induced by TRAIL through increasing the expression of DR5. A: transfection withDR5 siRNA inhibited the IMP-promoted cell death induced by TRAIL in T-47D cells; B: transfection withDR5 siRNA inhibited the IMP-promoted damage of mitochondrial membrane potential induced by TRAIL in T-47D cells; C: co-treatment with IMP and TRAIL significantly triggered the activation of caspase-8 and caspase-3 in T-47D cells; D: co-treatment with IMP and TRAIL significantly induced the apoptosis of T-47D cells. Mean±SD.n=3.*P<0.05vscontrol group;△P<0.05vsTRAIL group;&P<0.05vsIMP+TRAIL group.
图3欧前胡素通过上调T-47D细胞中DR5的表达促进TRAIL诱导的线粒体途径凋亡
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1):11-30.
[2] Spellman A, Tang SC. Immunotherapy for breast cancer: past, present, and future[J]. Cancer Metastasis Rev, 2016, 35(4):525-546.
[3] Joshi P, Jeon YJ, LaganA, et al. MicroRNA-148a reduces tumorigenesis and increases TRAIL-induced apoptosis in NSCLC[J]. Proc Natl Acad Sci U S A, 2015, 112(28):8650-8655.
[4] Li X, You M, Liu YJ, et al. Reversal of the apoptotic resistance of non-small-cell lung carcinoma towards TRAIL by natural product toosendanin[J]. Sci Rep, 2017, 7:42748.
[5] Sun X, Li Y, Zheng M, et al. MicroRNA-223 increases the sensitivity of triple-negative breast cancer stem cells to TRAIL-induced apoptosis by targeting HAX-1[J]. PLoS One, 2016, 11(9):e0162754.
[6] Prathapan A, Vineetha VP, Raghu KG. Protective effect of Boerhaavia diffusa L. against mitochondrial dysfunction in angiotensin II induced hypertrophy in H9c2 cardiomyoblast cells[J]. PLoS One, 2014, 9(4):e96220.
[7] Jiang K, Wang W, Jin X, et al. Silibinin, a natural flavonoid, induces autophagy via ROS-dependent mitochondrial dysfunction and loss of ATP involving BNIP3 in human MCF7 breast cancer cells[J]. Oncol Rep, 2015, 33(6):2711-2718.
[8] Mi C, Ma J, Wang KS, et al. Imperatorin suppresses proliferation and angiogenesis of human colon cancer cell by targeting HIF-1α via the mTOR/p70S6K/4E-BP1 and MAPK pathways[J]. J Ethnopharmacol, 2017, 203:27-38.
[9] Bdziul D, Jakubowicz-Gil J, Gawron A, et al. The effect of quercetin and imperatorin on programmed cell death induction in T98G cellsinvitro[J]. Pharmacol Rep, 2014, 66(2):292-300.
[10] 郑 颖, 姜 凯. 欧前胡素增强多柔比星对HeLa细胞的抗肿瘤效应[J]. 中国病理生理杂志, 2015, 31(9):1578-1583.
[11] Riddick E, Evans S, Rousch J, et al. Identification of death receptors DR4 and DR5 in HTB-12 astrocytoma cell lines and determination of TRAIL sensitivity[J]. J Solid Tumors, 2013, 3(6):20-26.
[12] Huang G, Chen X, Cai Y, et al. miR-20a-directed regulation of BID is associated with the TRAIL sensitivity in colorectal cancer[J]. Oncol Rep, 2017, 37(1):571-578.
[13] Laussmann MA, Passante E, Hellwig CT, et al. Proteasome inhibition can impair caspase-8 activation upon submaximal stimulation of apoptotic tumor necrosis factor-related apoptosis inducing ligand (TRAIL) signaling[J]. J Biol Chem, 2012, 287(18):14402-14411.
[14] Jayasooriya RG, Choi YH, Kim GY, et al. Camptothecin sensitizes human hepatoma Hep3B cells to TRAIL-mediated apoptosis via ROS-dependent death receptor 5 upregulation with the involvement of MAPKs[J]. Environ Toxicol Pharmacol, 2014, 38(3):959-967.
[15] Chang CC, Kuan CP, Lin JY, et al. Tanshinone IIA facilitates TRAIL sensitization by up-regulating DR5 through the ROS-JNK-CHOP signaling axis in human ovarian carcinoma cell lines[J]. Chem Res Toxicol, 2015, 28(8):1574-1583.

