青蒿琥酯通过增加活性氧簇生成诱导人肝癌HepG2细胞凋亡*
朱文赫, 张 巍, 李 妍, 徐俊杰, 张 红, 吕士杰
(吉林医药学院生物化学教研室, 吉林 吉林 132013)
1971年中国科学家从中药黄花蒿中提取出了青蒿素,证实青蒿素是一个具有过氧基团的新倍半萜内酯化合物。青蒿琥酯(artesunate,ART)是半合成的青蒿素衍生物,具有水溶性好、安全性高和耐药性低的突出优点,有很好的抗疟效果,同时其表现出的强大抗肿瘤活性越来越引起国内外学者注意[1-2]。Zhao等[3]通过体外培养A549细胞,并构建裸鼠体内移植瘤模型发现青蒿琥酯能增强A549细胞的放射敏感性,青蒿琥酯联合放疗可抑制移植瘤的生长。研究发现[4],青蒿琥酯能够抑制多发性骨髓瘤细胞的增殖并诱导其凋亡,并通过抑制骨髓血管新生和逆转骨髓瘤细胞多药耐药等多种机制,抑制多发性骨髓瘤的发生和发展。虽然青蒿琥酯对于不同组织来源的肿瘤细胞具有一定的杀伤性,但具体机制尚未完全明确。
因此,本研究以人肝癌细胞HepG2为研究对象,探讨青蒿琥酯促人肝癌细胞HepG2的凋亡作用及其可能的分子机制,为青蒿琥酯在肝癌临床治疗中应用提供理论依据。
材 料 和 方 法
1 细胞、试剂与仪器
人肝癌HepG2细胞购自中科院上海生命科学研究院细胞资源中心,由吉林医药学院生物化学教研室保存。细胞培养于含10%小牛血清、1×105U/L青霉素和100 mg/L 链霉素的RPMI-1640培养液中,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。每2天更换培养液1次,待细胞长满至培养瓶底,以0.25%胰酶消化传代。
青蒿琥酯购于Sigma;抗Bax、Bcl-2、caspase-3和细胞色素C(cytochrome C,Cyt C)抗体购于Santa Cruz;BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所。Muse细胞分析仪购于Merch Millipore;550型酶标仪购于Bio-Rad;CKX41-A32PH倒置显微镜购于Olympus。
2 方法
2.1MTT法测定细胞存活率的变化 取对数生长期的HepG2细胞,吸去细胞培养液,0.25%胰酶消化并调整细胞数至5×107/L。以每孔200 μL接种于96 孔板中,常规培养。待细胞贴壁后,分别给予10、20、40、80和160 μmol/L的青蒿琥酯,每组设5复孔,继续培养24 h,每孔加入20 μL MTT,37 ℃继续培养4 h。吸弃培养孔内上清液,每孔加入150 μL DMSO,振荡摇匀,在酶标仪上以波长490 nm 测各孔的吸光度(A),并计算细胞存活抑制率。细胞存活抑制率(%)= (1-A实验组/A对照组)×100%。
2.2Hoechst 33258 荧光染色检测细胞凋亡形态 取药物处理后的HepG2细胞,加入0.5 mL固定液固定10 min。弃去固定液,用PBS洗2次,每次3 min,吸尽液体。加入0.5 mL Hoechst 33258染色液,染色5 min。用PBS洗2遍,荧光显微镜下观察细胞凋亡形态的改变。
2.3细胞分析术检测凋亡 取药物处理后的HepG2细胞,0.25% 胰酶消化,1 000 r/min离心5 min,收集约1×105个细胞,弃去培养液,100 μL PBS重悬细胞,加入100 μL 凋亡试剂盒染料,Muse细胞分析仪检测细胞凋亡。
2.4HepG2细胞内活性氧簇(reactive oxygen species,ROS)水平的检测 收集处理后1×109/L 细胞悬液,PBS 洗涤后,加入1 mL PBS液重悬,加入2.5 mmol/L的CDFH-DA 液40 μL,使终浓度为100 μmol/L,在37 ℃下避光孵育1 h,PBS洗涤后上流式细胞仪检测。
2.5Western blot检测凋亡相关蛋白的表达 取药物处理后的HepG2细胞,0.25%胰酶消化,1 000 r/min离心10 min收集细胞,以PBS洗2次,用PIPA细胞裂解液于冰浴裂解,12 000 r/min离心5 min,收集上清。经BCA法进行蛋白定量后,取等量样品行12%SDS-PAGE。电泳后将蛋白转印至硝酸纤维素膜上,5%脱脂奶粉封闭1 h后,兔抗人Bax、Bcl-2、caspase-3、caspase-9和Cyt C抗体(浓度1∶1 000)孵育过夜,再以辣根过氧化酶标记的 II 抗封闭液孵育1 h,用ECL显影,扫描纪录。
2.6Western blot检测NADPH氧化酶亚基p47phox和p22phox表达水平 取HepG2细胞,经50 μmol/L的NADPH氧化酶抑制剂夹竹桃麻素(apocynin)预孵育30 min后, 再加入56.57 μmol/L(IC50)的青蒿琥酯处理细胞。按照方法2.5所述,提取细胞蛋白,进行Western blot实验,检测NADPH氧化酶亚基p47phox和p22phox的表达。
2.7Apocynin对青蒿琥酯诱导HepG2细胞内ROS的影响 取HepG2细胞,经50 μmol/L的apocynin预孵育30 min后,再加入56.57 μmol/L(IC50)的青蒿琥酯处理细胞。按照方法2.4所述,检测细胞内ROS水平变化。
3 统计学处理
所有实验数据均采用 SPSS 13.0 软件处理。实验数据以均数±标准差(mean±SD)表示,对照组与给药各组比较进行单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 青蒿琥酯对HepG2细胞活力的抑制作用
MTT实验结果显示,不同浓度青蒿琥酯作用HepG2细胞后,HepG2细胞的活力受到明显抑制,且随青蒿琥酯药物浓度增加,抑制作用显著提高(P<0.05),见图1。
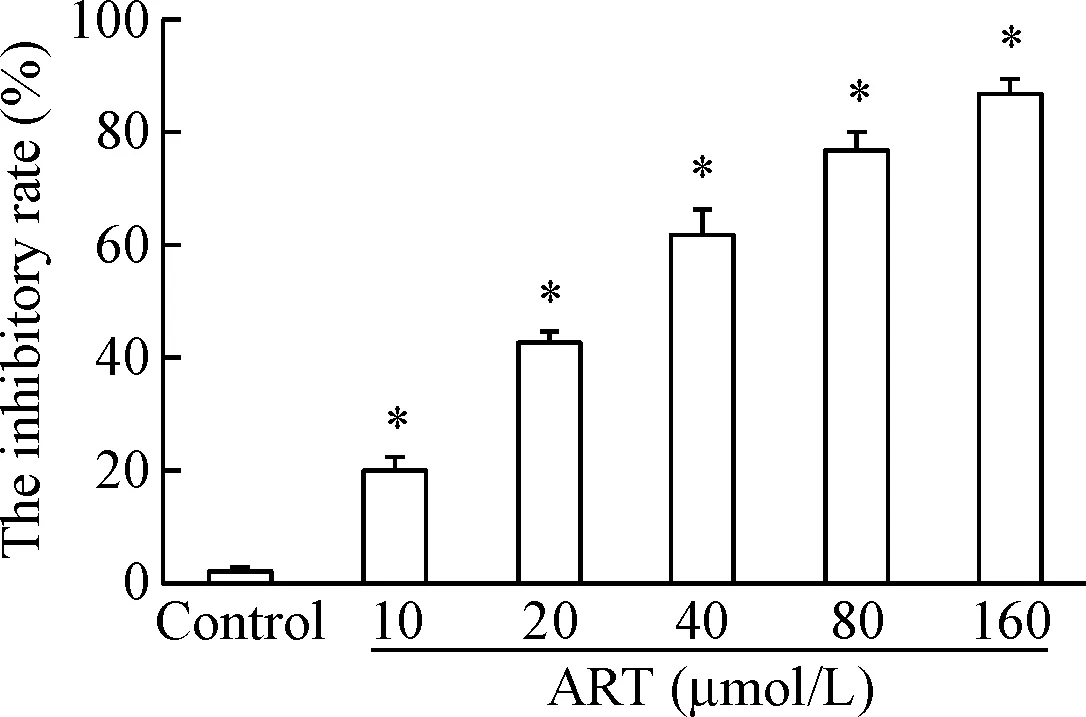
Figure 1. Inhibitory effect of ART at different concentrations on the viability of HepG2 cells. Mean±SD.n=5.*P<0.05vscontrol group.
图1不同浓度青蒿琥酯对HepG2细胞活力的抑制作用
2 青蒿琥酯对HepG2细胞凋亡形态的影响
Hoechst 33258 核染色结果显示,与对照相比,青蒿琥酯给药组的细胞凋亡明显增多,细胞染色质固缩,细胞核呈致密浓染色,且胞核变小浓集,呈现凋亡细胞的特征,见图2。
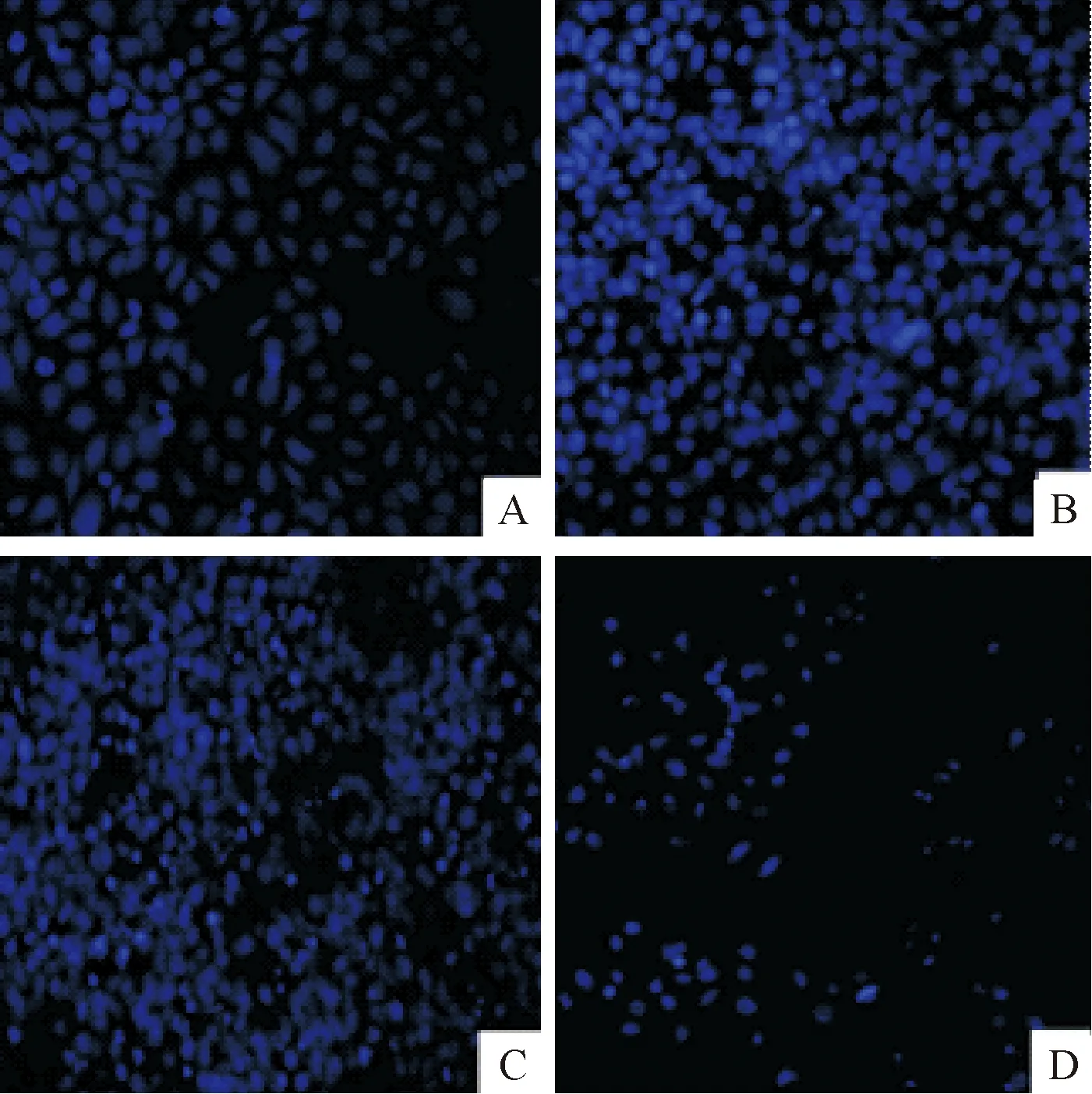
Figure 2. The effects of ART on the morphological changes of apoptotic HepG2 cells(×200). A: control group; B, C and D: the cells were treated with ART at 20, 40 and 80 μmol/L, respectively.
图2青蒿琥酯对HepG2细胞凋亡形态的影响
3 青蒿琥酯对HepG2细胞凋亡的影响
流式细胞术检测凋亡结果显示,青蒿琥酯作用HepG2细胞24 h后,细胞凋亡比例明显增加。对照组HepG2细胞早期凋亡率为2.35%±0.70%,与对照相比,青蒿琥酯给药组随着青蒿琥酯给药浓度的升高,HepG2细胞凋亡率明显升高,早期凋亡率分别为12.38%±0.80%、18.86%±1.72%和29.59%±1.49%,见图3。
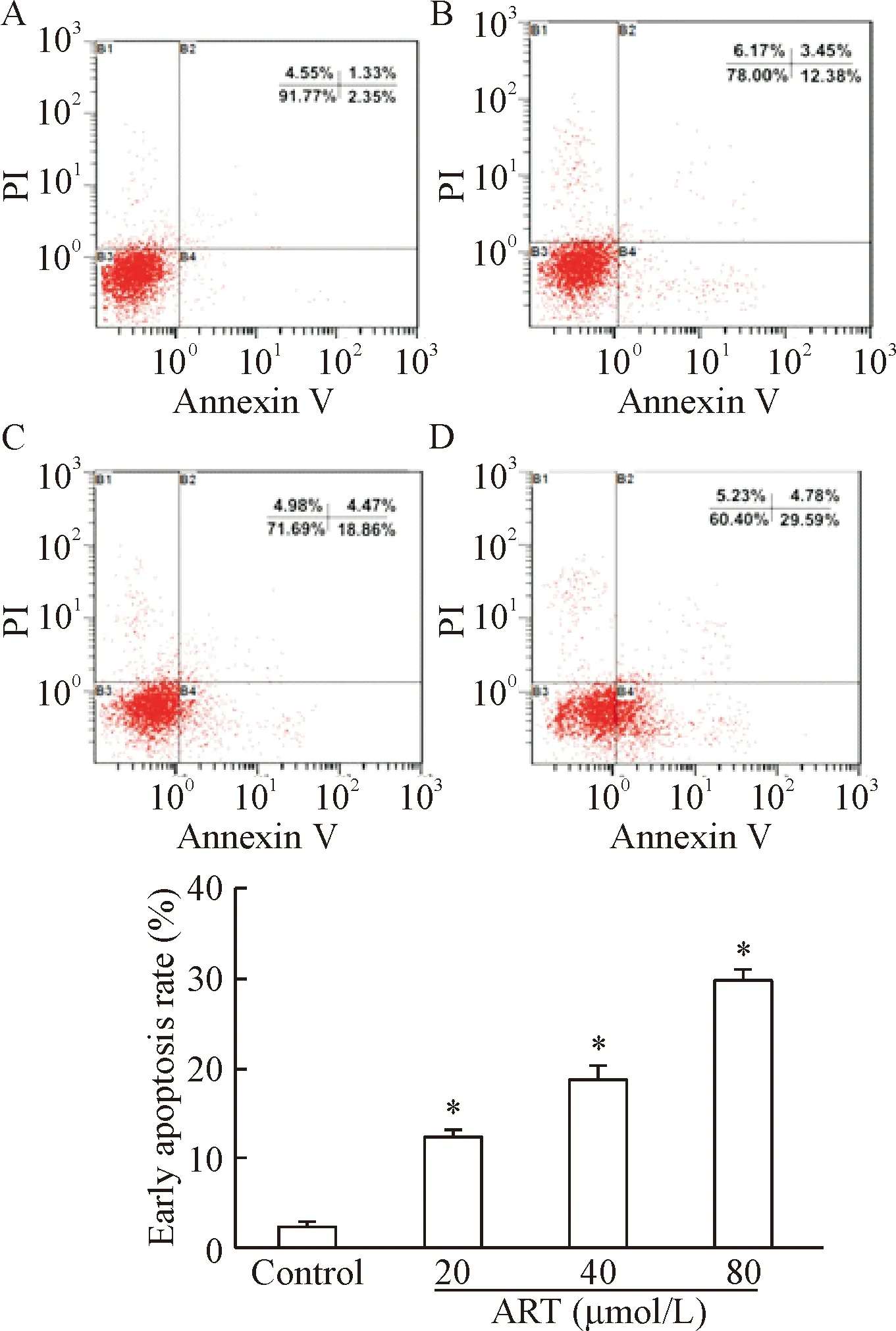
Figure 3. The cell apoptosis was detected by flow cytometry. A: control group; B, C and D: the cells were treated with ART at 20, 40 and 80 μmol/L, respectively. Mean±SD.n=5.*P<0.05vscontrol group.
图3流式细胞术检测细胞凋亡
4 青蒿琥酯对HepG2细胞ROS水平的影响
活性氧测定结果显示,与对照组相比,HepG2细胞内ROS的水平随着青蒿琥酯给药浓度的升高呈现升高趋势(P<0.05),见图4。
5 青蒿琥酯对HepG2细胞内凋亡相关蛋白表达的影响
Western blot检测结果显示,与对照组相比,不同浓度青蒿琥酯给药组HepG2细胞Bcl-2蛋白表达下调,Bax蛋白表达上调,Bax/Bcl-2蛋白表达比例升高。为了进一步探讨青蒿琥酯诱发HepG2细胞凋亡的作用机制,我们又检测了cleaved caspase-3和CytC蛋白水平的变化,结果显示其蛋白水平均明显上调。上述结果表明青蒿琥酯促HepG2细胞凋亡机制可能与线粒体凋亡途径相关,见图5。
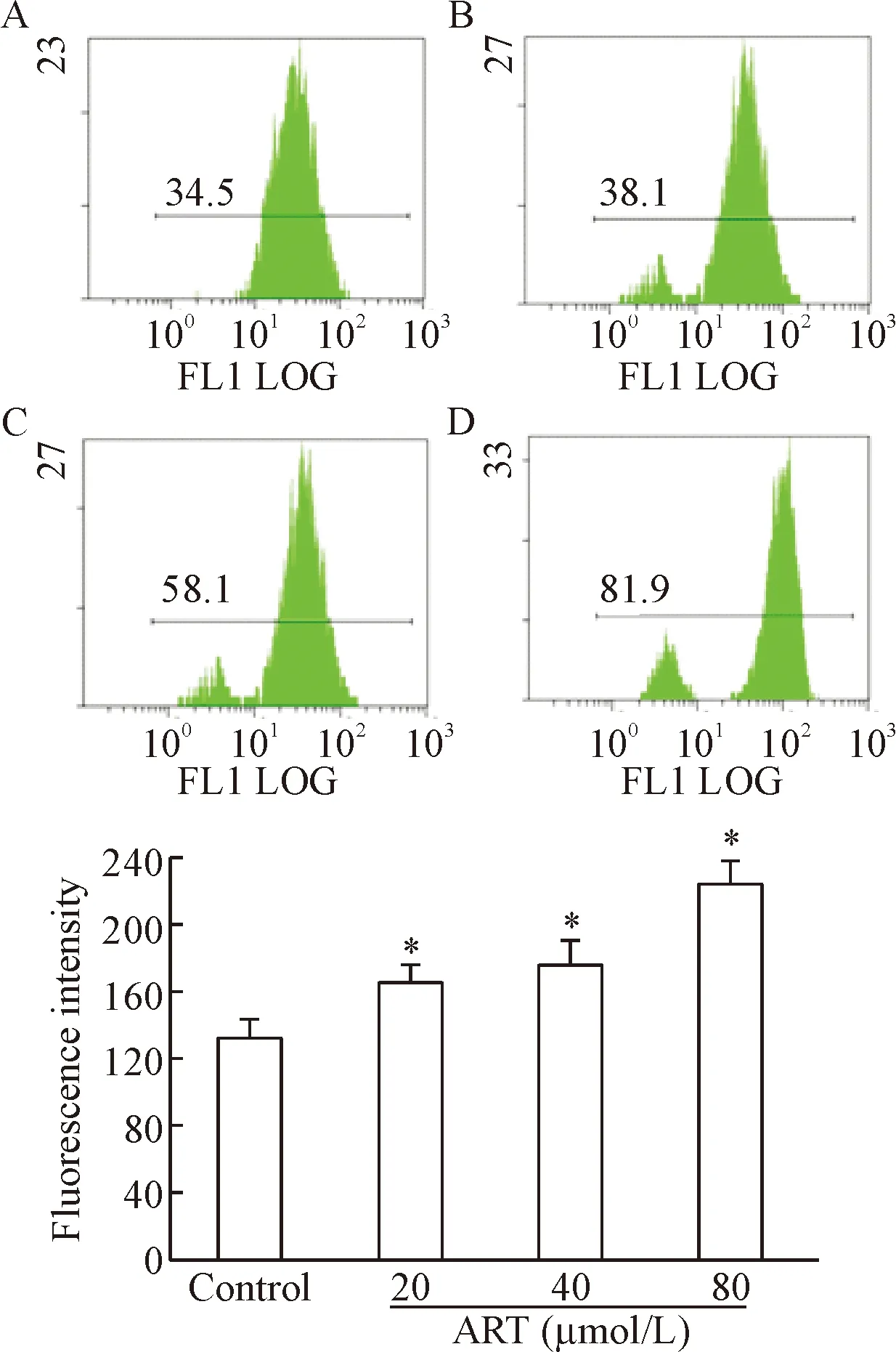
Figure 4. The changes of intracellular ROS in the HepG2 cells after treatment with ART for 24 h. A: control group; B, C and D: the cells were treated with ART at 20, 40 and 80 μmol/L, respectively. Mean±SD.n=5.*P<0.05vscontrol group.
图4青蒿琥酯诱导HepG2细胞24h后细胞内ROS水平的变化
6 Western blot检测p47phox和p22phox的表达水平
Western blot结果显示,与对照相比,青蒿琥酯给药组细胞内p47phox和p22phox蛋白表达水平呈现升高趋势。与青蒿琥酯给药组相比,预先经过NADPH氧化酶抑制剂apocynin孵育组p47phox和p22phox蛋白表达呈现下降趋势,见图6。
7 Apocynin对青蒿琥酯诱导HepG2内ROS生成的影响
活性氧测定结果显示,与对照组相比,青蒿琥酯给药组HepG2细胞内活性氧的水平呈现升高趋势。与青蒿琥酯给药组相比,预先经过apocynin孵育组ROS呈现下降趋势,见图7。
讨 论
肝细胞癌(hepatocellular carcinoma,HCC)是一种常见的消化系统恶性肿瘤,恶性程度高、生存期短,目前肝癌的手术和介入化疗等技术虽有所提高,但疗效仍然不尽人意,故寻找新的低毒高效药物意义重大。近年来研究发现[5-7],青蒿琥酯在肿瘤治疗中展现了潜在的应用价值,但是其具体作用机制仍然有待进一步的研究。因此,本研究以人肝癌细胞HepG2为研究对象,探讨青蒿琥酯对肝癌细胞增殖的抑制作用及其机制,为青蒿琥酯的进一步临床应用提供实验数据。
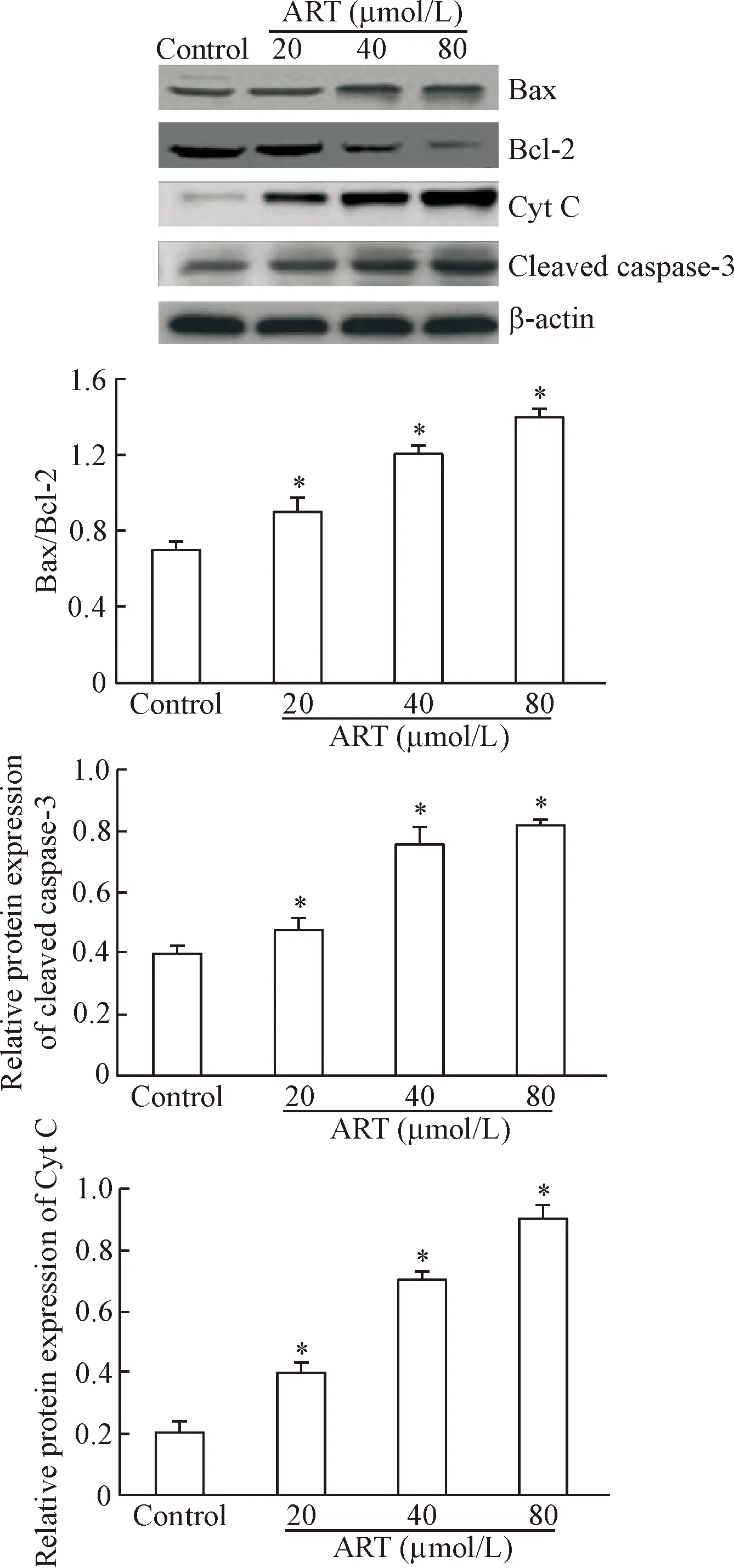
Figure 5. The protein levels of apoptosis-related proteins were detected by Western blot. Mean±SD.n=5.*P<0.05vscontrol group.
图5Westernblot检测细胞内凋亡相关蛋白水平的变化
ROS是一类氧的单电子还原产物,包括单线态氧、超氧化物、过氧化物、氢氧自由基、次氯酸及一氧化氮等。ROS可以作为第二信使参与对各种刺激的信号传导,而最新研究发现肿瘤的发生不仅是细胞分裂失控所导致细胞过度增生所致,同时也可能是细胞凋亡通路受阻所致,凋亡的诱导和抑制与信号转导通路有关[8-9]。活性氧是细胞凋亡的早期信号,它可作用于线粒体,促使线粒体膜通透性改变、线粒体膜电位下降、细胞色素C释放。它还能与Apaf-1、caspase-9前体、ATP/dATP形成凋亡体,然后召集并激活caspase-9和caspase-3,进而引发caspases级联反应,使DNA 断裂,引起细胞凋亡[10-12]。
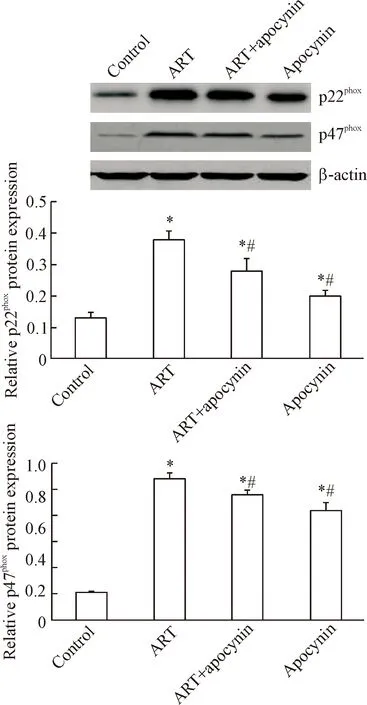
Figure 6. The effects of ART and apocynin on the expression of p47phoxand p22phox. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsART group.
图6青蒿琥酯和apocynin对p47phox和p22phox表达的影响
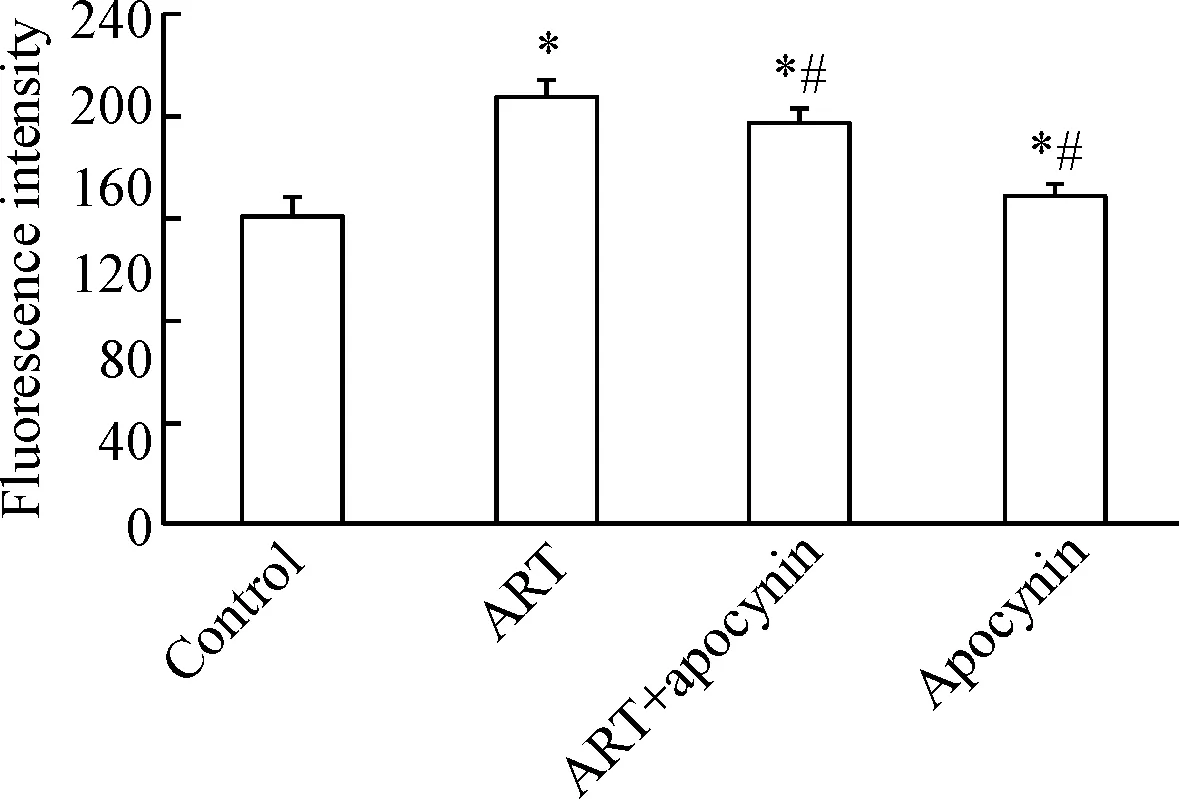
Figure 7. The effect of apocynin on ROS production induced by ART in the HepG cells. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsART group.
图7Apocynin对青蒿琥酯诱导的HepG2细胞内ROS生成的影响
本实验首先通过MTT实验观察青蒿琥酯对HepG2细胞存活率的影响。结果显示青蒿琥酯能抑制HepG2细胞的活力,其抑制作用随着青蒿琥酯药物浓度的升高呈现一定的剂量依赖性。流式细胞术检测凋亡结果显示,青蒿琥酯作用于HepG2细胞24 h,细胞凋亡比例增加,我们可以判断青蒿琥酯是通过细胞凋亡方式来抑制肿瘤细胞的生长。细胞内ROS水平检测发现,青蒿琥酯作用后肝癌细胞HepG2内的ROS明显增加,且在一定的浓度范围内呈浓度依赖。为了进一步明确青蒿琥酯诱导HepG2细胞凋亡的分子机制,我们通过Western blot检测细胞内蛋白表达变化,结果显示,青蒿琥酯作用HepG2细胞后,细胞内Bcl-2蛋白表达下调,Bax蛋白表达上调,Bax/Bcl-2蛋白表达比例升高,cleaved caspase-3和Cyt C蛋白表达升高。Bax与Bcl-2有很高的同源性,二者形成的蛋白二聚体是细胞死亡信号通路的分子开关,Bax相对量高于Bcl-2 时,Bax同二聚体的数量增多,促进细胞死亡[13];而Bcl-2表达量占优势时,则促进形成Bcl-2 /Bax异二聚体,并使Bcl-2 同二聚体量增多,抑制细胞凋亡。线粒体是ROS 的主要来源和促凋亡作用靶点,线粒体凋亡途径其特点是线粒体级联反应导致细胞色素C释放,活化caspases-9,并形成凋亡小体及多蛋白复合物,进而活化下游caspase-3,放大死亡信号,诱导细胞凋亡[14-16]。因此,青蒿琥酯抑制肝癌细胞HepG2的增殖并诱发细胞凋亡可能与线粒体凋亡途径相关。
NADPH 氧化酶是体内氧化应激的另一个重要来源,包括存在于胞膜的p22phox和gp91phox以及存在于胞质中的p47phox、p67phox等亚单位[17]。为了进一步明确青蒿琥酯促HepG2细胞凋亡的分子机制,我们检测了青蒿琥酯对HepG2细胞中p22phox和p47phox蛋白表达变化情况。结果发现青蒿琥酯能上调HepG2细胞内p22phox和p47phox蛋白表达,而采用NADPH氧化酶抑制剂apocynin能够下调青蒿琥酯给药组p22phox和p47phox蛋白表达。
综上所述,青蒿琥酯可能诱导HepG2细胞产生活性氧,由活性氧引发Bcl-2下调和Bax上调,使线粒体膜电位丧失,通透性增加,释放细胞色素C,激活典型的线粒体凋亡通路,是青蒿琥酯诱导HepG2细胞凋亡的可能分子机制之一。本研究为青蒿琥酯在肝癌中的治疗应用奠定理论基础。
[1] Rolling T, Agbenyega T, Krishna S, et al. Delayed haemolysis after artesunate treatment of severe malaria: review of the literature and perspective[J]. Travel Med Infect Dis, 2015, 13(2):143-149.
[2] Zuo S, Li Q, Liu X, et al. The potential therapeutic effects of artesunate on stroke and other central nervous system diseases[J]. Biomed Res Int, 2016, 2016:1489050.
[3] Zhao Y, Jiang W, Li B, et al. Artesunate enhances radiosensitivity of human non-small cell lung cancer A549 cells via increasing NO production to induce cell cycle arrest at G2/M phase[J]. Int Immunopharmacol, 2011, 11(12): 2039-2046.
[4] 成志勇, 杨晓阳, 魏玉涛, 等. 青蒿琥酯抗骨髓瘤作用机制研究进展[J]. 癌变畸变突变, 2010, 22(4):326-328.
[5] Kim C, Lee JH, Kim SH, et al. Artesunate suppresses tumor growth and induces apoptosis through the modulation of multiple oncogenic cascades in a chronic myeloid leukemia xenograft mouse model[J]. Oncotarget, 2015, 6(6): 4020-4035.
[6] Liu L, Zuo LF, Zuo J, et al. Artesunate induces apoptosis and inhibits growth of Eca109 and Ec9706 human esophageal cancer cell linesinvitroandinvivo[J]. Mol Med Rep, 2015, 12(1):1465-1472.
[7] Xu J, Wei M, Li G, et al. Synthesis and anti-tumor activities of novel artemisone-piperazine-sulfonamide derivatives[J]. Chem J Chin Univer, 2015, 36(5):919-926.
[8] Ago T, Sadoshima J. From contractile enhancement to pathological hypertrophy: angiotensin II-induced Nox2-mediated reactive oxygen species[J]. J Am Coll Cardiol, 2015, 66(3):273-277.
[9] Qu X, Alvarez PJ, Li Q. Photochemical transformation of carboxylated multiwalled carbon nanotubes: role of reactive oxygen species[J]. Environ Sci Technol, 2016, 47(24):14080-14088.
[10] Kwon YH, Bishayee K, Rahman A, et al.Morusalbaaccumulates reactive oxygen species to initiate apoptosis via FOXO-caspase 3-dependent pathway in neuroblastoma cells[J]. Mol Cell, 2015, 38(7):630-637.
[11] Mohammad G, Alam K, Nawaz MI, et al. Mutual enhancement between high-mobility group box-1 and NADPH oxidase-derived reactive oxygen species mediates diabetes-induced upregulation of retinal apoptotic markers[J]. J Physiol Biochem, 2015, 71(3):359-372.
[12] Ying J, Shan S, Chi L, et al. Methyl methanesulfonate induces necroptosis in human lung adenoma A549 cells through the PIG-3-reactive oxygen species pathway[J]. Tumor Biol, 2016, 37(3):3785-3795.
[13] Siddiqui WA, Ahad A, Ahsan H. The mystery of BCL2 family: Bcl-2 proteins and apoptosis: an update [J]. Arch Toxicol, 2015, 89(3):289-317.
[14] 朱文赫, 沈 楠, 徐俊杰, 等. 微波辐射对大鼠能量代谢及心肌细胞凋亡的影响[J]. 中国病理生理杂志, 2015, 31(4):647-651.
[15] Sitarek P, Skaa E, Toma M, et al. A preliminary study of apoptosis induction in glioma cells via alteration of the Bax/Bcl-2-p53 axis by transformed and non-transformed root extracts ofLeonurussibiricusL.[J]. Tumor Biol, 2016, 37(7):8753-8764.
[16] Zhang S, Qin F, Yang L, et al. Nucleophosmin mutations induce chemosensitivity in THP-1 leukemia cells by suppressing NF-κB activity and regulating Bax/Bcl-2 expression[J]. J Cancer, 2016, 7(15):2270-2279.
[17] 梅爱红, 刘俊许, 陈思锋, 等. 胰岛素通过活性氧的产生促进VEGF表达及血管平滑肌细胞迁移和增殖[J]. 中国病理生理杂志, 2013, 29(2): 272-277.

