miR-153靶向PRDM2基因并通过JAK/STAT信号通路影响膀胱癌的侵袭和迁移*
李冠军, 亚国伟, 唐正严, 苏开德
(南阳医学高等专科学校第一附属医院 1泌尿外科, 2肿瘤科, 河南 南阳 473000; 3中南大学湘雅医院泌尿外科, 湖南 长沙 410008; 4常德市第一人民医院泌尿外科, 湖南 常德 415003)
微小RNA(microRNA,miRNA,miR)是一类由 19~25个核苷酸组成的非编码单链小RNA,它可以通过与目标基因mRNA的非翻译区结合,起到调控细胞生长、器官分化和肿瘤细胞的增殖侵袭等生物学行为的作用[1-3]。miR-153是一种重要的miRNA,在肺癌、乳腺癌和膀胱癌等恶性肿瘤中都有相应的异常表达[4-6],与肿瘤的发生发展有密不可分的关联。
正性调控域锌指蛋白(positive regulatory domain zinc finger protein,PRDM)是锌指蛋白家族中的重要成员,具有组蛋白甲基转移酶活性和抑制性转录调节功能,在肿瘤细胞的增殖侵袭和器官分化等过程中起到重要作用,在肿瘤抑制蛋白家族中占有重要的一席之地[7-8]。
Janus激酶(Janus kinase,JAK)/信号转导及转录激活蛋白(signal transducer and activator of transcription,STAT)信号通路近年在肿瘤侵袭方向的研究备受关注[9]。干扰素家族、gp130家族、单链蛋白家族和部分G蛋白偶联受体的信号转导途径都与JAK/STAT信号通路有一定的关联,通过该信号通路发挥作用[10-11]。
本研究旨在揭示miR-153和PRDM2在膀胱癌中的表达及对膀胱癌细胞侵袭和迁移能力的影响,并初步探讨其可能的作用机制。
材 料 和 方 法
1 临床标本采集及处理
收集2015年1月~2016年1月在我院手术切除并且经病理检查确诊为膀胱癌组织50例,同时取配对正常膀胱组织50例。膀胱癌患者术前未进行放疗。肿瘤组织离体后,去除血迹,放入4%多聚甲醛固定。
2 细胞系和主要试剂
人膀胱癌细胞系 J82、UM-UC-3、RT4和5637 购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所,细胞均呈贴壁生长状态,所用培养基为含10%胎牛血清的高糖培养基。抗PRDM2、p-JAK2和p-STAT3的 I 抗均购自 Abcam;miR-153-mimic购自上海吉凯制药技术有限公司;Transwell小室购自Millipore;PCR试剂盒均购自广州复能基因有限公司。
3 方法
3.1免疫组织化学染色 将石蜡包埋好的组织行 4 μm 连续切片,60 ℃烤箱中烘烤 3~4 h;二甲苯溶液脱蜡 3 次,每次 15 min,梯度乙醇逐步水化,每次3 min;PBS 洗3次,每次3 min;将切片置入柠檬酸盐缓冲液高压修复10 min,再置于 PBS 液中浸洗3次,每次3 min;3%过氧化氢甲醇溶液封闭10 min,PBS 液洗3次,每次3 min;加山羊血清后静置15 min后滴加 I 抗,4 ℃孵育过夜;37 ℃下复温30 min,PBS+1‰ Tween 20 液浸洗3次,每次3 min;室温下滴加 II 抗孵育15 min,PBS+1‰ Tween 20 液浸洗3次,每次3 min;滴加二氨基联苯胺后观察染色情况;苏木素染色,清水冲洗3次,烘箱内烘干,用中性树胶进行封片。
3.2Western blot实验 每孔加入30 μg PRDM2蛋白样品,行10%SDS-PAGE。使用湿转法电转至PVDF膜,5%脱脂奶粉封闭2 h,1∶2 000 TBST稀释 I 抗(羊抗人PRDM2、p-JAK2和p-STAT3单克隆抗体),4 ℃过夜;加入辣根过氧化物酶标记的兔抗羊IgG(1∶5 000)稀释,室温孵育2 h;ECL发光检测。
3.3qPCR定量检测miR-153和PRDM2的表达 首先合成双向PCR引物,将反应混合液加热至94~98 ℃保持20~30 s,反应温度降至50~65 ℃时,引物与互补的序列形成氢键。miR-153上游引物序列为5’-GGGATGGAGTCGAGGTGCGGCTAAT-3’,下游引物序列为5’-GTAGGCTGAGGAAAGTCGAGCGAGC-3’;PRDM2上游引物序列为5’-AAATGCCGAATGGCGAGCGAGATTA-3’,下游引物序列为5’-TTGAGGGCGTGGGCAGGGAGAAATGC-3’。退火温度72 ℃,维持20~40 s,继续降低至68 ℃,PCR反应进行30~35个循环,68~74 ℃延伸5~10 min。根据荧光定量试剂盒操作说明配制反应体系,每组反应体系的体积为25 μL, 设置3个复孔, 每组样本cDNA 均需行目的RNA和内参照 GAPDH 荧光定量PCR扩增,DNA全部反应完毕,计算mRNA表达情况。
3.4双萤光素酶报告基因实验 为进一步确证miR-153能够靶向作用于PRDM2,本实验将PRDM2的3’UTR区构建突变型萤光素酶报告基因载体。将萤光素酶报告载体与miR-153-mimic共转染RT4细胞36 h后,收获细胞。按萤光素酶活性检测试剂盒说明书检测RT4细胞萤光素酶活性。相对萤光素酶活性=萤火虫萤光素酶活性值/海肾萤光素酶活性值。
3.5Transwell侵袭实验检测膀胱癌细胞的侵袭能力 本实验所用Transwell小室购自BD,小室孔径为8 μm,底面厚度为8 μm。使用50 μL细胞培养基平铺在小室底,Matrigel平铺在小室上,常温下凝胶后接种细胞。将RT4细胞浓度稀释为 1×109/L,在小室上层加入300 μL含胎牛血清的细胞培养基,向每个小室上层加入25 μL的细胞悬液,然后置于37 ℃孵箱孵育24 h。用无菌棉签轻度擦拭上室上层的细胞,擦拭干净后用结晶紫染色10 min,倒去染液,PBS清洗5 min,然后于镜下观察并拍照计数。实验重复3次。
3.6划痕实验检测膀胱癌细胞的迁移能力 取对数生长期细胞接种到6孔板中,在恒温孵箱中培养,等细胞长满视野时进行后续实验。使用黑色马克笔于6孔板背后划线。使用高温灭菌的20 μL枪头在孔板上垂直于线划痕,保证枪头划痕时垂直。划好后充分冲洗,将残余悬浮细胞冲洗掉。然后向孔内加入不含胎牛血清的细胞培养基,置于恒温孵箱孵育。分别于24、48和72 h后在显微镜下取点,观察,拍照。与0 h的初始距离作对比,分别测量细胞迁移的距离,计算细胞的迁移率。迁移率(%)=(D24/48/72 h-D0 h)/D0 h×100%。
4 统计学处理
采用SPSS 20.0软件进行统计分析,计量数据以均数±标准差(mean±SD)表示,组间比较采用两独立样本t检验,膀胱癌组织和正常膀胱组织中的PRDM2阳性表达率采用2检验比较,以P<0.05表示差异有统计学意义。
结 果
1 膀胱癌中miR-153和PRDM2的差异性表达
免疫组化结果显示,PRDM2定位在细胞膜和细胞浆,在膀胱癌组织中表达水平较高,见图1A;miR-153在膀胱癌组织中表达明显低于正常膀胱组织(P<0.05),见图1B。50例膀胱癌组织中,43例PRDM2表达阳性;50例正常膀胱组织中,8例PRDM2表达阳性,膀胱癌组织中PRDM2的阳性表达率相对于正常膀胱组织明显升高,差异具有统计学意义(P<0.05),见表1。
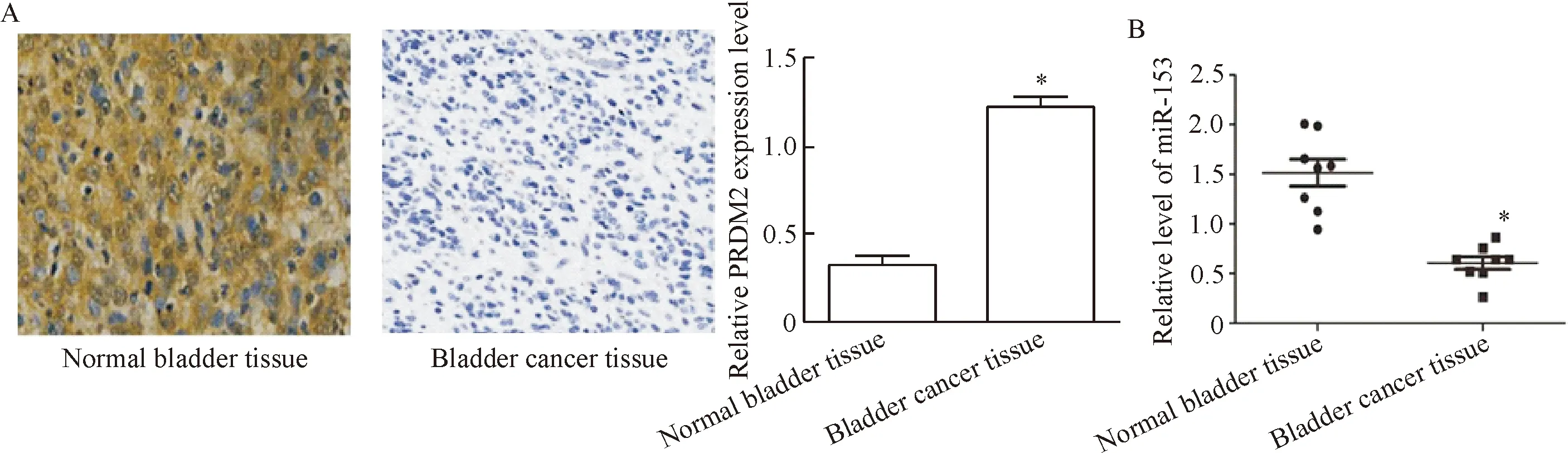
Figure 1. The expression of PRDM2 (A) and miR-153 (B) in bladder cancer detected by immunohistochemical staining (×20) and qPCR. Mean±SD.n=3.*P<0.05vsnormal bladder tissue group.
图1PRDM2和miR-153在膀胱癌组织和正常膀胱组织的表达情况
表1膀胱癌与正常膀胱组织中PRDM2的表达比较
Table 1. The expression of PRDM2 in bladder cancer tissues and normal bladder tissues (n=50)

GroupPRDM2proteinexpressionPositiveNegativeNormalbladder842Bladdercancer43* 7*
*P<0.05vsnormal bladder.
2 PRDM在不同膀胱癌细胞株中的表达
Western blot 实验结果显示,与J82、UM-UC-3和5637细胞株相比,PRDM2蛋白在RT4细胞株中表达最低(P<0.05),见图2,所以后续实验我们选取膀胱癌细胞RT4作为实验细胞株。
3 双萤光素酶报告基因实验验证miR-153与PRDM2的靶向关系
生物信息学软件(TargetScan)预测,miR-153可以调控PRDM2的表达。qPCR结果表明,和对照组比较,膀胱癌RT4细胞转染miR-153-mimic后,PRDM2的mRNA水平明显降低(P<0.05)。为了进一步证实PRDM2是miR-153下游的靶向基因,我们使用双萤光素酶报告系统检测发现,过表达miR-153后,RT4细胞PRDM2的转录活性相应下调(P<0.05),而将PRDM2的3’-UTR突变后,miR-153的抑制作用消失,见图3。
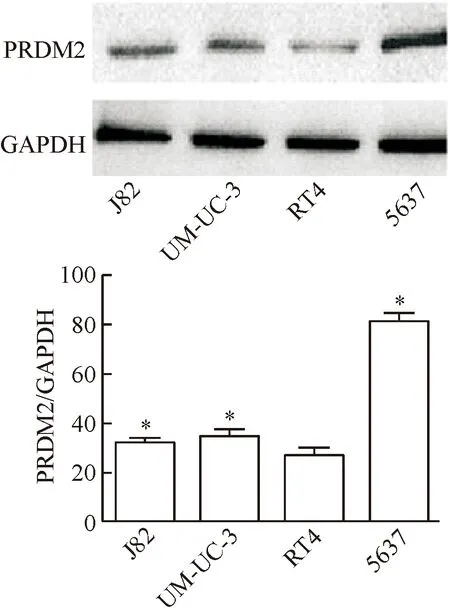
Figure 2. The expression of PRDM2 in different bladder cancer cell lines. Mean±SD.n=3.*P<0.05vsRT4.
图2PRDM2在不同膀胱癌细胞株中的表达
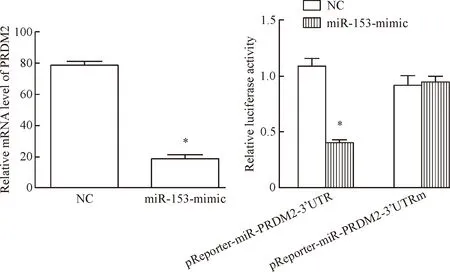
Figure 3. The expression of PRDM2 was regulated by miR-153. Mean±SD.n=3.*P<0.05vsNC group.
图3miR-153调控PRDM2的表达
4 Transwell实验检测过表达miR-153后膀胱癌细胞侵袭能力的变化
Transwell实验结果显示,miR-153-mimic组穿透基质胶的细胞数量明显少于NC组,差异有统计学意义(P<0.05),见图4。该结果表明,过表达miR-153后可以有效抑制膀胱癌RT4细胞的侵袭能力。

Figure 4. The effect of miR-153 over-expression on the invasion ability of RT4 cells detected by Transwell invasion assay (×200). Mean±SD.n=3.*P<0.05vsNC group.
图4Transwell侵袭实验检测过表达miR-153对膀胱癌细胞RT4侵袭能力的影响
5 划痕实验检测过表达miR-153后膀胱癌细胞的迁移能力的变化
划痕实验结果表明,与NC组相比,在24、48和72 h时,miR-153-mimic组迁移率均明显降低,差异有统计学意义(P<0.05),见图5。该结果表明,过表达miR-34a可以抑制RT4细胞的迁移能力。

Figure 5. The effect of miR-153 over-expression on the migration ability of RT4 cells detected by wound healing assay (×200). Mean±SD.n=3.*P<0.05vsNC group.
图5划痕实验检测过表达miR-153对膀胱癌细胞RT4迁移能力的影响
6 过表达miR-153后JAK/STAT信号通路蛋白水平的变化
Western blot实验结果显示,与NC组相比,miR-153-mimic组中p-JAK2和p-STAT3的蛋白水平明显降低(P<0.05),见图6。这说明miR-153的过表达可以有效下调p-JAK2和p-STAT3的蛋白水平。
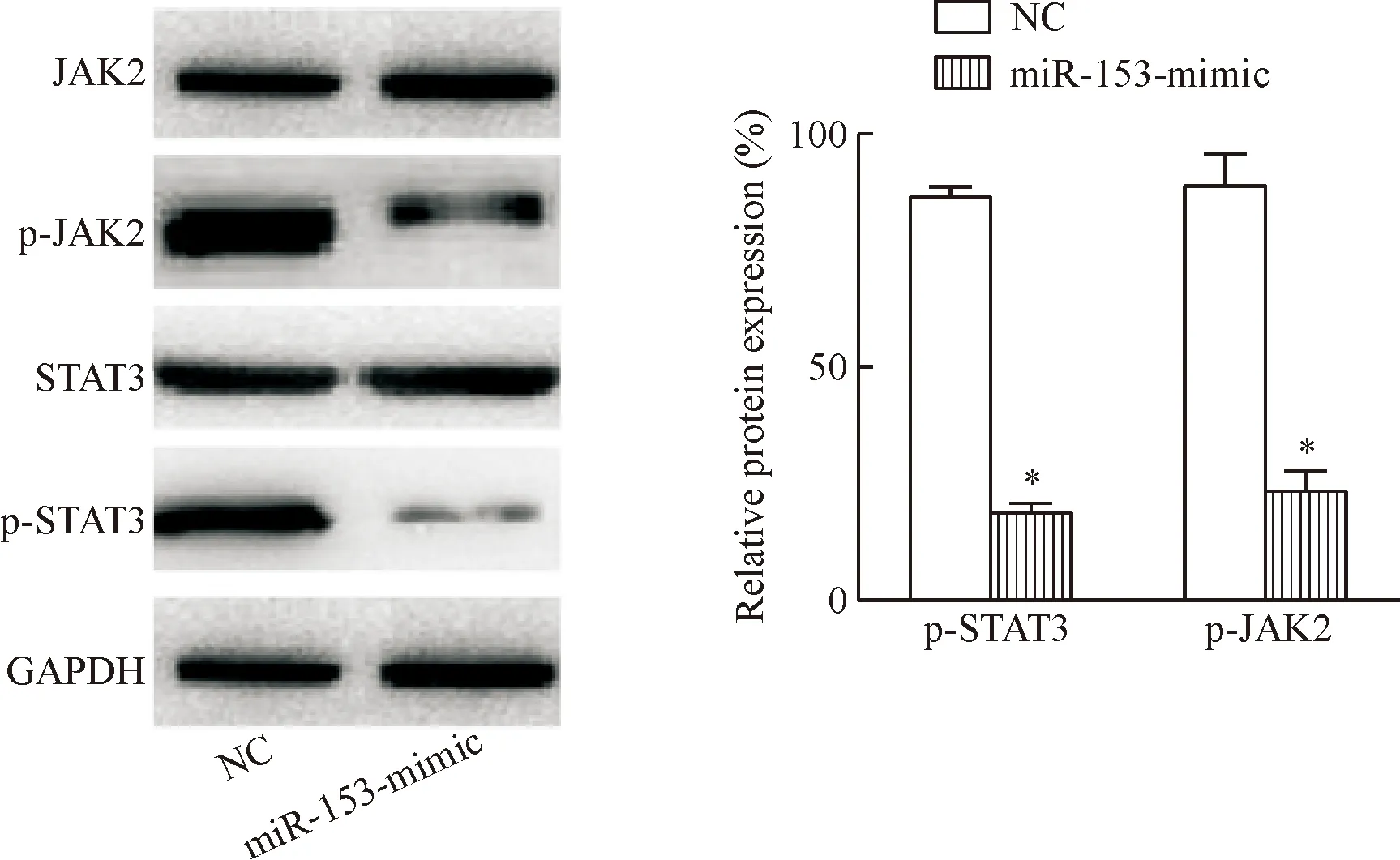
Figure 6. Over-expression of miR-153 down-regulated the protein levels of p-JAK2 and p-STAT3. Mean±SD.n=3.*P<0.05vsNC group.
图6过表达miR-153后p-JAK2和p-STAT3蛋白水平降低
讨 论
最近很多研究都报道miRNA在人类肿瘤中扮演很重要的角色。一般来说,miRNA作为一种肿瘤抑制因子,通过下调促癌基因的表达或者上调抑癌基因的表达来达到抑癌的作用。miRNA可以参与到生物机体的很多生物学进程中,比如细胞分化、增殖和侵袭等[12]。有学者研究表明,miRNA可以调控20%~30%的基因的表达,对机体蛋白的平衡表达提供至关重要的协调作用[13-14]。Yuan 等[15]指出,miR-153在肺癌中可以通过抑制AKT的表达起到抑癌作用;Ghasemi等[16]报道在胶质瘤细胞中miR-153可以下调Bcl的表达诱导肿瘤细胞凋亡;Niu等[17]的研究表明miR-153T可以上调TGF-β2的表达影响骨肉瘤细胞株的生物学行为。 但是miR-153在膀胱癌中的表达及影响机制目前尚未有研究报道。
PRDM与肿瘤关系密切,由于PRDM基因启动子甲基化、基因缺失和基因突变等原因导致蛋白表达变化,某些抑癌基因失活,导致多种肿瘤发生。PRDM家族基因在大部分肿瘤中扮演抑癌基因的角色。PRDM2基因包括内外2种启动子,外部启动子产物为缺失的短链PRDM2蛋白,通过基因甲基化影响后续转录过程起到抑制肿瘤的作用。通常来说,短链PRDM2蛋白是PRDM2的主要表达形式,一旦出现基因突变或失活的情况,PRDM2表达水平降低甚至出现表达缺失的情况,则不能有效抑制肿瘤的发生和发展[18]。Wu等[19]研究PRDM2基因与肿瘤的关系,检测了膀胱癌细胞株的基因表达情况,其研究均未检测RT4细胞。
STAT在多种恶性肿瘤组织及细胞系中广泛存在,在正常组织中很少出现STAT及其家族蛋白的活化情况[20]。比如在多种鳞状细胞癌、淋巴瘤、肺癌、肾细胞癌、前列腺癌、胰腺癌和宫颈癌中均有大量文献报告存在STAT的活化现象。而JAK则是负责活化STAT的酪氨酸激酶[21-23]。STAT家族中的STAT3蛋白,广泛存在于多种肿瘤组织中,影响肿瘤细胞的增殖、迁移及侵袭等一系列的生物学行为,扮演促癌基因的角色。作为STAT3上游的JAK因子,有报道指出,通过使用SG490(JAK体外阻断剂)可以减缓急淋白血病的发病进程[24]。有研究提示,PRDM2和JAK/STAT信号通路在多酚类的抑癌作用中扮演关键的调控作用[25]。总之,JAK/STAT信号通路在肿瘤发生、发展过程中发挥着重要作用。
本实验观察在体外环境下miR-153靶向PRDM2在膀胱癌的作用。体外实验表明,miR-153可以靶向PRDM2调控膀胱癌的生物学行为,而且miR-153可能通过PRDM2的表达而起到对PRDM2对膀胱癌的抑制作用。而后面继续通过Western blot实验检测过表达miR-153后JAK/STAT信号通路蛋白水平的变化,显示miR-153过表达后可能通过降低PRDM2的表达,下调p-JAK2和p-STAT3的蛋白水平,进而影响膀胱癌细胞的侵袭和迁移。
本研究表明miR-153在膀胱癌组织中表达减低,而PRDM2在膀胱癌组织中表达明显增高,同时发现miR-153可以靶向调控PRDM2的表达,通过JAK/STAT信号通路调控膀胱癌细胞的侵袭和迁移,提示miR-153和PRDM2可能参与膀胱癌的发展过程,有可能成为预测膀胱癌的发生和进展的标志物。
[1] Liacouras CA, Furuta GT, Hirano I, et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults[J]. J Allergy Clin Immunol, 2011, 128(1): 3-20.
[2] Harris TD, Buzby PR, Babcock H, et al. Single-molecule DNA sequencing of a viral genome[J]. Science, 2008, 320(5872):106-109.
[3] 唐夏莉, 焦德敏, 陈 君, 等. miRNA-126 对肺癌A549 细胞的增殖、迁移、侵袭及EGFR/AKT/mTOR 信号通路的影响[J]. 中国病理生理杂志, 2016, 32(3):458-463.
[4] Pelham HR, Jackson RJ. An efficient mRNA-dependent translation system from reticulocyte lysates[J]. Eur J Biochem, 1976, 67(1):247-256.
[5] Zamore PD, Tuschl T, Sharp PA, et al. RNAi: double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals[J]. Cell, 2000, 101(1):25-33.
[6] Kim TH, Kim YK, Kwon Y, et al. Deregulation of miR-519a, 153, and 485-5p and its clinicopathological relevance in ovarian epithelial tumours[J]. Histopathology, 2010, 57(5):734-743.
[7] Fog CK, Galli GG, Lund AH. PRDM proteins: important players in differentiation and disease[J]. Bioessays, 2012, 34(1):50-60.
[8] Di Zazzo E, De Rosa C, Abbondanza C, et al. PRDM proteins: molecular mechanisms in signal transduction and transcriptional regulation[J]. Biology, 2013, 2(1):107-141.
[9] 王 菲, 喻文立, 贾莉莉, 等. 异丙酚通过抑制JAK/STAT 通路减轻肝冷缺血再灌注大鼠肾损伤[J]. 中国病理生理杂志, 2016,32(11):2026-2030.
[10] Bournazou E, Bromberg J. Targeting the tumor microenvironment: JAK-STAT3 signaling[J]. JAKSTAT, 2013, 2(2):e23828.
[11] 廖静秋, 林佳琼, 张伟杰, 等. JAK/STAT 信号通路在高糖诱导人脐静脉内皮细胞损伤中的作用[J]. 中国病理生理杂志, 2016, 32(3):392-397.
[12] Iorio MV, Croce CM. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review[J]. EMBO Mol Med, 2012, 4(3):143-159.
[13] Fang W, Bartel DP. The menu of features that define primary microRNAs and enable de novo design of microRNA genes[J]. Mol Cell, 2015, 60(1):131-145.
[14] Zuo J, Wang D, Shen H, et al. MicroRNA-153 inhibits tumor progression in esophageal squamous cell carcinoma by targetingSNAI1[J]. Tumor Biol, 2016, 37(12):16135-16140.
[15] Yuan Y, Du W, Wang Y, et al. Suppression of AKT expression by miR-153 produced anti-tumor activity in lung cancer[J]. Int J Cancer, 2015, 136(6): 1333-1340.
[16] Ghasemi A, Fallah S, Ansari M. MiR-153 as a tumor suppressor in glioblastoma multiforme is downregulated by DNA methylation[J]. Clin Lab, 2015, 62(4):573-580.
[17] Niu G, Li B, Sun L, et al. MicroRNA-153 inhibits osteosarcoma cells proliferation and invasion by targeting TGF-β2[J]. PLoS One, 2015, 10(3): e0119225.
[18] Tan SX, Hu RC, Liu JJ, et al. Methylation of PRDM2, PRDM5 and PRDM16 genes in lung cancer cells[J]. Int J Clin Exp Pathol, 2014, 7(5):2305-2311.
[19] Wu S, Yang Z, Ye R, et al. Novel variants in MLL confer to bladder cancer recurrence identified by whole-exome sequencing[J]. Oncotarget, 2016, 7(3): 2629-2645.
[20] Molavi O, Ma Z, Mahmud A, et al. Polymeric micelles for the solubilization and delivery of STAT3 inhibitor cucurbitacins in solid tumors[J]. Int J Pharm, 2008, 347(1-2): 118-127.
[21] Lee MH, Kundu JK, Keum YS, et al. Resveratrol inhibits IL-6-induced transcriptional activity of AR and STAT3 in human prostate cancer LNCaP-FGC cells[J]. Biomol Ther (Seoul), 2014, 22(5):426-430.
[22] Panni RZ, Sanford DE, Belt BA, et al. Tumor-induced STAT3 activation in monocytic myeloid-derived suppressor cells enhances stemness and mesenchymal properties in human pancreatic cancer[J]. Cancer Immunol Immunother, 2014, 63(5):513-528.
[23] Wen W, Wu J, Liu L, et al. Synergistic anti-tumor effect of combined inhibition of EGFR and JAK/STAT3 pathways in human ovarian cancer[J]. Mol Cancer, 2015, 14:100.
[24] Joung YH, Na YM, Yoo YB, et al. Combination of AG490, a Jak2 inhibitor, and methylsulfonylmethane synergistically suppresses bladder tumor growth via the Jak2/STAT3 pathway[J]. Int J Oncol, 2014, 44(3):883-895.
[25] Colomer R, Sarrats A, Lupu R, et al. Natural polyphenols and their synthetic analogs as emerging anticancer agents[J]. Curr Drug Targets, 2017, 18(2):147-159.

