MR间质淋巴造影在VX2兔乳腺癌内乳前哨淋巴结显像中的初步研究
谭红娜,王攀鸽,刘 洋,夏燕娜,王 博,肖慧娟,高剑波
1. 郑州大学第一附属医院放射科,河南 郑州450052;
2. 郑州大学第五附属医院放射科,河南 郑州450052
内乳淋巴结(internal mammary lymph node,IMLN)是乳腺癌患者仅次于腋窝淋巴结的另一重要的独立预后因素,其对远处转移及远期复发的预测价值与腋窝淋巴结转移的价值相当[1-2]。IMLN在改良根治术下不能被清除,目前临床上只能对内乳区可能存在转移的患者盲目追加放疗。本着乳腺癌患者个体化治疗的原则,对所有乳腺癌患者行IMLN活检或切除是不必要的。如何选取适合IMLN活检或切除手术的乳腺癌患者,则是目前临床急需解决的问题。
随着前哨淋巴结活检(sentinel lymph node biopsy,SLNB)技术的推广应用,内乳SLNB已成为临床外科研究的热点[3]。鉴于IMLN解剖结构的复杂性,准确识别和定位前哨淋巴结(sentinel lymph node,SLN)是决定内乳SLNB成功的关键。本研究初步探讨MR间质淋巴造影(magnetic resonance lymphography,MR-LG)检查在显像兔VX2乳腺癌内乳SLN的可行性,旨在为临床定位及评价IMLN提供帮助,避免过度治疗。
1 材料和方法
1.1 VX2兔乳腺癌动物模型的建立
选取纯种雌性新西兰大白兔55只(郑州大学医学院实验动物中心提供),月龄5~8个月,体质量1.5~2.1 kg。先将新鲜VX2肿瘤软组织块用眼科剪剪成约1 mm×1 mm×1 mm大小的碎块,放入0.9%NaCl溶液中备用,然后用18G穿刺活检针将3~4块剪好的肿瘤组织块种植于实验兔左侧胸壁第2对乳头的乳垫下。密切观察肿瘤生长及腋窝淋巴结肿大情况。2周左右种植区可见约“黄豆”大小实质性结节形成,3~4周后实验兔腋下可触及淋巴结;待触及腋窝淋巴结肿大或移植肿瘤最大径超过3 cm时便制成实验兔模型,用于影像学检查。
1.2 MR间质淋巴管造影检查及图像解读
MRI检查采用Philips Achieva 3.0T扫描仪,使用八通道体部线圈。实验兔成功麻醉后(速眠新Ⅱ1.5 mL:0.03 g;0.1~0.2 mL/kg),采取仰卧位,四肢伸展并固定于约35 cm×35 cm大小的自制塑料检查板上(此位置基本与SLNB手术中体位相同)。MRI扫描序列主要包括e-THRIVE T1TFE横断位(TE 2 ms、TR 3 ms、FOV 180 mm和Slice Thick 2.0 mm)和T2W-SPAIR横断位/冠状位(TE 70 ms、TR 785 ms、FOV 210 mm和Slice Thick 3.0 mm),扫描范围自锁骨上窝至瘤体下缘(或至少包括瘤体最大截面)。先行常规MRI平扫,然后在实验兔VX2肿瘤深部及内侧缘皮下分别注射钆喷酸葡胺注射液(Magnevist,20 mL/9.38 g)0.5 mL,按摩1.5 min后行MRI扫描(便于后面统计此次扫描做为对比剂注射后即刻扫描),包括T1轴位及冠状位(扫描参数同常规平扫),并于注药结束5 min后重复扫描1次。
MRI原始图像传至ISP(Philips Intellispace Portal)工作站后,进行最大信号强度投影3D重建,观察并记录MR-LG检查显示的所有淋巴结及其引流淋巴管(选择两次扫描显像效果较好的);且自注射部位至腋窝/内乳淋巴结引流通路上最先显像的淋巴结定义为SLN,其余均认为是n-SLN。观察指标如下:① MR-LG图像上,显像效果按照淋巴结及淋巴管显像情况分成良好(淋巴结和淋巴管均显像)和较差[淋巴结和(或)和淋巴管未显像]。② 记录SLN、n-SLN的个数及测量其大小(长短径)。③ 记录显像内乳SLN的个数,并测量其引流淋巴管的直径。
1.3 VX2荷瘤兔内乳及腋窝SLN清扫及病理学评价
所有实验兔均于术前24 h内采用两点法(同MR-LG)注射99Tcm-硫胶体(核素强度0.7 mCi,直径10~20 nm,每点0.5 mL),并于注射45 min~1 h后行核素淋巴显像,以寻找腋窝和(或)内乳淋巴结的放射性热点,并行体表标记。对麻醉固定后(同MR-LG检查体位) 的试验兔,采用两点法(同MR-LG)注射亚甲蓝(每点1 mL),按摩3 min后经耳缘静脉空气栓塞处死。沿体表标记在腋窝做一约4 cm长的手术切口,切开皮下脂肪组织,寻找蓝染淋巴管,并循淋巴管找寻蓝染的淋巴结;然后用γ探测仪检出有放射性热点的淋巴结。同时沿双侧腋窝侧打开胸廓,在胸骨两旁寻找蓝染或放射性计数增高的内乳淋巴结。摘除所有SLN,即蓝染淋巴结、蓝染淋巴管直接指向的淋巴结,以及任何一个放射性计数大于等于10%最高计数值的淋巴结。记录内乳及腋窝SLN和n-SLN个数,并测量其大小。所有手术获取的淋巴结均术后石蜡包埋,常规H-E染色后行病理学评价。
1.4 统计学处理
实验数据使用SPSS 22.0软件包进行统计分析。观察所有实验兔MR-LG图像上显示的SLN及n-SLN的形态(包括形状、边缘及内部情况),并记录其数目和测量其大小±s );并将MR-LG检查结果与SLNB对照。数据用SPSS 22.0行独立样本t检验、独立样本Mann-Whitney U检验和卡方检验,P<0.05为差异有统计学意义。
2 结 果
2.1 实验动物建模及MR-LG检查一般情况
55只实验兔除1只未见肿瘤组织明确生长外均建模成功,成功率为98.2%(54/55),建模时间平均为38 d[(37.96±10.35) d],种植瘤大小约25 mm[(24.85±10.68) mm]。2只荷瘤实验兔在行MR-LG检查后24 h内不明原因死亡(未行尸体解剖),1只在MR-LG检查过程中因麻醉过度死亡,最终51只荷瘤实验兔成功入组。MRI平扫见荷瘤实验兔胸壁上软组织结节或肿块,伴有不同程度囊变坏死,其中18只皮肤破溃(图1),伴胸壁水肿和腹腔少量积液者各5只。
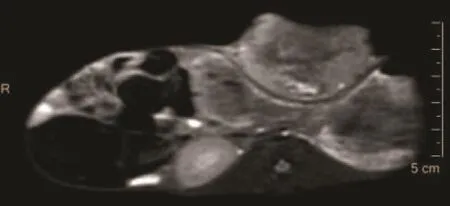
图 1 MRI平扫显示左侧胸壁种植瘤Fig. 1 Transplanted tumor of the left chest wall of experimental rabbit showed by the plain MRI
在51只成功入组的荷瘤实验兔的MR-LG图像上,对比剂注射后即刻扫描和5 min后扫描原始图像经3D重建后显示腋窝SLN及引流淋巴管情况见表1,两次扫描显像效果良好(腋窝淋巴结和引流淋巴管均显示)的荷瘤实验兔的百分比分别为72.5%(37/51)和88.2%(45/51),两者差异有统计学意义(P=0.040)。对比剂注射后即刻扫描,MR-LG图像上共14只实验兔显像效果较差,其中9只淋巴管未显示,5只淋巴结未显示;5 min后扫描除2只因显像淋巴结廓清而成像效果差外,淋巴结及其引流淋巴管显像进一步加强,但仍有4只实验兔显像效果较差(包括3只引流淋巴管和1只淋巴结未显示)。在51只荷瘤兔的MR-LG图像上,对比剂注射后即刻扫描和5 min后扫描分别有25只和36只荷瘤实验兔显示内乳区淋巴管,两者差异有统计学意义(P=0.021);结合两次扫描情况,共39(76.5%,39/51)只实验兔显示内乳区淋巴管。本研究中仅9只荷瘤兔内乳区SLN显像,故内乳区MR-LG显像效果无法做出评价(图2)。
2.2 荷瘤兔MR-LG显像情况分析
在本组51只荷瘤实验兔的MR-LG图像上,共46只实验兔显示腋窝MR-LG显像效果良好,共显示53枚腋窝SLN(平均每只1.04枚)、45枚n-SLN(平均每只0.88枚)和63条引流淋巴管(平均每只1.24条);分别有9只实验兔显示内乳区SLN和39只实验兔显示内乳区引流淋巴管,共显示11枚(平均每只0.22枚)SLN和51条(平均每只1条)引流淋巴管,其中9只双侧内乳区淋巴管显像。在内乳区MR-LG图像上,显像SLN长径为(2.64±0.59) mm,短径为(2.24±0.54) mm,引流淋巴管直径平均值为2.18 mm(图3)。
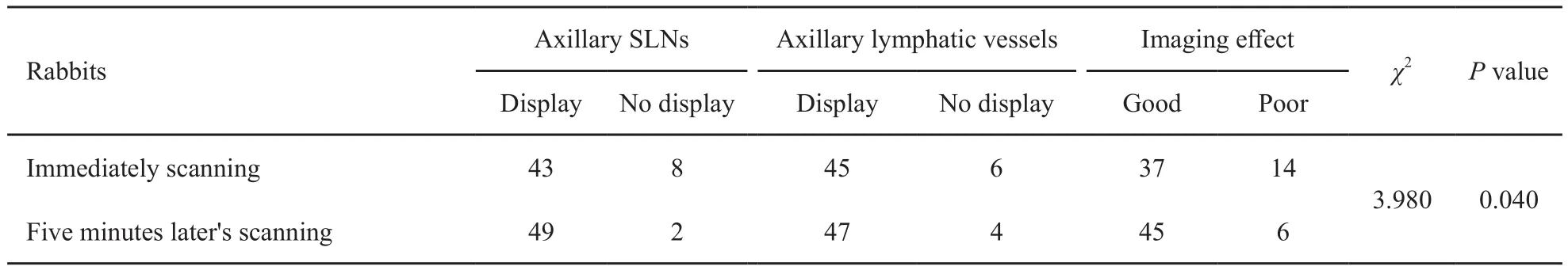
表 1 51只荷瘤实验兔不同扫描时间腋窝SLN及引流淋巴管显示情况Tab. 1 The detection of axillary SLNs and lymphatic vessels of 51 experimental rabbits for different scanning time
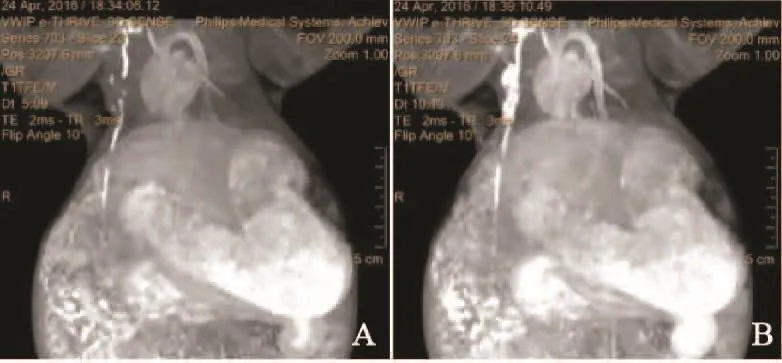
图 2 对比剂注射后即刻扫描(A)和5 min后扫描(B)结果Fig. 2 The result of MR-LG obtained by the contrast agent injection immediately scanning (A) and 5 min later’s scanning (B)
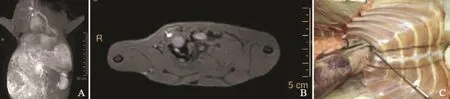
图 3 IM-SLN在MR-LG (A)、轴位MRI(B)和SLNB (C)上的显示情况Fig. 3 The displaying of IM-SLN on MR-LG(A), axial MRI(B) and SLNB(C)
分析MR-LG显像内乳区引流淋巴管的影响因素(表2),肿瘤大小及腋淋巴结数目对内乳淋巴管的显示差异均有统计学意义(P=0.032和P=0.040),而实验兔体质量、肿瘤生长周期、腋窝SLN大小及状态均对内乳区淋巴管显像影响不大。
2.3 MR-LG与SLNB结果对比
内乳区SLNB共检出11只荷瘤兔内乳区SLN,共15枚SLN(图3C),其中4只荷瘤兔分别检出2枚SLN。在这15枚SLN中,位于第2~3肋间者6枚(40%,6/15),1~2肋间者5枚(33.3%,5/15),3~4肋间者2枚(13.3%,2/15),而位于第10肋间和剑突旁者各1枚(6.7%, 1/15)。对照MRLG,共9只荷瘤兔共显示11枚内乳区SLN,其中7只(77.8%,7/9)与SLNB显示结果一致(图5)。对比分析两者检出SLN的长径、短径及长短径比,研究发现SLNB检出的SLN长短径均大于MR-LG图像上显示的SLN,且差异有统计学意义(P<0.05),而两者长短径比差异无统计学意义(P=0.166,表3)。
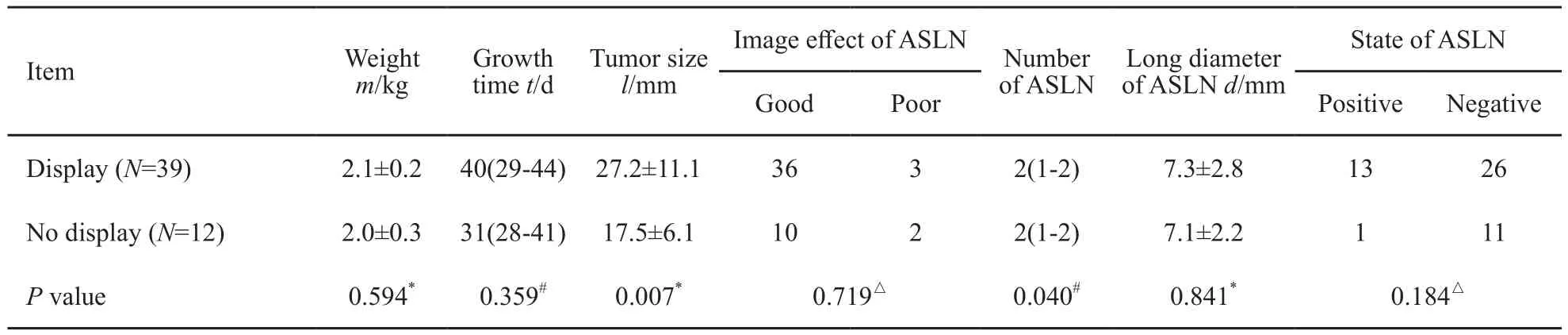
表 2 MR-LG显影内乳淋巴管影响因素分析Tab. 2 Analysis of the influences of internal mammary lymphatic vessels display on MR-LG

表 3 对比分析MR-LG与SLNB检出的IMSLN的特点Tab. 3 Analysis of the features of IMSLN detected by MR-LG and SLNB
3 讨 论
通过VX2肿瘤组织块原位种植建立乳腺癌动物模型简单有效[4]。本研究中除1只新西兰大白兔胸壁上未见肿瘤组织明确生长外,54只均建模成功(成功率为98.2%);2只荷瘤实验兔在行MR-LG检查后24 h内不明原因死亡,1只在MR-LG检查过程中因麻醉过度死亡,最终51只荷瘤实验兔成功入组。这可能与麻醉过深或荷瘤实验兔的麻醉耐受力下降有关。IMLN乳腺癌患者其发生转移时常伴有复发或远处转移,预后较差[5]。目前对IMLN转移的治疗方法仍存在较大的争议。术后预防性内乳区放射性治疗只能减少区域的复发,不能提高患者的生存率,而且还能使患者的心血管相关死亡率增加[6]。因此,有选择地进行IMLN活检或切除是必要的,可避免对乳腺癌内乳区进行盲目治疗;而内乳区SLNB可有助于合理选择IMLN活检或切除乳腺癌。提高SLN的显像率是内乳SLNB获得成功的关键。99Tcm-硫胶体示踪的淋巴闪烁显像是目前较常见的内乳SLN显像方法,但存在一定的假阴性率,且影响因素较多[7]。关于MR-LG检查显像SLN评价乳腺癌腋窝淋巴结状态的研究国内外已有不少报道[8-9],但在显像内乳SLN方面目前还未见类似的报道。本研究初步探讨MR-LG检查在显像VX2兔乳腺癌内乳SLN的可行性,旨在为临床定位及评价IMLN提供帮助,避免过度治疗。
SLN是指从原发肿瘤向区域淋巴引流的第一个或数个淋巴结。MR-LG检查目的主要是通过向皮下间隙注射对比剂,MR扫描后通过显像淋巴管进一步追踪其引流淋巴结,也即SLN。既往研究表明,MR-LG检查可较好地显示乳腺癌腋窝SLN及引流淋巴管[8-9],且本研究也进一步证实了这一点。我们进一步对比分析了对比剂注射后即刻扫描和5 min后扫描腋窝及内乳区SLN和引流淋巴管显像情况,尽管5 min后扫描2只实验兔,因腋窝淋巴结廓清而显像效果较第一次扫描差,但总体腋窝SLN及其引流淋巴管、内乳区淋巴管的显像率均较对比剂注射后即刻扫描明显提高,且差异均有统计学意义(P=0.040和P=0.021)。尽管内乳区SLN显像率较低,导致内乳区MR-LG显像效果不佳;然而5 min后MR-LG扫描36只荷瘤兔可显像内乳淋巴管,这也充分说明通过向肿瘤内部及胸壁皮下注射对比剂是可以实现内乳区SLN显像,但如何提高内乳区SLN显像率仍需进一步探讨。影响内乳区SLN显像的因素颇多,诸如肿瘤的异质性、对比剂注射的位置及用量、注射后按摩的时间以及合适的扫描时间等。鉴于MRI扫描序列时间偏长及荷瘤实验兔在检查过程中对麻醉药的耐受度有限,本研究中仅对比了对比剂注射后即刻(含1.5 min的按摩时间)和5 min后MR-LG检查腋窝及内乳区SLN和引流淋巴管的显像情况,目前对5 min后扫描结果基本满意。但随着时间的延长,对比剂进一步充填淋巴结和淋巴管,抑或是廓清仍是后续研究中值得深入探讨的问题。
本研究中MR-LG检查内乳区SLN显像率较低,51只荷瘤兔中仅9只共显示11枚内乳区SLN;而内乳区SLNB共检出11只荷瘤兔15枚内乳区SLN。对照二者的显像结果,其中7只荷瘤兔在两种检查方法中SLN均显像,符合率为77.8%(7/9),进一步说明了内乳区SLN的确显像率不高,此外MR-LG检查还是基本能直观地显示内乳区SLN。内乳SLN显示率较低,可能与肿瘤侵袭性不强、实验动物个体免疫力强或内乳区淋巴结未见增大或转移有关。也有研究显示,内乳淋巴结转移的发生率远不如腋窝淋巴结的转移发生率高,且与乳腺癌临床分期、肿瘤大小、位置及腋窝淋巴结有转移的相关性强[10-11]。分析影响内乳区淋巴管显像的因素,研究结果表明肿瘤大小及腋淋巴结数目对内乳淋巴管的显示差异有统计学意义(P=0.032和P=0.040)。这也间接说明内乳区SLN的显示与肿瘤的大小及腋窝淋巴结显像情况可能有关。
本研究中SLNB共检出15枚内乳区SLN,其中位于第2~3肋间者6枚,1~2肋间者5枚,3~4肋间者2枚,而位于第10肋间和剑突旁者各1枚,这与文献报道的内乳区淋巴结的位置基本吻合[12]。在内乳区MR-LG图像上,SLN长径为(2.64±0.59) mm,短径为(2.24±0.54) mm,引流淋巴管直径平均值为2.18 mm。而SLNB检出的SLN长短径均大于MR-LG图像上显示的SLN,且差异有统计学意义(P<0.05)。一方面,这可能与SLNB标本测量时长径为其三维最大径,而MR-LG图像上淋巴结长、短径的测量是在横轴位进行的,且所选测量层面可能并非最大截面有关(与扫描层厚及测量误差);另一方面,也可能与样本量相对较少有关。
总之,MR-LG显像内乳区SLN和引流淋巴管是可行的,但内乳区SLN显像率不高。鉴于内乳区SLN往往较小且位置较深,再加之内乳区SLN显像的影响因素颇多,如何提高内乳区SLN的显像率是今后需要进一步研究的问题。
[1] VERONESI U, MARUBINI E, MARIANI L, et al. The dissection of internal mammary nodes does not improve the survival of breast cancer patients. 30-year results of a randomisedtrial[J]. Eur J Cancer, 1999, 35(9): 1320-1325.
[2] CRANENBROEK S, VANDER SANGEN M J, KUIJT G P, et al. Diagnosis, treatment and prognosis of internal mammary lymph node recurrence in breast cancer patients[J]. Breast Cancer Res Treat, 2005, 89(3): 271-275.
[3] 邱鹏飞,赵荣荣,丛斌斌,等. 乳腺癌内乳区前哨淋巴结活检术对淋巴分期和个体化治疗的影响[J]. 中华肿瘤杂志,2016, 38(1): 42-47.
[4] 刘玉玺,孙业全,王苗苗,等. 改良型乳腺癌淋巴结转移模型的制备及超声表现[J]. 中国医学影像学杂志,2016, 24(6): 410-413.
[5] WHELAN T. Treatment of the internal mammary nodes in early breast cancer: back to the future[J]. Clin Oncol (R Coll Radiol), 2003, 15(1): 14-16.
[6] HENNEQUIN C, BOSSARD N, SERVAGI-VERNAT S, et al.Ten-year survival results of a randomized trial of irradiation of internal mammary nodes after mastectomy[J]. Int J Radiat Oncol Biol Phys, 2013, 86(5): 860-866.
[7] KONG A L, TEREFFE W, HUNT K K, et al. Impact of internal mammary lymph node drainage identified by preoperative lymphoscintigraphy on outcomes in patients with stage Ⅰ toⅢ breast cancer[J]. Cancer, 2012, 118(24): 6287-6296.
[8] TORCHIA M G, NASON R, DANZINGER R, et al. Interstitial MR lymphangiography for the detection of sentinel lymph nodes[J]. J Surg Oncol, 2001, 78(3): 151-156.
[9] 谭红娜, 彭卫军, 杨犇龙, 等. MR淋巴管造影显示VX2兔乳腺癌前哨淋巴结[J]. 中国医学计算机成像杂志,2012,18(1): 67-71.
[10] LEE H W, KIM S H. Breast magnetic resonance imaging for assessment of internal mammary lymph node status in breast cancer[J]. J Breast Cancer, 2016, 19(2): 191-198.
[11] HUANG O, WANG L, SHEN K, et al. Breast cancer subpopulation with high risk of internal mammary lymph nodes metastasis: analysis of 2269 Chinese breast cancer patients treated with extended radical mastectomy[J]. Breast Cancer Res Treat, 2008, 107(3): 379-387.
[12] 贺青卿, 姜 军, 杨新华, 等. 乳腺癌淋巴引流途径的临床研究[J]. 中华乳腺病杂志(电子版), 2008, 2(2): 140-148.

