经皮射频消融术治疗外科切除术后复发性肝细胞癌疗效分析
袁筑慧,王 洋,李 威
首都医科大学附属北京佑安医院肝病与肿瘤介入治疗中心,北京100069
肝细胞癌(hepatocellular carcinoma,HCC)是世界上第五大常见肿瘤和第三大肿瘤相关病死原因[1]。早期HCC患者可通过外科切除术获得根治,但其术后复发率高达70%,而二次外科切除率却不足50%[2-3]。肝移植是能够阻止肝癌复发的有效措施,但其移植后复发率仍可达15%[4-5]。因此,如何治疗这部分在根治术后,尤其是外科切除术后发生肝内复发的HCC患者,对于进一步延长患者生存期,改善其预后具有重要意义。
以射频消融(radiofrequency ablation,RFA)为代表的热消融是治疗肝癌的一种有效技术,具有微创、安全、并发症少、手术时间短、住院时间短、治疗费用低、可重复治疗等特点[6]。尤其对于直径小于2 cm的小肝癌患者,RFA的完全消融率可达100%,术后5年总生存(overall survival,OS)情况与外科手术相当[1]。对于不能手术的中晚期患者,RFA也可起到姑息治疗的作用。根据文献报道,大部分复发性的肝癌结节为直径小于3 cm的小肝癌结节,这一发现为RFA治疗复发性HCC提供了良好的契机[7]。肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)通过将化疗药物、栓塞剂等注入肿瘤滋养血管,引起肿瘤的缺血、缺氧和坏死。此外,术前TACE能够增加病灶检出率,明确病灶浸润范围,发现和确认卫星灶。因此,术前TACE对于延缓肿瘤复发进展、减少治疗次数具有积极意义。
1 资料和方法
1.1 一般资料
回顾性分析2009年3月—2016年7月于首都医科大学附属北京佑安医院肝病与肿瘤介入治疗中心接受治疗的复发性肝癌患者61例。纳入标准为:经影像学或病理学确诊为肝内复发肿瘤,年龄大于等于18岁,肿瘤最大直径小于等于3 cm,肝功能Child-Pugh评分A-B级,血小板计数大于5×109个/L,不能接受或拒绝外科治疗的患者,无RFA及TACE相关禁忌证。
本研究中复发性HCC患者的一般临床特征见表1。男性患者49例,女性12例,年龄39~80岁,平均年龄(54.48±9.97)岁。肝内肿瘤直径为2.0~28.0 mm,平均最大直径为(17.34±6.34) mm。肝内有1个复发性HCC的患者40例,2个复发性HCC的患者19例,2例患者肝内有3个复发性HCC病灶。
1.2 设备
AXIOM ARTIS dTA型号数字造影机购自德国Simens公司,单排螺旋CT(Hispeed)购自美国GE公司,1500X RFA系统和Starbust XL射频电极针购自美国RITA公司。

表 1 61例复发肝癌患者基线信息Tab. 1 Characteristics of the 61 recurrent HCCs patients[n (%)]
1.3 治疗方法
1.3.1 TACE
为增加病灶检出率,明确病灶浸润范围,在RFA治疗前对复发性HCC患者行TACE治疗。先以猪尾导管对其行腹主动脉造影,其后4F-5F肝管行肝动脉造影,超选择至肝脏肿瘤供血血管。若该供养血管纤细迂曲则改为微导管超选择至目标供养血管。注入化疗药物,如5-FU、羟基喜树碱、吡柔比星。药物剂量视患者肝功能、血小板、白细胞等而定。以超液态碘化油、明胶海绵颗粒栓塞肿瘤供养血管。术后再行肝动脉造影,检查肿瘤供养血管是否完全闭塞。
1.3.2 RFA
术前CT扫描,确定肿瘤的位置、穿刺方向、角度、进针深度。采用2%利多卡因局部麻醉,将Chiba针(22G)作为导引针穿刺入治疗靶灶,采用CT扫描确认引导针进入靶灶后,将射频电极针沿导引针方向进入消融靶点。根据肿瘤的大小、位置设置消融温度与作用时间(温度90~110 ℃,作用时间20~30 min)。消融结束后,退出消融针并行针道消融,CT扫描复查消融结果,确定有无肿瘤残余及有无肝包膜下出血、气胸等并发症。在消融过程中,需多次行CT扫描,以确认导引针和消融针位置正确。
1.3.3 观察指标及随访情况
术后24 h后行增强CT/MRI。观察患者有无并发症。所有患者在治疗结束后1个月接受包括血常规、肝功能、血清肿瘤标志物等在内的生化检查,并行增强CT或增强MRI评估治疗效果。完全消融定义为消融的肿瘤区域无强化,若出现强化则为不完全消融,需再次行TACE结合RFA或单独RFA治疗。随后,术后第1年需每3个月行血清AFP水平、肝功能、血常规、凝血常规、增强CT或增强MRI等检查以评估治疗后肿瘤复发情况等,之后每6个月随访1次。
1.4 统计学处理
采用SPSS 17.0软件进行统计分析,符合正态分布的连续变量以±s 表示,非正态分布的连续变量以中位值和四分位数间距表示。生存和复发分析以Kaplan-Meier法进行比较。采用COX比例风险模型和Kaplan-Meier法分别对连续变量和分类变量进行单变量分析。以COX比例风险回归模型行多变量分析。P<0.05为差异有统计学意义。
2 结 果
2.1 完全消融率与并发症发生率
61例患者在CT引导下完成RFA,术后1个月行增强CT或增强MRI评估消融效果。消融后影像图片显示治疗的靶灶肿瘤呈低密度或低信号的无强化区域。达到完全消融的患者57例,占总人数的93.4%(57/61)。不完全消融率为6.6%(4/61),其中2例患者在二次消融后获得完全消融。本研究无消融相关死亡患者。术后1例患者出现肝包膜下出血,行术后TACE并成功栓塞止血,住院时间为13 d。复发性HCC患者行RFA治疗后,术后住院时间为4~7 d,中位值为5 d。
2.2 生存率与无进展生存率
HCC手术切除术后复发行RFA治疗的患者的OS率曲线见图1。所有患者RFA术后随访时间为0.07~91.33个月,平均随访时间为(30.51±20.19)个月,患者的1、3和5年OS率分别为96.3%、77.9%和77.9%。患者的无进展生存(progression-free survival,PFS)率曲线见图2。复发性肝癌患者接受RFA治疗后,其1、3和5年PFS率分别为48.6%、20.3%和13.5%。PFS为0.07~62.39个月,中位值为9.6个月。61例患者中,28例在术后第1年出现消融后再复发,41例在第3年出现消融后再复发,43例在第5年出现消融后复发。5年内出现二次复发的43例患者中,5例患者未行消融治疗,38例二次复发患者均行二次复发后再消融治疗。
将单变量分析中差异有统计学意义的变量纳入COX回归模型进行多变量分析后,所得分析结果如表2所示。
影响OS的独立风险因子为患者HBsAg阳性(P=0.044,HR=7.496,95%CI:1.057~53.152)。患者年龄、血清TBil水平、复发肿瘤结节的数目与大小差异无统计学意义(P=0.612、P=0.099、P=0.111和P=0.062)。
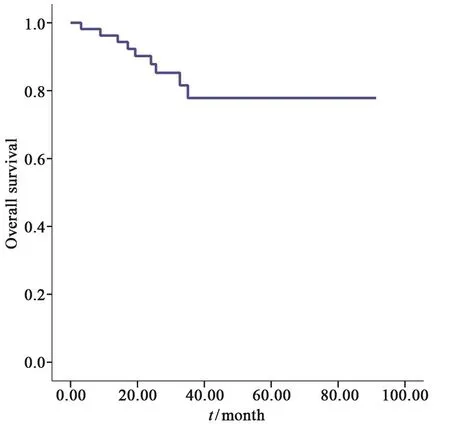
图 1 复发HCC患者接受RFA治疗后生存曲线图Fig. 1 The overall survival curve for recurrent HCC patients treated with RFA
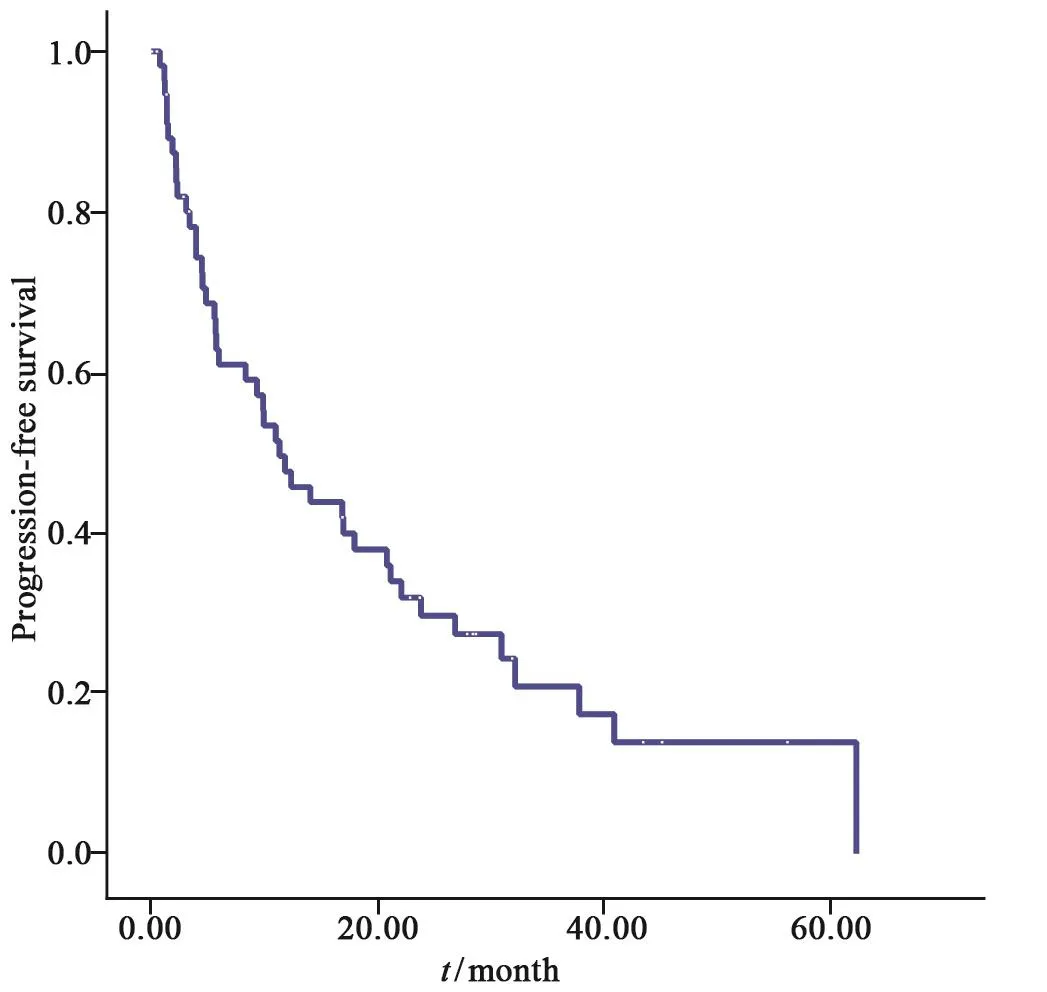
图 2 复发HCC患者接受RFA治疗后无进展生存期曲线图Fig. 2 The progression-free survival curve for recurrent HCC patients treated with RFA

表 2 COX回归多变量生存分析结果Tab. 2 Multivariate analysis for overall survival using the Cox proportional hazard model
3 讨 论
复发肿瘤的治疗策略目前仍具有较大争议,尚未达成统一标准。对于单个复发的结节,可选择二次手术切除,其术后5年OS率为37%~70%[8]。但当多中心复发,肿瘤位于危险部位,肝脏剩余组织少时,则限制了外科切除的作用。在本研究中,复发肿瘤的最大直径为2.8 cm,复发肿瘤数量的中位值为1,RFA治疗复发性HCC术后的5年OS率为77.9%,与外科治疗疗效近似。且患者术后无消融相关的死亡发生,无严重并发症出现。在治疗过程中大多数患者采取局部麻醉的方式,相较于二次手术切除而言,其并发症更少,死亡率更低。Albert等[9]在对比二次手术切除和射频消融治疗手术切除术后肝内复发性HCC的研究中发现,二次手术切除和RFA在PFS和OS上差异无统计学意义,但RFA的可重复操作率(33.3%)却显著高于第3次手术切除率(10.0%)。因此,对于直径小于3 cm的复发性HCC结节,虽然RFA治疗后的疗效同外科治疗相当,但经皮RFA在微创、出血量少、患者痛苦小、术后并发症少、治疗费用低等方面要优于二次手术切除,且对于许多高龄患者或具有二次手术禁忌证的患者,RFA可作为首选治疗方式。对于直径在3 cm以上的复发肿瘤结节,RFA由于受到射频电极热凝范围的限制,无法在一次消融治疗中使肿瘤完全坏死[10]。对于直径大于10 cm的巨块型肿瘤,往往形状不规则,且伴有微小卫星灶,在影像上可能难以辨别,容易造成遗漏,引起治疗后复发。因此,对于直径较大的肿瘤,可以采取射频消融同其他治疗手段相结合的方式进行治疗,如RFA结合TACE等[11]。
本研究中RFA的3年PFS率为20.3%。而在一项对比了二次手术切除和RFA的研究中,两者的3年PFS率分别为49.69%和31.76%(P=0.004)[12]。虽然RFA术后的复发率要高于再次手术切除,但从综合角度来看RFA治疗复发HCC仍优于再次手术切除[13]。首先在患者的OS率上,RFA与再次外科切除类似,且有部分研究认为RFA的3年OS率要优于二次手术切除。其次RFA的安全性要优于二次手术切除,其术后严重并发症更少。而相较于原发性HCC的治疗[14],RFA和二次手术的3年PFS率都有所下降,这可能同复发肿瘤在肝内发生了微转移有关[15]。
目前,HBV相关性肝癌的预后仍不乐观,其原因之一是治疗后起HBV的再激活。有文献报道,手术切除术后的HBV再激活率约为14%[16],而RFA引起的HBV再激活率约为5.6%[17]。本研究中患者群体为术后HCC复发的患者,其中HBsAg阳性的复发性HCC患者占总人数的78.3%,且在影响患者生存的预后因素分析中也发现HBsAg阳性会引起患者OS率降低。HBV再激活引起的肝炎,可表现为单纯的肝功能受损、黄疸、腹水,亦可表现为严重的肝衰竭甚至死亡。患者常因为上述原因中断或放弃治疗,引起生存时间缩短,甚至因肝功能持续受损而死亡。
综上所述,射频消融术治疗术后,直径在3 cm以内的复发HCC近期疗效确切,安全性高,与手术切除效果接近,但并发症少于二次手术切除。
[1] FORNER A, LLOVET J M, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2012, 379(9822): 1245-1255.
[2] EL-SERAG H B. Hepatocellular carcinoma[J]. N Engl J Med, 2011, 365(12): 1118-1127.
[3] ISHIZAWA T, HASEGAWA K, AOKI T, et al. Neither multiple tumors nor portal hypertension are surgical contraindications for hepatocellular carcinoma[J].Gastroenterology, 2008, 134(7): 1908-1916.
[4] JONAS S, BECHSTEIN W O, STEINMULLER T, et al.Vascular invasion and histopathologic grading determine outcome after liver transplantation for hepatocellular carcinoma in cirrhosis[J]. Hepatology, 2001, 33(5): 1080-1086.
[5] ZHENG Z, LIANG W, MILGROM D P, et al. Liver transplantation versus liver resection in the treatment of hepatocellular carcinoma: a meta-analysis of observational studies[J]. Transplantation, 2014, 97(2): 227-234.
[6] LENCIONI R, CIONI D, CROCETTI L, et al. Early-stage hepatocellular carcinoma in patients with cirrhosis: long-term results of percutaneous image-guided radiofrequency ablation[J]. Radiology, 2005, 234(3): 961-967.
[7] REGALIA E, FASSATI L R, VALENTE U, et al. Pattern and management of recurrent hepatocellular carcinoma after liver transplantation[J]. J Hepatobiliary Pancreat Surg, 1998,5(1): 29-34.
[8] ZHANG X, LI C, WEN T, et al. Appropriate treatment strategies for intrahepatic recurrence after curative resection of hepatocellular carcinoma initially within the Milan criteria:according to the recurrence pattern[J]. Eur J Gastroenterol Hepatol, 2015, 27(8): 933-940.
[9] CHAN A C, POON R T, CHEUNG T T, et al. Survival analysis of re-resection versus radiofrequency ablation for intrahepatic recurrence after hepatectomy for hepatocellular carcinoma[J]. World J Surg, 2012, 36(1): 151-156.
[10] RODRIGUEZ-SANJUAN J C, GONZALEZ F, JUANCO C, et al. Radiological and pathological assessment of hepatocellular carcinoma response to radiofrequency. A study on removed liver after transplantation[J]. World J Surg, 2008, 32(7):1489-1494.
[11] PENG Z W, CHEN M S, LIANG H H, et al. A case-control study comparing percutaneous radiofrequency ablation alone or combined with transcatheter arterial chemoembolization for hepatocellular carcinoma[J]. Eur J Surg Oncol, 2010,36(3): 257-263.
[12] ZHANG C S, ZHANG J L, LI X H, et al. Is radiofrequency ablation equal to surgical re-resection for recurrent hepatocellular carcinoma meeting the Milan criteria? A metaanalysis[J]. J BUON, 2015, 20(1): 223-230.
[13] LIANG H H, CHEN M S, PENG Z W, et al. Percutaneous radiofrequency ablation versus repeat hepatectomy for recurrent hepatocellular carcinoma: a retrospective study[J]. Ann Surg Oncol, 2008, 15(12): 3484-3493.
[14] LI L, ZHANG J, LIU X, et al. Clinical outcomes of radiofrequency ablation and surgical resection for small hepatocellular carcinoma: a meta-analysis[J]. J Gastroenterol Hepatol, 2012, 27(1): 51-58.
[15] SHERMAN M. Recurrence of hepatocellular carcinoma[J].N Engl J Med, 2008, 359(19): 2045-2047.
[16] HUANG G, LAI E C, LAU W Y, et al. Posthepatectomy HBV reactivation in hepatitis B-related hepatocellular carcinoma influences postoperative survival in patients with preoperative low HBV-DNA levels[J]. Ann Surg, 2013, 257(3): 490-505.
[17] DAN J Q, ZHANG Y J, HUANG J T, et al. Hepatitis B virus reactivation after radiofrequency ablation or hepatic resection for HBV-related small hepatocellular carcinoma: a retrospective study[J]. Eur J Surg Oncol, 2013, 39(8): 865-872.

